高中化学方程式知识点总结
高中化学方程式归纳总结

高中化学方程式归纳总结高中化学的学习过程中,化学方程式占据着一定的主导地位,如果你尝试归纳总结过化学方程式,那么你会发现高中的知识点很多都离不开化学方程式,很多实验的原理和一些流程基本都可以用化学方程式写出来,所以说,理解和学透化学方程式,是你学好化学这门科目的关键。
下面小编就对高中化学方程式进行了归纳和总结,希望对同学们有所帮助。
一、化学方程式化学方程式是用化学式表示不同物质之间化学反应的式子。
规范书写化学方程式要遵守的两个原则:一是必须以客观事实为基础。
因此,既要按照各类反应规律书写,又要注明必要的条件等。
二是要遵守质量守恒定律。
因此,一定要配平,配平系数为最简单的整数比,要防止假配平。
书写化学方程式的常见错误:一是乱套反应规律,如钠与氯化铜溶液反应误认为会发生生成铜单质的置换反应。
二是乱写逆向反应,如CO2通入CaCl2溶液中误认为会生成CaCO3沉淀。
三是乱标或漏写反应条件与生成物状态“↓、↑”,如实验室用MnO2与浓盐酸加热制取氯气时漏写“浓”、“加热”、“↑”等。
四是乱写化学式,如不按化合价写化学式。
在中学阶段规定,无机反应方程式一律用等号连接反应物和生成物。
有机反应方程式一律用箭头来连接反应物和生成物。
可逆反应一律用双向箭头即可逆号表示,但不一定要注明物质的聚集状态。
二、热化学方程式热化学方程式是表示化学反应热效应的化学方程式。
热化学方程式与化学方程式的对比示例:2H2(g)+O2(g)==2H2O(l) △H=﹣571.6 kJ· mol-1H+(aq)+OH-(aq)==H2O(l) △H=﹣57.3 kJ· mol-1与2H2+O2 2H2O“热”之别,做足“热”字文章。
①由于“热”,各物质要注明聚集状态,固态、液态、气态物质分别注明s、l、g,溶液注明aq,同素异形体还应注明名称。
②由于“热”,热化学方程式的右边要写出△H的符号和单位。
放热反应,△H为“-”,吸热反应,△H为“+”。
高二化学方程式知识点总结

高二化学方程式知识点总结化学方程式是描述化学反应过程的一种简明而精确的表达方式。
在高二化学学习中,掌握和理解化学方程式知识点是非常重要的。
本文将对高二化学方程式知识点进行总结和归纳。
一、化学方程式基本概念1. 反应物和生成物:化学方程式中,反应物是参与反应的起始物质,生成物是反应过程中产生的新物质。
2. 反应物和生成物的表示:反应物和生成物用化学式表示,化学式中包含元素符号和相应的下标。
3. 反应过程中的能量变化:化学方程式中,放出热量的反应称为放热反应,吸收热量的反应称为吸热反应。
二、化学方程式的平衡与反应类型1. 平衡反应:化学反应达到平衡状态时,反应物和生成物浓度保持不变。
平衡反应的化学方程式中用双箭头“⇌”表示。
2. 氧化还原反应:涉及到电子的转移过程,包括氧化和还原两个反应。
在化学方程式中,用氧化态表示电子的转移。
3. 酸碱中和反应:酸与碱反应生成盐和水,化学方程式中用H+表示酸,OH-表示碱。
三、化学方程式的平衡调整1. 增加系数:通过增加方程式中反应物和生成物的系数,使得反应物和生成物的物质的数量平衡。
2. 俄歇定律:化学反应过程中,物质的质量守恒,即反应物质的质量等于产物物质的质量。
四、常见化学方程式的表示方法1. 通用式:可用于表示各种类型的反应,包括酸碱中和反应、氧化还原反应等。
例如:2HCl + Na2CO3 → 2NaCl + H2O + CO22. 反应顺序:表示一步一步进行的化学反应过程。
例如:CH4 + 2O2 → CO2 + 2H2O3. 离子方程式:用离子表示反应物和生成物的化学方程式。
例如:2H+(aq) + CO3^2-(aq) → H2O(l) + CO2(g)↑五、其他化学方程式的相关知识点1. 配平方程式:使方程式中的原子种类和数量保持平衡的方法。
2. 反应条件的表示:在方程式中用符号表示反应条件,如∆表示加热、↑表示产生气体等。
3. 不可逆反应:只能从左向右进行的反应,不可逆反应的化学方程式中使用单向箭头“→”表示。
高中化学方程式必考重点知识点(大全)

高中化学方程式必考重点知识点(大全)高中化学方程式必考重点知识点1.碳与氧气(不足)的反应 2C+O2==== 2CO碳与氧气(充足)的反应 C+O2==== CO22.一氧化碳与氧气的反应 2CO+O2==== 2CO23.二氧化碳与碳的反应 CO2+C==== 2CO4.碳酸氢钠与盐酸的反应 NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应 Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应 CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应 NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应 Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应 NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O碳酸氢钠(过量)与氢氧化钙的反应 2NaHCO3+ Ca(OH)2====CaCO3+Na2CO3+2H2O10.碳酸氢钠加热的反应 2NaHCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应 Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应 CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应 Ca(OH)2+2CO2====Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应 Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应 N2+O2==== 2NO15.一氧化氮与氧气的反应 2NO+O2==== 2NO216.二氧化氮与水的反应 3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应 N2+3H2========= 2NH318.氨气与水的反应 NH3+H2O==== NH3?H2O19.氨气与盐酸的反应 NH3+HCl==== NH4Cl20.氨气与硫酸的反应 2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应 NH3+H+==== NH4+22.氨的催化氧化的反应 4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应 NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应 NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应 (NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应 2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应 NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应 NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应 NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应 4HNO3========= 4NO2↑+O2↑+2H2O高中化学方程式总结1.铜与浓硝酸的反应 Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O2.铜与稀硝酸的反应 3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O3.铁与浓硝酸的反应 Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O4.铁与稀硝酸的反应 Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O5.碳与浓硝酸的反应 C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O6.一氧化氮与一氧化碳的反应 2NO+2CO====== N2+2CO27.一氧化氮与氧气和水的反应 4NO+3O2+2H2O==== 4HNO38.二氧化氮与氧气和水的反应 4NO2+O2+2H2O==== 4HNO39.氢氧化钠吸收二氧化氮和一氧化氮的反应 2NaOH+NO2+NO==== 2NaNO2+ H2O10.氨气(过量)与氯气的反应 8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应 2NH3+3Cl2==== 6HCl+N2学好高中化学的学习方法要科学地阅读教材和资料书新教材在充分考虑学生心理、生理特征、教育教学原理、学科特点、社会发展等诸多因素的基础上精心编制而成的,具有极高的阅读价值,课前阅读能把握好重点方能提高听课效率,课上阅读使学生有充足的时间去分析思考问题,发现疑点,展示其特长,减少惰性,减少两极分化,课后充分利用资料书,可以及时弥补课堂上因疏忽等原因而产生的疑惑,并使已有的知识得到进一步升华,安排阅读应抓住时机,应本着阅读后能解决问题,能在提出新问题,再阅读再解决问题的原则,通过阅读仔细推敲,全面准确地领会知识的内涵,明确联系,掌握规律,使知识成块、成串,逐步培养自学能力。
(完整版)(完美版)高中有机化学方程式总结
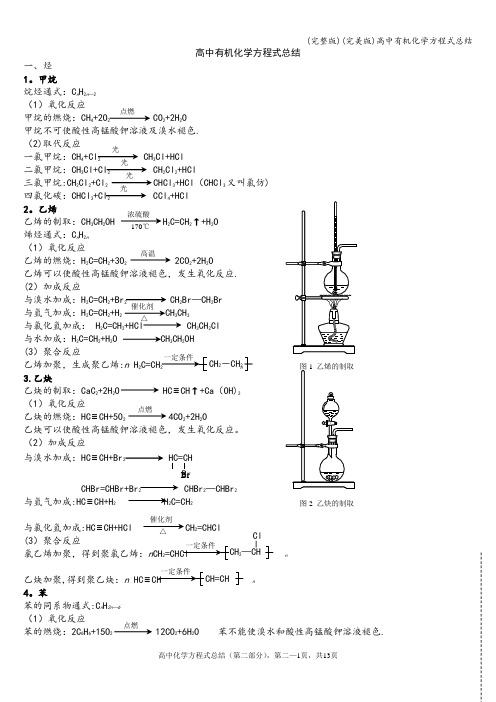
高中有机化学方程式总结一、烃 1。
甲烷烷烃通式:C n H 2n —2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色. (2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2。
乙烯 乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应. (2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2n 3.乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca (OH)2 (1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC ≡CH n4。
苯苯的同系物通式:C n H 2n —6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色.点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHCl点燃(2)取代反应 ①苯与溴反应(溴苯)②硝化反应+HO-NO +H 2O (硝基苯) (3)加成反应(环己烷)。
高中化学反应方程式总结

高中化学反应方程式总结化学反应方程式是描述化学反应中反应物转化为产品的化学方程式。
它由反应物和生成物之间的化学式组成,同时还包括反应条件和反应物的状态。
在高中化学中,学生们通常会接触到多种类型的反应方程式,包括酸碱中和反应、氧化还原反应、置换反应、合成反应、分解反应等等。
以下是对这些常见的反应方程式进行总结和解释。
1.酸碱中和反应酸碱中和反应是酸和碱反应,生成盐和水。
它的一般方程式可以表示为:酸+碱→盐+水例如:HCl+NaOH→NaCl+H₂O其中,HCl是酸,NaOH是碱,NaCl是盐,H₂O是水。
2.氧化还原反应氧化还原反应是指反应物中的原子氧化态发生改变的化学反应。
氧化态的改变是通过电子的转移实现的。
其中,被氧化的物质被称为还原剂,用来氧化其他物质;而用来被氧化的物质被称为氧化剂,用来还原其他物质。
一般的氧化还原反应可以表示为:氧化剂+还原剂→氧化产物+还原产物例如:2Na+Cl₂→2NaCl其中,Cl₂是氧化剂,Na是还原剂,NaCl是氧化产物。
3.置换反应置换反应是指一个原子或原子团在反应中取代了另一个原子或原子团的反应。
一般的置换反应可以表示为:A+BC→AC+B例如:Zn+2HCl→ZnCl₂+H₂其中,Zn是A,HCl是BC,ZnCl₂是AC,H₂是B。
4.合成反应合成反应是指两个或多个反应物结合形成单一化合物的反应。
一般的合成反应可以表示为:A+B→AB例如:2Na+Cl₂→2NaCl其中,Na是A,Cl₂是B,NaCl是AB。
5.分解反应分解反应是指一个化合物分解成两个或更多物质的反应。
AB→A+B例如:2H₂O→2H₂+O₂其中,H₂O是AB,H₂和O₂是A和B。
以上总结的只是常见的几个高中化学反应方程式,实际上在化学中还有许多其他类型的反应,如酯化反应、脱水反应、加成反应、消除反应等等。
不同类型的反应方程式可以帮助我们理解和解释化学反应的过程和结果。
通过学习化学反应方程式,我们可以了解反应物和生成物之间的化学变化,掌握化学反应的平衡和速率。
高中有机化学方程式汇总(全)(已免费)

光照 光照 光照 光照 高温 CaO△ 催化剂加热、加压 催化剂催化剂△ 催化剂 △ 催化剂 催化剂催化剂 催化剂△ 催化剂催化剂浓硫酸△ △CH 3 NO 2O 2N CH 3催化剂△高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br11. CH 2 = CH 2 + H 2 CH 3—CH 312. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n14. 2CH 2 = CH 2 + O 2 2CH 3CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)221. + Br 2 Br + HBr22. + HO -NO 2 NO 2 +H 2O23. + HO -SO 3H SO 3H+H 2O24. + 3H 2催化剂NaOH H 2O 醇△ 催化剂 △ 浓硫酸 170℃ 浓硫酸140℃OH Br Br OH 催化剂 △ 催化剂△△ △ 浓硫酸△ Br25. +3HO -NO 2 +3H 2O26. 3CH ≡CH →27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. OH+NaOH ONa+H 2O35. OH+H 2O O -+H 3O +36. ONa+H 2O+CO 2 OH+ NaHCO 337. +3Br 2 ↓ +3HBr 38. CH 3CHO + H 2 CH 3CH 2OH39. 2CH 3CHO + O 2 2CH 3COOH 40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O 48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC — CO OCH2-CH249. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O6 (s)+ 6O2 (g)6CO2 (g)+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH2 57. C17H35COO-CH2 CH2-OH C17H35COO-CH +3NaOH 3C17H35COONa+ CH-OHC17H35COO-CH2 CH2-OH 58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光2.3.4.5.6.7.8.9.10.11.12.13.14.15.16.17.18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中化学之最难化学方程式知识点

高中化学之最难化学方程式知识点一、非氧化还原反应1.若实验室用CaO和碳铵作原料制取氨气,用一个化学方程式表示反应原理。
[解析]NH4HCO3热分解的产物是NH3、CO2和H2O,CaO既吸收CO2又吸收H2O。
NH4HCO3+2CaO=NH3↑+CaCO3+Ca(OH)22.“在溶液中发生的离子互换反应一般总是向离子浓度减少的方向进行。
”此话实际上是存在少数反例的。
请举一个典型反例,用化学反应方程式(或离子方程式)表示。
[答]NH3·H2O+CH3COOH→NH4++CH3COO-+H2O3.在Na2S溶液中通入过量CO2,反应产物是和。
[解析] 虽说碳酸的酸性强于H2S,不至于在该反应中产生H2S 和Na2CO3。
一般而言,多元酸的正盐与酸(包括弱酸)是不能共存的。
反应产物是NaHS和NaHCO3。
4.将0.3mol/L NaOH溶液和0.1mol/l Ca(H2PO4)2溶液等体积混合,充分搅拌后静置,反应充分进行。
写出此反应的离子方程式。
[解析] NaOH与Ca(H2PO4)2 3:1反应。
Na+实际不参加反应。
3OH-+Ca2++2H2PO4-H2O是最弱的电解质,所以它常常是离子反应中的第一产物。
本例中有3份OH-,顶多产生3份H2O。
3OH-+Ca2++2H2PO4-→3H2O剩余微粒尚有1份Ca2+、1份HPO42-和1份PO43-。
先组合成最难溶的Ca3(PO4)2(1/3份),还剩1/3份PO43-和1份HPO42-,3OH-+Ca2++2H2PO4-→3H2O+1/3 Ca3(PO4)2↓+1/3 PO43-+HPO42-两边乘3,结果是:3Ca2++6H2PO4-+9OH-=Ca3(PO4)2↓+PO43-+3HPO42-+9H2O5.BiCl3水解生成BiOCl。
(1)写出水解的化学方程式。
(2)有人将BiOCl叫做次氯酸铋,你认为这有什么不妥之处?[解析] 水解的前提是H2O一解为二。
高中化学方程式知识点:最易考离子方程式汇总

高中化学方程式知识点:最易考离子方程式汇总摘要高中如何复习一直都是考生们关注的话题,下面是的编辑为大家准备的高中化学方程式知识点:最易考离子方程式汇总一、离子反应常见类型:1、复分解型离子反应:例:Ag++Cl-=AgCldarr;2H++CO32- =CO2uarr;+H2O2、置换反应型:例:Zn+2H+=Zn2++H2 uarr;Cl2+2I-=2Cl-+I23、盐类水解型:例:NH4++H2O==NH3 H2O+H+CH3COO-+H2O ==CH3COOH+0H-4、复杂的氧化还原型:例:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O 另外还有生成物中有络合物时的离子反应等。
二、离子方程式书写规则:1、只能将强电解质(指溶于水中的强电解质)写出离子形式,其它(包括难溶强电解质)一律写成分子形式。
如碳酸钙与盐酸的反应:CaCO3+2H+=Ca2++CO2uarr;+H2O 因此熟记哪些物质是强电解质、哪些强电解质能溶于水是写好离子方程式的基础和关键。
2、不在水溶液中反应的离子反应,不能书写离子方程式。
如铜与浓H2SO4的反应,浓H2SO4与相应固体物质取HCI、HF、HNO3的反应,以及Ca(OH)2与NH4Cl制取NH3的反应。
3、碱性氧化物虽然是强电解质,但它只能用化学方程式写在离子方程式中。
如CuO与盐酸的反应:CuO+2H+=Cu2++H2O4、有酸式盐参加的离子反应,对于弱酸酸式根离子不能拆成H+和酸根阴离子(HSO4-除外)。
如NaHCO3溶液和NaOH溶液混合:HCO3-+OH-=CO32-+H2O不能写成:H++OH-=H2O5、书写氧化还原反应的离子方程式时,首先写好参加反应的离子,然后确定氧化产物和还原产物,再用观察配平并补齐其它物质即可;书写盐类水解的离子方程式时,先写好发生水解的离子,然后确定产物,再配平并补足水分子即可。
6、必须遵守质量守恒和电荷守恒定律,即离子方程式不仅要配平原子个数,还要配平离子电荷数和得失电子数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一部分 钠及其重要化合物钠及其重要化合物的相互转化关系2O ClH1.钠在氯气中燃烧 2.钠与硫化合 3.钠暴露在空气中表面变暗 4.钠在空气中燃烧 5.过量钠与盐酸反应 6.钠与水反应(离子~) 7.Na 2O 溶于盐酸 8.Na 2O 与CO 2化合9.Na 2O 与水化合 10.Na 2O 暴露空气中变色 11.CO 2通过Na 2O 2 12.Na 2O 2投入水中(化学~) 13.Na 2O 2投入水中(离子~) 14.Na 2O 2投入盐酸(离子~) 15.少量CO 2通入烧碱溶液(离子~) 16.少量烧碱溶液吸收CO 2(离子~) 17.足量CO 2通入饱和Na 2CO 3溶液中(离子~)18.小苏打受热分解 19.小苏打溶液与烧碱溶液混合(离子~) 20.小苏打溶液与盐酸溶液混合(离子~) 21.往盐酸溶液中逐滴加入纯碱溶液(离子~) 22.往纯碱溶液中逐滴加入盐酸(离子~)23.电解饱和食盐水(化学~)24.电解饱和食盐水(离子~)25.电解熔融氯化钠26.饱和食盐水中先通NH3再通CO227.石灰纯碱法制备烧碱28.NaHSO4与NaHCO3溶液反应(离子~)29.Na投入CuSO4溶液(离子~)30.Na2O2投入足量硫酸酸化的KMnO4溶液31.Na218O2与水反应32.SO2通过Na2O233.Ba(OH)2溶液与少量NaHCO3溶液混合(离子~)34.标况下6.72LCO2通入400mL1 mol·L-1烧碱溶液(离子~)35.等物质的量的FeSO4溶液与Na2O2充分反应(离子~)36.将Na2O2投入Na2S溶液(离子~)37.NaHSO4溶液与少量Ba(OH)2溶液混合第二部分钙、镁及其重要化合物镁及其重要化合物相互关系2233)2N2OHNa2CO3通钙及其重要化合物相互关系CaN24通1.镁在空气中燃烧2.Mg3N2与水反应3.Mg3N2溶于硝酸4.镁粉使溴水褪色5.镁与水反应6.MgO与水反应7.MgO溶于盐酸(离子~)8.MgO与CO2混合加热9.Mg(OH)2溶于盐酸(离子~)10.Mg(OH)2受热分解11.从海水中提取镁制备金属镁所有反应的方程式(如果是离子反应写离子方程式)12.加热MgCO3浊液13.过量CO2通入MgCO3浊液14.高温煅烧Ca(HCO3)2固体15.Mg(HCO3)2溶液与过量烧碱溶液混合(离子~)16.CO2通入澄清石灰水直至过量17.过量CO2通入石灰水(离子~)18.石灰石溶于醋酸(离子~)19.饱和CaCl2溶液中滴加足量浓烧碱溶液(离子~)20.煅烧石灰石21.工业上用石灰石、纯碱、石英制玻璃的主要反应22.Cl2通入石灰浊液制备漂白粉23.工业上用石灰石吸收有毒SO2得到石膏第三部分 铝及其重要化合物铝及其重要化合物相互关系KAl(SO 4)2OH 2OH 212.1.Al 溶于盐酸(离子~) 2.Al 溶于烧碱溶液(离子~) 3.Al 高温下与Fe 3O 4反应 4.工业电解熔融Al 2O 3制备Al 5.Al 2O 3溶于盐酸(离子~) 6.Al 2O 3溶于烧碱溶液(离子~)7.AlCl 3溶液与过量氨水混合(离子~) 8.往AlCl 3溶液滴加烧碱溶液直至过量(离子~)9.AlCl 3溶液与过量烧碱溶液混合(离子~) 10.往NaAlO 2溶液通入过量CO 2(离子~)11.往NaAlO 2溶液滴加盐酸溶液直至过量(离子~)12.NaAlO 2溶液与过量盐酸溶液混合(离子~)13.Al(OH)3受热分解 14.明矾溶于水形成净水剂(离子~)15.AlCl 3溶液与NaAlO 2溶液混合(离子~)16.泡沫灭火器工作原理[Al 2(SO 4)3与小苏打溶液混合](离子~)17.NH4Cl溶液与NaAlO2溶液混合(离子~)18.Al4C3与适量水混合19.Al(OH)3的电离20.往明矾溶液中滴加Ba(OH)2溶液至Al3+完全沉淀(离子~)21.往明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀(离子~)22.Ba(AlO2)2溶液与少量硫酸反应(离子方程式)23.在硫酸铝铵溶液中加入少量Ba(OH)2溶液反应24.在硫酸铝铵溶液中加入过量Ba(OH)2溶液反应第四部分 铁及其重要化合物铁及其重要化合物相互关系O Fe 3O 4-2+3Na 2FeO 4O 2胶体杀菌消 毒1.Fe 溶于盐酸(离子~) 2.Fe 棒浸入CuSO 4溶液(离子~) 3.Fe 粉、S 粉混合加热 4.Fe 在氯气中燃烧 5.Fe 在氧气中燃烧 6.Fe 溶于过量稀HNO 3 7.过量Fe 与稀HNO 3作用8.Fe 粉高温下与水蒸气反应 9.FeCl 2溶液中滴入氯水(离子~) 10.FeSO 4溶液中滴入溴水(离子~) 11.酸性FeSO 4溶液中滴入双氧水(离子~) 12.酸性FeSO 4溶液暴露在空气中(离子~) 13.酸性FeSO 4溶液使酸性KMnO 4溶液褪色(离子~)14.H 2S 气体通入FeCl 3溶液(离子~) 15.FeCl 3溶液与KI 溶液混合(离子~) 16.SO 2气体通入FeCl 3溶液(离子~)17.Fe 溶于FeCl 3溶液(离子~) 18.Cu 溶于FeCl 3溶液(离子~) 19.1~2mL 饱和FeCl 3溶液滴入20mL 沸水(离子~)20.无水FeCl 3暴露空气中产生棕色烟雾 21.Cl 2通入NaOH 、Fe(OH)3混合物中制得高铁酸钠22.FeCl3溶液与NaHCO3溶液混合(离子~)23.FeCl3溶液与NaAlO2溶液混合(离子~)24.往FeCl3溶液中滴入KSCN溶液(离子~)25.Fe(OH)2浊液露置空气中变色26.工业炼铁原理(铁矿石以Fe2O3为例)27.等物质的量的FeSO4溶液与Na2O2充分反应(离子~)28.Fe(OH)3溶于氢碘酸(离子~)29.少量氯气通入FeBr2溶液中(离子~)30.过量氯气通入FeI2溶液中(离子~)31.氯气通入FeBr2溶液将其中2/3的Br-氧化(离子~)32.请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个配平的化学方程式。
O2第五部分 铜及其重要化合物铜及其重要化合物相互关系Cu 2O3)42+1.Cu 溶于稀硝酸 2.Cu 溶于浓硝酸 3.用灼热的铜除去氧气 4.Cu 在硫蒸气中燃烧 5.Cu 在氯气中燃烧 6.Cu 溶于浓硫酸 7.H 2还原CuO8.CuO 氧化乙醇 9.CuO 溶于硝酸(离子~) 10.Cu(OH)2溶于醋酸(离子~) 11.新制Cu(OH)2氧化乙醛 12.碱式碳酸铜受热分解13.H 2S 通入CuSO 4溶液(离子~)14.CuSO 4溶液与Ba(OH)2溶液混合(离子~) 15.电解CuSO 4溶液(离子~)16.CuSO 4溶液中加入过量氨水(离子~) 17.加热条件下用氨还原CuO18.Na 投入CuSO 4溶液(离子~) 19.Cu 2O 溶于酸性H 2O 2溶液(离子~) 20.Cu 溶于酸性双氧水 21.Cu 2S 溶于稀硝酸22.对苯二甲醛与新制Cu(OH)2浊液反应第六部分 碳、硅及其重要化合物碳及其重要化合物CaO 2+NaOH 3)22CO 3Na 2CO NaHCO 32CO 2+H 2O2CuO2OH2①浓硫酸②①③②③硅及其重要化合物2CaSiO 3Na 2SiO 3H 4SiO 4H 2SiO 3SiF 4SiCl 42CO 3CaO Ca(OH)2CaCO 3CO 2+H 2OH +②①③①②1.C 燃烧可能反应的方程式 2.C 还原CuO 可能的反应方程式 3.工业上用水与煤反应制备氢气 4.碳被浓硫酸氧化 5.碳在热的浓硝酸中燃烧 6.镁在CO 2中燃烧 7.C 与CO 2化合8.工业上用C 还原SiO 2制粗硅 9.工业上煅烧石灰石制生石灰10.少量Ca(OH)2溶液与NaHCO 3溶液混合(离子~) 11.Si 粉在O 2中灼烧 12.Si 溶于氢氟酸13.Si 溶于强碱溶液(离子~) 14.SiO 2溶于强碱溶液(离子~) 15.SiO 2与CaO 高温下化合 16.SiO 2溶于氢氟酸17.工业上用石英、石灰石、纯碱制玻璃18.在水玻璃中通入过量CO2生成白色胶状沉淀19.原硅酸失水最终变成SiO2第七部分 氮及其重要化合物氮及其重要化合物相互关系NH 4+N 2O 433OH 2NH ClNH 4HCO OH-Mg 3N 2H 22O 22-2+2-2H 21.N 2与O 2反应 2.工业上合成氨 3.Mg 在N 2中燃烧 4.Mg 3N 2与少量水反应 5.Mg 3N 2与过量水反应6.氨与水反应(离子~) 7.浓氨水与浓盐酸靠近产生白烟 8.工业上制硝酸的3个反应 9.实验室制取氨 10.碳铵受热分解 11.将生石灰加入浓氨水12.NH 4Cl 溶液与烧碱溶液混合(离子~)13.NH 4Cl 溶液与烧碱溶液混合加热(离子~)14.NH 4Cl 浓溶液与烧碱浓溶液混合(离子~) 15.NO 2变成N 2O 4 16.硝酸见光或受热分解 17.灼热的C 在浓硝酸中燃烧 18.铜与浓硝酸反应 19.铜与稀硝酸反应 20.过量铁与稀硝酸反应(假设还原产物为NO )(离子~)21.银溶于稀硝酸(离子~)22.Fe2+溶于稀硝酸(离子~)23.SO2通入稀硝酸(离子~)24.稀硝酸使KI淀粉试纸变蓝(离子~)25.H2S气体通入稀硝酸(离子~)26.NO、O2混合气体(体积比4∶3)溶于水27.NO2、O2混合气体(体积比4∶1)溶于水28.氨与氯气混合产生白烟29.加热条件下用氨还原CuO30.在催化剂条件下用氨清除有毒的NO31.氨在纯氧中燃烧32.请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个配平的化学方程式。
O233.NO2与SO2混合34.NH4HCO3溶液与足量热Ba(OH)2溶液反应(离子~)35.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合(离子~)36.少量NH4HS固体与浓烧碱溶液混合(离子~)37.SO2通入BaCl2和HNO3的混合溶液第八部分硫及其重要化合物硫及其重要化合物相互关系32Na2SO Na2BaSO42SO2SO3232222223KMnO4/HFe Ca(ClO)2SO3H2SO4SO42-2等1.S的燃烧2.S与H2化合3.用硫粉处理洒落地面的液态汞4.铁粉与硫粉混合加热5.铜丝在硫蒸气中燃烧6.H2S的不完全燃烧7.H2S的完全燃烧8.H2S通入CuSO4溶液(离子~,此反应可用于H2S的检验与吸收)9.实验室用FeS溶于稀硫酸或稀盐酸制备H2S气体(离子~)10.工业上制硫酸的3个反应11.实验室用Na2SO3粉末与浓硫酸制备SO212.SO2溶于过量烧碱(离子~)13.SO2溶于水14.SO2与CaO化合15.Na2SO3溶液(或亚硫酸)暴露空气中变质(离子~)16.少量Mg在SO2中燃烧17.过量Mg在SO2中燃烧18.SO2使氯水褪色(离子~)19.SO2与H2O2反应20.SO2使酸性KMnO4溶液褪色(离子~)21.SO2与H2S混合22.工业上用氨水吸收SO2防止污染空气23.工业上用石灰石吸收SO2防止污染空气(生成石膏)24.灼热的C与浓硫酸反应25.铜与浓硫酸反应26.Na2S2O3溶液与稀硫酸混合27.SO2通过Na2O228.将Na2O2投入Na2S溶液(离子~)29.Cu2O溶于酸性H2O2溶液(离子~)30.Cu溶于酸性双氧水31.NO2与SO2混合32.O3与SO2混合33.O3使湿润的淀粉KI试纸变蓝(离子~)34.S溶于热的烧碱溶液35.SO2通入BaCl2和HNO3的混合溶液第九部分氯及其重要化合物氯及其重要化合物相互关系FeClCuCl2NaClO2Fe光照化1.H2在Cl2中燃烧2.Na在Cl2中燃烧3.Cu在Cl2中燃烧4.Fe在Cl2中燃烧5.Cl2与水的反应(化学~)6.Cl2与水的反应(离子~)7.Cl2通入烧碱溶液(离子~)8.工业上用Cl2与石灰浊液制漂白粉9.Cl2水滴入氢硫酸(离子~)10.Cl2水滴入亚硫酸(离子~)11.Cl2水滴入亚硫酸钠溶液(离子~)12.Cl2水滴入NaBr溶液(离子~)13.Cl2水使KI淀粉试纸变蓝(离子~)14.Cl2水滴入FeSO4溶液(离子~)15.MnO2氧化浓盐酸16.过量CO2通入漂白粉溶液(离子~)17.HClO见光分解18.AgX(X为Cl、Br或I)见光分解19.AgCl浊液中滴入NaBr溶液20.AgBr浊液中滴入NaI溶液(离子~)21.AgNO3溶液中滴入氨水直至沉淀恰好溶解(离子~)22.氨与氯气混合产生白烟23.Fe(OH)3溶于氢碘酸(离子~)24.少量氯气通入FeBr2溶液中(离子~)25.过量氯气通入FeI2溶液中(离子~)26.甲苯与氯气混合光照27.氯气通入FeBr2溶液将其中2/3的Br-氧化(离子~)28.Cl2与热、浓KOH反应(产物之一可用于实验室制O2)29.KMnO4常温下可将盐酸氧化成氯气(离子~)OO3O NHN221OO Cl2223。
