药物合成课后习题答案
药物合成技术课后习题答案

药物合成技术课后习题答案药物合成技术课后习题答案在药物合成技术的学习过程中,课后习题是巩固知识、检验理解的重要环节。
下面是一些常见的药物合成技术习题及其答案,希望能够对大家的学习有所帮助。
一、简答题1. 请简要介绍药物合成技术的基本原理。
答:药物合成技术是指通过一系列化学反应,将原料转化为目标药物的过程。
其基本原理包括反应物的选择、反应条件的控制、反应路径的设计等。
2. 药物合成中,为什么需要选择合适的溶剂?答:合适的溶剂在药物合成中起到溶解反应物、促进反应、调节反应速率等作用。
合适的溶剂应具备与反应物相容性好、溶解度高、反应条件稳定等特点。
3. 请简述药物合成中常见的保护基团策略。
答:保护基团策略是指在合成过程中,对某些易受损害的官能团进行保护,以避免其在反应中发生意外的化学变化。
常见的保护基团策略包括酯化、酰化、醚化等。
4. 请简要介绍药物合成中的催化剂的作用。
答:催化剂在药物合成中起到加速反应速率、提高产率、改善选择性等作用。
催化剂能够通过降低反应的活化能,促进反应的进行,同时在反应结束后能够恢复原状,不参与反应。
二、计算题1. 已知反应A+B→C的摩尔配比为2:1,若反应中A的摩尔数为10mol,求反应中B的摩尔数和C的摩尔数。
答:根据反应的摩尔配比,A与B的摩尔比为2:1,即B的摩尔数为10/2=5mol。
由于A与B的摩尔比为1:1,所以C的摩尔数也为5mol。
2. 已知反应A→B的反应物A的摩尔数为20mol,B的摩尔数为15mol,求反应的转化率。
答:转化率是指反应物转化为产物的摩尔数与反应物初始摩尔数之比。
根据题目中的数据,反应物A转化为产物B的摩尔数为20-15=5mol,所以转化率为5/20=0.25,即25%。
三、综合题1. 请设计一种合成药物X的反应路径,并标注关键反应步骤。
答:药物X的合成反应路径可以包括以下几个关键反应步骤:(1)反应1:化合物A与化合物B发生酯化反应,得到中间产物C。
药物合成课后习题答案
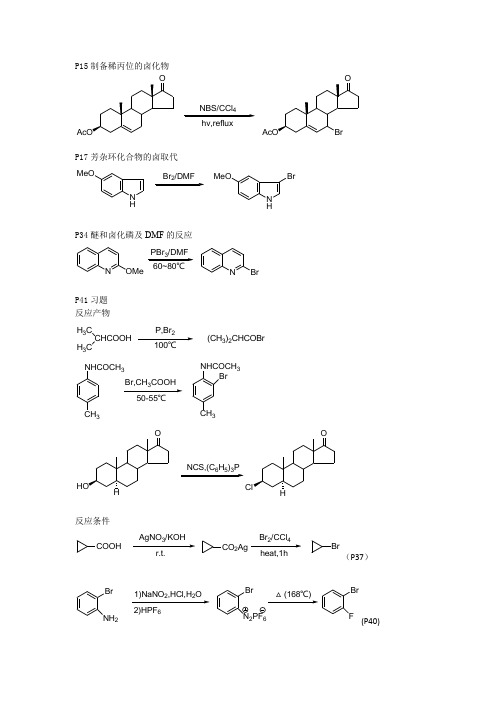
P15制备稀丙位的卤化物4hv,refluxP17芳杂环化合物的卤取代N HMeOBr /DMFN HMeOBrP34醚和卤化磷及DMF 的反应NOMe3NBrP41习题 反应产物 H 3C CHCOOHH 3CP,Br (CH 3)2CHCOBrCH 3NHCOCH 3Br,CH COOH 50-55℃CH 3NHCOCH 3Br653反应条件COOHAgNO /KOHCO 2AgBr /CCl Br(P37)Br NH 21)NaNO ,HCl,H O Br F2)HPF 6Br N 2PF 6△(168℃)(P40)P52有位阻或螯合酚的烃化O HOO OH OMeOMeOO OHOMeP54 DCC缩合法HOR HHOArNHCONH+ArORP56伯胺的制备——Gabriel反应(肼解法)NH OO KOH/EtOHNOOK NOORNH NHOONHNH+RNH2P62还原烃化法的应用NH23N CHMeH/Raney NiNHCH2CH3P63 Ullmann反应:芳胺的N-芳烃化CF3NH2+ClCOOH无水K23105-110℃F3CNHHO2CP65 芳烃的烃化:Friedel-Crafts反应R1+R C AlCl3XR'R''R'CR''RRAlCl3XR1CR'R R''+AlCl3+HXP79稀胺的C-烃化N H +OCH3NCH3P84习题反应产物KNO O+OON OOPhHN OOPhHN OONH222.2+OOBrOMeSnCl0℃OOMeO反应条件2OLi(P77 )P853(P77)O原子上的酰化反应P92羧酸为酰化剂——伯醇酯的制备+NO2CO2HDEAD/Ph3r.t.,1h2N CO22NNHOO P95活性酯用于大环内脂合成NS SN/PPh3PhH/r.t.HOP98酸酐为酰化剂H 3C NCH 3OH1)(CH 3CH 2CO)2O/Py2)HClH 3C NCH 3OCOCH 2CH 3.HCl(Anadol)P101酰氯为酰化剂——仲醇的酰化NNNO OHNClClONNCH 3.HClpy/CH 2Cl 2NNNON ClONN OCH 3(Zopiclone)N 原子上的酰化反应P107 酸酐为酰化剂O O O+PhCH 2CHCOOHNH 2Tol refiux,2hN OOCHCOOH CH 2PhC 原子上的酰化反应P113 Friedel-Crafts 反应(芳烃取代成芳酮)S+H 3COOO CH 3H PO reflux,2hSOCH 3O O O+CH 3AlCl 390℃,3hCO 2HOCH 3NEtO 2CCO 2EtBF 20℃,15minNEtO 2COP116 Vilsmeier-Haack 反应(芳环引入醛基)N HDMF/POCl CH 2Cl 2H ON HCHOP122利用烯胺化进行的C-酰化反应ON HONOCOClEt 3NOO2P123习题 反应产物N Boc+HNDCC/CH Cl N BocN反应条件OHCH 3OOCOPhCH 3OOHOO OONP124H 3CO H 3CONHCOCH 3POCl 3,toluene△H 3CO H 3CON CH 3Ac O,py H 3CO H 3CON CH 2COCH 3P133 Robinson 环化法OCH 3+OO CH 3CH 3O OHCH 3O -H 2OCH 3Oα-羟烷基化(Aldol 缩合) P136 Reformatsky 反应 O+BrCF 2COOC 2H 5OHCF 2COC 2H 5OP138 Grignard 反应O1)BrMg PhOHPhα-卤烷基化(Blanc 反应) P139反应通式+H OH+HClZnCl Cl+H 2Oα-氨烷基化(Mannich 反应) P143 Pictet-Spengler 反应H323NH 2OCH 3N H 3CO3羰基烯化反应(Wittig 反应) P148反应机理148R (C 6H 5)3C R1R 2+(C 6H 5PCR1R 2CR 4R 3CR3R 4C R 1R 2(C 6H 5)3C C R 1R 2R 4R 3+(C 6H 5)3POP149 制备环外烯键化合物3Ph P=CH 3P150 制备共轭多烯化合物CHO+(C 6H 5)3PCOOC 2H 5COOC 2H 5LiAlH CH 2OHP165 习题 反应产物+NO 220℃NO 2C 到C 重排Wagner-Meerwein 重排P170 胺与亚硝酸作用生成碳正离子C CH 3H 3C CH 3CH 2NH 2HNO 2C CH 3H 3C CH 3CH 2N N2C CH 3H 3C CH 32P171CH 3NH 2HO 2C2HO 2CHHH 3C OHPinacol 重排P175制备环状酮(Tiffenfan 扩环) OH C Ph PhOH H SO /Et Or.t./3h2O Ph PhOH OH0.2molSnCl /HC(OMe)OWoff 重排(α-重氮酮生成烯酮) P182ON 22240min/-78℃/-N 2C Ohv,O /CH Cl -78℃~-10℃/20minOC 到杂重排Beckmann 重排(肟生成取代酰胺) P185立体专一性NH 2ONOHHNOSchmidt 反应 (叠氮酸) P191叠氮酸与羧酸生成伯胺HOOCCH 3CH 3COOH NaN /H SO /CHCl HOOCCH 3CH 3NH 2Baeyer-villiger 反应(酮与过氧酸重排成酯) P193HC OCH 333HO C OCH 3机理HC OCH 3HO C OCH 3HH C OHCH 33O C OPhC OH3-HCO O 2N33O 2NCO O机理CO O 2NCH 3CO 3H/AcOHO 2NCO OHCOH O 2N O 2C OH OC OCH 3C OOH O 2N-Hσ-键迁移重排P199 Claisen 重排(烯丙基芳基醚重排为邻烯丙基酚)O C C C ROH C C C R机理C RCO C HC C ROH C C C RP200脂肪族Claisen 重排OOOCO 2EtOCO 2EtP202 cope 重排Ph Ph150℃Ph PhCH 2CH2350℃习题 反应产物 P205OHHO CH 3COOH H 2SO 4OP207OCH 3CHOOOCH 3CHOOH(P199烯丙基重排到对位)醇类的氧化P220 氯铬酸吡啶鎓盐(PPC )氧化法OO CH 2OHCH 2Cl 2OO CHOP222 DMSO-DCC 氧化法OHON HNO CH 3OOAc 34r.t.ON HN OCH 3OOAcOHCP225 1,2-二醇的氧化HOOH4OO醛酮的氧化P226 Dakin 反应OH CHOC H COOHOH O C OHOH OH烯键化合物的氧化P229 不与羰基共轭的烯键的环氧化t-BuOOH 6OP232顺式羟基化OOsO OHHOH OH习题 反应条件 P248CH 33.2CH 3O (p218 Collins 试剂 烯丙酮的制备)3333(P229 过氧酸环烯烃环氧化)羰基的还原P263 Clemmensen 反应(酸性锌汞齐还原醛酮为甲基亚甲基) Ph C OCH 2CH 2COOHZn-Hg/HCl/TolCH 2CH 2CH 2COOHPhC H C HPh COOEtZn-Hg/HCl PhCH 2CH 2COOEtP264 Wolff-kishner-黄鸣龙还原反应OR R'H NNH NNH 2R R'R CH 2R'+N 2P265 腙还原为烃CO H NNH CN NH 2DMSOC HHP272 Leuckart-Wallach 反应O NCH 3CH 3HCON(CH )OHN(CH 3)2CHO HCOOHOHNH(CH 3)22N(CH 3)2HCOOH 中间体羧酸及衍生物的还原 P278 金属复氢化物的还原CNNO 325℃NO 3CH 2NH 2含氮化合物的还原P281 Benoxaprofen 中间体制备 O 2NHC CN CH 34H 2NHC CH 3CNP282 HOO 2N NO 224HOH 2N NO 2习题 反应产物 P290FCHO +NHFHC NFH 2C N2Zn(BH )反应条件 P291COClNO 2O 2NCHONO 2O 2NLiAlH[OC(CH )](三叔丁氧基氢化铝锂/甘醇二甲醚) H 3COC NH 3COCHODIBAL-H /H 2SO 4(氢化二异丁基铝/硫酸)4hv,refluxN HMeOBr /DMFN HMeOBrNOMe3NBrH 3C CHCOOHH 3CP,Br 100℃(CH 3)2CHCOBrCH 3NHCOCH 3Br,CH COOH 50-55℃CH 3NHCOCH 3BrHNCS,(C 6H 5)3PHCOOHAgNO /KOHr.t.CO 2AgBr /CCl heat,1hBrBr NH 21)NaNO ,HCl,H O Br F2)HPF 6Br N 2PF 6△(168℃)OHO O OHOMeMeI/NaOHOMeO O OHOMeNNHORHN HHOArNH O N O OK RX/DMFN O ORNH 23N CHMeH /Raney NiNHCH 2CHCF 3NH 2+ClCOOH无水K 23105-110℃F 3C NHHO 2C N H+O CH 3NCH 3KNOO+O DMFNO O PhHNOOPhH NNH.2+OOBrOMeSnCl 0℃OOMeO2OLiN CHON CHO3+NO 2CO 2HDEAD/Ph 3r.t.,1h2NCO 22NNHO OHOOHNS S N/PPh 3PhH/r.t.HOOHH 3C NCH 3OH1)(CH 3CH 2CO)2O/Py2)HClH 3C NCH 3OCOCH 2CH 3.HCl(Anadol)NNNO OHNClClONNCH 3.HClpy/CH 2Cl 2NNNO N ClONN OCH 3(Zopiclone)O O O+PhCH 2CHCOOHNH 2Tol refiux,2hN OOCHCOOH CH 2PhS+H 3COO O CH 3H PO reflux,2hSO CH 3O O O+CH 3AlCl 390℃,3hCO 2HOCH 3NEtO 2CCO 2EtBF 320℃,15minNEtO 2CON HDMF/POCl CH 2Cl 2H 2ON HCHOON HONOCOClEt 3NOO2N Boc+HNDCC/CH Cl N BocNOHCH3 O ClCOPhOCOPhCH3OOHO ONH3COH3CONHCOCH3POCl3,toluene△H3COH3CONCH3OCH3+O OCH3CH3OAldol缩合OHCH3OO+BrCF2COOC2H5OHCF2COC2H5OO1)BrMg PhOHPh+HOH+HClZnCl Cl+H2OH32CHO3 NH2OCH3NH3COCH3148R(C6H5)3P CR1R2(C6H5)P CR1R2CR4R3R3R4CR1R2(C6H5)3CCR1R2R4R3+3Ph3P=CH23CHO+(C6H5)3P COOC2H5COOC2H5LiAlH4+NO220℃NO2CCH3H3CCH3CH2NH2HNO2CCH3H3CCH3CH N2CCH3H3CCH32CH3NH2HO2C2HO2CHHH3C OHOH C Ph PhOH H SO /Et Or.t./3h2O Ph PhOH OH0.2molSnCl /HC(OMe)-20℃/5minOON 22240min/-78℃/-N 2C Ohv,O /CH Cl -78℃~-10℃/20minONH 2ONOHHOOCCH 3CH 3COOH NaN /H SO /CHCl r.t.,25hHOOCCH 3CH 3NH 2HC OCH 333HO C OCH 3HC OCH 3HO C OCH 3HHC OHCH 33O C OPhC OH3-HCO O2N CH3CO3H/AcOHO2NCOOCOO2N33O2N C O OHCOHO2NO2COOHO2N-HO C C CRheatOHC C C RO OOCO2EtOCO2EtPhPh150℃PhPhCH2CH2350℃1hOHHO 3H 2SO 4OOCH 3CHOOOCH 3CHOOHOO CH 2OHCH 2Cl 2OOCHOOHON HNO CH 3OOAc34r.t.ON HN OCH 3OOAcOHCHOOH4(60%)OOOH CHOC H COOHOHO C OHOH OHt-BuOOH 6OOOsO4OHHOHOHCH3CrO(Py)CH3OOH333OH3Ph COCH2CH2COOHZn-Hg/HCl/TolCH2CH2CH2COOHPhCHCHPh COOEtZn-Hg/HClheatPhCH2CH2COOEtORR'H NNHNNH2RR'RCH2R'+N2 CO H NNHCNNH2DMSO ON3CH3HCON(CH)OHN(CH3)2CHOHCOOHOHNH(CH3)2 2N(CH3)2HCOOHCNNO 3B H /THF25℃NO 3CH 2NH 2O 2NHC CN CH 3495℃,1.5hH 2NHC CH 3CNHOO 2N NO 22480~85℃HOH 2N NO 2FCHO +NHFHCNF2Zn(BH )COClNO 2O 2NCHONO 2O 2NGlymeLiAlH[OC(CH )]H 3COC NH 3COCHODIBAL-H /H 2SO 4。
药物合成习题答案
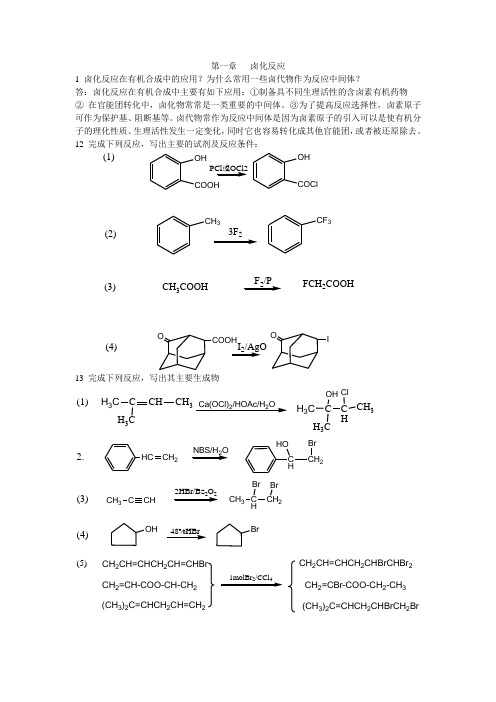
13完成下列反应,写出其主要生成物
第二章烃化反应
一√烃化剂的种类有哪些?进行甲基化和乙基化反应时,应选用那些烃化剂?引入较大烃基时选用那些烃化剂为好?
答:烃化剂种类主要有:卤代烷类;硫酸酯、磺酸酯类;醇、醚类;烯烃类;环氧烷类;重氮甲烷;甲基化和乙基化时选用的烃化剂为:卤代烃RX(R为甲基或乙基,);硫酸二甲酯或硫酸二乙酯,重氮甲烷。引入较大的烃基时选用芳基磺酸酯。
答:KmnO4的氧化能力在酸性条件下最强;中性和碱性条件下氧化能力相当且相对较弱,两者只是使用场合有些不同。KmnO4主要用于烯键的断裂氧化、将醇氧化成醛或酮和将醛氧化成酸。
16完成下列反应(12345)
(1)
(2)
(3)
(4)
(5)
重排反应
完成下列反应,并注明反应名称
1
2
3
4
5
6
3在Backmann重排中常用的催化剂有那几种?
用LiAlH4反应结束后可加入乙醇、无水乙醚或10%氯化胺水溶液以分解未反应的LiAlH4和还原物;NaBH4反应结束后可加稀酸分解还原物并使剩余的NaBH4生成硼酸,便于分离。
七、√完成下列反应
九、√完成下列反应
第三章酰化反应
2.常见的酰化剂有哪些?他们的酰化能力、应用范围、以及使用条件上有何异同点?
答:常见的酰化剂有:羧酸、羧酸酯、酸酐、酰氯、酰胺等。
羧酸的酰化能力较弱,可用于C-酰化、N-酰化和O-酰化,一般需设法活化羧酸以增强羰基的亲电能力。
羧酸酯的酰化能力比羧酸弱,可用于N-酰化和O-酰化反应,一般应在高温下进行反应,且以质子酸、Lewis酸或醇钠进行催化。
相转移催化氢化:指在相转移催化剂的作用下所进行的催化氢化反应。相转移催化剂是指在非均匀相反应中,它能使水相中的反应物转入有机相,从而改变了离子的溶剂化程度,增大离子反应活性,加快反应速率,简化处理手续的一种有机试剂。
药物合成反应习题及答案

药物合成反应习题及答案一、举例解释下列概念:1,官能团保护;为什么保护?当分子中有多个官能团,想在某一官能团进行转换反应,为了不使其他官能团影响反应,需对这些官能团进行衍生化,这就是官能团的保护。
达到反应目的后再还原这些官能团。
理想保护基:试剂易得、无毒,保护基稳定,引入和脱去反应选择性好,收率高。
2,相转移催化剂; 一种与水相中负离子结合的两性物质,可以把亲核试剂转移到有机相进行亲核反应。
相转移催化剂优点:克服溶剂化作用;不需无水操作;可用无机碱代替有机金属碱;降低反应温度。
3,重排反应;重排反应是指在同一分子内,某一原子或基团从一个原子迁移至另一原子而形成新分子的反应。
按反应机理可分为亲电重排、亲核重排、自由基重排和协同重排。
4,合成子;合成子:组成靶分子或中间体骨架的各个单元结构的活性形式.包括:离子合成子、自由基或周环反应所需的中性分子。
离子合成子:包括 d 合成子和a合成子d 合成子: 亲核性的离子合成子d---donor of electrond 合成子等价试剂a合成子:氧化性或亲电性的离子合成子a合成子:等价试剂5,协同反应协同反应:在反应过程中,若有两个或两个以上的化学键破裂和形成时,都必须相互协调地在同一步骤中完成。
6, 非均相催化氢化: 催化剂、反应物、试剂和氢供体在两项或多项中反应,催化剂自成一相,称为非均相催化氢化。
催化剂自成一相称为非均相催化剂如Pd/C为催化剂,氢气为氢供体,在反应液中还原双键的反应。
1) DMAP2) DMF3) DCC4) TBAF1) Aromatic Electrophilic Substitution; 芳香亲电取代2) Phase-transfer catalyst; 相转移催化剂3) Carbocations; 碳负离子4) trifluoroacetic anhydride.三氟乙酸酐Ryoji Noyori was awarded the Nobel Prize in 2001, What did he discover?Ryoji Noyori日本名古屋大学的野伊良治因在手性催化氢化反应方面做出了突出贡献而被授予2001年Nobel化学奖。
药物合成反应习题答案

药物合成反应习题答案药物合成反应习题答案药物合成反应是药物化学中的重要内容,通过合成反应可以获得特定结构的化合物,从而用于研发新药。
在药物合成反应的学习过程中,习题是不可或缺的一部分,通过解答习题可以加深对药物合成反应的理解和应用。
下面将给出一些药物合成反应习题的答案,帮助读者更好地掌握这一知识点。
1. 请给出以下反应的产物:(a) CH3CH2CH2MgBr + H2O(b) CH3CH2CH2COOH + SOCl2(c) C6H5CH2OH + H2SO4(a) CH3CH2CH2MgBr + H2O答案:CH3CH2CH2OH + Mg(OH)Br(b) CH3CH2CH2COOH + SOCl2答案:CH3CH2CH2COCl + SO2 + HCl(c) C6H5CH2OH + H2SO4答案:C6H5CH2OSO2OH + H2O2. 请给出以下反应的产物和反应类型:(a) CH3CH2CH2Br + NH3(b) CH3COOH + CH3OH(c) CH3CH2CH2OH + PCl5(a) CH3CH2CH2Br + NH3答案:CH3CH2CH2NH2 + HBr反应类型:亲核取代反应(b) CH3COOH + CH3OH答案:CH3COOCH3 + H2O反应类型:酯化反应(c) CH3CH2CH2OH + PCl5答案:CH3CH2CH2Cl + POCl3 + HCl反应类型:亲电取代反应3. 请给出以下反应的产物和反应机理:(a) CH3CH2CH2OH + H2SO4(b) CH3CH2CH2COOH + NaOH(c) CH3CH2CH2Br + Mg(a) CH3CH2CH2OH + H2SO4答案:CH3CH2CH2OSO2OH + H2O反应机理:在酸性条件下,H2SO4负责质子化,使得CH3CH2CH2OH中的羟基离子化,生成CH3CH2CH2O+,然后与H2SO4中的SO42-发生亲核取代反应。
药物合成习题及答案3

CDI 11.写出以下保护基缩写所代表的中、英文全称及结构式。 (1)Cbz (2)Boc (3)Fmoc 参考答案:(1) Cbz = Benzyloxycarbonyl,苄氧羰基;(2) Boc = t-Butylcarbonyl,叔丁氧羰基; (3) Fmoc = 9-Fluorenylmethylcarbonyl,9-芴甲氧羰基。
NCN
可以与有一定酸性的羟基加成,形成活性酯或活性酚醚作为烃化试剂或酰化剂使用。 DCC 在强烈条件下可使酚-醇偶联即酚的烃基化(生成酚醚——上一章)及生成酸酐。DCC 最常用于多肽合成中羧基-胺偶联生成肽。所以 DCC 是一个在药物合成中非常重要的脱水缩 合试剂。 5.用于酯化反应的活性羧酸酯(酰化剂)主要有哪些类型?其结构上的共同特点是什么? 参考答案:用于酯化反应的活性羧酸酯(酰化剂)主要有:羧酸硫醇酯,羧酸吡啶酯,羧酸 三硝基苯酯,羧酸异丙烯酯,1-羟基苯并三唑的羧酸酯。*关于活性酯试剂的共同特点归纳 如下:活性酯是不稳定化合物,构成的活性酯羰基的亲电性较强;形成活性酯的醇部分一般 是个良好的离去基团,离去后或是一个酸性较强的醇(如羧酸三硝基苯酯中的离去基团三硝 基苯酚),或是一个稳定的非醇类化合物(如甲基吡啶酮、丙酮等),从而促使酯交换完全。 6.在使用混合酸酐酰化剂时,一般期望转移的酰基部分与另一部分相比有什么差别? 参考答案:如羧酸-三氟乙酸混合酸酐和羧酸-磺酸混合酸酐等,羧酸的酸性一般较弱,其 共轭碱的离去能力较差;另一部分酸的酸性较强(三氟乙酸、对甲苯磺酸等),其共轭碱(酸 根负离子)是比较好的离去基团。还有一种情况是利用空间位阻作用,控制两个酸性差别不 大的混合酸酐的选择性转移酰基。如 2,4,6-三氯苯甲酸与羧酸形成的混合酸酐。 7.氰化银(AgCN)可用于强化酰氯的酰基化能力,请说明其作用原理。 参考答案:银离子的可极化性诱导卤素氯离子极化,促使酰氯结构中的碳氯键的断裂(氯的 离去能力增加),从而增强酰氯的酰化能力。 8.试比较 α-卤代乙酰基与未取代的乙酰基在用作乙酰基保护基使用时的适用性。 参考答案:常用的α-卤代乙酰可以是RCO-(R=ClCH2-、Cl2CH-、Cl3C-、CF3-、等)。 α-卤代乙酰化与未取代的乙酰基比较,由于卤素的引入使羰基碳原子的亲核性增强而易于水 解,故可利用这一性质进行选择性脱除(如保留乙酸酯、苯甲酸酯基),且反应温度低,收 率高。 9.简述羧酸为酰化剂制备酰胺的反应历程(用反应式表示)、反应的特点及其适用性。
药物合成反应综合习题与答案-2

《药物合成反应》综合习题与答案(答案附后)一、判断题。
1.NBS是N-氯代丁二酰亚胺。
2.烃化试剂如R-Br,一般提供烃化反应的负电中心。
3.酰化试剂一般提供酰化反应的正电中心,表现在羰基的碳原子上。
4.SN1反应的典型特征是生成构型反转的产物。
5.Friedel-Crafts烷基化底物中苯环上存在给电子基团,会促进反应的发生。
6.LiAlH4的还原性弱于NaBH4。
7.卤仿反应为甲基酮类化合物在酸性条件下发生的α-H的多次卤代水解。
8.还原反应是有机分子中增加H的反应。
9.氰基是一种吸电子能力极强的基团,这种能力强于硝基。
10.不饱和烃与卤素的加成反应中,Cl2易按桥型卤正离子机理进行。
二、选择题。
1. 药物合成反应的主要任务是。
A. 研究药物的毒性反应B. 研究药物的生物活性C. 研究药物合成及修饰方法D. 研究药物的剂型改造2.下列碳正离子稳定性最弱的是。
A. RCH2+B. H3C+C. R2CH+D. R3C+3.以下有关Friedel-Crafts烷基化反应的影响因素正确的是。
A.底物芳环上存在吸电子基团,有助于反应的发生B.底物芳环上存在给电子基团,有助于反应的发生C.质子酸的催化活性强于Lewis酸D. HF的催化活性弱于磷酸4.氰基还原得到的产物类型是。
A. 酰胺B. 脂肪胺C. 羟基D.亚甲基5.以下基团的吸电子能力最强的是。
A. 硝基B. 苯基C. 磺酰基D. 酯基6.亲核反应、亲电反应最主要的区别是。
A. 反应的动力学不同B. 反应要进攻的活性中心的电荷不同C. 反应的热力学不同D. 反应的立体化学不同7.共轭二烯烃与烯烃、炔烃(亲二烯)进行环化反应,生成环己烯衍生物的反应称为。
A. Diels-Alder反应B. Perkin反应C. Michael反应D. Blanc反应8.由羧酸为原料制备酰氯的过程中,最常的优良试剂是。
A. PCl5B. SOCl2C.PCl3D. POCl39. 自由基反应的条件通常是。
药物合成习题及答案5

O BnO
O H
H N
OH O H N
BnO
HO
-H , - OH OH
BnO
OH
7.指出下列反应的机理过程
O O
O NaOEt EtOH O
参考答案:经两次 Michael 反应,历程如下:
O
O
O EtO
O
O O
O O
四、连续缩合反应
参考答案:
5
药物合成反应
第四章 缩合反应习题参考答案
6
药物合成反应
第四章 缩合反应习题参考答案
7
药物合成反应
第四章 缩合反应习题参考答案
8
药物合成反应
第四章 缩合反应习题参考答案
五、定向合成
1.以亚甲二氧基苯乙醛为原料(其他无机原料任选)合成以下化合物:
O
CHO
O
O
O
NH
O
O
参考答案:最简单的两步反应,先经醛的还原胺化制备芳基乙胺衍生物,再经 Pictet-Spengler
药物合成反应
第四章 缩合反应习题参考答案
第四章 缩合反应习题参考答案
一、简述题
本章的人名反应:要求简要叙述反应定义并举一例说明。 1.Claisen-Schimidt 反应:芳醛与含有 α-活性氢的醛、酮之间的缩合,生成 α,β-不饱和醛、 酮。(反应举例略 p180) 2.Tollens 缩合:甲醛与含有 α-活性氢的醛、酮之间的缩合(羟甲基化),生成 β-羟基醛、 酮或其脱水物——α,β-不饱和醛、酮。(反应举例略 p184) 3.Connizzaro 反应和交叉 Connizzaro 反应:醛类化合物在强碱处理下发生歧化反应,两 种不同醛之间的氧化反应反应。(反应举例略 p185) 4.Robinson 环化反应:分子内的 Aldol 反应。(反应举例略 p185) 5.Prins 反应:烯烃与甲醛(或其他醛)在酸催化下加成得 1,3-二醇或其环状缩醛 1,3-二氧 六环及 α-烯醇的反应。(反应举例略 p185) 6.Reformatsky 反应:醛或酮与 α-卤代酸酯在金属锌粉存在下缩合而得 β-羟基酸酯或脱水 得 α,β-不饱和酸酯。(反应举例略 p188) 7.Grignard 反应:有机卤化物与金属镁在无水醚存在下反应生成格式试剂(Grignard’s Reagents),后者再与羰基化合物(醛、酮、酯等)反应得到相应的醇。(反应举例略 p191) 8.Normant 改进法:采用无水四氢呋喃作为制备格式试剂的溶剂体系。(反应举例略 p192) 9.Blonc反应:芳烃在甲醛、氯化氢及无水ZnCl2(或AlCl3、SnCl4)或质子酸等缩合剂存在 下,在芳环上引入氯甲基(—CH2Cl)的反应,也称氯甲基化反应。(反应举例略p193) 10.Mannich 反应:具有活性氢的化合物与甲醛(或其他醛)、胺进行缩合,生成氨甲基衍 生物的反应及其类似反应。(反应举例略 p192) 11.Pictet-Spengler 反应:β-芳乙胺与羰基化合物在酸性溶液中缩合生成 1,2,3,4-四氢异喹啉 的反应。(反应本质是 Mannich 氨甲基化反应的特例 p198) 12.Strecker 反应:醛、酮类与氰化氢和过量氨(和胺类)作用生成 α-氨基腈,再经酸或碱 水解得到(dl)-α-氨基酸类的反应。(反应举例略 p199) 13.Michael 反应(加成):活性亚甲基化合物和 α,β-不饱和羰基化合物在碱性催化剂存在 下发生加成缩合,生成 β-羰烷基类化合物的反应。(反应举例略 p202) 14.Wittig 反应:羰基化合物醛、或酮与 Wittig 试剂(烃代亚甲基三苯膦、ylide 叶立得、 内鎓盐)反应,生成相应的烯类化合物及氧化三苯膦。又称羰基烯化反应。(反应举例略 p207) 15.Horner 反应及 Wittig-Horner 反应:利用磷酸酯与醛、酮类化合物在碱存在下作用生 成烯烃的反应。(反应举例略 p212) 16.Knoevenagel 反应:活性亚甲基化合物在氨、胺或其羧酸盐的催化下,与醛、酮发生 Aldol 缩合,脱水得 α,β-不饱和化合物的反应。(反应举例略 p213) 17.Stobbe 反应:丁二酸酯或 α-烃基取代的丁二酸酯在碱性试剂存在下,与羰基化合物进 行缩合而得 α-烷烃(或芳烃)亚甲基丁二酸单酯的反应。(反应举例略 p216) 18.Perkin 反应:芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合,生成 β-芳基 丙烯酸类化合物的反应。(反应举例略 p217) 19.Erlenmeyer-Plöchl 反应:α-酰氨基乙酸在醋酸和醋酸钠(或碳酸钾)存在下,与芳香 醛(或其他醛)缩合,先制成二氢噁唑酮(azlactone)中间体,经水解、还原等反应,生成 α-氨基酸或 α-酮酸等衍生物的反应。(反应举例略 p218) 20.Darzens 反应(缩合):醛或酮与 α-卤代酸酯在碱催化下缩合生成 α,β-环氧羧酸酯(缩 水甘油酸酯)的反应。(反应举例略 p220) 21.Diels-Alder 反应(双烯合成或环加成反应):共轭二烯烃与烯烃、炔烃进行环化加成,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
P15制备稀丙位的卤化物4hv,refluxP17芳杂环化合物的卤取代N HMeOBr /DMFN HMeOBrP34醚和卤化磷及DMF 的反应NOMe3NBrP41习题 反应产物 H 3C CHCOOHH 3CP,Br (CH 3)2CHCOBrCH 3NHCOCH 3Br,CH COOH 50-55℃3NHCOCH 3Br653反应条件COOHAgNO /KOHCO 2AgBr /CCl Br(P37)Br NH 21)NaNO ,HCl,H O Br F2)HPF 6Br N 26△(168℃)(P40)P52有位阻或螯合酚的烃化O HOO O OMeOMeOO OHOMeP54 DCC缩合法HOR HHOArNHCONH+ArORP56伯胺的制备——Gabriel反应(肼解法)NH OO KOH/EtOHNOK NORNH NHONHNH+RNH2P62还原烃化法的应用NH23N CHMeH/Raney NiNHCH2CH3P63 Ullmann反应:芳胺的N-芳烃化CF3NH2+ClCOOH23105-110℃F3CNHHO2CP65 芳烃的烃化:Friedel-Crafts反应R1+R C AlCl3XR'R''R'CR''RRAlCl3XR1CR'R R''+AlCl3+HXP79稀胺的C-烃化N H +OCH3NCH3P84习题反应产物KNO O+OON OOPhOOPhOONH222.2+OOBrOMeSnCl0℃OOMeO反应条件2低温OLi(P77 )P853(P77)O原子上的酰化反应P92羧酸为酰化剂——伯醇酯的制备+2CO2HDEAD/Ph3r.t.,1h2N CO22NNHOO P95活性酯用于大环内脂合成NS SN/PPh3PhH/r.t.HOP98酸酐为酰化剂H 3C NCH 3OH1)(CH 3CH 2CO)2O/Py2)HClH 3C NCH 3OCOCH 2CH 3.HCl(Anadol)P101酰氯为酰化剂——仲醇的酰化NNNO OHNClClONNCH 3.HClpy/CH 2Cl 2NNNON ClONN OCH 3(Zopiclone)N 原子上的酰化反应P107 酸酐为酰化剂O O O+PhCH 2CHCOOH2Tol refiux,2hN OOCHCOOH CH 2PhC 原子上的酰化反应P113 Friedel-Crafts 反应(芳烃取代成芳酮)S+H 3COOO CH 3H PO reflux,2hSOCH 3O O +CH 3AlCl 390℃,3hCO 2HOCH 3NEtO 2CCO 2EtBF NEtO 2COP116 Vilsmeier-Haack 反应(芳环引入醛基)N HDMF/POCl CH 2Cl 2H ON HCHOP122利用烯胺化进行的C-酰化反应ON HONOCOClEt 3NOO2P123习题 反应产物N +HNDCC/CH Cl N BocN反应条件OHCH 3OCOPhCH 3OOHOO OONP124H 3CO H 3CONHCOCH 3POCl 3,toluene△H 3CO H 3CON CH 3Ac O,py H 3CO H 3CON CH 2COCH 3P133 Robinson 环化法OCH 3+OO CH 3CH 3O OHCH 3O -H 2OCH 3Oα-羟烷基化(Aldol 缩合) P136 Reformatsky 反应 O+BrCF 2COOC 2H 5OHCF 2COC 2H 5OP138 Grignard 反应O1)BrMg PhOHPhα-卤烷基化(Blanc 反应) P139反应通式+H O+HClZnCl Cl+H 2Oα-氨烷基化(Mannich 反应) P143 Pictet-Spengler 反应H323NH 2OCH 3N H 3CO3羰基烯化反应(Wittig 反应) P148反应机理148R (C 6H 5)3C R1R 2+(C 6H 5CR 1R 2CR 4R 3CR3R 4C R 1R 2(C 6H 5)3C C R 1R 2R 4R 3+(C 6H 5)3POP149 制备环外烯键化合物3Ph P=CH 3P150 制备共轭多烯化合物CHO+(C 6H 5)3PCOOC 2H 5COOC 2H 5LiAlH CH 2OHP165 习题 反应产物+NO 220℃NO 2C 到C 重排Wagner-Meerwein 重排P170 胺与亚硝酸作用生成碳正离子C CH 3H 3C CH 3CH 2NH 2HNO 2C CH 3H 3C CH 3CH 2N N2C CH 3H 3C CH 32P171CH 3NH 2HO 2C2HO 2CHHH 3C OHPinacol 重排P175制备环状酮(Tiffenfan 扩环) OH C Ph PhOH H SO /Et Or.t./3h2O Ph PhOH OH0.2molSnCl /HC(OMe)OWoff 重排(α-重氮酮生成烯酮) P182ON 22240min/-78℃/-N 2C Ohv,O /CH Cl -78℃~-10℃/20minOC 到杂重排Beckmann 重排(肟生成取代酰胺) P185立体专一性NH 2ONOHHNOSchmidt 反应 (叠氮酸) P191叠氮酸与羧酸生成伯胺HOOCCH 33COOH NaN /H SO /CHCl HOOCCH 33NH 2Baeyer-villiger 反应(酮与过氧酸重排成酯) P193HC OCH 333HO C OCH 3机理OCH 3HO C OCH 3HC OHCH 33O C OPhC OH3-HO O 2NCH 3CO 3H/AcOH O 2NCO O机理CO O 2NCH 3CO 3H/AcOHO 2NCO OHCOH O 2N O 2C OH OC OCH 3C OOH O 2N-Hσ-键迁移重排P199 Claisen 重排(烯丙基芳基醚重排为邻烯丙基酚)O C OH C C C R机理C RCO C HC C R异构化OH C C C RP200脂肪族Claisen 重排OOOCO 2EtOCO 2EtP202 cope 重排Ph Ph150℃Ph PhCH 2CH2350℃习题 反应产物 P205OHHO CH 3COOH H 2SO 4OP207OCH 3CHOOOCH 3CHOOH(P199烯丙基重排到对位)醇类的氧化P220 氯铬酸吡啶鎓盐(PPC )氧化法OO CH 2OHCH 2Cl 2OO CHOP222 DMSO-DCC 氧化法OHON HNO CH 3OOAc 34r.t.ON HN OCH 3OOAcOHCP225 1,2-二醇的氧化HOOH4OO醛酮的氧化P226 Dakin 反应OH CHOC H COOHOH O C OHOH OH烯键化合物的氧化P229 不与羰基共轭的烯键的环氧化6P232顺式羟基化OOsO OHHOH OH习题 反应条件 P248CH 33.2CH 3O (p218 Collins 试剂 烯丙酮的制备)3333(P229 过氧酸环烯烃环氧化)羰基的还原P263 Clemmensen 反应(酸性锌汞齐还原醛酮为甲基亚甲基) Ph C OCH 2CH 2COOHZn-Hg/HCl/TolCH 2CH 2CH 2COOHPhC H C HPh COOEtZn-Hg/HCl heatPhCH 2CH 2COOEtP264 Wolff-kishner-黄鸣龙还原反应OR R'H NNH NNH 2R R'R CH 2R'+N 2P265 腙还原为烃CO H NNH CN NH 2DMSOC HHP272 Leuckart-Wallach 反应O NCH 3CH 3HCON(CH )OHN(CH 3)2CHO HCOOHOHNH(CH 3)22N(CH 3)2HCOOH 中间体羧酸及衍生物的还原 P278 金属复氢化物的还原CNNO 3B H /THF25℃NO 3CH 2NH 2含氮化合物的还原P281 Benoxaprofen 中间体制备 O 2NHC CN 34H 2NHC CH 3CNP282 HOO 2N NO 224HOH 2N NO 2习题 反应产物 P290FCHO +NHFHC NFH 2C N2Zn(BH )反应条件 P291COClNO 2O 2NCHONO 2O 2NLiAlH[OC(CH )](三叔丁氧基氢化铝锂/甘醇二甲醚) H 3COC NH 3COCHODIBAL-H /H 2SO 4(氢化二异丁基铝/硫酸)4hv,refluxN HMeOBr /DMFN HMeOBrNOMe360~80℃NBrH 3C CHCOOHH 3CP,Br 100℃(CH 3)2CHCOBrCH 3NHCOCH 3Br,CH COOH 50-55℃CH 3NHCOCH 3BrNCS,(C H )PCOOHAgNO /KOHr.t.CO 2AgBr /CCl heat,1hBrBr NH 21)NaNO ,HCl,H O Br F2)HPF 6Br N 26△(168℃)OHO O OOMeMeI/NaOHOMeO O OHOMeNNHORHN HHOArNH OONOKRX/DMFNORNH23N CHMeH/Raney NiNHCH2CHCF3NH2+ClCOOH23105-110℃F3CNHHO2CN H+OCH3NCH3 KNO O+ON OOPhOOPhH NNH.2 +OOBrOMeSnCl0℃OOMeOi-Pr 2NLi 低温OLi RXN CHON CHO3+NO 2CO 2HDEAD/Ph 3r.t.,1h2NCO 22NNHO OHOOHNS S N/PPh 3PhH/r.t.HOOHH 3C NCH 3OH1)(CH 3CH 2CO)2O/Py2)HClH 3C NCH 3OCOCH 2CH 3.HCl(Anadol)NNNO OHNClClONNCH 3.HClpy/CH 2Cl 2NNNO N ClONN OCH 3(Zopiclone)O O O+PhCH 2CHCOOHNH 2Tol refiux,2hN OOCHCOOH CH 2PhS+H 3COO O CH 3H PO reflux,2hSO CH 3O O O+CH 3AlCl 390℃,3hCO 2HOCH 3NEtO 2CCO 2EtBF 320℃,15minNEtO 2CON HDMF/POCl CH 2Cl 2H 2ON HCHOON HONOCOClEt 3NOOH 2O HClN +HNDCC/CH Cl N BocNOHCH3 O ClCOPhOCOPhCH3OOHO O NH3COH3CONHCOCH3POCl3,toluene△H3COH3CONCH3OCH3+O OCH3CH3OAldol缩合OHCH3OO+BrCF2COOC2H5OHCF22H5OO1)BrMg PhOHPh+HO+HClZnCl Cl+H2OH32CHO3 NH2OCH3NH3COCH3148R(C6H5)3P CR1R2(C6H5)CR1R2CR4R3R3R4CR1R2(C6H5)3CCR1R2R4R3+3Ph3P=CH23CHO+(C6H5)3P COOC2H5COOC2H5LiAlH4+NO220℃NO2CCH3H3CCH3CH2NH2HNO2CCH3H3CCH3CH2N N2CCH3H3CCH32CH3NH2HO2C2HO2CHHH3C OHOH C Ph PhOH H SO /Et Or.t./3h2O Ph PhOH OH0.2molSnCl /HC(OMe)-20℃/5minOON 22240min/-78℃/-N 2C Ohv,O /CH Cl -78℃~-10℃/20minONH 2ONOHHOOCCH 3CH 3COOH NaN /H SO /CHCl r.t.,25hHOOCCH 3CH 3NH 2HOCH 333HO C OCH 3HC OCH 3HO C OCH 3HHC OHCH 33O C OPhC OH3-HOO2NCH3CO3H/AcOHO2NCOOOO2N33O2N C O OHOHO2NO2COOHO2N-HO CRheatOHC C C RO OOCO2EtOCO2EtPhPh150℃PhPhCH2CH2350℃1hOHHO 3H 2SO 4OOCH 3CHOO封管,Tol,215℃OCH 3CHOOHOO CH 2OHCH 2Cl 2OOCHOOHON HNO CH 3OOAc34r.t.ON HN OCH 3OOHCHOOH4(60%)OOOH CHOC H COOHOHO C OHOH OHt-BuOOH 6OOOsO4OHHOHOHCH3CrO(Py)CH3OOH333OH3PhOCH2CH2COOHZn-Hg/HCl/TolCH2CH2CH2COOHPhCHCHPh COOEtZn-Hg/HClheatPhCH2CH2COOEtORR'H NNHNNH2RR'RCH2R'+N2O H NNHCNNH2DMSO ON3CH3HCON(CH)OHN(CH3)2CHOHCOOHOHNH(CH3)2 2N(CH3)2HCOOHCNNO 3B H /THF25℃NO 3CH 2NH 2O 2NHC CN CH 3495℃,1.5hH 2NHC 3CNHOO 2N NO 22480~85℃HOH 2N NO 2FCHO +NHFHCNF2Zn(BH )COClNO 2O 2NCHONO 2O 2NGlymeLiAlH[OC(CH )]H 3COC NH 3COCHODIBAL-H /H 2SO 4。
