胃蛋白酶原II测定试剂盒(酶联免疫吸附法)产品技术要求meikang
HER2检测试剂盒(免疫组化法)说明书-Agilent

DAB 显色液。 5% 3, 3’-二氨联苯胺四盐酸显色剂溶液。
3×500mL
2×5
抗原修复液(包含清洗剂)(10×)。 0.1 mol/L柠檬酸盐缓冲液,1% 吐温-20,pH 5.7。
质控切片
P04605CN_01_SK00121-2CN/2017.02 2/26
P04605CN_01
10 × 试剂瓶
外。该试剂盒所提供的材料足够用于最多 10 次免疫组化染色。
数量
说明
1×22 mL
过氧化物酶阻断剂。 3%的过氧化氢,含有15 mmol/L的叠氮钠(NaN3)。
1×12 mL
1×22 mL
兔抗人HER2多克隆抗体。 即用型亲和分离的抗体,保存在0.05 mol/L Tris/HCl, 0.1 mol/L NaCl, 1%BSA, 酒 石黄(Tartrazin), 专利蓝V(Patentblue V), 15 mmol/L NaN3, pH 7.2溶液中。 免疫原:合成的HER2蛋白的C-末端(细胞质部分)片段部分,并偶联至血蓝蛋 白上。
2×22 mL
阴性质控试剂。
与HER2抗体等价蛋白浓度下的正常兔血清免疫球蛋白成分,保存在0.05 mol/L Tris/HCl, 0.1 mol/L NaCl, 15 mmol/L NaN3, pH 7.2,并含有1%BSA稳定剂的溶液 内。
1×1mL
DAB底物缓冲液。 50 mM咪唑, 1mM N, N'-乙基双 (2-[2-羟基苯基]甘氨酸) (EDHPA), 0.1%乙基苯基 聚乙二醇(Nonidet P-40), 0.02% 过氧化氢, 0.01% 氯化苯二甲烃铵, pH 7.5。
【检测原理】
HercepTest™检测试剂盒包含对常规处理的、石蜡包埋的样本进行两步法免疫组化染色 所需要的全部试剂。兔抗人 HER2 蛋白一抗孵育后,该试剂盒采用基于葡聚糖技术的即用型 显色试剂。该试剂包含羊抗兔二抗和偶联至葡聚糖多聚体骨架上的辣根过氧化酶分子。因此, 不需要再依次使用连接抗体,人免疫球蛋白显色试剂和胎牛血清之间的交叉反应也因为使用 固相吸附材料而消除。依次填加的色素原的酶转换,也使得显色反应发生于抗原所在部位。 标本需要复染和封片。反应结果在光学显微镜下观察。质控玻片包含 3 个福尔马林固定、石 蜡包埋的人类乳腺癌细胞系,染色强度分别在 0、1+、以及 3+,提供用于对染色结果进行 评估。这些细胞的染色强度与其所表达的受体密度一致。
胃蛋白酶原II(PGII)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk
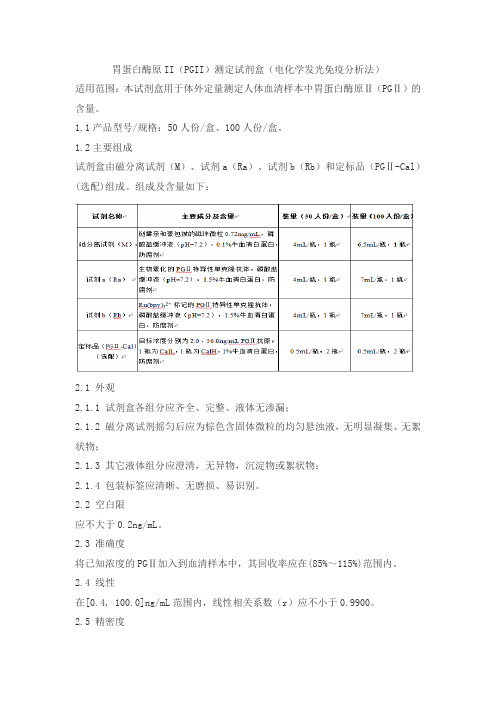
胃蛋白酶原II(PGII)测定试剂盒(电化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人体血清样本中胃蛋白酶原Ⅱ(PGⅡ)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成
试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(PGⅡ-Cal)(选配)组成。
组成及含量如下:
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;
2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;
2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限
应不大于0.2ng/mL。
2.3 准确度
将已知浓度的PGⅡ加入到血清样本中,其回收率应在(85%~115%)范围内。
2.4 线性
在[0.4, 100.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度
2.5.1 重复性
在试剂盒的线性范围内,测定高低两个水平的的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差
在试剂盒的线性范围内,用3个批号试剂盒分别检测高低两个水平的的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性
本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源至深圳新产业的PGⅡ定标液。
胃蛋白酶原试剂盒说明书

胃蛋白酶原试剂盒说明书一、产品简介胃蛋白酶原试剂盒是一种用于检测胃蛋白酶原水平的试剂盒。
胃蛋白酶原是一种消化酶,在胃中起到分解蛋白质的重要作用。
该试剂盒通过测量样品中胃蛋白酶原的含量,可以帮助医生评估胃黏膜功能和炎症程度,辅助诊断和监测相关疾病。
二、试剂盒组成本试剂盒包含以下组分: 1. 胃蛋白酶原检测试剂:用于检测样品中的胃蛋白酶原。
2. 样品稀释液:用于稀释样品,以确保浓度在检测范围之内。
3. 阳性对照液:含有已知浓度的胃蛋白酶原,用于验证试剂盒的准确性。
4. 阴性对照液:不含胃蛋白酶原,用于验证试剂盒的特异性。
三、使用方法1. 样品准备•收集患者的胃液样品,并将其转移至干净的离心管中。
•如样品浑浊或含有颗粒物,可先进行离心分离。
•如样品量不足,可使用样品稀释液进行适当稀释。
2. 试剂配置•打开胃蛋白酶原检测试剂瓶盖,取出所需量的试剂。
•按照试剂瓶上标示的比例,将试剂与样品混合均匀。
3. 反应孵育•将混合好的样品和试剂放置于恒温水浴中孵育一定时间。
•孵育时间和温度应根据试剂盒说明书中的要求进行设定。
4. 测量结果•在设定的反应时间后,取出孵育好的样品。
•使用本试剂盒所提供的分析仪器或读板器,按照仪器操作说明进行测量。
•记录测量结果,并根据说明书中提供的参考范围判断胃蛋白酶原水平是否正常。
四、注意事项1.本试剂盒仅供专业医务人员使用,请遵循相关操作规范。
2.所有试剂和样品均需避免直接接触皮肤和黏膜,如不慎接触,请立即用大量清水冲洗。
3.试剂盒的保存温度应符合说明书中的要求,避免高温或低温存放。
4.使用过程中,请勿混用不同批次的试剂盒,以免影响检测结果的准确性。
5.未使用完的试剂盒应密封保存,避免受到污染或湿气。
五、质量控制1.每次进行检测时,应同时使用阳性对照液和阴性对照液进行质量控制。
2.根据说明书中提供的质量控制范围,判断检测结果是否符合要求。
3.若阳性对照液和阴性对照液的检测结果超出质量控制范围,则表示本次检测结果可能不准确,需重新进行检测。
酶联免疫分析试剂盒说明书

人chemerin酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用预期应用ELISA法定量测定人血清、血浆或其它相关液体中chemerin含量。
实验原理本试剂盒应用双抗体夹心酶标免疫分析法测定标本中chemerin水平。
用纯化的抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入chemerin抗原、生物素化的抗人chemerin抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的chemerin呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1.酶联板:一块(96孔)2.标准品(冻干品):2瓶,每瓶临用前以样品稀释液稀释至1ml,盖好后静置10分钟以上,然后反复颠倒/搓动以助溶解,其浓度为20,000pg/ml,做系列倍比稀释后,分别稀释10,000pg/ml,5,000pg/ml,2,500pg/ml,1,250pg/ml,625pg/ml,312.5pg/ml,156pg/ml,样品稀释液直接作为标准浓度0pg/ml,临用前15分钟内配制。
如配制10,000pg/ml标准品:取0.5ml20,000pg/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3.样品稀释液:1×20ml/瓶。
4.检测稀释液A:1×10ml/瓶。
5.检测稀释液B:1×10ml/瓶。
6.检测溶液A:1×120ul/瓶(1:100)临用前以检测稀释液A1:100稀释,稀释前根据预先计算好的每次实验所需的总量配制(每孔100ul),实际配制时应多配制0.1-0.2ml。
如1ul检测溶液A加99ul检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制。
7.检测溶液B:1×120ul/瓶(1:100)临用前以检测稀释液B1:100稀释。
胃蛋白酶原Ⅱ(PGⅡ)检测试剂盒(化学发光法)产品技术要求广州瑞博奥生物

2.性能指标
2.1外观
试剂盒各组分应齐全、完整,液体无渗漏,试剂架无损坏;
晰,易识别。
2.2检出限
PGII检出限应不高于0.8ng/mLa
2.3线性
该试剂盒样本检测的线性区间为[1.5〜200]ng/mL,其相关系数R应不低于
0.9900=
2.4准确度
回收率应在85.0%〜115.0%范围内。
2.5精密度
2.5.1批内精密度
在试剂盒的剂量-反应曲线范围内,设置2个不同浓度的质控品,全自动操作试剂盒测定结果的变异系数(CV)应不高于8.0%o
2.5.2批间精密度
在3个不同批次产品之间,在试剂盒的剂量-反应曲线范围内,设置2个不同浓度的质控品,测定结果的的变异系数(CV)应不高于15.0%o
2.6特异性
PGII测定浓度不低于100ng/mLPGI样本,其测定结果应不高于0.5ng/mL。
胃蛋白酶原Ⅰ 胃蛋白酶原Ⅱ(PGⅠ PGⅡ)二合一测定试剂盒(荧光免疫层析法)产品技术要求海格德生物

胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ(PGⅠ/PGⅡ)二合一测定试剂盒(荧光免疫层析法)
1.性能指标
2.1 外观
2.1.1试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
2.1.2检测卡的外观应符合下列要求:外观平整、色泽均匀、边缘无毛刺,不能有色斑或污渍。
2.2物理检测
试纸条宽度均为4.0±0.5mm。
2.3液体移行速度
应不小于10.0mm/min。
2.4 空白限
PGⅠ空白限应不高于2ng/mL;
PGⅡ空白限应不高于2ng/mL。
2.5准确度
在试剂盒线性区间内,检测两个不同浓度的工作校准品,测定值与标示值的相对偏差应不超过±15%。
2.6线性
PGⅠ:在线性范围(2~150)ng/mL内,试剂盒的线性相关系数r≥0.990,在(2~10)ng/mL区间内测定的线性绝对偏差不超过±1ng/mL,在(10~150)ng/mL区间内测定的线性相对偏差应不超过±15%。
PGⅡ:在线性范围(2~80)ng/mL内,试剂盒的线性相关系数r≥0.990,在(2~10)ng/mL区间内测定的线性绝对偏差不超过±1 ng/mL,在(10~80)ng/mL区间内测定的线性相对偏差应不超过±15%。
2.7 重复性
用同一批号试剂盒测定两个不同浓度的内部参考品,要求变异系数CV≤15%。
2.8批间差
使用3个不同批号的试剂盒测定高、低两个浓度的参考品,要求批间变异系数CV≤15%。
抗M2型线粒体抗体(IgG)测定试剂盒(酶联免疫吸附法)产品技术要求万泰
抗M2型线粒体抗体(IgG)测定试剂盒(酶联免疫吸附法)适用范围:本试剂盒用于体外定量检测人血清样品中的抗M2型线粒体IgG抗体。
1.1 产品规格包装规格:48人份/盒,96人份/盒。
1.2 主要组成成分表1 试剂盒主要组成成分各组份主要组成:酶标板:包被有M2抗原;酶标试剂:辣根过氧化物酶标记的抗人IgG抗体;样品稀释液:含PBS的缓冲液;M2-IgG校准品:含4水平的M2-IgG;浓缩洗涤液:含表面活性剂的缓冲液;显色剂A液:含浓度不低于0.3g/L的过氧化物溶液;显色剂B液:含浓度不低于0.2g/L的TMB溶液;终止液:含浓度不高于2mol/L的硫酸溶液。
2.1 外观试剂(盒)各组份应齐全、完整,液体无渗漏;标签应清晰,易识别。
2.2 准确度回收实验:回收率应在100%±20%范围内。
2.3 空白限应不高于5.0 RU/mL。
2.4 测量系统的线性本检测系统的线性范围为[10,159]RU/mL,在[10,159]RU/mL范围内,线性相关系数r应不低于0.9900。
2.5 重复性检测低、高两个浓度重复性参考品CV1和CV2,变异系数CV(%)应均不超过15%。
2.6 批间差用3个批号试剂盒检测重复性参考品CV2,变异系数CV(%)应不超过20%。
2.7 稳定性效期稳定性:将2℃~8℃放置6个月的试剂盒检测2.1~2.5各项,应符合各项目规定的要求。
2.8 溯源性校准品溯源性应符合GB/T 21415-2008有关规定,可溯源至企业的工作校准品,并经与已上市产品比对赋值。
胃蛋白酶原I 胃蛋白酶原II测定试剂盒(荧光免疫层析法)产品技术要求北京康思润业生物
胃蛋白酶原I/胃蛋白酶原II测定试剂盒(荧光免疫层析法)适用范围:用于体外定量测定人全血、血浆、血清中胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ的含量。
1.1 包装规格1人份/盒、5人份/盒、20人份/盒、25人份/盒、50人份/盒、100人份/盒。
1.2 主要组成成分每种包装规格含相应人份数的检测卡、标记管、干燥剂、样品缓冲液及1个校准信息卡。
2.1外观2.1.1 检测卡使用铝塑单个密封包装,标签应完整清晰,内容物齐全,卡壳应整洁、无破损,扣合紧密;2.1.2 缓冲液为无色或淡黄色透明液体,不得有任何沉淀及絮状悬浮物。
2.2宽度试纸条宽度为4.0±0.2mm。
2.3装量样品缓冲液装量偏差应不大于±10%。
2.4移行速度液体移行速度不低于10mm/min。
2.5 空白限胃蛋白酶原Ⅰ的空白限不大于1ng/mL。
胃蛋白酶原Ⅱ的空白限不大于1ng/mL。
2.6线性—1 —胃蛋白酶原Ⅰ在[10,200] ng/mL范围内,线性相关系数应满足r≥0.990。
胃蛋白酶原Ⅱ在[5,100] ng/mL范围内,线性相关系数应满足r≥0.990。
2.7重复性用高浓度质控品(PGⅠ[100,200] ng/mL、PGⅡ[50,100] ng/mL)、低浓度质控品(PGⅠ[20,100]ng/mL、PGⅡ[10,50] ng/mL)为样本重复测定10次,其测定值的变异系数(CV)应不大于15%。
2.8准确度以胃蛋白酶原I,胃蛋白酶原II纯品配制的溶液对本试剂盒做回收试验,其回收率应在85%~115%范围内。
2.9批间差用3个不同批号的试剂盒分别测试样本,所得结果的相对极差(R)应不大于15%。
2.10 稳定性包装的试剂盒在2℃~30℃贮存,有效期为18个月。
在有效期满后六个月以内的试剂盒,分别检测2.1,2.2,2.3,2.4,2.5,2.6,2.7,2.8项,结果应符合各项目的要求。
2.11 溯源性根据GB/T 21415-2008及有关规定,提供校准曲线的赋值过程及不确定度等内容,溯源至企业工作校准品并与已上市产品比对赋值。
可溶性生长刺激表达基因2蛋白测定试剂盒(荧光免疫层析法)产品技术要求北京康思润业
可溶性生长刺激表达基因2蛋白测定试剂盒(荧光免疫层析法)适用范围:用于体外定量测定人全血、血浆、血清中可溶性生长刺激表达基因2蛋白(ST2)的含量。
1.1包装规格1人份/盒、5人份/盒、20人份/盒、25人份/盒、50人份/盒、100人份/盒。
1.2主要组成成分每种包装规格含相应人份数的检测卡、加样枪头、干燥剂、样本缓冲液及1个校准信息卡。
不同批号试剂盒中各组分不可互换。
2.1外观1)检测卡使用铝塑单个密封包装,标签应完整清晰,内容物齐全,卡壳应整洁、无破损,扣合紧密;2)缓冲液为无色或淡黄色透明液体,不得有任何沉淀及絮状悬浮物。
2.2装量样本缓冲液装量偏差应不大于±10%。
2.3宽度试纸条宽度为4.0±0.2mm。
2.4移行速度液体移行速度不低于10mm/min。
2.5空白限试剂盒的空白限不大于1.0ng/ml。
2.6线性在[5,200]ng/ml 范围内,线性相关系数应满足r≥0.990。
2.7重复性用高浓度[100,200]ng/ml、低浓度[10,50]ng/ml两水平样本重复测定10次,其测定值的变异系数(CV)应不大于15%。
2.8准确度用本试剂盒做回收试验,其回收率应在85%~115%范围内。
2.9特异性取不含可溶性生长刺激表达基因2蛋白的样本,加入以下物质平行检测3次,结果均应不大于1.0 ng/ml。
表1特异性2.10溯源性根据GB/T 21415-2008及有关规定,提供校准曲线的赋值过程及不确定度等内容,溯源至企业工作校准品并与已上市产品比对赋值。
2.11批间差用3个不同批号的试剂盒分别测试样本,所得结果的相对极差(R)应不大于15%。
2.12稳定性原包装的试剂盒在2℃~30℃贮存,有效期为12个月。
在有效期满后六个月以内的试剂盒,分别检测2.1,2.2,2.3,2.4,2.5,2.6,2.7,2.8,2.9项,结果应符合各项目的要求。
胃肠道六项介绍(肠道两项为主)
女
性
性
发
发
病
病
率
率
男
女
性
性
死
死
亡
亡
率
率
Wanqing Chen et al. CA CANCER J CLIN. 2016,66:115—132
肠易激综合征简介
肠 易 激 综 合 征 (Irritable bowel syndrome, IBS)是一种功能性肠道疾病, 表现为与排便或排便习惯改变相关的腹痛或 腹部不适。腹胀、腹泻、腹部膨隆和排便障 碍是常见的特征。
钙卫蛋白对炎症性肠病活动性的评价
C
反
应 蛋
VS
白
钙 卫 蛋 白
纳入了19项研究的荟萃分析显示,以内镜检查作为金标准时,钙卫蛋白评 价IBD活动性的敏感度和特异性分别为88%和73%,远优于C反应蛋白。
MH Mosli et al. American Journal of Gastroenterology. 2015,110(6):1—17.
动性的判断
儿科
➢ 功能性腹泻与感染性 腹泻的鉴别
体检中心
➢ 结直肠癌的早期筛查 指标之一
炎症性肠病与肠易激综合征的鉴别
➢ IBD和IBS患者钙卫蛋白水平就有明显的差 异,可作为有效的鉴别标志物
➢ 钙卫蛋白在鉴别IBD和IBS上远优于传统指 标,如C反应蛋白、红细胞沉降率等
Chang MH et al. Mol Med Rep. 2014,10(1):522—526
IBS是一种反复发作性功能性肠病,不 伴可发现的器质性病因。
这些症状并非IBS特有。
肠易激综合征的流行病学特点
欧美地区发病率较高,但近些年来亚太地区的发病率持续升高
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胃蛋白酶原II测定试剂盒(酶联免疫吸附法)
适用范围:用于体外定量检测人血清中胃蛋白酶原II的含量。
1.1 包装规格
包装规格为:48人份/盒、96人份/盒、192人份/盒、480人份/盒。
1.2 主要组成成分
2.1外观
试剂盒各组份应齐全、完整,液体无渗漏,包装标签应清晰。
2.2 净含量
液体试剂的净含量不少于标示值。
2.3 线性
线性范围为[1.0,43]μg/L,线性相关系数r≥0.9900。
2.4 空白检测限
不高于1.0μg/L。
2.5重复性
检测高、低两个浓度的样本,变异系数(CV)应不大于15% 。
2.6准确度
回收率在85%~115%。
2.7特异性
测定PGI浓度为200μg/L校准品中PGII的浓度,计算交叉反应率,应小于10%。
2.8批间差
检测一个高浓度的样本,批间变异系数(CV)应不大于15%。
2.9稳定性
2℃~8℃保存,有效期12个月,有效期末分别检测2.3~2.7项,其结果应符合各项要求。
2.10 校准品溯源性
试剂盒校准品按照GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,溯源到本公司工作校准品,工作校准品通过芬兰biohit公司试剂盒比对赋值。
