(完整版)【人教版】高中化学选修3知识点总结:第三章晶体结构与性质
【人教版】高中化学选修3知识点总结:第三章晶体构造与特性

【人教版】高中化学选修3知识点总结:第三章晶体构造与特性
1. 晶体的基本概念
- 晶体是由原子、离子或分子以一定的方式排列形成的固体物质。
- 晶体的结构由晶格和基元组成。
晶格是由离子或原子排列所形成的三维重复结构,基元是晶格中最小的具有完整晶体结构的部分。
2. 晶体的分类
- 按照构成晶体的粒子种类可分为离子晶体、原子晶体和分子晶体。
- 按照晶体的组成方式可分为金属晶体、离子晶体、共价晶体和导电晶体等。
3. 晶体的结构与性质
- 晶体的结构决定了其性质。
晶体的结构可以通过X射线衍射实验来确定。
- 晶体的性质包括硬度、熔点、热胀冷缩性、电导率、光学性质等。
4. 离子晶体的结构与性质
- 离子晶体的结构是由正、负离子按一定比例排列形成的。
- 离子晶体具有高熔点、脆性、电解质导电性等特点。
5. 共价晶体的结构与性质
- 共价晶体是由原子通过共价键相互连接而成的。
- 共价晶体具有较高的熔点、硬度和脆性,不导电。
6. 金属晶体的结构与性质
- 金属晶体是由金属原子通过金属键相互连接而成的。
- 金属晶体具有良好的导电性、导热性和延展性。
7. 晶体缺陷
- 晶体缺陷是指晶体中原子或离子的位置发生偏离或缺失的现象。
- 晶体缺陷包括点缺陷、面缺陷和体缺陷。
以上是第三章晶体构造与特性的知识点总结,希望对你的学习有所帮助。
【人教版】高中化学选修3知识点总结:第三章晶体结构与性质

【人教版】高中化学选修3知识点总结:第三章晶体结构与性质第一篇:【人教版】高中化学选修3知识点总结:第三章晶体结构与性质第三章晶体结构与性质课标要求1.了解化学键和分子间作用力的区别。
2.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
3.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
4.理解金属键的含义,能用金属键理论解释金属的一些物理性质。
5.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
要点精讲一.晶体常识 1.晶体与非晶体比较2.获得晶体的三条途径①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
3.晶胞晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”。
4.晶胞中微粒数的计算方法——均摊法如某个粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学中常见的晶胞为立方晶胞立方晶胞中微粒数的计算方法如下:注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状二.四种晶体的比较2.晶体熔、沸点高低的比较方法(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高.如熔点:金刚石>碳化硅>硅(3)离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
(4)分子晶体①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。
④同分异构体,支链越多,熔、沸点越低。
(5)金属晶体金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
【人教版】高中化学选修3知识点总结
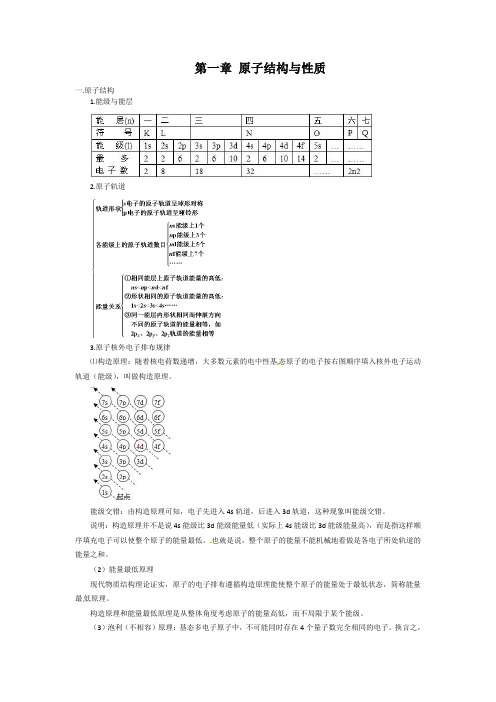
第一章原子结构与性质一.原子结构1.能级与能层2.原子轨道3.原子核外电子排布规律⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。
说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。
也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。
(2)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。
换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli )原理。
(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund )规则。
比如,p3的轨道式为或,而不是。
洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
4. 基态原子核外电子排布的表示方法(1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K :1s22s22p63s23p64s1。
(完整版)高中化学选修3知识点总结

高中化学选修3知识点总结二、复习要点1、原子结构2、元素周期表和元素周期律3、共价键4、分子的空间构型5、分子的性质6、晶体的结构和性质(一)原子结构1、能层和能级(1)能层和能级的划分①在同一个原子中,离核越近能层能量越低。
②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。
③任一能层,能级数等于能层序数。
④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。
⑤能层不同能级相同,所容纳的最多电子数相同。
(2)能层、能级、原子轨道之间的关系每能层所容纳的最多电子数是:2n2(n:能层的序数)。
2、构造原理(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。
(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。
(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np(4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。
根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。
(5)基态和激发态①基态:最低能量状态。
处于最低能量状态的原子称为基态原子。
②激发态:较高能量状态(相对基态而言)。
基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。
处于激发态的原子称为激发态原子。
③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。
利用光谱分析可以发现新元素或利用特征谱线鉴定元素。
高中化学选修3-物质结构和性质-全册知识点总结

高中化学选修3物质结构与性质知识点总结主要知识要点:1、原子结构2、元素周期表和元素周期律3、共价键4、分子的空间构型5、分子的性质6、晶体的结构和性质(一)原子结构1、能层和能级(1)能层和能级的划分①在同一个原子中,离核越近能层能量越低。
②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。
③任一能层,能级数等于能层序数。
④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。
⑤能层不同能级相同,所容纳的最多电子数相同。
(2)能层、能级、原子轨道之间的关系每能层所容纳的最多电子数是:2n2(n:能层的序数)。
2、构造原理(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。
(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。
(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E (5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np(4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。
根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。
(5)基态和激发态①基态:最低能量状态。
处于最低能量状态的原子称为基态原子。
②激发态:较高能量状态(相对基态而言)。
基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。
处于激发态的原子称为激发态原子。
③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。
利用光谱分析可以发现新元素或利用特征谱线鉴定元素。
【人教版】高中化学选修3知识点总结:第三章晶体排列与特性

【人教版】高中化学选修3知识点总结:第三章晶体排列与特性
本文档总结了高中化学选修3课程中第三章晶体排列与特性的主要知识点。
一、晶体的定义和特点
- 晶体是具有规则的、有序的三维排列的固体结构。
- 晶体呈现出明显的平面、直线和点的等级性。
- 晶体有着明确的晶体结构和晶体缺陷。
二、晶体排列
- 晶体的排列方式主要有原子堆积和离子堆积两种。
- 原子堆积有3种典型的结构类型:简单立方堆积、面心立方堆积和密堆积。
- 离子堆积有3种典型的排列方式:简单立方堆积、体心立方堆积和面心立方堆积。
三、晶体的类型
- 晶体分为金属晶体、离子晶体、共价晶体和分子晶体四种类型。
- 金属晶体由金属原子组成,具有良好的导电性和热导性。
- 离子晶体由阳离子和阴离子组成,具有高熔点和良好的溶解性。
- 共价晶体由共价键连接的原子组成,具有高硬度和高熔点。
- 分子晶体由分子间的弱力相互作用连接的组成,具有低熔点和易溶性。
四、晶体的缺陷
- 晶体的缺陷分为点缺陷、线缺陷和面缺陷。
- 点缺陷包括空位、间隙原子和杂质原子等。
- 线缺陷包括位错和螺旋位错。
- 面缺陷包括阴极空位和阳极不完整等。
以上是高中化学选修3课程中第三章晶体排列与特性的知识点总结。
以上信息仅供参考,如有需要请自行查阅教材或参考其他可靠资料确认。
人教版 化学 选修3 第3章第3节 晶体结构与性质

晶体中粒子分布详解
每8个Cs+、8个Cl-各自构成 立方体,在每个立方体的中心 有一个异种离子(Cs+或Cl-)。 在每个Cs+周围最近的等距离 (设为a/2)的Cl-有8个,在每 个Cs+周围最近的等距离(必 为a)的Cs+有6个(上、下、左、 右、前、后),在每个Cl-周围 最近的等距离的Cl-也有6个
(3)氧化物MO的电子总数与SiC的相等,则M为 __________(填元素符号)。MO是优良的耐高温材 料,其晶体结构与NaCl晶体相似。MO的熔点比 CaO的高,其原因是 ___________________________________________ _____________________________。 Na、M、Ca三种晶体共同的物理性质是 ________(填序号)。 ①有金属光泽 ②导电性 ③导热性 ④延展性
六方最密 Mg、Zn、 74% 12 堆积(镁型) Ti 面心立方 Cu、Ag、 74% 12 最密堆积 Au (铜型)
(2010· 高考题改编) (1)(2010· 山东高考题节选)铅、钡、氧形成的某化 合物的晶胞结构是:Pb4+处于立方晶胞顶点, Ba2+处于晶胞中心,O2-处于晶胞棱边中心。 ①该化合物化学式为________。 ②每个Ba2+与________个O2-配位。
氯化 铯晶 体
二 氧 化 碳 晶 体
每 8 个 CO2 构成立方 体,且在 6 个面的中心 又各占据 1 个 CO2。在 每个 CO2 周围等距离 ( 2a/2,a 为立方体棱 长)的最近的 CO2 有 12 个(同层 4 个、上层 4 个、下层 4 个)
金刚 石晶 体
金刚石晶体是一种空间网状结 构——每个C与另外4个C以共 价键结合,前者位于正四面体 的中心。晶体中所有C—C键 键长相等,键角相等(均为 109°28′);晶体中最小碳环 由6个C组成且六者不在同一 平面内;晶体中每个C参与了 4个C—C键的形成,C原子数 与C—C键数之比为1∶2
【人教版】高中化学选修3知识点总结:第三章晶体构造与属性

【人教版】高中化学选修3知识点总结:
第三章晶体构造与属性
晶体构造与属性是高中化学选修3课程中的重要内容。
本章主
要讲解了晶体的特点、晶体的拓扑结构、晶体的点阵和晶体的性质
等知识点。
1. 晶体的特点
- 晶体是由一定规律排列的原子、离子或分子组成的固体物质。
- 晶体具有规则的几何外形,有明确的晶面和晶点。
- 晶体中离子、原子或分子按照一定规律排列形成周期性结构,具有长程有序性。
2. 晶体的拓扑结构
- 晶体的拓扑结构是指晶体中原子、离子或分子之间的连接关
系和排列方式。
- 晶体可分为离子晶体、共价晶体和金属晶体等不同类型。
3. 晶体的点阵
- 晶体的点阵是晶体中最小的周期结构单元,在三维空间中重复排列形成整个晶体结构。
- 常见的晶体点阵有立方晶系、正交晶系、单斜晶系、正六角晶系等。
4. 晶体的性质
- 晶体的物理性质:晶体具有明确的熔点、硬度和透明度等特性。
- 晶体的光学性质:晶体对光具有不同的折射、吸收、散射和偏振等特性。
- 晶体的磁性性质:晶体中的离子或原子在外磁场作用下表现出不同的磁性行为。
以上是关于【人教版】高中化学选修3知识点总结中第三章晶体构造与属性的内容概述。
详细内容请参考教材或其他可靠资料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章晶体结构与性质
课标要求
1•了解化学键和分子间作用力的区别。
2•理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
3•了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
4•理解金属键的含义,能用金属键理论解释金属的一些物理性质。
5•了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
要点精讲一一.晶体常识
1•晶体与非晶体比较
晶体韭晶悴
结梅徴粒周期性有序掾列
红构裟粒无序拄列1性质峙性有目范性、固定熔点、对称性、
各冋异性
没有自葩性、固定焙点“揃佗■&
向异性
2.获得晶体的三条途径
①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)
③溶质从溶液中析出。
3.晶胞
晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”
4.晶胞中微粒数的计算方法一一均摊法
如某个粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学中常见的晶胞为立
方晶胞
「厂-4同为慎个霜肿.所比右■[碎F
w I •俊歸咆
同为2个忌胞所几好• £粒T
I 询上一 4
.U F滾品咆
望于内部-*1®个锂子都翼于議骷盹
立方晶胞中微粒数的计算方法如下:
注意:在使用均摊法”计算晶胞中粒子个数时要注意晶胞的形状
二•四种晶体的比较
2 •晶体熔、沸点高低的比较方法
(1)不同类型晶体的熔、沸点高低一般规律:原子晶体〉离子
晶体〉分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体
由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高•如熔点:金刚石〉碳化硅>硅
(3)离子晶体
一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
(4)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。
④同分异构体,支链越多,熔、沸点越低。
(5)金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
三•。
