《环境化学》复习资料总结
环境化学复习资料(仅供参考_请注意核对)

环境工程化学复习第二章一、影响大气污染物迁移的因素1、风和大气湍流的影响;2、天气形势和地理地势的影响;(1)、海陆风;(2)、城郊风;(3)、山谷风、二、自由基也称游离基,是指由于共价键均裂而生成的带有未成对电子的碎片。
大气中常见的自由基如:HO·,HO2·,RO,RO2·,RC (O)O2三、与大气污染有直接关系的重要的光化学过程1、氧分子和氮分子的光解2、臭氧的光解3、NO2的光解4、亚硝酸和硝酸的光解5、二氧化硫对光的吸收6、甲醛的光解7、卤代烃的光解四、降水的化学组成无机物:土壤衍生物离子Al3+,Ca2+,Mg2+,Fe3+,Mn2+和硅酸盐等;海洋盐类离子Na+,Cl-,Br-,SO42-,HCO3-及少量K+,Mg2+,Ca2+,I-和PO43+;气体转化物SO42-,NO3-,NH4+,Cl-和H+;人为排放源As,Cd,Cr,Co,Cu,Pb,Mn,Mo,Ni,V,Zn,Ag,Sn和Hg等化合物。
五、酸雨的化学组成酸雨现象是大气化学过程和大气物理过程的综合效应。
酸雨中含有多种无机酸和有机酸,其中绝大部分是硫酸和硝酸,多数情况下以硫酸为主。
从污染源排放出来的SO2和NOx是形成酸雨的主要起始物,其形成过程为SO2+[O] →SO3SO3+H2O→H2SO4SO2+H2O→H2SO3H2SO3+[O] →H2SO4NO+[O] →NO22NO2+H2O→HNO3+HNO2式中:[O]——各种氧化剂六、影响酸雨形成的因素1、酸性污染物的排放及其转化条件2、大气中的NH33、颗粒物酸度及其缓冲能力4、天气形势的影响七、大气颗粒物的化学组成1、无机颗粒物(1)硫酸及硫酸盐颗粒物(2)硝酸及硝酸盐颗粒物2、有机颗粒物P126第四章农药的类型农药进入土壤的途径1)农药以颗粒剂形式施入土壤2)农药以种子处理剂进入土壤3)农药喷施被作物截获和散落到土壤4、农药在土壤环境中的扩散行为。
环境化学考试知识点总结

环境化学考试知识点总结work Information Technology Company.2020YEAR一绪论:1环境污染:大气污染、臭氧层破坏、酸雨、水资源短缺、土地沙漠化、绿色屏障锐减、垃圾、物种濒危、人口激增、温室效应。
2造成环境污染的因素:物理的、化学的和生物的三方面,其中化学的占80%~90%。
3环境化学的特点是从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。
4由于环境污染物种类繁多,世界各国都筛选一些毒性强、难降解、残留时间长,在环境中分布广的污染物优先进行控制,称为优先污染物。
5当前世界范围内最关注的化学污染物主要是持久性有机污染物,具有致突变、致癌变和致畸变作用的所谓“三变”化学污染物,以及环境内分泌干扰物。
6按环境变化的性质划分,则可分为环境物理效应、环境化学效应和环境生物效应。
7污染物在环境中的迁移主要有机械迁移、物理-化学迁移和生物迁移。
二大气环境化学1根据温度随海拔高度的变化情况将大气分为四层:对流层、平流层、中间层、热层。
2大气污染物按照化学组成还可以分为含硫化合物、含氮化合物、含碳化合物和含卤化合物。
3燃料燃烧过程中影响NOx形成的因素:根据NOx形成的机理,燃烧过程中NO的生成量主要与燃烧温度和空燃比有关。
4甲烷是一种重要的温室气体,每个CH4分子导致温室效应的内力比CO2分子大20倍。
5氟氯烃类化合物既可以破坏臭氧层也可以导致温室效应。
6逆温:在对流层中,气温一般是随高度增加而降低,但在一定条件下会出现反常现象。
7大气稳定度是指气层的稳定程度,或者说大气中某一高度上的气块在垂直方向上相对稳定程度。
气块在大气中的稳定度与大气垂直递减率和干绝热垂直递减率(干空气在上升时温度降低值与上升高度之比用Td表示)有关。
一般来讲,大气温度垂直递减率越大,气块越不稳定。
8影响大气污染物迁移的因素:空气机械运动如风和湍流,由于天气形势和地理地势造成的逆温想想以及污染源本身特性。
环境化学复习重点

环境化学复习要点第一章:绪论环境化学的研究对象:环境污染物造成的环境问题环境问题:全球环境或区域环境中出现不利于人类生存和发展的各种现象,称为环境问题人类面临的两大类环境问题:生态破坏和环境污染八大公害事件:美国洛杉矶光化学烟雾美国多诺拉烟雾事件英国伦敦烟雾事件比利时马斯河谷事件日本水俣病事件日本骨痛病事件日本米糠油事件日本四日市哮喘事件环境污染:指自然或人为的破坏,向环境中添加某种物质而超过环境的自净能力而产生危害的行为环境化学:环境化学是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学。
环境化学的研究内容:(1)有害物质在环境介质中存在的浓度水平和形态;(介质存在)(2)潜在有害物质的来源,它们在个别环境介质中和不同介质间的环境化学行为;(环境行为)(3)有害物质对环境和生态系统以及人体健康产生效应的机制和风险性;(环境效应)(4)有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
(环境控制)研究特点:以微观研究宏观;研究对象复杂;物质水平低。
核心:研究化学污染物在环境中的化学转化(trans- fer)和效应(transformation)。
环境污染物:环境污染物是指进入环境后使环境的正常组成和性质发生直接或间接有害于人类的变化的物质化学污染物的分类:元素、无机物、有机化合物和烃类、金属有机和准金属有机化合物、含氧有机化合物、有机氮化合物、有机卤化合物、有机硫化合物、有机磷化合物优先污染物:在化学污染物中筛选出一些毒性强、难降解、残留时间长、在环境中分布广的污染物优先进行控制中国优先控制污染物“黑名单”:共有14类,68种优先控制的污染物。
其中优先控制的有毒有机化合物有12类,58种,占总数的85.29%引起世人关注的化学污染物:(1)持久性有机污染物(2)三致化学污染物(3)环境内分泌干扰物符合上述定义的POPs物质有数千种之多。
–斯德哥尔摩国际公约提出首批控制12种:艾氏剂、狄氏剂、异狄氏剂、DDT、氯丹、六氯苯、灭蚁灵、毒杀芬、七氯、多氯联苯(PCBs)、二恶英和苯并呋喃(PCDD/Fs)环境内分泌干扰物:二恶英、六氯苯、多氯联苯、DDT等自然过程或人类的生产和生活活动会对环境造成污染和破坏,从而导致环境系统的结构和功能发生变化,称为环境效应环境效应分为环境物理效应、环境化学效应、环境生物效应环境污染源:工业、农业、交通运输、生活第二章:大气环境化学大气的组成大体上分为干洁空气、水蒸气、颗粒物(包括固体颗粒和液体颗粒)大气污染过程:大气光化学、自由基反应、活性粒子反应大气的组成:N2(78.08%)、O2(20.95%)、Ar(0.943%)和CO2 (0.0314%)。
环境化学复习资料

1.迁移转化的区别。
答:污染物在环境中所发生的空间位移及其所引起的富集、分散和消失的过程谓之污染物的迁移。
污染物在环境中的迁移主要有机械迁移,物理-化学迁移和生物迁移三种方式。
而污染物的转化是指污染物在环境中通过物理、化学或生物的作用改变存在形态或转变为另一种物质的过程。
污染物可通过蒸发、渗透、凝聚、吸附和放射性元素蜕变等物理过程实现转化;可通过光化学氧化、氧化还原、配位和螯合、水解等化学作用实现转化;也可通过生物的吸收、代谢等生物作用实现转化。
2.两种烟雾答:两种烟雾为光化学烟雾(洛杉矶型烟雾),硫酸烟雾型烟雾(伦敦型烟雾)光化学烟雾也称洛杉矶型烟雾含有氮氧化物和碳氢化合物等第一次污染物的大气,在阳光照射下发生光化学反应而产生二次污染物,这种由第一次污染物和第二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾.光化学烟雾形成的条件是大气中有氮氧化物和碳氢化合物存在,大气温度较低,而且有强的阳光照射.这样在大气中就会发生一系列复杂的化学反应,生成一些二次污染物。
光化学烟雾的污染物为:碳氢化合物、NO x、O3、PAN、醛类、汽油、煤气、石油等。
常出现在夏、秋两季,常出现在温度较高(24℃以上),湿度较低,日光强,臭氧浓度高的白天,对眼和呼吸道有强刺激作用,严重时会导致死亡。
对光化学烟雾有以下控制对策:(1)控制反应活性高的有机物的排放有机物反应活性表示某有机物反应生成产物的能力。
碳氢化合物是光化学烟雾形成过程中必不可少的重要组分。
因此,控制那些反应活性高的有机物的排放,能有效地控制光化学烟雾的形成和发展。
(2)控制臭氧的浓度硫酸烟雾型污染硫酸烟雾也称伦敦型烟雾,它主要是由于燃煤而排放出来的SO2,颗粒物以及由SO2氧化所形成的硫酸盐颗粒物所造成的大气污染现象。
这种污染多发生在冬季,气温较低(4℃以下),湿度较高、日光较弱和臭氧浓度较低的气象条件下。
对呼吸道有刺激作用,严重时可导致死亡。
硫酸烟雾型污染物,从化学上看是属于还原性混合物,故称此烟雾为还原烟雾。
环境化学复习资料 (部分)

一、排放源的分类源:指污染物的发生源。
按生产过程的不同可以分为人为源和天然源。
人为源:工农业生产、生活污水、交通运输、居民燃煤天然源:动物、稻田、动物反刍根据排放源的分布特点,又可分为点源、线源和面源。
点源:指排放位置明确、排放物的组成和含量相对稳定的污染源,相对比较容易控制。
如工厂、发电站和市政污水等。
线源:交通工具等属于典型的线源。
面源:具有分布面积广、排放不规律、污染物数量多、种类杂等特点,治理起来更困难。
如农田、森林、绿地及城市街道。
二、造成环境污染的因素:有物理的、化学的和生物的三方面,其中由化学物质引起的约占80%-90%。
三、自由基及其来源:自由基在其电子外层有一个未成对电子,它们对于增加第二个电子有很强的亲和力,因此能起强氧化剂的作用。
自由基的化学活性很高,是反应的中间产物,平均寿命仅为10-3 s。
已经发现大气中存在各种自由基,如·OH、HO2·、NO3·、R·、RO2 ·(过氧烷基自由基)、RO·(烷氧基自由基)、RCO·(酰基自由基)、RCO2·、RC(O)O2·、RC(O)O·等其中·OH、HO2·、RO·、RO2·是大气中重要的自由基,而·OH自由基是迄今为止发现的氧化能力最强的化学物种,能使几乎所有的有机物氧化,它与有机物反应的速率常数比O3大几个数量级。
·OH是大气中最重要的自由基,其全球平均浓度约为7 105个/cm3。
近十几年来的研究表明,·OH自由基能与大气中各种微量气体反应,并几乎控制了这些气体的氧化和去除过程。
如·OH与SO2、NO2的均相氧化生成HOSO2和HONO2是造成环境酸化的重要原因之一;·OH与烷烃、醛类以及烯烃、芳烃和卤代烃的反应速率常数要比与O3的反应大几个数量级。
环境化学期末复习资料
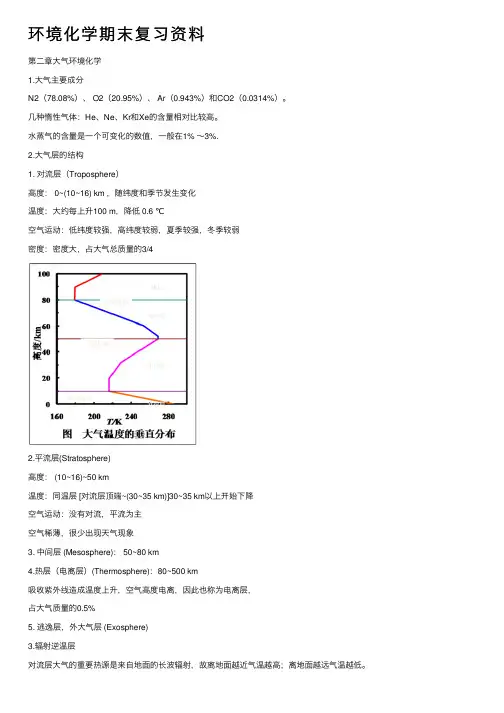
环境化学期末复习资料第⼆章⼤⽓环境化学1.⼤⽓主要成分N2(78.08%)、 O2(20.95%)、 Ar(0.943%)和CO2(0.0314%)。
⼏种惰性⽓体:He、Ne、Kr和Xe的含量相对⽐较⾼。
⽔蒸⽓的含量是⼀个可变化的数值,⼀般在1% ~3%.2.⼤⽓层的结构1. 对流层(Troposphere)⾼度: 0~(10~16) km ,随纬度和季节发⽣变化温度:⼤约每上升100 m,降低 0.6 ℃空⽓运动:低纬度较强,⾼纬度较弱,夏季较强,冬季较弱密度:密度⼤,占⼤⽓总质量的3/42.平流层(Stratosphere)⾼度: (10~16)~50 km温度:同温层 [对流层顶端~(30~35 km)]30~35 km以上开始下降空⽓运动:没有对流,平流为主空⽓稀薄,很少出现天⽓现象3. 中间层 (Mesosphere): 50~80 km4.热层(电离层)(Thermosphere):80~500 km吸收紫外线造成温度上升,空⽓⾼度电离,因此也称为电离层,占⼤⽓质量的0.5%5. 逃逸层,外⼤⽓层 (Exosphere)3.辐射逆温层对流层⼤⽓的重要热源是来⾃地⾯的长波辐射,故离地⾯越近⽓温越⾼;离地⾯越远⽓温越低。
随⾼度升⾼⽓温的降低率称为⼤⽓垂直递减率:Γ=-dT/dz式中:T——热⼒学温度,K;z——⾼度。
在对流层中,dT/dz<0,Γ = 0.6 K · (100m)-1,即每升⾼100 m ⽓温降低0.6 ℃。
⼀定条件下出现反常现象当Γ=0 时,称为等温层;当Γ<0 时,称为逆温层。
这时⽓层稳定性强,对⼤⽓的垂直运动的发展起着阻碍作⽤。
辐射逆温产⽣特点●是地⾯因强烈辐射⽽冷却降温所形成的。
●这种逆温层多发⽣在距地⾯ 100~150 m ⾼度内。
●最有利于辐射逆温发展的条件是平静⽽晴朗的夜晚。
●有云和有风都能减弱逆温。
●风速超过 2~3 m · s-1,逆温就不易形成4.主要⾃由基及其来源HO ?和HO2 ?来源1) HO ?来源清洁⼤⽓:O3 的光解是清洁⼤⽓中HO ?的重要来源O3 + h→ O ? + O2O ? + H2O → 2HO ?污染⼤⽓,如存在HNO2,H2O2 (HNO2 的光解是⼤⽓中HO ?的重要来源)HNO2 + h→ HO ? + NOH2O2 + h→ 2HO ?2)HO2 ?来源①主要来⾃醛类的光解,尤其是甲醛的光解H2CO + h→ H ? + HCO ?H ? + O2 + M → HO2 ? + MHCO ? + O2 → HO2 ? + CO②只要有 H ?和 HCO ?存在,均可与 O2 反应⽣成 HO2 ?③亚硝酸酯和 H2O2 光解CH3ONO + hv → CH3O ? + NOCH3O ? +O2 → HO2 ? + H2COH2O2 + hv → 2HO ?HO ? + H2O2 → H2O + HO2 ?④若有CO存在,则:HO ? + CO → CO2 + H ?H ? + O2 → HO2 ?R ?,RO ?,RO2 ?来源1) R ?烷基⾃由基来源:⼤⽓中存在最多的烷基是甲基,它的主要来源是⼄醛和丙酮的光解。
环境化学复习资料
环境化学复习资料环境化学复习资料环境化学是研究环境中化学物质的性质、分布、转化和对环境的影响的学科。
它涉及到大量的知识和概念,因此在复习环境化学时,我们需要有一份全面而系统的复习资料。
本文将为大家提供一些关于环境化学复习的重点内容和方法,帮助大家更好地备考。
一、环境化学基础知识1. 环境化学的定义和研究对象:环境化学是研究环境中各种化学物质的性质、分布、转化和对环境的影响的学科。
它的研究对象包括大气、水体、土壤以及生物体等。
2. 环境化学的重要概念:包括环境污染、环境质量、环境容量、环境风险等。
了解这些概念的含义和相互关系,有助于我们更好地理解环境化学的基本原理。
3. 环境化学的研究方法:环境化学研究的方法包括野外调查、实验室分析、模拟实验和数学模型等。
熟悉这些方法的应用和原理,可以帮助我们更好地进行环境化学的实验和研究。
二、环境污染物的分类和特性1. 大气污染物:包括颗粒物、二氧化硫、氮氧化物、挥发性有机物等。
它们的来源、传输和转化过程对大气环境质量具有重要影响。
2. 水污染物:包括有机污染物、无机污染物、重金属等。
了解不同污染物的特性和对水体生态系统的影响,有助于我们更好地进行水环境治理和保护。
3. 土壤污染物:包括有机污染物、重金属、农药等。
了解土壤污染物的来源和迁移途径,有助于我们更好地进行土壤环境修复和保护。
三、环境化学的应用1. 环境监测与评价:环境化学在环境监测与评价中起着重要作用。
通过采集样品,进行实验室分析,可以获得环境中各种污染物的含量和分布情况,为环境管理和决策提供科学依据。
2. 环境污染控制与治理:环境化学在环境污染控制和治理中发挥着重要作用。
通过研究污染物的来源和转化途径,制定合理的治理策略,可以有效降低环境污染的程度。
3. 环境风险评估与管理:环境化学在环境风险评估和管理中具有重要意义。
通过对环境中化学物质的毒性和暴露的评估,可以判断环境对人体健康的潜在风险,并采取相应的措施进行管理和控制。
《环境化学》综合复习资料
《环境化学》综合复习资料一、填空题⒈由可见光(400nm<λ<780nm)引起光化学离解的物质键能是(c=3.0×108m/s,h=6.626×10-34J.s/光量子)153.5kJ/mol < E < 299.3kJ/mol 。
⒉N2O 是无色气体,是清洁空气的组分,也是低层大气中含量最高的含氮化合物;矿物燃料燃烧过程中所产生的NO X以NO 为主,通常占90%以上。
植物摄取氮的主要形态是NH4+和NO3-。
⒊将下列物质:乙烯、正丁烯、正丁烷和丁二烯,按照光化学反应活性大小依次排列为丁二烯> 正丁烯> 乙烯> 正丁烷。
⒋大气颗粒物依照表面积与粒径分布的关系得到了三种不同类型的粒度模,分别是爱根核模、积聚模和粗粒子模,并用来解释大气颗粒物的来源与归宿。
其中爱根核模主要来源于燃烧过程所产生的一次颗粒物,以及气体分子通过化学反应均相成核而生成的二次颗粒物。
⒌由电介质促成的聚集称作凝聚,而由聚合物促成的聚集称作絮凝;根据DLVO理论把范德华吸引力和扩散双电层排斥力考虑为仅有的作用因素。
⒍水中有机污染物一般通过吸附作用、挥发作用、水解作用、光解作用和生物富集和生物降解等过程进行迁移转化。
⒎污染物由土壤向植物体内的迁移主要包括被动迁移和主动迁移两种方式;植物摄取氮的主要形态是NH4+和NO3-。
⒏土壤的固磷作用可通过化学沉淀、土壤固相表面交换吸附作用、闭蓄作用以及生物固定作用完成。
⒐砷的甲基化在厌氧菌作用下主要产生二甲基胂,而好氧的甲基化反应则产生三甲基胂;当土壤处于淹水还原状态时,砷对植物的危害增大;与无机砷相比,有机砷的毒性减少。
(后2个空填“增大”或“减少”)⒑表面活性剂的生物降解机理主要是烷基链上甲基氧化(或ω氧化)、 氧化、芳香族化合物的氧化和脱磺化过程。
二、单项选择题1.下列属于环境物理效应的是 A 。
A.温室效应B.土壤盐碱化C.光化学烟雾D.酸雨2.关于HO·说法不正确的是 B 。
《环境化学》复习资料
《环境化学》复习资料1、过氧乙酰基硝酸酯(PAN)的生成1.乙醛光解产生乙酸基2.乙酰基与空气中O2结合形成过氧乙酰基.3.过氧乙酰基与No2化合生成PANps:PAN具有热不稳定性,遇热会分解而回到过氧乙.基和NO2,因而PAN的分解和合成之间存在着平衡.2、温室效应、气体概念大气中的co2吸收了地面辐射出来的红外光,把能量截留于大气之中,从而使大气温度升高,这种现象称为温室效应,能够引起温室效应的气体,称为温室气体.3、大气颗粒物消除方式并解释/(机制)①干沉降指颗粒物在重力作用下沉降或与其他物体碰撞后发生的沉降。
机制i通重力对颗粒物作用,使其降落在土、水等物体上 ii 粒径小于0.1um 靠布朗运动扩散相互碰撞成较大颗粒随大气湍流到地面去除。
②湿沉降.指通过阵雨,降雪等使颗粒物从大气中去除.机制 i 雨除:半径小于1um ii 冲刷:半径大于4um4、水中无机物的迁移转化方式:沉淀一溶解、氧化还原、配合作用、胶体形成、吸附一解吸.5、水环境中颗粒物的吸附作用.①表面吸附:胶体具有巨大的比表面和表面能..物理吸附②离子交换吸附:静电作用,胶体每吸附一部分阳离子,同时也放出等量其他阳离子,属于物理化学吸附,不受温度影响,可逆反应③专属吸附:除化学键外,尚有加强的憎水键、范德华力、氢键在起作用.在中性表面甚至在与吸附离子带相同电荷符号的表面也可吸~6、沉积物中重金属诱发适当的因素盐浓度升高。
氧化还原条件变化。
降低ph。
增加水中配合剂的含量7、腐殖质分为腐殖酸(不碱可酸)、富里酸(可可)、腐黑物(不不)8、光解过程分三类:直接光解、敏化光解、氧化反应敏化光解:水体中存在的天然物质腐殖质被阳光激发,又将其激发态的能量转移给化合物而导致的分解。
9、有机物在土壤中的吸着在在两种机理(只适用于非离子型农药)1.分配作用:即在水溶液中,土壤有机质对有机物的溶解作用.而且在溶质的整个溶解范围内,吸附等温线都是线性的,与表面吸附位无关,只与有机物的溶解度相关(因而放出热量小)2.吸附作用:即在非极性的有机溶剂中.即在非极性有机溶剂中,土壤、矿物质对有机物表面的吸附作用或干土壤矿物质对有机物…作用.10、生物降解作用→两种代谢模式区别①生长代谢:许多有毒物质可以像天然有机污染物作为微生物的生长基质:作为微生物唯碳源有滞后期②共代谢:某些有机污染物不能作为微生物的唯一碳源和能源,必须有另外的化合物存在提供微生物碳源和能源时,该有机物才能被降解.这是共代谢无滞后期11、重金属在土壤一植物体系中的迁移及其机制,从三大类(土壤、植物、重金属分析) 1.土壤理化性质:~PH越低,H+越多,活动性越强,加大了土壤中重金属向生物体迁移的数量.~土壤质地黏重,对重金属的吸附力强,降低了重金属的迁移转化能力~土壤中有机质含量高.对重金属吸附力强.降低了重金属转化能力.~还原条件下能力弱、氧化条件下能力强。
环境化学知识点总结复习-完善版(大学期末复习资料)
第一章绪论1、环境问题:全球环境或区域环境中出现不利于人类生存和发展的各种现象,称为环境问题。
原生环境问题:自然力引发,也称第一类环境问题,火山喷发、地震、洪灾等。
次生环境问题:人类生产、生活引起生态破坏和环境污染,反过来危及人类生存和发展的现象。
目前的环境问题一般都是次生环境问题。
当今世界上最引人注目的几个环境问题温室效应、臭氧空洞、酸雨等是由大气污染所引起的。
环境污染:由于人为因素使环境的构成状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件。
造成环境污染的因素有物理、化学和生物的三个方面,其中化学物质引起的约占80%~90%。
2、认识过程:①20世纪60年代人们只把环境问题作为污染来看待,没有认识到生态破坏的问题.;②20世纪70年代1972年联合国,瑞典,斯德哥尔摩“人类环境会议”,将环境污染和生态破坏提升到同一高度看待;③20世纪80年代1987年,由挪威首相布伦特兰夫人组建的“联合国世界环境与发展委员会”发表了《我们共同的未来》;④20世纪90年代1992年,巴西,里约热内卢,联合国环境与发展大会,强调和正式确立了可持续发展的思想,并形成了当代的环境保护的主导意识。
环境保护的主要对象是由于人类生产、生活活动所引起的次生环境问题,主要包括:环境污染和生态破环两个方面。
为保护人类生存环境,联合国将每年的4月22定为世界地球日,6月5日定为世界环境日。
3、环境化学定义:是一门研究有害化学物质在环境介质中的存在、化学特征、行为和效应及其控制的化学原理和方法的科学。
研究特点:(1)以微观研究宏观:从原子、分子水平,研究宏观环境圈层中环境现象和变化机制;(2)研究对象复杂:既有人为来源的也有天然来源的,处于环境开放体系内,多种环境因素同时相互作用,其研究需要多学科的结合。
(3)物质水平低:mg/kg(ppm,10-6)、ug/kg(ppb,10-9)发展动向:目前,国界上较为重视元素(尤其是碳、氮、硫和磷)的生物地球化学循环及其相互偶合的研究;重视化学品安全评价、臭氧层破坏、气候变暖等全球变化问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《环境化学》复习资料总结(课件版)一、绪论:1.什么是环境化学(1)环境化学是在化学科学的传统理论和方法基础上发展起来的,以化学物质在环境中出现而引起的环境问题为研究对象,以解决环境问题为目标的一门新兴学科。
(2)定义:它是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学,既是环境科学的核心组成部分,也是化学科学的一个新的重要分支。
2、环境化学的内容查明潜在有害物质在环境介质中存在的来源,浓度水平和形态分布;对这些潜在有害物质溯本求源,并查明它们在环境介质中和不同环境介质之间的环境化学行为;查明这些潜在有害物质对环境、生态系统和人体健康发生作用的途径、方式、程度和风险;探索缓解或消除这些有害物质已造成的影响或防止它们可能造成影响的方法和途径。
3、环境污染物:是环境化学研究的对象,主要指进入环境后使环境的正常组分和性质发生直接或间接的有害于人类的变化的物质。
大部分污染物是人类生产和生活活动产生的。
4、环境学或毒理学意义的重金属:Hg、Cd、Pb、Zn、Cu、Co、Ni、Ba(钡)、Sn(锡)、Sb(锑)等,从毒性角度讲还包括:As、Be、Li、Se、B、Al 等。
5、BTEX:苯、甲苯、乙基苯和三个二甲基苯的异构体。
是汽油中的重要组成部分,并广泛用作溶剂。
这些化合物是土壤和地下水的常见污染物。
6、PAHs:多环芳烃7、有机卤化合物:①氟氯烃(CFCs)②有机溶剂③有机氯农药④PCB 多氯联苯,有209 个同系物和PCT 多氯三联苯,有8149 个同类物。
8、POPs 名单:滴滴涕(DDT) 六氯苯二恶英呋喃9、环境效应:自然过程或人类的生产和生活活动会对环境造成污染和破坏,从而导致环境系统的结构和功能发生变化。
10、环境本底:也称环境背景值某地未受污染的环境中某种化学元素或化学物质的含量(浓度)。
目前,未受污染的环境已经基本不存在,因此获得环境本底已经十分困难,一般只能获得相对轻污染的环境背景值。
11、环境容量:特定环境单元在不影响其特定环境功能的情况下,能够容纳污染物的最大量。
这里的特定环境功能一般以环境质量标准为依据。
12、生物浓缩因子(BCF)生物体内某种物质的平衡浓度(mg / L)环境中该物质的平衡浓度(mg / L )13、生物半衰期(BHL):污染物进入生物体内后,在代谢作用下,污染物削减到初始浓度的一半所需要的时间,即生物半衰期14、协同作用:一种污染物的存在会导致另一种污染物的毒性或危害性增加。
也称相乘作用。
例如伦敦烟雾中,冶炼厂排出的SO2 废气中若含有锌、铁等金属离子的烟气气溶胶,则其危害性就会大大增加。
拮抗作用:一种污染物质的毒性能够被另一种物质所抑制,称为拮抗作用。
金属硒(Se)能够抑制Hg 的毒性金属锌(Zn)能够抑制Cd 的毒性15、常用单位介绍mg/L----一般水环境中污染物的浓度;mg/kg----一般土壤中污染物的浓度,或生物体内污染物的浓度;mg/m3----一般大气中污染物浓度。
ppm, ppb, ppt----10-6,10-9,10-12;LD----致死剂量;LD100----绝对致死剂量;LD50----半致死剂量;LD0----最大耐受剂量。
16、污染物的迁移:污染物在环境中所发生的空间位移及其所引起的富集、分散和消失的过程。
有机械迁移、物理-化学迁移和生物迁移三种方式。
17、污染物的转化:污染物在环境中通过物理、化学或生物的作用,改变存在形态或转变为另一种物质的过程。
有氧化-还原作用、配合作用、水解作用、生物吸收、代谢等。
二、大气:1、大气的主要成分:氮(78.8%)、氧(20.95%)、氩(0.934%)、二氧化碳(0.0314%)2 、对流层(Troposphere ):0-10~15 km 平流层(Stratosphere ):10~15-50km 中间层(Mesosphere):50 -80 km 热层(Thermosphere ):80-500~800 km3、含硫化合物[COS、CS2、(CH3)2S、H2S、SO2、H2SO4、MSO4];含氮化合物[N2O、NO、NO2];含碳化合物[CO、CO2、CHX];含卤素化合物[卤代烃、CFC]4、自由基:共价键均裂而成的带有未成对电子的碎片,产生方法:光解法、氧-还法、电解法、热解法、诱导分解法等。
5、HO ·O3 光解(清洁大气中HO ·的主要来源)O3+ һν(λ<290nm)→O + O2 O + H2O →2HO ·•HNO2 光解(污染大气中HO ·的主要来源)HNO2+ һν(λ<400nm)→HO·+ NO•H2O2 光解H2O2+ һν(λ<360nm)→2HO·6、HO2 ·•醛的光解HCHO HCHO+ һν(λ<313nm)→H·+HCO·H ·+ O2 →HO2 ·HO2 ·+NO →HO ·+NO2•任何光解过程只要有H ·和HCO ·生成,均可与O2 作用生成HO2 ·HO ·+ CO→CO2 + H ·H ·+ O2 →HO2 ·•H2O2 光解H2O2+ һν(λ<360nm)→2HO·2HO ·+H2O2→HO2 ·+ H2O•亚硝酸酯的光解CH3ONO CH3ONO + һν(λ<300~400nm)→CH3O·+NO CH3O ·+ O2→HCHO +HO2 ·•烷氧基与O2 的作用RCH2O ·+O2→RCHO +HO2 ·7、R·•醛、酮的光解CH3CHO + һν→CH3·+HCO· CH3COCH3+ һν→CH3·+CH3CO·•O 和HO ·的夺H 反应RH + O→R ·+HO ·RH + HO ·→R ·+H2ORO ·: CH3ONO + һν→CH3O·+NO CH3ONO2+ һν→CH3O·+NO2RO2 ·: R ·+ O2→RO2 ·RCO ·+ O2→RCOO2 ·8、自由基的重要作用:电子转移[Fe(CN)6]4-+ HO ·→[Fe(CN)6]3-+ OH-氢原子转移RH + HO ·→R ·+ H2O自由基双键加成CH2=CH2+ HO ·→HOCH2CH2结合O2 和NO2R ·/ RCO ·+ O2→RO2 ·/ RCOO2 ·RO ·/ RCOO2 ·+ NO2→RONO2/ RCOO2NO2自由基聚合反应R ·+ M →RM ·RM ·+ M →RM2 ·RM2 ·+ nM →RM(M)nM ·RM(M)nM ·+ R ·→RM(M)nMR•自由基的终止反应2R ·→R2RO ·+ R ·→ROR2R ·+ I2→2RI8、光化学反应:分子、原子、自由基或离子吸收光子而发生的化学反应9、CFC-XYZ1)Z = number of fluorine atoms.2)Y =1 + number of hydrogen atoms.3)X= number of carbon atoms -1发泡剂:CFC-11 CFCl310、无机气体污染物:NO、NO2、N2O、NH3、HNO2、HNO3、亚硝酸酯、硝酸酯、亚硝酸盐、硝酸盐、铵盐,来源:天然源:生物有机体腐败人为源:燃烧过程(固定源1/3,流动源2/3)11、NO2 的光解:大气中最重要的化学反应,大气中O3 生成的引发反NO2+һν(λ<313nm) →NO+ O·O ·+ O2 +M→O3+ M 该反应是O3 生成的引发反应,是O3 唯一的人为来源12、过氧乙酰硝酸脂PAN:是光化学烟雾的指示物。
非甲烷烃(NMHC)13、光化学烟雾:由前述的氮氧化物和碳氢化合物的转化过程,只要大气中存在三个条件:强烈的太阳光+碳氢化合物、氮氧化合物+低湿度时,就会由光化学反应引发一系列的化学过程,产生一些氧化性很强的物质,如臭氧、PAN,HNO3,H2O2 等二次污染物,该过程实际就是光化学烟雾的形成过程。
含有氮氧化物和碳氢化合物等一次性污染物的大气,在阳光照射下发生化学反应而产生的二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾,因最早在1940 年的美国洛杉矶首先发现,因此又称为洛杉矶烟雾。
16、影响光化学烟雾的因素:有机物的反应活性;NMHC/NOX(初始体积分数比);HO ·阻化剂:如DEHA (二乙基羟胺)17、硫酸烟雾型污染:硫酸烟雾也称为伦敦烟雾,因为其最早发生在英国伦敦。
•主要是由于燃煤排放的二氧化硫、颗粒物、以及由于二氧化硫氧化生成的硫酸盐颗粒物所造成的大气污染现象。
•这种污染一般发生在冬季、气温低、湿度高和日光弱的天气条件下。
•硫酸烟雾形成过程中,二氧化硫转化为三氧化硫的氧化反应主要靠雾滴中锰、铁、氨的催化氧化过程。
18、化学烟雾型污染有两种类型,即伦敦烟雾和洛杉矶烟雾,对比如下:伦敦烟雾(硫酸型烟雾):白天、夜间连续出现;颗粒物、硫酸雾、SO2;燃煤;冬季、气温低、湿度高、日光弱;对呼吸道刺激;对建筑材料损伤;还原型洛杉矶烟雾(光化学烟雾):一般在白天,夜间消失;HC、PAN、NOx、醛类、O3;燃烧汽油、柴油等石油类产品;夏季、气温高、湿度低、日光强;对眼睛和呼吸道刺激强烈,橡胶开裂;氧化型19、酸雨化学组成:阳离子:H+、Ca2+、NH4+、Na+、K+、Mg2+;阴离子:SO42-、NO3-、Cl-、HCO3-18、酸雨的形成必须具备以下几个条件:•污染源条件,即酸性污染物的排放以及转化条件。
•大气中的气态碱性物质浓度较低,对酸性降水的缓冲能力很弱大气中颗粒物的酸碱度及其缓冲能力。
•天气形式的影响。
20、空气中颗粒:TSP(总悬浮颗粒物):降尘/飘尘RSP:可吸入悬浮颗粒物PM10: 颗粒物小于10微米,相当于可吸入悬浮粒子PM2.5: 颗粒物小于2.5微米21、气溶胶粒子的成核是通过物理和化学过程形成的。
