九年级化学中考《原子结构》练习题
九年级原子练习题

九年级原子练习题一、选择题1. 下列关于原子的说法,正确的是:A. 原子是化学变化中的最小粒子B. 原子是由质子、中子和电子组成的C. 原子的质量主要集中在原子核上D. 所有的原子都能发生化学变化2. 下列元素中,属于金属元素的是:A. 氢(H)B. 氧(O)C. 钠(Na)D. 硅(Si)3. 下列关于原子结构的说法,错误的是:A. 原子核由质子和中子组成B. 电子带正电C. 电子在原子核外的轨道上运动D. 电子层数越多,原子半径越大二、填空题1. 原子由______、______和______组成。
2. 原子核由______和______组成,其中质子带______电,中子不带电。
3. 在原子中,电子带______电,电子在原子核外的______上运动。
三、判断题1. 原子的质量主要集中在原子核上。
()2. 原子中的电子层数越多,原子的化学性质越稳定。
()3. 所有原子都能发生化学变化。
()四、简答题1. 简述原子结构的基本特点。
2. 举例说明原子在化学变化中的作用。
五、计算题1. 氢原子的原子核内有一个质子,求该氢原子的相对原子质量。
2. 氧原子的原子核内有8个质子和8个中子,求该氧原子的相对原子质量。
六、连线题原子结构1:原子核内有11个质子和12个中子原子结构2:原子核内有17个质子和18个中子原子结构3:原子核内有6个质子和6个中子元素符号:Na、Cl、C七、作图题请画出氧原子的结构示意图,并标注出原子核、电子层及电子数量。
八、匹配题请将下列元素与其电子排布相匹配:元素:A. 钠(Na) B. 氧(O) C. 硅(Si)电子排布:1. 2, 8, 1 2. 2, 8, 6 3. 2, 8, 4九、解释名词1. 相对原子质量2. 原子序数3. 同位素十、应用题1. 铁原子(Fe)的原子序数是26,请写出铁原子的电子排布。
2. 铝(Al)的相对原子质量是27,已知铝原子的原子核内有13个质子,求铝原子核内的中子数。
初中九年级上册化学 原子的结构测试题(含答案)

初中九年级上册化学原子的结构测试题(含答案)1.下列粒子中不能直接构成物质的是()A.原子 B.分子 C.电子 D.离子。
2.含有原子团的物质是()A.XXX。
3.下列我国著名科学家中,为相对原子质量的测定作出了卓越贡献的是()A.钱学森 B.屠呦呦 C.张青莲 D.侯德榜。
4.下列有关微粒的说法错误的是()A.一个氯原子失去一个电子成为阳离子 B.公园里花香四溢,说明分子在不断运动 C.要保持水的化学性质,就必须保持水分子不变 D.氢原子和氧原子是水分子中的最小微粒。
5.下列关于四种粒子结构示意图的说法正确的是()A.①③属于不同种元素 B.④属于离子,离子符号为Mg C.②③的化学性质相似 D.①④均达到相对稳定的结构。
6.下列物质中,由分子构成的是()A.镁 B.金刚石C.氯化钠 D.水。
7.1897年,英国科学家XXX发现了原子内有带负电的电子,而原子是电中性的,由此推测,原子内还有带正电的物质。
在此基础上,经过XXX、XXX等科学家的不断完善和修正,建立了现代原子结构模型。
如图是XXX整理的物质微观构成网络图,则XXX当年推测的“带正电的物质”相当于图中的()2- A、甲 B、乙 C、丙 D、丁。
8.如图是某元素的原子结构示意图,下列有关该原子的说法错误的是()A.质子数为11 B.易失去电子形成阳离子C.最外层有1个电子 D.该原子有三个电子层。
9.下列说法不正确的是()A.原子呈电中性 B.原子中一定含有质子 C.化学反应前后原子的种类不变 D.保持水的化学性质的微粒是氢原子和氧原子。
10.XXX同学撰写的“心目中的原子”短文中,阐述了以下观点,你认为不正确的是()A.原子可以转化为离子 B.原子是最小的微观粒子 C.有些物质是由原子构成的 D.原子可以“搭建”成分子。
11.铈(Ce)是一种常见的稀土元素,已知铈原子的原子核内有58个质子和82个中子,该原子的核外电子数为()A.24 B.58 C.82 D.140.12.核电荷数多于核外电子数的粒子一定是()A.分子B.原子 C.阴离子 D.阳离子。
初中化学 原子的结构 练习题(含答案)

初中化学原子的结构练习题(含答案)一、选择题1. 原子的结构是()A. 细胞B. 粒子C. 分子D. 质子答案:C2. 原子中组成原子核的粒子是()A. 电子B. 质子C. 中子D. 什么都不是答案:B3. 下列说法正确的是()A. 电子在原子核外绕行B. 质子和中子分别带正电和负电C. 原子核中的粒子数目不固定D. 原子核内质子质量大于中子答案:A4. 原子的结构是由()构成的。
A. 原子核和电子云B. 原子核和质子C. 原子核和中子D. 电子云和质子答案:A5. 原子核中所含的质子数决定了()。
A. 元素的化学性质B. 元素的物理性质C. 元素的放射性D. 元素的熔点答案:A6. 下列关于原子核的说法,正确的是()A. 原子核的直径是电子云的数千倍B. 原子核内质子和中子的质量几乎相等C. 原子核内质子和中子的数量相等D. 原子核是由正电质子组成的答案:B二、判断题1. 原子核由质子和电子组成。
答案:错2. 原子核的直径大约是原子的直径的万分之一。
答案:对3. 原子核的电子云中没含有电子。
答案:错4. 原子核中的质子数目决定了元素的原子序数。
答案:对5. 原子核内质子的质量大于中子。
答案:错三、填空题1. 原子核由________和________组成。
答案:质子,中子2. 原子核的直径约为________。
答案:10^-15米3. 原子核内质子与中子的数量差异称为________。
答案:中子过剩4. 原子的质子数称为________,用符号____表示。
答案:原子序数,Z5. 电子绕行的区域称为________。
答案:电子云四、简答题1. 请简要描述原子核的构成和性质。
答案:原子核是由质子和中子组成的,在原子中占据着非常小的体积空间,约占整个原子体积的10^-15倍。
原子核带有正电荷,质子和中子的质量几乎相等,质子的质量略大于中子。
此外,原子核还具有放射性。
2. 原子的质子数如何影响元素的性质?答案:元素的质子数,即原子核内质子的数量,决定了元素的原子序数。
九年级化学 - 原子的结构(练习+答案)

九年级化学- 原子的结构1.原子是由居于原子中心的原子核和__核外电子__构成的,原子核是由__质子__和__中子__构成的。
2.由于原子核内质子所带电荷与核外电子的电荷数量__相等__,电性__相反__,因此原子不显电性。
3.在原子中,核电荷数=核内__质子数__=核外__电子数__。
4.原子中的核外电子是分层排布的,可以用__原子结构示意图__表示。
5.相对原子质量是以__一种碳原子质量的1/12__作为标准,其他原子的__质量__与它相比较所得到的比。
6.原子结构示意图的含义:小圆圈和圈内的数字表示__原子核__和__核电荷数__,弧线表示__电子层__,弧线上的数字表示该电子层上的__电子数__。
7.稀有气体最外层有__8__个(除氦外)电子,形成相对稳定的结构;金属的原子最外层电子一般少于__4__个,在化学反应中易__失去__电子;非金属的原子最外层电子一般多于__4__个,在化学反应中易__得到__电子。
9.构成物质的的粒子除了原子、分子之外,还有__离子__,__带电__的原子叫做离子。
其中带正电的原子叫做__阳__离子,带负电的原子叫做__阴__离子。
9.原子的质量主要集中在__原子核__上,因此相对原子质量≈__质子数__+__中子数__。
小节练习题1.原子核中一定含有的粒子是(B)A.中子B.质子C.电子D.质子和中子2.锂电池可用作心脏起搏器的电源。
已知一种锂原子核内含有3个质子和4个中子,则该锂原子的核外电子数为(B)A.1 B.3C.4 D.73.下列粒子不显电性的是(D)A.质子B.电子C.原子核D.分子4. 氯化钠由什么粒子构成?四位同学分别给出以下答案,你认为正确的是(A)A.离子B.分子C.原子D.中子5. 下列关于原子结构的认识错误的是(C)A.原子内部有相对较大的空间B.原子由原子核和核外电子构成C.原子由质子和中子构成D.原子核带有正电荷6.下列有关离子的认识错误的是(D)A.原子失去电子,形成了阳离子B.原子得到电子,形成了阴离子C.离子也是构成物质的粒子D.原子失去电子后带负电荷7.下列结构示意图中,表示阴离子的是(D)8.下图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。
初中化学《原子的结构》精品练习2

《原子的结构》精品练习1·锂电池可用作心脏起搏器的电源。
已知一种锂原子核内含有3个质子和4个中子,则该锂原子的核外电子数为()A. 1B. 3C. 4D. 7【答案】B【解答】在原子中,质子数=电子数,故选B。
2·原子不显电性的原因是()A.原子中不含带电荷的粒子B.原子太小了C.原子核和核外电子带等量的异种电荷D.原因至今不明【答案】C【解答】A、原子核内的质子带正电荷,原子核外的电子带负电荷,故A错;B、原子的体积大小与是否不显电性无关,电子比原子小得多,但带负电荷,故B错;C、原子核带正电荷,原子核外的电子带负电荷,且电量相等,电性相反,所以整个原子不显电性,故C正确;D、因为原子内所带的正负电荷数相等造成不显电性,故D错。
故选C。
3·氧的相对原子质量为16,表示的意义是()A.氧原子核中有16个质子B.一个氧原子的质量为l6C.氧原子的质量是一个碳原子质量的1/12D.氧原子的质量是一个碳原子质量的1/12的16倍【答案】D【解答】A、相对原子质量近似的等于原子中质子数+中子数,所以氧原子的相对原子质量为16不能反应其原子核内质子数为16,故A说法错误;B、原子质量是单位的,其单位为g,故B说法错误;C、相对原子质量是一个原子的真实质量跟一个碳-12原子质量的1/12的比值,而不是一个碳原子质量的1/12,故C说法错误;D、相对原子质量是一个原子的真实质量跟一个碳-12原子质量的1/12的比值,故一个氧原子的质量是一个碳原子质量的1/12的16倍,故D说法正确。
故选D。
4·知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、c对应的是()A.原子核、核外电子B.原子、核外电子C.原子、原子核D.核外电子、原子【答案】B【解答】分子是由原子构成的,故a是原子,原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,故b是原子核,c是核外电子,观察选项,故选B。
中考化学专题练习原子的结构(含解析)
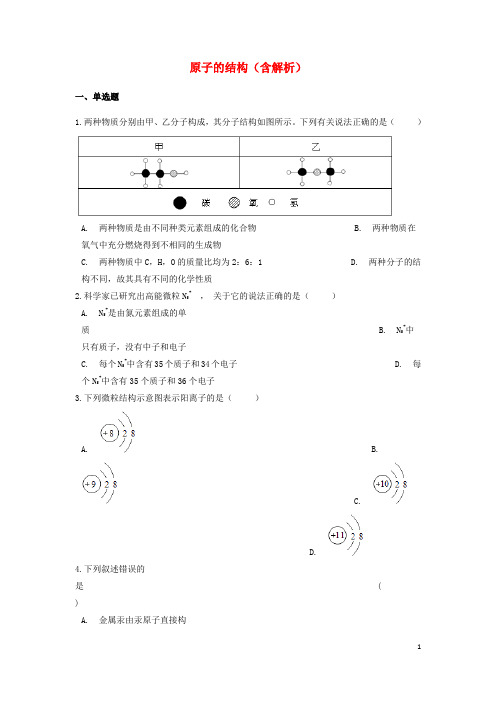
原子的结构(含解析)一、单选题1.两种物质分别由甲、乙分子构成,其分子结构如图所示。
下列有关说法正确的是()A. 两种物质是由不同种类元素组成的化合物B. 两种物质在氧气中充分燃烧得到不相同的生成物C. 两种物质中C,H,O的质量比均为2:6:1D. 两种分子的结构不同,故其具有不同的化学性质2.科学家已研究出高能微粒N5+,关于它的说法正确的是()A. N5+是由氮元素组成的单质 B. N5+中只有质子,没有中子和电子C. 每个N5+中含有35个质子和34个电子D. 每个N5+中含有35个质子和36个电子3.下列微粒结构示意图表示阳离子的是()A. B.C.D.4.下列叙述错误的是 ()A. 金属汞由汞原子直接构成 B.原子核由电子和质子构成C. 水分子保持水的化学性质 D.化学变化中原子不能再分5.已知某粒子的结构示意图是,则该粒子是:()A. 阳离子 B. 阴离子 C. 原子 D. 原子核6.如图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子.下列说法错误的是()A. 此反应有单质生成B. 参加反应的两种分子的个数比为1:1C. 原子在化学变化中没有分裂 D. 图中生成物全部是化合物7.下列关于原子的说法,正确的是()A.B.C.D.8.黑白小圈分别表示不同的原子,下图所表示的物质是( )A. 两种元素组成的化合物B. 两种元素组成的纯净物C. 由7种物质分子构成的混合物 D. 由5种物质分子构成的混合物9.下列属于化合物的是( )A. B.C. D.10.下列粒子结构示意图中,表示阳离子的是()A. B.C.D.11.下图为某反应的微观示意图,不同的球代表不同元素的原子。
下列说法中错误的是()A. 该反应的反应物可能属于氧化物B. 不考虑反应条件时,该图示可以表示双氧水制取氧气的反应C. 该反应类型为分解反应D. 该反应的生成物都属于化合物12.牙膏中的含氟化合物对牙齿有保护作用。
九年级化学上册 原子的结构练习 试题

乏公仓州月氏勿市运河学校原子的结构1.以下物质由原子直接构成的是〔〕A.氧气B.铜C.水 D.空气2.分子、原子、离子等都是构成物质的微粒,以下物质由离子构成的是〔〕A.氯化钠B.黄金 C.HY石 D.干冰3.以下粒子中不能直接构成物质的是〔〕A.核外电子 B.原子 C.分子 D.离子4.科学家发现月球土壤中含有较丰富的氦〔He-3),其原子核内质子数为2,中子数为1,那么氦原子的核外电子数为〔〕A.1B.2C.3D.45. 2012年4月15日,央视曝光一些企业生产的药用胶囊里重金属铬〔Cr〕超标,即震惊全国的“毒胶囊〞事件。
铬原子核内有24个质子,铬元素的相对原子质量为52。
以下有关铬元素的说法中不正确的选项是〔〕A.铬原子的核外电子数为24B.铬元素的原子序数是52C.铬原子核由质子和中子构成D.铬原子呈电中性6.根据原子结构示意图,不能确定的是〔〕A.最外层电子数B.中子数C.质子数 D.电子层数7.以下粒子结构示意图中,表示相对稳定结构的是〔〕8.以下四种粒子的结构示意图中,最容易失去电子的粒子是〔〕9.以下微粒结构示意图中,表示阴离子的是〔〕A B C D10.原子是构成物质的根本粒子。
以下有关原子的表达错误的选项是〔〕A.原子在化学变化中能够再分B.原子质量主要集中在原子核上C.原子的质子数等于核电荷数D.原子的体积及在化学变化中的表现是由电子决定11.卢瑟福的α粒子轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了根底。
右图线条中,可能是α粒子〔带正电〕在该实验中的运动轨迹的是〔〕A.abcdB.abcC.bcdD.ad12.以下关于相对原子质量的表达正确的选项是〔〕A.相对原子质量就是原子实际质量的简称B.氧原子的相对原子质量是16gC.相对原子质量就是一种碳原子质量的 1/12D.相对原子质量约等于原子核中质子数和中子数之和13.下面是4位同学对分子、原子、离子的描述,其中正确的选项是〔〕14.右图为镁的原子结构示意图,该元素的原子核外有 ______________个电子层,它属于_____________〔填“金属〞或“非金属〞〕元素,其化学性质比较活泼,在化学反响中易_____________〔填“得〞或“失〞〕电子,形成_______________〔填“阴〞或“阳〞〕离子。
九年级化学第三单元第二节原子的结构练习和答案

原子的结构与离子练习一.选择题(共30小题)1.下列关于Na和Na+的叙述中,错误的是()A.它们相差一个电子层B.它们的化学性质相似C.钠原子,钠离子均为同一元素D.灼烧时,它们的焰色反应都呈黄色2.氚是氢的一种同位素,氚原子含有1个质子和2个中子.下列示意图能正确表示氚原子结构的是()A.A B.B C.C D.D3.关于原子、分子、离子的说法中,错误的是()A.原子不能直接构成物质B.分子可以保持物质的化学性质C.原子的质量主要集中在原子核上D.金属原子失去电子会形成阳离子4.下列各种粒子,不带电的是()A.原子核B.质子 C.中子 D.电子5.下列说法中正确的是()A.原子的质量几乎都集中在原子核中B.生活中常接触到的“高钙牛奶”、“碘盐”中的“钙”、“碘”指的是离子C.通常把PH<7的降水称为酸雨D.氯化铵可以与草木灰(含碳酸钾)混合施用6.一种元素的离子变成原子,这种离子发生的变化是()A.一定失去电子B.可能失去电子,也可能得到电子C.一定得到电子D.既不失去电子,也不得到电子7.某元素的一个原子失去1个电子后形成的粒子与Ne原子有相同的核外电子数,下列说法正确的是()A.该元素为非金属元素B.该粒子为阴离子C.该粒子核电荷数为10 D.该粒子为Na+8.运用推理、归纳、类比、对比的方法得出下列结论,其中正确的是()A.Na+、Mg2+、Cl﹣的最外层电子数均为8,所以离子的最外层电子数均为8B.催化剂可以改变化学反应速率,所以加入催化剂后,反应速率一定会加快C.氧化物中含有氧元素,所以含有氧元素的化合物就是氧化物D.构成一氧化碳和二氧化碳的分子不同,所以两者的化学性质不同9.如图形象地表示了氯化钠的形成过程.下列相关叙述中不正确的是()A.钠离子与钠原子的化学性质不同B.钠跟氯气反应生成氯化钠C.氯化钠是由离子构成的化合物D.钠原子得到一个电子形成阳离子,氯原子失去一个电子形成阴离子10.在下列微粒中带有电荷的是()A.分子B.中子 C.原子 D.离子11.下列计算正确的是()A.在Na+中,质子数为11,电子数为11B.Mr[CO(NH2)2]=12+16+14+2×2C.化工颜料普鲁士蓝Fe4[Fe(CN)6]中,Fe、C、N三元素原子个数比为5:6:6D.抗癌药物顺铂[Pt(NH3)2Cl2]中,氢元素和氯元素质量比为3:7112.科学家最近制造出第112号新元素,其原子的相对原子质量为277.关于该元素的下列叙述正确的是()A.其原子核内中子数和质子数都是112B.其原子核内中子数为277,核外电子数为112C.其原子质量是碳﹣12原子质量的277倍D.其原子质量与碳﹣12原子质量之比为277:1213.在化学反应2H2+O22H2O中的最小微粒是()A.H2O B.O2C.H2D.H和O14.已知氦﹣3的原子核是由一个中子和两个质子构成的,其一个原子中,电子数为()A.1 B.2 C.3 D.515.下列对分子、原子、离子的认识,正确的是()A.原子是最小的粒子,不可再分B.分子在化学变化中可以再分C.离子不能直接构成物质D.固体难压缩,说明固体分子间无间隔16.下列变化中,最小粒子是原子的是()A.氧气溶解于水 B.水受热后汽化C.水分解生成氢气和氧气 D.贮氮气的钢瓶受热爆炸17.化学知识中有许多的“一定”和“不一定”,下列有关说法正确的是()A.原子的最外层电子数相等,则元素化学性质一定相似B.同种元素组成的物质一定是单质C.10g甲和15g乙两物质恰好反应,生成物的总质量不一定为25gD.能保持物质化学性质的最小粒子不一定是分子18.1991年我国著名化学家,测定了铟(In)元素相对原子质量新值.铟元素的核电荷数为49,相对原子质量为115.铟原子的中子数为()A.115 B.49 C.66 D.16419.我国南海海底蕴藏着丰富的含有锰、铁、铜等金属的矿物.已知锰原子的核内质子数为25,相对原子质量为55,则锰原子的核内中子数为()A.25 B.55 C.30 D.8020.2006年度世界十大科技进展新闻之一是合成118号超重元素,全球学生所熟悉的元素周期表将需要作出更新.已知该元素原子的相对原子质量为293,核电荷数为118,其核内中子数和核外电子数分别为()A.118 175 B.118 118 C.193 118 D.175 11821.我国著名化学家张青莲教授与其他科学家合作测定了铟原子相对原子质量新值,铟原子核外有49个电子,相对原子质量为115,则铟原子的中子数为()A.164 B.115 C.49 D.6622.某一种原子的相对原子质量是32,这种原子的原子核内中子数和质子数相等,则它的中子数、质子数、核外电子数分别是()A.16、32、32 B.32、32、32 C.16、16、16 D.16、16、3223.碳﹣14是碳的一种具放射性的同位素,于1940年首被发现,它是透过宇宙射线撞击空气中的氮原子所产生.科学家曾通过测定古生物遗骸中的碳﹣14含量来推断古城年代.碳﹣14原子的核电荷数为6,相对原子质量为14.下列关于碳﹣14原子的说法中,错误的是()A.中子数为6 B.质子数为6C.电子数为6 D.质子和中子数之和为1424.金属钕是最活泼的稀土金属之一,钕元素(Nd)的到来活跃了稀土领域,在稀土领域中扮演着重要角色,并且左右着稀土市场,已知钕元素在元素周期表中的原子序数为60,则下列关于钕原子的说法不正确的是()A.其核电荷数为60 B.其核内质子数为60C.其相对原子质量为60 D.其核外电子数为6025.据悉,日本大地震导致核电站核泄漏的一些辐射物中,最主要的一种辐射物是I﹣131(即相对原子质量为131),I﹣131发射的β射线可杀伤甲状腺细胞,已知I是53号元素(即核电荷数为53),下列说法正确的是()A.I﹣131核内质子数为78B.I﹣131和I﹣127互为同位素关系C.“I”可以表示固态碘这种物质D.I﹣离子核外有53个电子26.科学家曾通过测定古生物遗骸的碳﹣14含量来推测古城年代.碳14原子的核电荷数为6,相对原子质量为14.下列关于碳14原子的说法中错误的是()A.中子数为6 B.质子数为6C.电子数为6 D.质子数与中子数之和为1427.居里夫人在1898年从几吨含铀废料中提炼出0.3g镭.镭元素的核电荷数为88,相对原子质量为226,镭原子的核外电子数为()A.226 B.88 C.138 D.31428.某阴离子X2﹣的核外有18个电子,核内有18个中子,则X的相对原子质量为()A.54 B.38 C.36 D.3429.物质是由原子所组成的,原子又由电子、质子与中子等更微小的粒子所构成.若以分别代表电子、质子与中子,则下列各示意图中,何者带负电?()A.B. C.D.30.如图是核聚变燃料氦的原子结构模型.该原子核外有2个电子,则其原子核内的质子数为()A.1 B.2 C.3 D.5九年级化学第三单元第三节原子的结构练习和答案参考答案一.选择题(共30小题)1.B 2.A 3.A 4.C 5.A 6.B 7.D 8.D 9.D 10.D 11.C 12.D 13.D 14.B 15.B 16.C 17.D 18.C 19.C20.D 21.D 22.C 23.A 24.C 25.BC 26.A 27.B 28.D29.D 30.B。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《原子结构》练习题
1. 最近医学界通过用放射性14C标记的C
60,发现一种C
60
的羧酸衍生物在特定条件下可通过断裂DNA杀
死细胞,从而抑制艾滋病,则有关14C的叙述正确的是()
A.与14N 含有的中子数相同
B.是C
60
的同素异形体
C.与C
60
中普通碳原子的化学性质不同 D.与12C互为同位素
2. 据报道,月球上有大量3He存在,以下关于3He的说法正确的是()
A.是4He的同分异构体
B.比4He 多一个中子
C.是4He 的同位素
D.比4He少一个质子
3. X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是
()A.X的原子序数比Y的小
B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大
D.X的元素的最高正价比Y的大
4. 2002年由德.法.美及波兰等多国科学家组成的科研小组合成了非常罕见的45
26
Fe原子,有关Fe的说法正确的是()
A.它是一种新元素
B.它是一种新核素
C.45
26Fe与56
26
Fe互为同素异形体
D.这种铁原子发生衰变放出两个质子后变成43
26
Fe
5. 某元素的原子最外电子层只有2个电子,该元素()
A.一定是IIA族元素
B.一定是金属元素
C.可能是金属元素
D.一定是+2价元素
6. 不具有放射性的同位素称为稳定同位素。
近20年来,稳定同位素分析法在科学研究中有着广泛应用。
下
列说法中,正确的是()
A.34S原子核内的中子数为16
B.13C和15N原子核内的质子数相差2
C.16O与18O互为同位素
D.2H与1H的质子数.中子数.电子数均不相同
7. 613C可以用于含碳化合物的结构分析。
613C表示的碳原子( )
A.核外有13个电子,其中6个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个中子
D.质量数为13,原子序数为6,核内有7个质子
8. A、B均为原子序数1~20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个,则B的原子序数
是()
A.n+4
B.n+6
C.n+8
D.n+10
9.下列表达中,错误的
...是()A.铝原子结构示意图:
B.1
1H.2
1
H、3
1
H是氢的三种核素
C.Na+和O2-的核外电子数相等
D.NaOH、Mg(OH)2、Al(OH)3的碱性依次增强
10. 下列各组微粒中,核外电子层结构相同的是()
A.Mg2+、S2-、Na+、F-
B. Na+、F-、S2-、Ar
C.K+、Ca2+、S2-、Ba2+
D.Mg2+、O2-、Na+、F-
11. 铀元素有234U、235U、238U等多种同位素,用做核燃料的是235
92
U。
下列有关说法正确的是
()
A.235
92
的中子数为235
B.234U、235U、238U是铀的三种不同核素
C.234U、235U互为同分异构体
D.235U、238U的中子数相同
12. 1996年科学家在宇宙中发现了H3分子,H3和H2属于()
A.同位素B.同素异形体C.同分异构体D.同一物质
13. 和Na+离子具有相同质子数和电子数的微粒是()
A.NH4+B.F-C.H2O D.NH3
14. 下列离子中,其核外电子排布与氩原子核外电子排布不同的是()
A.Mg2+ B.S2—C.K+D.Cl—
15. 美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该
元素原子核内的中子数和核外电子数之差为 ( ) A .57 B .47 C .61 D .293 16. 中国科学院在世界上首次发现铂元素的一种同位素
20278
Pt ,它的中子数( )
A .78
B .124
C .202
D .280
17. 我国“神舟”六号载人飞机已发射成功,“嫦娥”探月工程也已正式启动。
据科学家预测,月球的土壤中吸
附着百万吨的He 3
2,每百吨He 32核聚变所释放出的能量相当于目前人类一年消耗的能量。
在地球上,
氦元素主要以He 4
2
的形式存在。
下列说法中正确的是
( )
A .He 4
2原子核内含有4个质子 B .He 32和He 42互为同位素 C .He 32原子核内含有3个中子
D .He 42的最外层电子数为2,所以He 42具有较强的金属性
18. 简单原子的原子结构可用下图形象地表示: 表示中子。
则下列有关①②③的叙述中,正确的是( ) A.①②③互为同位素
B.①②③为同素异形体
C.①②③是三种化学性质不同的粒子
D.①②③具有相同的质量数
19. 已知离子 b X 3+ 的原子结构示意图为: 。
下列认识正确的是( ) A .b=10
B .X单质能溶于氢氧化钠溶液 C.X为稀有气体
D.X单质既具有还原性,又具有氧化性 20. 下列关于原子的几种描述中,不正确的是 ( )
A .18O 与19F 具有相同的中子数
B .16O 与19O 具有相同的电子数
C .12C 与13C 具有相同的质量数
D .15N与14N 具有相同的质子数
2 8
+b
答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 答案 D C C B C C C A D D B B A A 题号15 16 17 18 19 20
答案 A B B A B C。
