原子吸收光谱法(本)
合集下载
原子吸收光谱法(atomic absorption spectrometry,简称AAS)

双光束型:来自光源的光束被分 成两束,一束作测量光束,通过 火焰;另一束作参比光束;交替 进入单色器到达光电倍增管检测 比较
– 特点:消除因光源波动造成的影响,
但不能抵消因火焰波动造成的影响
完整版ppt
16
四、定量分析方法
1、标准曲线法:吸光度—浓度标准曲线
– 方法:
配制一组含有不同浓度被测元素的标准溶液 在与试样测定完全相同的条件下,按浓度由低到高的顺序测定吸 光度值 绘制吸光度对浓度的校准曲线。 测定试样的吸光度 查校准曲线上用内插法求出被测元素的含量。
完整版ppt
12
火焰原子化器和石墨炉原子化器可测定的元素
H Li Be Na Mg
火焰 火焰 & 石墨炉
He B C N O F Ne Al Si P S Cl Ar
K Ca Sc Ti V Cr Mn Fe Co Zn Cu Zn Ga Ge As Se Br Kr
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
e- e-
e-
Dynode (9-13)
Quartz Window
*100 Million Amplification of Signal
Photomultiplier Tube Operation
三、原子吸收分光光度计
单光束型:空白溶液调透光率T 到100%。测试剂溶液的透射比
– 特点:仪器结构简单,不能消除因 光源波动造成的影响,基线漂移
完整版ppt
6
完整版ppt
7
原子化器
原子化:将试样转变为原子蒸汽的过程
原子化器的功能:提供能量使试样干燥、蒸 发和原子化。同时入射光束在这里被基态原 子吸收,因此也可把它视为“吸收池”。
原子吸收光谱法(AAS)

局限性:测不同的元素需不同的元 素灯,不能同时测多元素,难熔元 素、非金属元素测定困难。
原子吸收光谱法基本原理
1.原子的能级与跃迁
基态第一激发态,吸收一定频率的辐射能量。 产生共振吸收线(简称共振线) 吸收光谱 激发态基态,发射出一定频率的辐射。 产生共振吸收线(也简称共振线) 发射光谱
原子吸收光谱法基本原理
A kc
原子吸收分光度计
原子吸收分光度计
原子吸收分光度计
光源
原子化器
单色器
检测系统
思考:光学系统(单色器)为什么在原子化器和检 测系统之间?
光 源
提供待测元素的特征光谱。获得较高的 灵敏度和准确度。 光源应满足如下要求; (1)能发射待测元素的共振线; (2)能发射锐线; (3)辐射光强度大,稳定性好。
2.元素的特征谱线
(1)各种元素的原子结构和外层电子排布不同 基态第一激发态:
跃迁吸收能量不同——具有特征性。
(2)各种元素的基态第一激发态
最易发生,吸收最强,最灵敏线。特征谱线。
(3)利用原子蒸气对特征谱线的吸收可以进行定量分析
原子吸收光谱法基本原理
从光源发射出具有待测元素特征 谱线的光,通过试样蒸气时,被蒸气 中待测元素的基态原子所吸收,吸收 的程度与被测元素的含量成正比。故 可根据测得的吸光度,求得试样中被 测元素的含量。
将待测试样在专门的氢化物生成器中产生氢
化物,送入原子化器中检测。
单色器
•作用:将待测元素的吸收线与邻近线分开
•组件:色散元件 ( 棱镜、光栅 ) ,凹凸镜、 狭缝等
检测系统
•作用: 将待测元素光信号转换为电信号, 经放大数据处理显示结果。 •组件: 检测器、放大器、对数变换器、显 示记录装置。
原子吸收光谱法
无火焰法 特征量 65 种元素 5. 不能进行多元素同时测定
第二节 原子吸收光谱法的原理 A KbC 一、吸收定律
1. 入射光是单色光; 2. 入射线与吸收线中心频率重合 二、原子吸收线 1. 吸收线的轮廓
(△K小)
0 中心 吸收频率
λ0 中心 吸收波长
1
2
半宽度
△λ1/2
I
第七章 原子吸收光谱法 ( Atomic Absorption Spectrometry, AAS )
第一节
概
述
一、原子吸收光谱法(AAS) 根据物质的基态原子蒸气对其特征辐射的吸收作用来进行
元素定量分析的方法。
二、原子吸收光谱法简史 1.1802年 Wollaston发现:太阳连续光谱中几条位置固定的暗 线, 如 589.0 nm; 589.6nm 2. 1955年,Walsh发表了著名论文《原子吸收光谱法在 分析化学中的应用》, 提出了AAS技术 ①空心阴极灯; 3.1961年 ②火焰原子化器
2)火焰的类型
火焰的类型 富燃火焰 化学计量火焰 贫燃火焰 燃助比 约 1: 3 约 1: 4 约 1: 6 火焰的性质 还原性 中性 氧化性 火焰状态 层次模糊 呈亮黄色 应用范围 易氧化而形成难解离氧 化物的元素 大多数元素皆适用 不易氧化的元素
层次清楚 蓝色透明
火焰发暗 高度缩小
** 气流量
灵敏度
лЪвов 提出无火焰AAS
三、特点
1. 精密度高 RSD<1%
Ei kT
Ni gi e N0 g0
N0≈N , N0 对温度变化迟钝 相对误差 1~5%
2. 选择性好 准确度高 一种元素一个灯 3. 灵敏度高 火焰法
第七章原子吸收光谱分析法

? 由于原子的吸收线比发射线的数目少的多,谱线重叠的概率就小的多,空 心阴极灯一般不发射临近波长的辐射线,因而其他辐射线干扰较小,故原 子吸收法选择性高,干扰小且易于克服。
原子吸收光谱法(也称原子吸收分光光法 )与可 见、紫外分光光度法基本原理相同,都是基于物质 对光选择吸收而建立起来的光学分析法。
2010年1月25日1时53分
组成:阳极(吸气金属)、空心圆筒形(使待测原子集中)阴极(W+ 待测元素)、低压惰性气体(谱线简单、背景小)。
工作过程:高压直流电(300V)---阴极电子---撞击隋性原子---电离(二 次电子维持放电)---正离子---轰击阴极---待测原子溅射----聚集空 心阴极内被激发----待测元素特征共振发射线。
? 自然宽度(约在10-5nm数量级)。
?
?2.多普勒变宽(热变宽):
? 由于多普勒效应而导致的谱线 变宽。由于原子热运动引起的。 其宽度约为 10-3nm数量级。
?3.压力变宽:由于同类原子或 与其它粒子(分子、原子、离子、 电子等)相互碰撞而造成的吸收 谱线变宽。其宽度也约为 10-3nm 数量级。
区别:在可见、紫外分光光度法中,吸光物质 是溶液中被测物质的分子或离子对光的选择吸收, 原子吸收光谱法吸光物质是待测元素的基态原子对 光的选择吸收,这种光是由待测元素制成的空心阴 极灯(称元素灯)作光源。
原子吸收光谱分析的过程:
A元素含量测定----- A元素的空心阴极灯发射特征辐射 --------试样在原子化器中变为气态的基态原子-------吸收空心 阴极灯发射特征辐射---------空心阴极灯发射特征辐射减弱-----产生吸光度------元素定量分析
钨丝灯光源和氘灯,经分光后,光谱通带0.2nm。而原子吸收线
原子吸收光谱法(也称原子吸收分光光法 )与可 见、紫外分光光度法基本原理相同,都是基于物质 对光选择吸收而建立起来的光学分析法。
2010年1月25日1时53分
组成:阳极(吸气金属)、空心圆筒形(使待测原子集中)阴极(W+ 待测元素)、低压惰性气体(谱线简单、背景小)。
工作过程:高压直流电(300V)---阴极电子---撞击隋性原子---电离(二 次电子维持放电)---正离子---轰击阴极---待测原子溅射----聚集空 心阴极内被激发----待测元素特征共振发射线。
? 自然宽度(约在10-5nm数量级)。
?
?2.多普勒变宽(热变宽):
? 由于多普勒效应而导致的谱线 变宽。由于原子热运动引起的。 其宽度约为 10-3nm数量级。
?3.压力变宽:由于同类原子或 与其它粒子(分子、原子、离子、 电子等)相互碰撞而造成的吸收 谱线变宽。其宽度也约为 10-3nm 数量级。
区别:在可见、紫外分光光度法中,吸光物质 是溶液中被测物质的分子或离子对光的选择吸收, 原子吸收光谱法吸光物质是待测元素的基态原子对 光的选择吸收,这种光是由待测元素制成的空心阴 极灯(称元素灯)作光源。
原子吸收光谱分析的过程:
A元素含量测定----- A元素的空心阴极灯发射特征辐射 --------试样在原子化器中变为气态的基态原子-------吸收空心 阴极灯发射特征辐射---------空心阴极灯发射特征辐射减弱-----产生吸光度------元素定量分析
钨丝灯光源和氘灯,经分光后,光谱通带0.2nm。而原子吸收线
原子吸收光谱法

n0 n
半宽度受原子性质和 外界因素的影响
原子吸收光谱轮廓图
基本原理
Basic principle
谱线变宽因素
自然宽度
Doppler变宽
压力变宽 自吸效应 场致变宽
基本原理
Basic principle 自然宽度(△nN) :无外界因素影响时谱线具有的宽度,与激
发态原子的平均寿命有关,平均寿命越长,谱线宽度越窄。根据量子力 学的测不准原理,粒子能级能量和跃迁时刻不可能同时测准,其能量的 不确定度△E和其跃迁时刻的不确定度△t间有如下关系
其中Kv为吸收系数
基本原理
Basic principle
• 吸收线轮廓
In I0
中心频率n0最大吸收系数 所对应的频率或波长,由 原子能级决定
不同元素原子吸收不同频率的 光,由图可见,在频率为v0处
透过光强度最小,也就是吸收
最大。原子群从基态跃迁到激
发态所吸收的谱线并不是绝对
单色,而是具有一定的宽度,
第七章 原子吸收分光光度法
Atomic Absorption Spectrometry
( AAS)
专业:环境工程 姓名:韩朝丽
原子吸收光谱法
Atomic Absorption Spectrometry
概 述 基本原理
本章内容
仪 器
干扰及其 消除办法
分析应用
原子吸收光谱法概述
Atomic Absorption Spectrometry
原子吸收光谱法——仪器
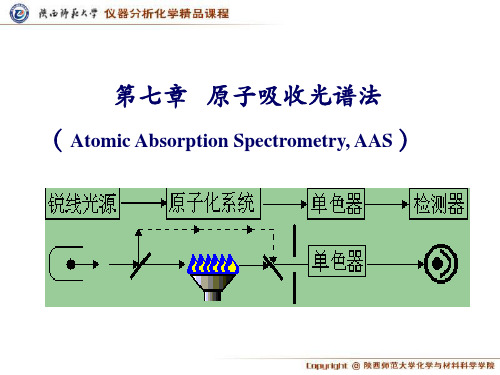
(Atomic Absorption Spectrometry)
原子吸收分 光光度计
光源
原子化系统
光学系统
检测系统
半宽度受原子性质和 外界因素的影响
原子吸收光谱轮廓图
基本原理
Basic principle
谱线变宽因素
自然宽度
Doppler变宽
压力变宽 自吸效应 场致变宽
基本原理
Basic principle 自然宽度(△nN) :无外界因素影响时谱线具有的宽度,与激
发态原子的平均寿命有关,平均寿命越长,谱线宽度越窄。根据量子力 学的测不准原理,粒子能级能量和跃迁时刻不可能同时测准,其能量的 不确定度△E和其跃迁时刻的不确定度△t间有如下关系
其中Kv为吸收系数
基本原理
Basic principle
• 吸收线轮廓
In I0
中心频率n0最大吸收系数 所对应的频率或波长,由 原子能级决定
不同元素原子吸收不同频率的 光,由图可见,在频率为v0处
透过光强度最小,也就是吸收
最大。原子群从基态跃迁到激
发态所吸收的谱线并不是绝对
单色,而是具有一定的宽度,
第七章 原子吸收分光光度法
Atomic Absorption Spectrometry
( AAS)
专业:环境工程 姓名:韩朝丽
原子吸收光谱法
Atomic Absorption Spectrometry
概 述 基本原理
本章内容
仪 器
干扰及其 消除办法
分析应用
原子吸收光谱法概述
Atomic Absorption Spectrometry
原子吸收光谱法——仪器
(Atomic Absorption Spectrometry)
原子吸收分 光光度计
光源
原子化系统
光学系统
检测系统
原子吸收光谱法

2014年7月10日7时9分
返回
36
续前
应用:As、Sb、Bi、Sn、Ge、Se、Pb、Ti等
原理:在酸性介质中,与强还原剂硼氢化钠 反应生成气态氢化物。例 AsCl3 +4NaBH4 + HCl +8H2O = AsH3 +4NaCl +4HBO2+13H2 将待测试样在专门的氢化物生成器中产生氢 化物,送入原子化器中检测。 特点:原子化温度低 ;灵敏度高(对砷、硒 可达10-9g);基体干扰和化学干扰小
e
E kT
Pj P0
e
h kT
上式中Pj和 PO分别为激发态和基态的统计权重,激发态原子数 Nj 与基态原子数 No 之比较小 ,<1%. 可以用基态原子数代表待测元素 的原子总数。公式右边除温度T外,都是常数。T一定,比值一定。
三、原子吸收法的测量
(一) 积分吸收测量法
钨丝灯光源和氘灯,经分光后,光谱通带0.2mm。而原子 吸收线半宽度:10-3mm。如图: 若用一般光源 照射时, 吸 收光的强度变化仅为 0.5% 。灵 敏度极差。 理论上:
2 . 峰值吸收测量
I0 A lg I
I0
e
0
I 0 d ;
e
I
e
0
I d
将 It=I0e-Kvb 代入上式:
则: A lg
I
0
I 0 e-K Ld
e
e
0
I 0 d
0
I 0 e -K Ld
采用锐线光源进行测量,则
I0 2 π ln 2 e 2 A lg 0.434 K 0 b 0.434 N0 f b I v D mc 峰值吸收系数: 2 π ln 2 e 2 K 0 0.434 N0 f v D mc A = k N0 b N0 ∝N∝c ( N0吸收辐射的基态原子数,N原子数,c 待测元素浓度)
返回
36
续前
应用:As、Sb、Bi、Sn、Ge、Se、Pb、Ti等
原理:在酸性介质中,与强还原剂硼氢化钠 反应生成气态氢化物。例 AsCl3 +4NaBH4 + HCl +8H2O = AsH3 +4NaCl +4HBO2+13H2 将待测试样在专门的氢化物生成器中产生氢 化物,送入原子化器中检测。 特点:原子化温度低 ;灵敏度高(对砷、硒 可达10-9g);基体干扰和化学干扰小
e
E kT
Pj P0
e
h kT
上式中Pj和 PO分别为激发态和基态的统计权重,激发态原子数 Nj 与基态原子数 No 之比较小 ,<1%. 可以用基态原子数代表待测元素 的原子总数。公式右边除温度T外,都是常数。T一定,比值一定。
三、原子吸收法的测量
(一) 积分吸收测量法
钨丝灯光源和氘灯,经分光后,光谱通带0.2mm。而原子 吸收线半宽度:10-3mm。如图: 若用一般光源 照射时, 吸 收光的强度变化仅为 0.5% 。灵 敏度极差。 理论上:
2 . 峰值吸收测量
I0 A lg I
I0
e
0
I 0 d ;
e
I
e
0
I d
将 It=I0e-Kvb 代入上式:
则: A lg
I
0
I 0 e-K Ld
e
e
0
I 0 d
0
I 0 e -K Ld
采用锐线光源进行测量,则
I0 2 π ln 2 e 2 A lg 0.434 K 0 b 0.434 N0 f b I v D mc 峰值吸收系数: 2 π ln 2 e 2 K 0 0.434 N0 f v D mc A = k N0 b N0 ∝N∝c ( N0吸收辐射的基态原子数,N原子数,c 待测元素浓度)
原子吸收光谱法(共73张课件)
比尔定律:
▪ 分析中,待测元素的浓度与其吸收辐射的原子总数成正 比。在一定浓度范围和一定火焰宽度L下:
▪ 可以通过测吸光度可求得待测元素的含量。
▪ 原子吸收分光光度A分析k'的c定量基础。待测元素浓度
2024/8/30
27
§4-3 原子吸收分光光度计
一、基本构造
光源
原子化系统
分光系统
检测系统 显示装置
表
处吸收轮廓上两点间的距离
征
(即两点间的频率差)。
▪ 数量级为10-3 -10-2 nm (发射线10-4 -10-3 nm )。
图4.2 原子吸收光谱轮廓图
2024/8/30
12
谱线变宽: 自然宽度 :N
▪ 无外界影响下,谱线仍有一定宽度—自然宽度。
▪ 与原子发生能级间跃迁时激发态原子的平均寿命有关。
2024/8/30
图4.3 峰值吸收测量示意图
21
应用原理: ▪ 光源:
2024/8/30
A lg I0 I
I0
e
0
I0d
I
e
0
Id
I I0eKL
I e 0
I0eKLd
Alg
e
0
I0 d
I e d e
K L
0 0
则:
在满足瓦尔西方法的测量条件时,在积分界限
内 吸可 收以 系认 数为。为常数,并合K理 地使之等于峰值
5%,测定灵敏度极差。
噪音低;
用该元素的锐线光源发射出特征辐射。 特点: 原子吸收分析的主要特点是测定灵敏度高,特效
发射的谱线稳定性好、强度高且宽度窄。
共振线在外光路损失小。
试样在原子化器中被蒸发,解离为气态基态原子。 共Ok振! L线et(’s特Ha征ve谱a线B)re是ak元. 素所有谱线中最容易发生、最灵敏的线,又具有元素的特征,所以分析中用该谱线作为分析线。
原子吸收光谱分析法
对于物理干扰,最好的消除方法 就是配制与试样溶液组成相似的 标准溶液。也可用标准参加法来 进行测定。
三,测定条件的选择: 1.分析线的选择:一般选用共
振线作分析线。 2.灯电流:保正稳定和适当光
强度输出的条件下,尽量选 用较低的工作电流。
5.狭缝宽度:由于原子吸收光谱法谱 线的重叠较少,一般可用较宽的狭 缝,以增强光的强度。但当存在谱 线干扰和背景吸收较大时,那么宜 选用较小的狭缝宽度。
SCV0.0044(g/1% 吸 收 ) A
式中:S为绝对灵敏度;C为试液 中 待 测 元 素 的 浓 度 〔g能检 出的元素的最低浓度或最小质 量。
定义为:能给出信号强度 等于3倍噪声信号强度标准偏差 时所对应的元素浓度或质量。
当在正负电极上施加适当电 压〔一般为200~500伏〕时,在 正负电极之间便开始放电,这时, 电子从阴极内壁射出,经电场加 速后向阳极运动。
电子在由阴极射向阳极的过程中, 与载气〔惰性气体〕原子碰撞使其 电离成为阳离子。带正电荷的惰性 气体离子在电场加速下,以很快的 速度轰击阴极外表,使阴极内壁的 待测元素的原子溅射出来,在阴极 腔内形成待测元素的原子蒸气云。
三.光学系统: 分光系统一般用光栅来进行分光。
光谱通带: W=D×S×10-3
其中:W为光谱通带〔单位nm〕;D为 光 栅 的 倒 线 色 散 率 〔 单 位 nm/mm-1〕 ; S为狭缝宽度〔单位μm〕。
四.检测系统: 检测系统包括检测器、放大器、
对数转换器、显示器几局部。
原子吸收光谱法的分析过程:
计算式为:D c 3 ( g / m L )
A
或 D g 3 ( g )
A
式 中 D 为 检 出 极 限 〔μg/mL 或 g〕 ; σ 为 对 空 白 溶 液 进 行 不 少 于 10 次 测 量时的标准偏差;A为吸光度;g为 质量〔g〕。
原子吸收光谱法PPT课件
消除电离干扰的方法
加入消电离剂 利用富燃火焰也可抑制电离干扰 利用温度较低的火焰 提高溶液的吸喷速率 标准加入法
化学干扰
是指试样溶液转化为自由基态原子的过程中,待 测元素和其他组分之间发生化学作用而引起的干 扰效应.它主要影响待测元素化合物的熔融,蒸发 和解离过程.这种效应可以是正效应,增强原子吸 收信号;也可以是负效应,降低原子吸收信号.化学 干扰是一种选择性干扰,它不仅取决于待测元素与 共存元素的性质,还与火焰类型,火焰温度,火焰状 态,观察部位等因素有关.化学干扰是火焰原子吸 收分析中干扰的主要来源,其产生的原因是多方面 的.
物理干扰
吸喷速率
喷雾量和雾化效率
毛细管形状
物理干扰一般都是负干扰,最终影响火焰分 析体积中原子的密度.
消除物理干扰的方法
配制与待测试液基体相一致的标准溶液; 当前者困难时,可采用标准加入法; 当被测元素在试液中浓度较高时,可以稀释溶液来降低
或消除物理干扰; 在试液中加入有机溶剂,改变试液的粘度和表面张力,
A.
A lg
I0 I
KC
原子吸收光谱仪的构成
光源:提供特征锐线光谱 原子化器:产生原子蒸汽,使被测元素
原子化 分光系统:将被测分析线与光源其他谱
线分开,并阻止其他谱线进入检测器 检测系统:光电倍增管 数据处理系统器
测量条件的选择
吸收线的选择 灯电流的选择 火焰种类的选择 燃烧气和助燃气的流量 火焰高度 石墨炉原子化条件的选择
内标法:分别在标准试样和被测试样中加入已知量的第
三种元素作为内标元素,测定分析线和内标线的吸光度比
D (工D作,曲D线x .)然并后以在D对标应准标曲准线溶上液根中据被测元计素算含出量试或样浓中度待绘测制
原子吸收光谱法
结构 工作原理
《仪器分析》第四章原子吸收光谱法
石墨炉原子化系统
基本原理:利用大电流(数百安培)通过高阻值的石墨管所产 生的高温,使管中少量试液或固体试样蒸发和原子化。
电源:12~24V 0~500 A 直流电
《仪器分析》第四章原子吸收光谱法
石墨炉原子化步骤
四个阶段: 1.干燥 (去除溶剂) 2.灰化(去除基体) 3.原子化 4.净化(去除残渣),
石墨炉升温示意图
《仪器分析》第四章原子吸收光谱法
元 最 高 灰 化 最高原子化温 线性范围 推荐的改进剂
素 温 度 度(℃)
( ppb )
(℃)
Ag 800 Al 1200 As 1200
1500
1-15 0.005mgPd+0.03mgMg(NO3)2
反2230应0000物和产5物5--的1800熔0 沸0同.点0A1g5或mgSMe g(NO3)2
• f-----振子强度, N0----单位体积内的基态原子数, • e----为电子电荷, m--- -个电子的质量.
《仪器分析》第四章原子吸收光谱法
积分吸收的限制
要对半宽度(∆v)约为10-3 nm的吸收谱线进行积分, 需要极高分辨率的光学系统和极高灵敏度的检测器, 目前还难以做到。 这就是早在19世纪初就发现了原子吸收的现象, 却难以用于分析化学的原因。
Kv~v曲线反映出原子核外层电子 对不同频率的光辐射具有选择性
吸收特性。
《仪器分析》第四章原子吸收光谱法
影响原子谱线宽度的因素
由原子本身性质决定 由外界影响决定
①. 自然宽度ΔλN( Δ υ N)
它与原子发生能级间跃迁时激发态原子的有限寿命
有关。 一般情况下约相当于10-4 Å (10-5nm)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四节 干扰及其消除
一、物理干扰 来源:试样粘度、表面张力的不同使其进入火焰的速度或喷雾效率改变引起的 干扰。 消除:可通过配制与试样具有相似组成的标准溶液或标准加入法来克服。 二、化学干扰 来源:Analytes (Target species)与共存元素发生化学反应生成难挥发的化合物所
引起的干扰,主要影响原子化效率,使待测元素的吸光度降低。
消除: 1. 加入释放剂:SO42-、PO43-对Ca2+的干扰----加入La(III)、Sr(II)---释放Ca2+; 2. 加入保护剂(配合剂):
PO43-对Ca2+的干扰---加入EDTA----CaY (稳定但易破坏) 。
含氧酸中Mg 和Al 形成MgAl2O4---使A急剧下降-----加8-羟基喹啉作保护剂。 3. 加入缓冲剂或基体改进剂:主要对GFAAS。例如加入EDTA可使Cd的原子化 温度降低。 4. 化学分离:溶剂萃取、离子交换、沉淀分离等
4. 火焰背景干扰
来自燃烧气的背景干扰 宽带吸收:火焰生成物的分子受激产生的宽带光谱对入射光的吸收; 粒子散射:火焰中粒子质对光的散射。 消除:以上两种干扰方式都产生正误差(A增加)。因干扰主要来自燃烧气,
因此可通过空白进行校正。
来自样品基体的背景干扰 宽带吸收:样品基体中分子或其碎片的形成、有机溶剂分子或其碎片对光 的吸收,如CaOH分子宽带对Ba线的干扰。 粒子散射:一些高浓度的元素,如Ti,Zr,W的氧化物,它们的氧化物具 有分馏效应且直径较大,可对光产生散射;有机溶剂的不完全
火焰温度: 不同类型火焰其温度不同,如下表所示。
燃气 C2H2 C2H2 C2H2 H2 H2 H2 丙烷 助燃气 Air O2 N2O Air O2 N2O Air 燃烧速度 /cm.s-1 158-266 温度/oC 特 点
2100-2500 温度较高,最常用(稳定、噪声小、 重现性好,可测定 30 多种元素) 1100-2480 3050-3160 高温火焰,可作上述火焰的补充, 用于其它更难原子化的元素 高温火焰,具强还原性(可使难分 160-285 2600-2990 解的氧化物原子化) , 可用于多达 70 多种元素的测定。 300-440 2000-2318 较低温氧化性火焰,适于共振线位 于短波区的元素(As-Se-Sn-Zn) 900-1400 2550-2933 高燃烧速度,高温,但不易控制 ~390 ~2880 高温,适于难分解氧化物的原子化 低温,适于易解离的元素,如碱金 ~82 ~2198 属和碱土金属。
• 3 引起吸收线变宽的原因 • 1)照射光具有一定的宽度。无外界因素影响 时谱线具有的宽度(10-5nm) • 2)多普勒变宽(温度变宽) • 多普勒效应:一个运动着的原子发出的光,如 果运动方向离开观察者(接受器),则在观察 者看来,其频率较静止原子所发的频率低,反 之,则高。实质上分析样品时,检测器接收到 的是各种稍大或稍小频率的光。 • 3)压力变宽:一定气体压力下粒子之间互相 碰撞 • 4)场致变宽(电场,磁场)
在峰值吸收中,发射线比吸收线窄,并要求 两者的中心频率或波长一致。 这就要求装置中能提供发出和被测元素波长 一致的谱线的光源。如图,假定发射谱线强
度为 1 ,通过样品后到达检测器,变为 0.672
,说明被吸收了0.328 因而,原子吸收光谱仪中通常用待测元素 的空心阴极灯 作锐线光源。
• 5 原子吸收光谱分析的理论基础 • 原子吸收光谱是利用待测元素的原子蒸气中基 态原子与共振线吸收之间的关系来测定的。 • 需要考虑原子化过程中,原子蒸气中基态原 子与待测元素原子总数之间的定量关系 • 势力学平衡中,由于激发态原子数Nj与基态原 子数No之比较小,<1%。可以用基态原子数代 表待测元素的原子总数。
五、检测系统
主要由检测器、放大器、对数变换器、显示记录装置组成。 1. 检测器---将单色器分出的光信号转变成电信号。 如:光电池、光电倍增管、光敏晶体管等。 分光后的光照射到光敏阴极 K上,轰击出的 光电 子又 射向光敏阴极1,轰击出更多的光电子,依次倍增,在最后放 出的光电子 比最初多到 106 倍以上,最大电流可达 10μ A , 电流经负载电阻转变为电压信号送入放大器。 2. 放大器 ---将光电倍增管输出的较弱信号,经电子线路进 一步放大。 3. 对数变换器---光强度与吸光度之间的转换。 4. 显示、记录
(类似样品容器)、分光系统及检测系统。
原子化器 空心阴极灯
单色仪
切光器
检测器
燃气
原子化系统
助燃气 样品液 雾化器 废液
原子吸收仪器结构示意图
一、流程
1.作用
二、光源
提供待测元素的特征光谱。获得较高的灵敏度和准确度 。光源应满足如下要求; (1)能发射待测元素的共振线;
(2)能发射锐线;
(3)辐射光强度大, 稳定性好。
2、原子吸收线的形状 原子吸收光谱线线宽~0.001nm 原子发射光谱线线宽~0.0005nm (有谱线展宽现象) 因此,光谱测定的特征谱线会有区别:
测定元素 吸收分析线波长 发射分析线波长
Al Co
3093 2407
3961 3453
所得曲线为吸收线轮廓(line profile)。原子吸收线轮 廓以原子吸收谱线的中心频率(或中心波长)和半宽 度(half-width) 表征。
4.积分(面积)吸收和峰值(峰高)吸收
钨丝灯光源和氘灯,经分光后,光谱通带 0.2nm 。而原 子吸收线的半宽度:0.001nm。如图所示:
若用氘灯作光源照射气态的 待测原子时,吸收光的强度变 化仅为 0.5%(0.001/0.2) 。灵敏 度极差。 若将原子蒸气吸收的全部能 量,即谱线下所围面积测量出 (积分吸收)。则是一种绝对 测量方法,现在的分光装置无 法实现。 目前测量吸收值的方 法是峰值吸收代替积分吸收。
原子吸收光谱法
(Atomic Absorption Spectrometry, AAS)
第一节 概述
分析对象为金属元素; 通用型方法;
难实现多元素同时测定。
AAS特点: 1)灵敏度高:火焰原子法,ppm 级,有时可达 ppb 级;石 墨炉可达10-9—10-14(ppt 级或更低). 2)准确度高:FAAS 的 RSD 可达1~3%。 3)干扰小,选择性极好; 4)测定范围广,可测70 种元素。 不足:多元素同时测定有困难; 对非金属及难熔元素的测定尚有困难; 对复杂样品分析干扰也较严重;
石墨炉原子吸收分析的重现性较差。
校准曲线的线性范围窄,大多只有一个数量级.
第二节 原子吸收光谱分析基本原理
1、原子吸收线和原子发射线
E3
E2
E1 A B
E0
A 产生吸收光谱 B 产生发射光谱 E0 基态能级 E1、E2、E3、激发态能级 电子从基态跃迁到能量最 低的激发态(称为第一激发态) 时要吸收一定频率的光,这 种谱线称为共振吸收线;当 它再跃迁回基态时,则发射 出同样频率的光(谱线),这 种谱线称为共振发射线(它们 都简称共振线)。
干燥 灰化 原子化 净化 时间,t
干 燥:去除溶剂,防样品溅射; 灰 化:使基体和有机物尽量挥发除去; 原子化:待测物化合物分解为基态原子,此时停止通 Ar,延长原子停
留时间,提高灵敏度;
净 化:样品测定完成,高温去残渣,净化石墨管。
思考:试比较FAAS和GFAAS的优缺点!
(3)优缺点
优点:原子化程度高,试样用量少(1 ~100μL ),可测固体
2.空心阴极灯
结构如图所示
3.空心阴极灯的原理
• 施加适当电压时,电子将从空心阴极内壁流向阳极; • 与充入的惰性气体碰撞而使之电离,产生正电荷,其在 电场作用下,向阴极内壁猛烈轰击; • 使阴极表面的金属原子溅射出来,溅射出来的金属原子 再与电子、惰性气体原子及离子发生撞碰而被激发,于是 阴极内辉光中便出现了阴极物质和内充惰性气体的光谱。 • 用不同待测元素作阴极材料,可制成相应空心阴极灯。 • 空心阴极灯的辐射强度与灯的工作电流有关。 优缺点: (1)辐射光强度大,稳定,谱线窄,灯容易更换。 (2)每测一种元素需更换相应的灯。
四、单色器
同其它光学分光系统一样,原子吸收光度计中的分光系统亦包括出射、 入射狭缝、反射镜和色散原件(多用光栅)。 单色器的作用在于将空心阴极灯阴极材料的杂质发出的谱线、惰性气体 发出的谱线以及分析线的邻近线等与共振吸收线分开。 必须注意: 在原子吸收光度计中,单色器通常位于光焰之后,这样可分掉火焰的 杂散光并防止光电管疲劳。 由于锐线光源的谱线简单,故对单色器的色散率要求不高(线色散率为 10~30Å/mm)。
2)氢化物原子化 特点:可将待测物从在一定酸度 条件下,将试样以还原剂 ( NaBH4 ) 还原为元素的气态氢 化物 ( 常温下 ) ,并通过 Ar 或 N2 将 其带入热的石英管内原子化并测 定(右图)。测定砷\硒\锑等元素.
特点:大量基体被分离,检测限比 火焰法低1-3个数量级,选择性好 且干扰也小。
旦发生重叠干扰,则要求仪器可分辨两条波长相差0.1Å的谱线。
消除:另选分析线。如V线(3082.11Å)对Al 线(3082.15 Å)的干扰; 多谱线的元素产生的谱线之间的干扰等。 2. 非吸收线干扰:来自被测元素自身的其它谱线或光源中杂质的谱线。 消除:减小狭缝和灯电流或另选分析线。 3. 火焰的直流发射:火焰的连续背景发射,可通过光源调制消除。
及粘稠试样,灵敏度高,检测限10-12 g/L。
缺点:精密度差,测定速度慢,操作不够简便,装置复杂。
低温原子化(化学原子化)
包括汞蒸汽原子化和氢化物 原子化。 1)汞蒸汽原子化(测汞仪) 将试样中汞的化合物以还原 剂 ( 如 SnCl2 ) 还原为汞蒸汽 , 并通过 Ar 或 N2 将其带入吸收池 进行测定。
三、原子化系统
1.作用
将试样中离子转变成原子蒸气。
