(word完整版)高三化学试题和答案
高考化学试题及答案word版

高考化学试题及答案word版一、选择题(每题3分,共30分)1. 下列物质中,属于混合物的是:A. 氧气B. 氮气C. 空气D. 二氧化碳答案:C2. 化学反应中,元素的化合价发生变化的是:A. 物理变化B. 化学变化C. 核反应D. 能量转换答案:B3. 金属元素的原子结构中,最外层电子数一般:A. 少于4个B. 多于4个C. 等于4个D. 等于8个答案:A4. 下列化合物中,属于共价化合物的是:A. NaClB. HClC. NaOHD. MgO答案:B5. 根据元素周期表,元素的原子序数越大,其原子半径:A. 越大B. 越小C. 不变D. 先变大后变小答案:B6. 酸雨的pH值一般小于:A. 5.6B. 7C. 5D. 6.5答案:A7. 金属活动性顺序表中,排在氢前面的金属可以:A. 与酸反应放出氢气B. 与水反应放出氢气C. 与氧气反应放出氢气D. 与二氧化碳反应放出氢气答案:A8. 实验室制取氧气的方法是:A. 加热高锰酸钾B. 电解水C. 过氧化氢溶液分解D. 以上都是答案:D9. 下列物质中,不能燃烧的是:A. 木炭B. 硫磺C. 铁丝D. 氮气答案:D10. 根据质量守恒定律,化学反应前后:A. 元素种类不变B. 原子种类不变C. 原子数目不变D. 以上都是答案:D二、填空题(每题4分,共20分)1. 金属钠与水反应生成氢氧化钠和氢气,反应方程式为:______。
答案:2Na + 2H2O → 2NaOH + H2↑2. 硫酸铜溶液呈蓝色,这是因为溶液中含有______离子。
答案:Cu2+3. 实验室中常用的干燥剂有浓硫酸和______。
答案:无水硫酸铜4. 原子核由质子和______组成。
答案:中子5. 根据平衡移动原理,当温度升高时,吸热反应会向______方向移动。
答案:正反应三、计算题(每题5分,共10分)1. 已知2g氢气完全燃烧生成18g水,求氢气燃烧的热化学方程式。
高三化学试题大全及答案

高三化学试题大全及答案一、选择题(每题3分,共30分)1. 下列关于原子结构的说法中,正确的是:A. 原子核由质子和中子组成B. 原子核由质子和电子组成C. 原子核由电子和中子组成D. 原子核由电子和质子组成答案:A2. 元素周期表中,元素的排列顺序是根据:A. 原子序数B. 原子量C. 电子数D. 质子数答案:A3. 下列化合物中,属于共价化合物的是:A. NaClB. H2OC. MgOD. NaOH答案:B4. 化学反应中,能量变化主要表现为:A. 光能B. 热能C. 电能D. 机械能答案:B5. 下列物质中,属于非电解质的是:A. HClB. NaClC. H2OD. CH4答案:D6. 金属元素的活泼性顺序是:A. Na > Mg > AlB. Mg > Al > NaC. Al > Mg > NaD. Na > Al > Mg答案:A7. 下列物质中,属于强酸的是:A. H2SO4B. HClC. CH3COOHD. H2CO3答案:A8. 氧化还原反应中,氧化剂和还原剂之间的关系是:A. 氧化剂被还原B. 还原剂被氧化C. 氧化剂被氧化D. 还原剂被还原答案:A9. 根据勒夏特列原理,当一个平衡系统受到外部条件变化时,系统会:A. 保持不变B. 向减弱外部条件影响的方向移动C. 向加强外部条件影响的方向移动D. 随机移动答案:B10. 下列物质中,属于强碱的是:A. KOHB. NH3C. Na2CO3D. Ca(OH)2答案:A二、填空题(每题4分,共20分)1. 元素周期表中,第IA族元素的价电子数为______。
答案:12. 化学反应中,当反应物的摩尔比为1:1时,该反应为______反应。
答案:等摩尔3. 金属元素的活泼性顺序中,位于氢前面的金属元素能与酸反应生成氢气,这是基于金属的______性。
答案:还原4. 氧化还原反应中,氧化剂失去电子,被还原,其化合价______。
高三化学试题卷子及答案

高三化学试题卷子及答案一、选择题(每题3分,共30分)1. 下列物质中,属于电解质的是:A. 蔗糖B. 酒精C. 硫酸D. 氯化钠答案:D2. 化学反应速率与下列哪个因素无关?A. 反应物浓度B. 温度C. 催化剂D. 反应物的物理状态答案:D3. 下列化合物中,属于共价化合物的是:A. NaClB. CaOC. HClD. MgO答案:C4. 根据元素周期表,下列元素中属于金属元素的是:A. 氢B. 氧C. 钠D. 氯答案:C5. 根据酸碱中和反应的原理,下列物质中可以中和盐酸的是:A. 氢氧化钠B. 硫酸C. 硝酸D. 碳酸钠答案:A6. 下列反应中,属于氧化还原反应的是:A. 2H2 + O2 → 2H2OB. 2NaOH + H2SO4 → Na2SO4 + 2H2OC. 2H2O → 2H2 + O2D. NaCl + AgNO3 → AgCl + NaNO3答案:A7. 下列物质中,可以作为干燥剂的是:A. 浓硫酸B. 浓盐酸C. 酒精D. 蒸馏水答案:A8. 在化学反应中,下列物质中可以作为还原剂的是:A. 氧气B. 氢气C. 氯气D. 铁答案:B9. 根据化学平衡原理,下列反应中,平衡常数Kc最大的是:A. 2NO2(g) ⇌ N2O4(g)B. 2HI(g) ⇌ H2(g) + I2(g)C. 2SO2(g) + O2(g) ⇌ 2SO3(g)D. 2H2(g) + O2(g) ⇌ 2H2O(g)答案:A10. 根据原子结构,下列元素中,最外层电子数为8的元素是:A. 氦B. 氧C. 氟D. 氖答案:D二、填空题(每题4分,共20分)1. 写出下列化合物的化学式:硫酸铜______。
答案:CuSO42. 写出下列化合物的化学式:碳酸钠______。
答案:Na2CO33. 写出下列化合物的化学式:硝酸钾______。
答案:KNO34. 写出下列化合物的化学式:氯化铵______。
高中化学试题(word版,含答案)

同恩教育教师招聘化学测试卷(高中)姓名______________ (60分钟完卷;总分100分)分数_________________ 一.选择题(8×5分=40分)1.化学与生活、社会密切相关。
下列说法正确的是()A.光导纤维导电能力很强,是一种很好的通讯材料B.凡含有食品添加剂的食物对人体健康均有害,不可食用C.苯酚有一定毒性,能做消毒剂和防腐剂D.棉、麻、丝、毛及合成纤维完全燃烧都只生成二氧化碳和水2.N A代表阿伏加德罗常数。
下列说法中,不正确...的是()A.标准状况下,NO和O2各11.2 L 混合,所得混合气体的分子总数为0.75 N AB.25℃时,l L pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 N AC.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2N A个电子D.2.8g 乙烯与丙烯的混合物中含碳原子的数目为0.2N A3.下列实验问题处理方法不正确的是()A.制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞B.在气体发生装置上直接点燃乙炔气体时,必须先检验乙炔气体的纯度C.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室D.给试管中的液体加热时不时移动试管或加入碎瓷片,以免暴沸伤人4.右图是电解饱和氯化钠溶液(滴入酚酞)的装置,电极均为惰性电极。
下列判断正确的是A.x 极为阴极,y极为阳极B.电解过程中,氢离子浓度不变C.通电一段时间后,d极附近溶液颜色变红D.通电一段时间后,b试管中溶液颜色变蓝5.在密闭容器中,反应2X (g) + Y (g) 3Z (g) 达到平衡后,若将容器体积缩小一半,对反应产生的影响是()A.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动C.正、逆反应速率都减小,平衡不移动D.正、逆反应速率都增大,平衡不移动6.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为A.NH3、NO2、N2B.NH3、NO、CO2C.NH3、NO2、CO2D.NO、CO2、N27.氢化铵(NH 4H )与氯化铵的结构相似,又知NH 4H 与水反应有H 2生成,下列叙述正确的是A .NH 4H 是共价化合物B .NH 4H 溶于水,所形成的溶液显碱性C .NH 4H 与水反应时,水作还原剂D .NH 4H 中的H 元素只有一种化合价8.科学家研制出多种新型杀虫剂,化合物A 是其中的一种。
高三化学试题及答案word

高三化学试题及答案word一、选择题(每题3分,共30分)1. 下列物质中,属于电解质的是:A. 二氧化碳B. 蔗糖C. 氯化钠D. 酒精答案:C2. 金属钠与水反应的化学方程式为:A. 2Na + 2H2O → 2NaOH + H2B. 2Na + H2O → 2NaOH + H2C. Na + 2H2O → NaOH + H2D. Na + H2O → NaOH + H2答案:B3. 以下化合物中,属于共价化合物的是:A. NaClB. HClC. MgOD. NaOH答案:B4. 在标准状况下,1 mol氧气的体积是:A. 22.4 LB. 44.8 LC. 22.4 mLD. 44.8 mL答案:B5. 以下物质中,不属于碱的是:A. NaOHB. KOHC. HClD. Ca(OH)2答案:C6. 根据元素周期表,下列元素中,原子半径最大的是:A. NaB. MgC. AlD. Si答案:A7. 下列反应中,属于氧化还原反应的是:A. 2H2 + O2 → 2H2OB. 2H2O → 2H2 + O2C. 2H2O → 2H2O2D. H2 + Cl2 → 2HCl答案:A8. 根据化学反应速率,下列反应中,反应速率最快的是:A. 2H2 + O2 → 2H2OB. 2H2 + O2 → 2H2O(点燃)C. 2H2 + O2 → 2H2O(加热)D. 2H2 + O2 → 2H2O(常温)答案:B9. 下列物质中,属于非金属单质的是:A. O2B. NaC. Cl2D. Cu答案:A10. 根据酸碱中和反应,下列反应中,属于中和反应的是:A. HCl + NaOH → NaCl + H2OB. H2SO4 + NaOH → Na2SO4 + 2H2OC. HCl + KOH → KCl + H2OD. HCl + H2O → H3O+答案:A二、填空题(每题5分,共20分)1. 写出金属铁与稀硫酸反应的化学方程式:Fe + H2SO4 → FeSO4 + H2↑。
高三化学试题大全及答案

高三化学试题大全及答案一、选择题(每题3分,共30分)1. 下列物质中,属于纯净物的是:A. 空气B. 矿泉水C. 液态氧D. 铁矿石2. 化学方程式书写正确的是:A. 2H2 + O2 → 2H2OB. 2H2 + O2 → 2H2O(未配平)C. 2H2 + O2 → 2H2O(未标条件)D. 2H2O → 2H2 + O2(未标条件)3. 根据题目所给的化学方程式,计算反应物或生成物的量,正确的计算方法是:A. 直接使用化学方程式中的系数进行计算B. 将化学方程式配平后,再进行计算C. 根据化学方程式中各物质的摩尔质量进行计算D. 根据化学方程式中各物质的相对分子质量进行计算4. 根据题目所给的化学方程式,下列说法正确的是:A. 反应物和生成物的总质量在反应前后相等B. 反应物和生成物的总能量在反应前后相等C. 反应物的摩尔数在反应前后相等D. 反应物的原子数在反应前后不相等5. 下列物质中,属于电解质的是:A. 蒸馏水B. 酒精C. 氯化钠D. 二氧化碳6. 根据题目所给的化学方程式,下列说法正确的是:A. 反应物的总摩尔数等于生成物的总摩尔数B. 反应物的总质量等于生成物的总质量C. 反应物的总能量等于生成物的总能量D. 反应物的总电荷数等于生成物的总电荷数7. 根据题目所给的化学方程式,下列说法错误的是:A. 反应物和生成物的摩尔比等于化学方程式中的系数比B. 反应物和生成物的原子数在反应前后相等C. 反应物和生成物的总质量在反应前后相等D. 反应物和生成物的总能量在反应前后不相等8. 根据题目所给的化学方程式,下列说法正确的是:A. 反应物的摩尔数在反应前后不相等B. 反应物的总质量在反应前后不相等C. 反应物的总能量在反应前后相等D. 反应物的总电荷数在反应前后不相等9. 下列物质中,属于非电解质的是:A. 硫酸B. 氢氧化钠C. 水D. 蔗糖10. 根据题目所给的化学方程式,下列说法正确的是:A. 反应物的总摩尔数在反应前后不相等B. 反应物的总质量在反应前后不相等C. 反应物的总能量在反应前后相等D. 反应物的总电荷数在反应前后不相等二、填空题(每空2分,共20分)11. 摩尔质量的单位是________。
全国高三高中化学专题试卷带答案解析
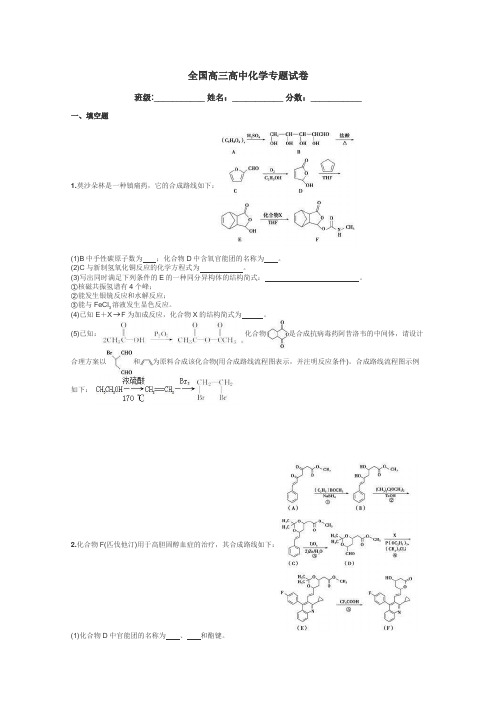
全国高三高中化学专题试卷班级:___________ 姓名:___________ 分数:___________一、填空题1.莫沙朵林是一种镇痛药,它的合成路线如下:(1)B中手性碳原子数为;化合物D中含氧官能团的名称为。
(2)C与新制氢氧化铜反应的化学方程式为。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:。
①核磁共振氢谱有4个峰;②能发生银镜反应和水解反应;③能与FeCl溶液发生显色反应。
3(4)已知E+X F为加成反应,化合物X的结构简式为。
(5)已知:化合物是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以和为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。
合成路线流程图示例如下:2.化合物F(匹伐他汀)用于高胆固醇血症的治疗,其合成路线如下:(1)化合物D中官能团的名称为、和酯键。
(2)A→B 的反应类型是 。
(3)写出同时满足下列条件的A 的一种同分异构体的结构简式: 。
①分子中含有两个苯环;②分子中有3种不同化学环境的氢;③不含—O —O —。
(4)实现D→E 的转化中,化合物X 的分子式为C 19H 15NFBr ,写出其结构简式: 。
(5)已知:化合物E 在CF 3COOH 催化作用下先转化为,再转化为F 。
你认为合成路线中设计步骤②的目的是 。
(6)上述合成路线中,步骤③的产物除D 外还生成,该反应原理在有机合成中具有广泛应用。
试写出以为主要原料制备的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:3.托卡朋是基于2012年诺贝尔化学奖的研究成果开发的治疗帕金森氏病药物,《瑞士化学学报》公布的一种合成路线如下:(1)C→D 的反应类型为 。
(2)化合物F 中的含氧官能团有羟基、 和 (填官能团名称)。
(3)写出同时满足下列条件的D 的一种同分异构体的结构简式: 。
①能与Br 2发生加成反应;②是萘()的衍生物,且取代基都在同一个苯环上;③在酸性条件下水解生成的两种产物都只有4种不同化学环境的氢。
高考化学试题及答案解析

高考化学试题及答案解析一、选择题(每题3分,共30分)1. 下列物质中,属于纯净物的是()。
A. 空气B. 矿泉水C. 蒸馏水D. 石油答案:C解析:纯净物是指由单一物质组成的物质,蒸馏水是由水分子组成的纯净物,而空气、矿泉水和石油都是混合物。
2. 化学反应中,能量变化的主要形式是()。
A. 光能B. 热能C. 电能D. 机械能答案:B解析:化学反应中,能量变化的主要形式是热能,因为反应过程中通常伴随着热量的释放或吸收。
3. 下列物质中,属于电解质的是()。
A. 酒精B. 蔗糖C. 硫酸D. 醋酸答案:C解析:电解质是指在水溶液中或熔融状态下能够导电的化合物,硫酸是一种强酸,属于电解质。
4. 元素周期表中,第ⅢA族元素的价电子数是()。
A. 1B. 2C. 3D. 4答案:C解析:元素周期表中,第ⅢA族元素的最外层电子数为3,因此价电子数为3。
5. 下列反应中,属于氧化还原反应的是()。
A. 2H2O → 2H2 + O2B. NaCl + AgNO3 → AgCl + NaNO3C. 2H2 + O2 → 2H2OD. 2H2O2 → 2H2O + O2答案:C解析:氧化还原反应是指在化学反应中,元素的氧化态发生变化的反应。
选项C中,氢气与氧气反应生成水,氢元素的氧化态从0变为+1,氧元素的氧化态从0变为-2,因此属于氧化还原反应。
6. 根据勒夏特列原理,下列操作中,可以使平衡向正反应方向移动的是()。
A. 增加反应物浓度B. 减少生成物浓度C. 增加生成物浓度D. 减少反应物浓度答案:A解析:勒夏特列原理指出,如果改变影响平衡的一个条件,平衡会向减弱这种改变的方向移动。
增加反应物浓度会使得平衡向正反应方向移动。
7. 下列化合物中,属于共价化合物的是()。
A. NaClB. H2OC. NaOHD. MgO答案:B解析:共价化合物是由共用电子对形成的化合物。
水分子中,氢原子与氧原子之间通过共用电子对形成共价键,因此属于共价化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2016~2017学年度高三第二次检测化学试题一、选择题(每小题2分,共60分,每小题只有一个选项符合题意)1.下列有关海水综合利用的说法正确的是( )A.电解饱和食盐水可制得金属钠B.海带提碘只涉及物理变化C.海水提溴涉及氧化还原反应D.海水提镁不涉及复分解反应2.某学生以铁丝和Cl2为原料进行下列三个实验。
从分类角度分析,下列选项正确的是( )A.实验①、③反应制得的物质均为纯净物B.实验②、③均未发生氧化还原反应C.实验②、③均为放热反应D.实验①、②所涉及的物质均为电解质3.下列有关物质应用的说法正确的是()A.生石灰用作食品抗氧剂 B.盐类都可作调味品C.铝罐可久盛食醋 D.小苏打是面包发酵粉的主要成分4.将足量2CO通入下列各溶液中,所含离子还能大量共存的是()A. 224Na OH SO+---、S、、 B.6533Na C COO HCO+---、H O、CH、C. 3244H Al SO+++-、NH、、 D. 233K Cl NO+---、SiO、、5.下列物质与水作用形成的溶液能与NH4Cl反应生成NH3的是()A.二氧化氮B.钠 C.硫酸镁 D.二氧化硅6.下列说法错误的是()①加热HgO制取Hg ②将钠加入氯化铜溶液中制取铜③电解熔融氯化铝制取铝④电解饱和食盐水来制取金属钠⑤不能利用铝热反应制取镁A.②④ B.①③⑤ C.②③④ D.①⑤7.某同学用下列装置制备并检验Cl2的性质,下列说法正确的是( )A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成C.Ⅲ图中:生成蓝色的烟D.Ⅳ图中:量筒中发生了加成反应,量筒内液面上升,量筒壁上有无色液滴出现7.以下进行性质比较的实验,不合理的是()A.比较Cu、Fe2+的还原性:铁加入硫酸铜溶液中B.比较氯、溴单质的氧化性:溴化钠溶液中通入氯气C.比较镁、铝金属性:氯化镁、氯化铝溶液中分别加入过量的NaOH溶液D.比较碳、硫非金属性:测定同条件同物质的量浓度的Na2CO3、Na2SO4溶液的pH8.将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是()A.H Cl B.N aOH C.K2SO4D.M gSO49.下列关于物质或离子检验的叙述正确的是()A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO210.从下列事实所列出的相应结论正确的是11.下列关于硫及含硫化合物的叙述正确的是()A.将Cu片置于浓H2SO 4中,无明显现象,说明Cu在冷的浓硫酸中被钝化B.SO2具有漂白性所以它能使碘的淀粉溶液由蓝色变为无色C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体D.SO2和Cl2分别与双氧水反应均产生O211.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是()A.NaOH B.KMnO4C.KSCN D.苯酚12.A、B、C、D有如图所示转化关系:,则A、D可能是( ) ①C、O2②Na、O2③NaOH、CO2④S、O2⑤Fe、Cl2A.①②③ B.④⑤ C.①②④ D.①②③⑤13.下列类比关系正确的是()A.AlCl3与过量NaOH溶液反应生成,则与过量NH3·H2O也生成B.Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2C.Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3D.Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应13.在化学学习与研究中类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否.下列几种类推结论中错误的是()①SO2能与碱反应,则非金属氧化物都能与碱反应②镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物也是Na2O③CO2和SiO2化学式相似,则CO2与SiO2的物理性质也相似④Ca(HCO3)2的溶解度比CaCO3大,则NaHCO3的溶解度比Na2CO3大.A.①B.②③④C .①②③④ D.②③13.已知BrCl能发生下列反应:nBrCl+2M=MCl n+MBr n(M为+n价的金属元素),BrCI+H20=HCl+HBrO,以下推论不正确的是 ( )A.BrCl具有和卤素单质相似的化学性质B.BrCl和M反应时,BrCl只作氧化剂C.BrCl和NaOH溶液反应生成NaCI.NaBrO两种盐D.将BrCl跟FeS04溶液反应。
溶液会变成无色14.向物质的量浓度均为1 mol·L-1的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,如图中能正确表示这个反应过程的是( ) 14.在通风橱中进行下列实验:步骤现象Fe表面产生大量无色气泡,液面上方变为红棕色Fe表面产生少量红棕色气泡后,迅速停止Fe、Cu接触后,其表面产生红棕色气泡下列说法中不正确...的是()A.Ⅰ 种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化15. “飘尘”是物质燃烧时产生的粒状漂浮物,颗粒很小(直径小于10-7m),不易沉降(可漂浮数小时甚至数年),它与空气中的SO2.O2接触时, SO2:会转化为SO3,使空气酸度增加。
飘尘所起的主要作用与下列变化中硫酸的作用相同的是( )。
A.胆矾中加浓硫酸B.浓硫酸与木炭共热C.乙酸乙酯与稀硫酸共热D.浓硫酸滴到蔗糖中制“黑面包”16.A 、B 、C 为3种单质(其中A 为固体,B 、C 为气体),将D 的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B 、C 反应的产物易溶于水得到无色溶液E 。
它们之间的转化关系如图,下列推断正确的是( )A .物质B 是H 2 B .物质C 是Cl 2 C .物质D 是FeCl 2 D .物质F 是FeCl 217.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe 2O 3、SiO 2、Al 2O 3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO 4·7H 2O),设计了如下流程:下列说法不正确...的是() A .溶解烧渣选用足量硫酸,试剂X 选用铁粉B .固体1中一定含有SiO 2,控制pH 是为了使Al 3+转化为Al(OH)3,进入固体2C .从溶液2得到FeSO 4·7H 2O 产品的过程中,须控制条件防止其氧化和分解D .若改变方案,在溶液1中直接加NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO 4·7H 2O17.如图是某研究小组采用电解法处理石油炼制过程中产生的大量H 2S 废气的工艺流程。
该方法对H 2S 的吸收率达99%以上,并可制取H 2和S 。
下列说法正确的是 ( )A .吸收H 2S 的离子方程式为Fe 3++H 2S =Fe 2++S↓+2H +B .电解过程中的阳极反应主要为2Cl --2e -=Cl 2↑ C .实验室可用点燃充分燃烧的方法消除H 2S 污染 D .该工艺流程体现绿色化学思想18.在给定条件下,下列选项中所示的物质间转化均能一步实现的是 ( )A.粗硅SiCl 4SiB.Mg(OH)2MgCl 2(aq)MgC.Fe 2O 3FeCl 3(aq)无水FeCl 3D.AgNO 3(aq)OH(aq)Ag19.已知:①向KMnO 4晶体上滴加浓盐酸,产生黄绿色气体;②向FeCl 2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉-KI 试纸上,试纸变蓝色。
下列判断正确的是( )A .实验①生成的气体不能使湿润的淀粉-KI 试纸变蓝B.实验②证明Fe2+既有氧化性又有还原性C.上述实验证明氧化性:MnO-4>Cl2 >Fe3+>I2D.上述实验中,共有两个氧化还原反应20.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:Na Cu Al Fe熔点(0C)97.5 1083 660 1535沸点(0C)883 2595 2200 3000你判断其中不能形成合金的是A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na21.下列反应中,反应后固体物质增重的是()A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液21.在相同条件下,总质量为2 g的CO和H2的混合气体,在O2中完全燃烧后全部通过足量的Na2O2固体,则固体质量增加 ( )A.2 g B.1 g C.18 g D.无法计算22. “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。
实验操作:钠与氯气反应的装置可作如下图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已擦净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。
先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。
以下叙述错误的是()A.反应生成的大量白烟是氯化钠晶体B.玻璃管尾部塞一团浸有NaOH溶液的棉花球是用于吸收过量的氯气,以免其污染空气C.钠着火燃烧产生苍白色火焰D.若在棉花球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收23.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。
下列化合物中符合上述条件的是( )A.AlCl3B.Na2OC.FeCl2D.SiO223.下列实验中不能出现沉淀现象的是()A.NO2和SO2气体同时通入BaCl2溶液中B.SO2气体通入BaCl2溶液中C.SO2气体通入Ba(NO3)2溶液中 D.SO2气体和过量NH3同时通入BaCl2溶液中24.要确定铁的某氯化物FeCl x的化学式,可用离子交换和滴定的方法。
实验中称取0.54 g的FeCl x 样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。
交换完成后,流出含OH-的溶液用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。
则FeCl x中x的值为( )A.1 B.2 C.3 D.425.少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是()A. a:Cl﹣b:K+ c:CO32﹣ d:HCO3﹣B. a:K+ b:CO32﹣ c:Cl﹣ d:HCO3﹣C. a:K+ b:CO32﹣ c:HCO3﹣ d:Cl﹣D. a:K+ b:HCO3﹣ c:Cl﹣ d:CO32﹣25.常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。
