高三化学一轮复习 7.2 化学平衡状态化学平衡常数课件 新人教版
高考化学一轮复习 第1课时 化学平衡状态 化学平衡常数课件

(1)化学平衡研究的对象:封闭体系的可逆反应。只有可逆反应才有可能存在化学 平衡状态。 (2)“v(正)=v(逆)”,是化学平衡状态微观本质的条件,其含义可简单地理解为:对 反应物或生成物中同一物质而言,其生成速率等于消耗速率。“反应混合物中各 组分的浓度不变”是平衡状态的宏观表现,是v(正)=v(逆)的必然结果。 (3)平衡状态直接规定了在一定条件下可逆反应进行的程度大小,也是可逆反应进 行到最大限度的结果。 (4)从化学平衡的特征判断可逆反应是否达到化学平衡时,要特别注意外界条件 的限制及反应本身的特点,如“恒温、恒容”、“体积可变”、“体积不变”、 “全是气体参加”等。
(2)若将2 molN2和4 molH2放入起始体积相同的恒容容器中,在与(1)相同的温 度下达到平衡,试比较平衡时NH3的浓度:(1)________(2)(填“>”、“<”或 “=”)。
解析:①由反应:N2(g)+3H2(g) 起始物质的量
2NH3(g)
(mol)
2
4
0
转化物质的量
(mol)
x
正反应进行的程度 越高 。
3.平衡常数的应用和注意事项 (1)在不同条件下进行的同一可逆反应,K值越大,反应物的转化率 越大 , 正反应进行的程度 越高 。
(2)平衡常数只与 温度 有关,与其他因素无关。 (3)固体 和纯液体 的浓度通常看作常数“1”,不计入平衡常数表达式中。
思考:
反应:①3H2+N2
1.应用 (1)判断、比较可逆反应进行程度的大小。 K值越大,反应进行的程度越大; K值越小,反应进行的程度越小。 (2)判断可逆反应是否达到化学平衡状态 对于可逆反应aA(g)+bB(g) cC(g)+dD(g), 在一定温度下的任意时刻, 反应物与生成物浓度有如下关系: 浓度商Q=
高三一轮复习-化学平衡ppt课件.ppt

行到t1时刻达到平衡状态的是
bd
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
判断:
(1)当条件改变时,平衡一定会发生移动
(2)当速率发生变化时,平衡一定发生移动
√ (3)当平衡发生移动时,速率一定发生变化
(4)当平衡正向移动时,反应物的转化率一定 增大
(二)化学平衡的移动: 病原体侵入机体,消弱机体防御机能,破坏机体内环境的相对稳定性,且在一定部位生长繁殖,引起不同程度的病理生理过程
增大N2或H2的浓度
升高温度
减小压强
使用催化剂
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 பைடு நூலகம்长繁 殖,引 起不同 程度的 病理生 理过程
2.2HI(g) H2(g)+I2(g),平衡后再充入HI, HI转化率_不__变_
3.A(s)+ B(g)
C(g)+D(g)平衡后再充入B,
B的转化率__减__小
例1:向密闭容器中加入NO2,一段时间后形成平 病原体侵入机体,消弱机体防御机能,破坏机体内环境的相对稳定性,且在一定部位生长繁殖,引起不同程度的病理生理过程
衡2NO2
N2O4; △H<0.
(1)恒温恒容充入少量Ne,气体颜色_不__变__
(2)恒温恒压充入少量Ne ,气体颜色先__变__浅__后__变_深_
(3) 恒温恒压充入少量NO2,在新的平衡状态混合 气体的颜色_不__变_,NO2的平衡转化率_不_变__ , NO2的体积分数__不__变___。 (4)恒温恒容再充入少量NO2,新的平衡状态混合气 体的颜色_加_深__,NO2的平衡转化率_增__大_ NO2的体积分数___减__小_____.
人教版高中化学选择性必修第一册第二章 第二节 第1课时 化学平衡状态和化学平衡常数(课件PPT)

应用
②判断反应的热效应,若升高温度,K值越大,则正反应为吸 热反应;反之,K值减小,则正反应为放热反应③用于计算平
衡浓度,物质的量分数、转化率等
说明:①对于一个可逆反应,浓度平衡常数的表达式不是唯一 的,它与化学反应方程式的书写有关。化学反应方程式的书 写不同,各反应物、生成物的化学计量数不同,平衡常数的 表达式就不同。
可知为4 mol·L-1,则①的平衡常数K1=[NH3]平·[HI]平=
5×4=20,C正确。
[答案] C
谢 谢!
[解析] 若反应向右进行,则X2、Y2、Z三种物质的物质的量 浓度范围依次是:0~0.1 mol·L-1、0.2 mol·L-1~0.3 mol·L-1、0.2 mol·L-1~0.4 mol·L-1;若反应向左进行, 则X2、Y2、Z三种物质浓度范围依次是:0.1 mol·L-1~0.2 mol·L-1、0.3 mol·L-1~0.4 mol·L-1、0~ 0.2 mol·L-1。
①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)。达
到平衡时,c(H2)=0.5 mol·L-1 c(HI)=4 mol·L-1,则此温度
下反应①的平衡常数为
()
A.9
B.16
C.20
D.25
[解析] 由H2和HI的平衡浓度可推算出①反应生成的HI和 NH3的浓度都为0.5×2+4=5 mol·L-1,由于NH3没有转 化,其平衡浓度仍为5 mol·L-1,而HI的平衡浓度由题意
密度一定(ρ= )
不一定 平衡
反应体系内有有色物质时,颜色稳 颜色
定不变
平衡
注意:可逆反应达到平衡状态时有两个核心判断依据: (1)正反应速率和逆反应速率相等。 (2)反应混合物中各组成成分的百分含量保持不变。 依据其他有关的量判断可逆反应是否达到平衡状态时,最
高考化学一轮复习化学平衡常数与平衡图像复习讲义
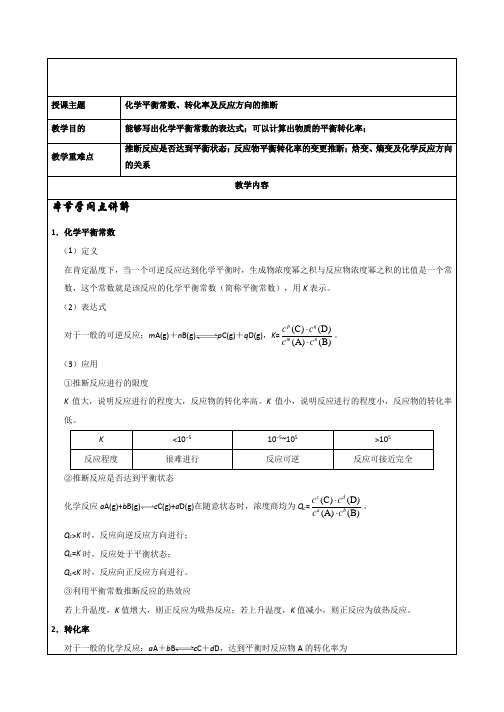
授课主题化学平衡常数、转化率及反应方向的推断教学目的能够写出化学平衡常数的表达式;可以计算出物质的平衡转化率;教学重难点推断反应是否达到平衡状态;反应物平衡转化率的变更推断;焓变、熵变及化学反应方向的关系教学内容本节学问点讲解1.化学平衡常数(1)定义在肯定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用K表示。
(2)表达式对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),K=(C)(D) (A)(B)p qm nc cc c⋅⋅。
(3)应用①推断反应进行的限度K值大,说明反应进行的程度大,反应物的转化率高。
K值小,说明反应进行的程度小,反应物的转化率低。
K <10−510−5~105>105反应程度很难进行反应可逆反应可接近完全②推断反应是否达到平衡状态化学反应a A(g)+b B(g)c C(g)+d D(g)在随意状态时,浓度商均为Q c=(C)(D) (A)(B)c da bc cc c⋅⋅。
Q c>K时,反应向逆反应方向进行;Q c=K时,反应处于平衡状态;Q c<K时,反应向正反应方向进行。
③利用平衡常数推断反应的热效应若上升温度,K值增大,则正反应为吸热反应;若上升温度,K值减小,则正反应为放热反应。
2.转化率对于一般的化学反应:a A+b B c C+d D,达到平衡时反应物A的转化率为α(A)=A AA的初始浓度-的平衡浓度的初始浓度×100%=0(A)(A)(A)c cc×100%[c0(A)为起始时A的浓度,c(A)为平衡时A的浓度]反应物平衡转化率的变更推断推断反应物转化率的变更时,不要把平衡正向移动与反应物转化率提高等同起来,要视详细状况而定。
常见有以下几种情形:反应类型条件的变更反应物转化率的变更有多种反应物的可逆反应m A(g)+n B(g)p C(g)+q D(g) 恒容时只增加反应物A的用量反应物A的转化率减小,反应物B的转化率增大同等倍数地增大(或减小)反应物A、B的量恒温恒压条件下反应物转化率不变恒温恒容条件下m+n>p+q反应物A和B的转化率均增大m+n<p+q反应物A和B的转化率均减小m+n=p+q反应物A和B的转化率均不变只有一种反应物的可逆反应m A(g)n B(g)+p C(g) 增加反应物A的用量恒温恒压条件下反应物转化率不变恒温恒容条件下m>n+p反应物A的转化率增大m<n+p反应物A的转化率减小m=n+p反应物A和B的转化率不变3.化学反应进行的方向一、自发过程1.含义在肯定条件下,不须要借助外力作用就能自动进行的过程。
高中化学人教版《化学平衡常数》精品课件1

2 4 3.下列关于氢原子的电子云图的描述中,正确的是 ( )
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
2
(2)根据流程图,二氧化锰与氢氧化钾溶液、氧气在高温条件下发生反应生成锰酸钾和水,化学方程式为2MnO2+4KOH+O2
2K2MnO4+2H2O;
K2 = [NO2]/[N2O4]1/2
温度
623K 698K 763K
浓度平衡常数 66 .9 54.4
45.9
通过改变温度,平衡常数大小的变化趋势可以判断
上面可逆反应的正方向是 放热反应 .
(3)计算平衡转化率
对于可逆反应: mA(g)+nB (g)
pC(g)+qD(g)
反应物A的平衡转化率(该条件最大转化率)可表示:
(A)% A的初 A的 始初 浓 A的 始 度平 浓衡 度 浓 10 度 % 0
c(H2) • c(I2)
2、常数K与反应的起始浓度大小无关;
3、常数K与正向建立还是逆向建立平衡无关即 与平衡建立的过程无关。
其它平衡体系的数据进行分析,都有类似的关系
对于反应: aA + bB
cC + dD
K
cc (C)cd (D) ca ( A) cb (B)
一、化学平衡常数
1、定义: 在一定温度下,当一个可逆反应达到平衡时,
α(H2O)= 20%
结论: 增大一种反应物的浓度,能提高另一种反应物的转
化率,而本身的转化率减小
练习 1.下列关于平衡常数K的说法中,正确的是( D )
①平衡常数K只与反应本身及温度有关 ②改 变反应物浓度或生成物浓度都会改变平衡常数K ③加入催化剂不改变平衡常数K ④平衡常数K只
人教版高考化学复习精品课件 专题七 化学反应速率 化学平衡 第21讲 化学平衡 化学平衡常数及计算

考向2 平衡标志的判断
①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变
√
续表
[对点训练2] (2023·苏州模拟)在恒温恒容密闭容器中,可以作为合成氨反应达到化 学平衡状态的标志的是( D )
乙丁戊
甲
乙
丙
丁
戊
己
02 考点2 化学平衡常数及计算
必备知识·梳理
1.概念 在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂 之积的比值是一个常数,即化学平衡常数,用符号___表示。
温度
4.平衡常数的意义及应用 (1)判断可逆反应进行的程度
反应程度
很难进行
反应可逆
反应接近完全
正 平衡
逆 (3)判断可逆反应的热效应
关键能力·提升
考向1 化学平衡常数与化学方程式的关系
B
考向2 化学平衡常数的应用
700
800
0.6
0.9
830
1000
1200
1.0
1.7
2.6
回答下列问题: 吸热
正反应
逆反应
二、化学平衡
1.化学平衡状态:在一定条件下,__可__逆__反应中正反应速率与逆反应速率__相__等__,反 应混合物中各组成成分浓度、含量保持__不__变__的状态,叫做化学平衡状态。
最大
零
小
大
平衡状态既可从正反应方向开始达到平衡,也可以从逆反应方向开始达到平衡。
3.化学平衡的特点: 动态
等于
不 行
向逆反应方向进
容器编号
温度
Ⅰ
0.2
0.2
0.05
Ⅱ
0.2
0.2
高中化学《平衡常数一轮复习》最新公开课PPT课件

的Kp=
(用表达式表示)。
平衡常数表达式Βιβλιοθήκη 高考真题回顾乙苯催化脱氢制苯乙烯反应:
(2)维持体系总压强 p 恒定,在温度 T 时,物质的量为 n 、体积
为 V 的乙苯蒸汽发生催化脱氢反应,已知乙苯的平衡转化率
为 a ,则在该温度下反应的平衡常数 K =
(用 a 等
符号表示)
平衡常数计算
知识整合
表明反应 进行程度
数表达式。
4、写出次氯酸根离子水解的离子方程式,并写出其对应的平
衡常数表达式。
基础巩固Ⅱ—平衡常数的影响因素
思考:升高温度,K怎样变化?
Ka、Kw、Kh 怎样变?
2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率(a)与 体系总压强(p)的关系如图所示。根据图示回答下列问题: (1)平衡状态由A变到B时,平衡常数K(A)____K(B)。
后,溶液显中性
基础巩固Ⅲ—平衡常数的意义
1、化学平衡常数K 的大小能说明反应进行的程度。 K 越大,表示反应进行的越_______。
2、Ka、Kb的大小表示弱酸、弱碱的相对强弱。
Ka 越大,弱酸的酸性越____; Kb 越大,弱碱的碱性越____。
3、Kh 越大,盐水解程度越_____……
基础巩固Ⅲ—平衡常数的意义
意义
表达式 影响因素
概 念
应用
平衡常数
判断反应进行方向 计算反应物转化率
化
电盐
学
离水
平
平解
衡
衡常
常
常数
数
数
基础巩固Ⅰ—平衡常数表达式
1、写出下列反应的平衡常数表达式
注(意1):N1H、2C表OO达NH式4(s中) ,固2体NH、3 (纯g)+液C体O2 (一g) 般不写;
《化学平衡状态》课件

总结词
详细描述
反应速率受温度、浓度、压力和催化剂等 因素影响。
温度越高,反应速率越快;浓度越高,反 应速率越快;压力越大,反应速率越快; 适当使用催化剂可以加快反应速率。
化学反应的方向
总结词
反应方向决定了化学平衡的移 动方向。
详细描述
根据勒夏特列原理,如果改变 影响平衡的条件,平衡就会向 着减弱这种改变的方向移动。
在制药工业中,化学平衡状态对于药物的合成和分离过程至关重要,通过调节平衡 条件可以获得高纯度的药物。
环境保护中的应用
化学平衡状态在环境保护中也有着重 要的应用,例如在大气污染控制中, 通过化学反应原理来降低大气中的污 染物浓度。
在土壤污染修复中,通过调节土壤中 的化学平衡来降低重金属等有害物质 的活性,从而减少对生态环境的危害 。
用率。
促进环境保护
通过研究化学平衡状态,可以减少 有害物质的排放,促进环境保护。
推动科学研究
化学平衡状态是化学反应动力学和 热力学研究的重要内容,有助于深 入了解化学反应的本质和规律。
02
化学平衡状态的建立
化学反应的速率
总结词
详细描述
反应速率是化学平衡状态建立的关键因素 。
化学反应速率决定了反应进行的快慢,对 于可逆反应,正逆反应速率相等是平衡状 态的特征之一。
《化学平衡状态》ppt课件
目录
• 化学平衡状态的定义 • 化学平衡状态的建立 • 化学平衡状态的移动 • 化学平衡状态的应用 • 化学平衡状态的实验验证
01
化学平衡状态的定义
什么是化学平衡状态
01
化学平衡状态是指在一定条件下 ,可逆反应进行到正、逆反应速 率相等且不再改变的状态。
02
