pH法测乙酸乙酯皂化反应速率常数数据处理
乙酸乙酯皂化反应速率常数的测定实验报告

乙酸乙酯皂化反应速率常数的测定实验报告乙酸乙酯皂化反应速率常数的测定实验报告引言:皂化反应是一种重要的有机化学反应,通过碱与酯的反应,生成相应的醇和盐。
乙酸乙酯皂化反应速率常数的测定是研究皂化反应动力学的关键实验之一。
本实验旨在通过测定乙酸乙酯与氢氧化钠溶液反应的速率常数,探究该反应的动力学特性。
实验方法:1. 实验器材准备:取得所需的实验器材,包括烧杯、移液管、试管、滴管等。
2. 实验液体制备:准备一定浓度的氢氧化钠溶液,并称取适量的乙酸乙酯。
3. 实验操作:将一定量的氢氧化钠溶液倒入烧杯中,加热至适宜的温度。
然后,将乙酸乙酯滴入溶液中,同时记录下滴加的时间。
在滴加过程中,用试管定期取出少量反应液,加入酚酞指示剂,观察颜色变化。
4. 数据记录:根据实验操作过程中的数据记录,计算出不同时间点下的反应物浓度。
实验结果:根据实验数据,我们得到了乙酸乙酯与氢氧化钠溶液反应的速率常数。
通过绘制反应物浓度与时间的关系曲线,我们可以观察到反应速率的变化趋势。
在实验过程中,我们还注意到了反应温度对反应速率的影响,并进行了相应的分析。
讨论与分析:根据实验结果,我们可以得出以下结论:1. 反应速率随时间的增加而逐渐减小,呈现出指数衰减的趋势。
这符合化学反应动力学中的经典理论,即反应速率与反应物浓度的指数关系。
2. 反应温度对反应速率有显著影响。
在实验过程中,我们可以观察到在较高温度下,反应速率更快,反应物浓度下降更迅速。
这是因为高温加快了反应物分子的碰撞频率和能量,从而促进了反应的进行。
3. 乙酸乙酯皂化反应的速率常数可以通过实验数据计算得出,并且可以用于描述该反应的动力学特性。
通过测定不同条件下的速率常数,我们可以进一步研究该反应的影响因素。
结论:通过本实验,我们成功测定了乙酸乙酯皂化反应的速率常数,并观察到了反应速率与时间、温度的关系。
这一实验为进一步研究皂化反应的动力学特性提供了基础数据。
同时,我们也意识到实验中可能存在的误差和改进的空间,例如实验条件的控制和数据处理的精确性等。
乙酸乙酯皂化反应速率常数的测定实验结果
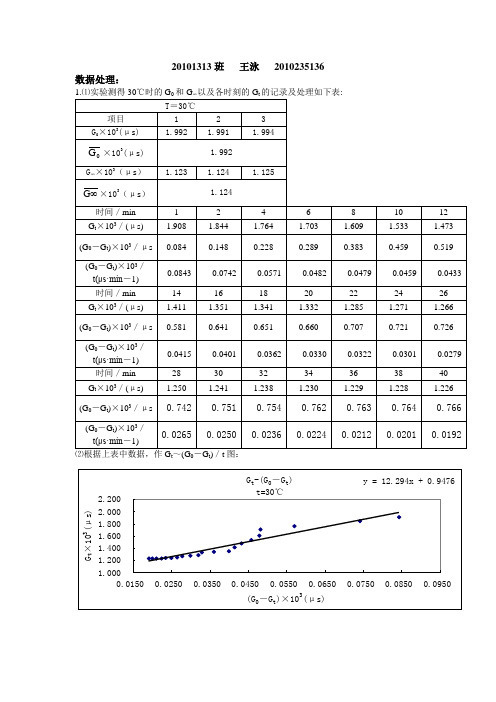
20101313班王泳2010235136 数据处理:∞⑵根据上表中数据,作G t~(G0-G t)/t图:⑶T =30℃时,从图中可以看出直线的斜率为12.294,即:294.1201.0110=⨯=k kc ,得 K 30℃=8.134L ·mol -1·min -1=0.136L ·mol -1·s -1。
∞t 0t⑶ T =35℃时,从图中可以看出直线的斜率为9.146,即:146.901.0110=⨯=k kc ,得:K 35℃=10.934L ·mol -1·min -1=0.182L ·mol -1·s -1。
3. 由文献值K 20℃=7.23×10-2L ·mol -1·s -1,K 30℃=0.135 L ·mol -1·s -1,E a =46.1KJ /mol ,得:K 35℃=0.182 L ·mol -1·s -1。
所以,T =30℃时,K 值的相对误差为:%741.0%100135.0135.0136.0=⨯-T =35℃时,K 值的相对误差为:%000.0%100182.0182.0182.0=⨯-4.由上两图可得: t =30℃时,∞G =0.9476×103μst =35℃时,∞G =1.328×103μs与实验测得∞G 相比较:t =30℃时,0.9476×103μs -1.124×103μs =-0.176×103μs t =35℃时,1.328×103μs -1.228×103μs =0.100×103μs 5. T =30℃时,min 294.12102/1==kc t T =35℃时,min 146.9102/1==kc t 6. 计算反应活化能:由)11(303.2lgT T R E k k a '-='得TT T RT K K E a -''∙'=303.2lg, 所以15.30315.30815.30815.303314.8303.2136.0182.0lg-⨯⨯⨯⨯=a E J ·mol -1=45.26KJ ·mol -1由文献值E a =46.1KJ ·mol -1得,相对误差为%82.1%1001.461.4626.45=⨯-7.实验结果讨论:由上述实验结果可以看出,与文献值存在误差较小,实验测得G ∞与做图结果存在较大的误差影响实验测量结果可能由以下因素造成的:①.读数上所造成的误差;②.作图时所产生的误差;③.电导仪在测量水的电导值时发生不正常现象。
乙酸乙酯皂化反应速率常数测定

乙酸乙酯皂化反应速率系数测定姓名:张腾 学号:2012011864 班级:化21同组人姓名:田雨禾实验日期:2014年10月23日 提交报告日期:2014年10月30日指导教师: 麻英1 引言1.1 实验目的(1)学习测定化学反应动力学参数的一种物理化学分析方法——电导法。
(2)了解二级反应的特点,学习反应动力学参数的求解方法,加深理解反应动力学特征。
(3)进一步认识电导测定的应用,熟练掌握电导率仪的使用方法。
1.2 实验原理反应速率与反应物浓度的二次方成正比的反应为二级反应,其速率方程式可以表示为22dc-=k c dt(1) 将(1)积分可得动力学方程:0ct 22c 0dc-=k dt c ⎰⎰ (2)2011-=k t c c (3) 式中: 为反应物的初始浓度;c 为t 时刻反应物的浓度; 为二级反应的反应速率常数。
将1/c 对t 作图应得到一条直线,直线的斜率即为 。
对于大多数反应,反应速率与温度的关系可以用阿累经验方程式来表示:aE ln k=lnA-RT(4) 式中: 乌斯活化能或反应活化能;A 指前因子;k 为速率常数。
实验中若测得两个不同温度下的速率常数,就很容易得到21T a 21T 12k E T -T ln=k RT T ⎛⎫ ⎪⎝⎭(5) 由(5)就可以求出活化能 。
乙酸乙酯皂化反应是一个典型的二级反应,325325CH COOC H +NaOH CH COONa+C H OH →t=0时, 0c 0c 0 0 t=t 时, 0c -x 0c -x x x t=∞时, 0 0 0x c → 0x c →设在时间t 内生成物的浓度为x ,则反应的动力学方程为220dx=k (c -x)dt (6) 2001xk =t c (c -x)(7)本实验使用电导法测量皂化反应进程中电导率随时间的变化。
设κ 、κ 和κ∞分别代表时间为0、t 和∞(反应完毕)时溶液的电导率,则在稀溶液中有:010=A c κ20=A c κ∞t 102=A (c -x)+A x κ式中A 1和A 2是与温度、溶剂和电解质的性质有关的比例常数,由上面的三式可得0t0-x=-c -κκκκ∞ (8) 将(8)式代入(7)式得:0t20t -1k =t c -κκκκ∞(9)整理上式得到t 20t 0=-k c (-)t+κκκκ∞ (10)以κ 对 κ κ∞ 作图可得一直线,直线的斜率为 ,由此可以得到反应速率系数 。
乙酸乙酯皂化反应速率常数的测定实验报告

乙酸乙酯皂化反应速率常数的测定实验报告OH -电导率大,CH 3COO -电导率小。
因此,在反应进行过程中,电导率大的OH -逐渐为电导率小的CH 3COO -所取代,溶液电导率有显著降低。
对稀溶液而言,强电解质的电导率L 与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。
如果乙酸乙酯皂化在稀溶液下反应就存在如下关系式:a A L 10= (4)a A L 2=∞ (5) xA x a A L t 21)(+-=(6)A 1,A 2是与温度、电解质性质,溶剂等因素有关的比例常数,0L ,∞L 分别为反应开始和终了时溶液的总电导率。
t L 为时间t 时溶液的总电导率。
由(4),(5),(6)三式可得:a LL L L x t·00⎪⎪⎭⎫ ⎝⎛--=∞ 代入(2)式得:⎪⎪⎭⎫⎝⎛--=∞L L L L a t K t t0·1(7)重新排列即得:∞+-=L tL L k a L tt 0·1三、实验仪器及试剂DDS-11A 型数字电导率仪1台(附铂黑电极1支),恒温槽1台,秒表1只,电导池3支,移液管3支;0.0200mol /L 乙酸乙酯(新配的),O.0200mol /L 氢氧化钠(新配的)四、简述实验步骤和条件:1、调节恒温槽为所测温度25℃。
2、0L 的测量:分别取10mL 蒸馏水和10mL0.0200mol/L 的NaOH 溶液,加到洁净、干燥的叉形管电导池中充分混合均匀,置于恒温槽中恒温15min 。
用DDS-11A 型数字电导率仪测定上述已恒温的NaOH 溶液的电导率即为0L 。
3、t L 的测量:在另一支叉形电导池直支管中加10mL 0.0200mol/L CH 3COOC 2H 5,侧支管中加入10mL 0.0200 mol/L NaOH ,并把洗净的电导电极插入直支管中。
在恒温情况下,混合两溶液,同时开启停表,记录反应时间(注意停表一经打开切勿按停,直至全部实验结束),并在恒温槽中将叉形电导池中溶液混合均匀。
乙酸乙酯皂化反应速率常数的测定数据处理

乙酸乙酯皂化反应速率常数的测定数据处理乙酸乙酯是一种广泛应用于化学工业中的有机化合物,其皂化反应速率常数的测定是一项重要的实验。
本文将介绍乙酸乙酯皂化反应速率常数的测定方法以及数据处理过程。
我们需要了解皂化反应的概念。
皂化反应是指碱与酯反应生成相应的盐和醇,其中碱起催化作用。
在本实验中,我们使用氢氧化钠作为碱催化剂,乙酸乙酯则为酯。
测定乙酸乙酯皂化反应速率常数的方法是,将一定量的氢氧化钠溶液和乙酸乙酯混合,然后在一定时间内测定生成的乙醇的量。
根据反应物的化学计量关系,可以计算出反应物的物质摩尔比例,从而得到反应速率常数。
在实验中,我们需要使用一些实验室常用的实验仪器,如天平、移液管、比色皿等。
同时,需要准备好一定浓度的氢氧化钠溶液、乙酸乙酯等实验试剂。
实验步骤如下:1. 将一定量的氢氧化钠溶液和乙酸乙酯混合,加入比色皿中。
2. 在一定时间内测定生成的乙醇的量,可以通过比色法、滴定法等方法进行测定。
3. 根据反应物的化学计量关系,计算出反应物的物质摩尔比例,从而得到反应速率常数。
数据处理过程如下:1. 计算出反应物的物质摩尔比例。
2. 根据反应速率常数的定义,计算出反应速率常数。
3. 统计测定结果并求出平均值,计算出标准偏差和相对误差。
4. 利用统计学原理,计算出反应速率常数的置信区间和置信度。
在数据处理过程中,需要注意一些细节问题。
例如,要确保实验中使用的试剂纯度高,实验操作要精确、规范,数据处理要仔细、准确。
总的来说,测定乙酸乙酯皂化反应速率常数是一项重要的实验,可以帮助我们更好地理解化学反应的机理和规律。
通过实验和数据处理,我们可以得到准确可靠的结果,为化学工业的应用提供了理论基础和技术支持。
乙酸乙酯皂化反应速率常数的测定的实验报告

乙酸乙酯皂化反应速率常数的测定的实验报告一、实验目的1.了解二级反应的特点,学会用图解计算法求取二级反应的速率常数;2.用电导法测定乙酸乙酯皂化反应速率常数,了解反应活化能的测法。
二、实验原理CH3COOC2H5+Na++OH-®CH3COO-+Na++C2H5OH为了方便起见,在设计实验时将反应物CH3COOC2H5和NaOH采用相同的浓度c作为起始浓度。
当反应时间为t时,反应所生成的CH3COO-和C2H5OH的浓度为x,那么CH3COOC2H5和NaOH的浓度则为(c-x)。
CH3COOC2H5+NaOH ®CH3COONa+C2H5OHt=0c c0 0t=tc-x c-x xxt®∞®0®0®c®c二级反应的速率方程可表示为:dx/dt=k(c-x)(c-x)积分得:kt=x/c(c-x)t=t时,x=b(G0-Gt)t=∞时,c=b(G0-G∞)则kt=b(G0-Gt)/cb[(G0-G∞)-(G0-Gt)]=(G0-Gt)/c(G0-G∞)或ckt=(G0-Gt)/(G0-G∞)以(G0-Gt)/(G0-G∞)对t作图应得一直线,由斜率即可求出反应速率常数k 值,k的单位是min-1·mol-1·L三、实验仪器及药品四、实验步骤1.G0和G∞的测定将电导池洗净洪干,加入0.0100mol·l-1的NaOH溶液,液面约浸没铂黑电极1cm。
再将铂黑电极从电导水电取出,用相同浓度的NaOH溶液淋洗电极,(注意:不要碰电极上的铂黑)。
然后将电导池置于25℃恒温水浴中,恒温10min,并接上电导率仪,测其电导率值,更换溶液重复测量,取其平均值即为G0。
实验测定中,不可能等到t→∞,故通常以0.0100mol·l-1CH3COONa溶液的电导值作为G∞,G∞的测量方法与G0相同。
必须注意,每次更换电导池中的溶液时,都要先用电导水淋洗电极和电导池,然后再用被测溶液淋洗2至3次。
乙酸乙酯皂化反应速率常数的测定实验报告

学号:201114120222基础物理化学实验报告实验名称:乙酸乙酯皂化反应速率常数的测定应用化学二班班级 03 组号实验人姓名: xx同组人姓名:xxxx指导老师:李旭老师实验日期: 2013-10-29湘南学院化学与生命科学系一、实验目的:1、了解测定化学反应速率常数的一种物理方法——电导法。
2、了解二级反应的特点,学会用图解法求二级反应的速率常数。
3、掌握DDS-11A 型数字电导率仪和控温仪使用方法。
二、实验原理:1、对于二级反应:A+B →产物,如果A ,B 两物质起始浓度相同,均为a ,则反应速率的表示式为2)(x a K dtdx-= (1) 式中x 为时间t 反应物消耗掉的摩尔数,上式定积分得:xa x ta K -=·1 (2) 以t xa x~-作图若所得为直线,证明是二级反应。
并可以从直线的斜率求出k 。
所以在反应进行过程中,只要能够测出反应物或产物的浓度,即可求得该反应的速率常数。
如果知道不同温度下的速率常数k (T 1)和k (T 2),按Arrhenius 公式计算出该反应的活化能E⎪⎪⎭⎫ ⎝⎛-⨯=122112)()(lnT T T T R T K T K E a (3) 2、乙酸乙酯皂化反应是二级反应,其反应式为:OH -电导率大,CH 3COO -电导率小。
因此,在反应进行过程中,电导率大的OH -逐渐为电导率小的CH 3COO -所取代,溶液电导率有显著降低。
对稀溶液而言,强电解质的电导率L 与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。
如果乙酸乙酯皂化在稀溶液下反应就存在如下关系式:a A L 10= (4)a A L 2=∞ (5) x A x a A L t 21)(+-= (6)A 1,A 2是与温度、电解质性质,溶剂等因素有关的比例常数,0L ,∞L 分别为反应开始和终了时溶液的总电导率。
t L 为时间t 时溶液的总电导率。
乙酸乙酯皂化反应速率常数及活化能的测定

乙酸乙酯皂化反应速率常数及活化能的测定各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢篇一:电导法测定乙酸乙酯皂化反应的速率常数数据处理数据处理①25℃的反应速率常数kT1,将实验数据及计算结果填入下表:-1恒温温度=℃?0=·cmVV乙酸乙酯NaOH=[乙酸乙酯]=/L=[NaOH]=/L c0=×=/L图1:25℃?t-?0??tt由于第一个数据偏离其它数据太多,有明显的误差,所以舍去。
数据处理:?t对?0??tt作图,求出斜率m,并由m?1kc0求出速率常数.直线公式:y= + =m=,kT1=1/(mc0)=1/(*)mol·L-1·min=/(mol·mi n) 文献参考值:k()=(6±1)L/(mol·min)②用同样的方法求37℃的反应速率常数kT2,计算反应的表观活化能Ea:恒温温度=℃?0=·cm-1V乙酸乙酯=[乙酸乙酯]=/L VNaOH=[NaOH]=/L c0=×=/L 实验数据记录及处理表2:图1:25℃?t-?0??tt直线公式:y= + =m=,kT2=1/(mc0)=1/(*)mol·L-1·min=/(mol·mi n) 文献参考值:k()=(10±2)L/(mol·min) b.计算反应的表观活化能:文献值:Ea=/mol ln(kT2/kT1)=Ea/R·(1/T1-1/T2) ∴Ea=Rln(kT2/kT1)/[T1T2/(T2-T1)]=×ln(/)/[298×308÷(308-298)]J/mol =/mol分析:℃时速率常数符合文献参考值,说明乙酸乙酯混合比较充分,电导率能较好地反应其反应速率,℃时,实验过程中加入乙酸乙酯后混合得并不充分就开始测定,且有部分溶液露在恒温水面之上,温度并没有℃。
