第11章-元素周期表PPT课件
合集下载
化学必修元素周期表ppt课件

ppt课件.
41
总结:
碱金属的原子结构
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子
化学性质相似
1) 都易失电子表现强还 原性
2) 化合物中均为+1价
核电荷数
2.递变性: 电子层数
原子半径
核对最 外层电 子的引 力
失电 子能 力
还原 性
金 属 性
(电子层数的影响大于核电荷数的影响)
很好 逐渐增大(K特殊) 单质的熔沸点逐渐降低
ppt课件.
40
通过比较碱金属单质与氧气、水的反应, 我们可以看出,元素性质与原子结构有密 切关系,主要与原子核外电子的排布,特 别是 最外层电子数 有关。原子结构相 似的一族元素,它们在化学性质上表现出
相似性 和递变性 。
在元素周期表中,同主族元素从上到下原 子核外电子层数依次 增多 ,原子半径逐 渐 增大 ,失电子能力逐渐 增强 ,金 属性逐渐 增强 。
通过大量实验和研究,人们得出了如下结论:
碱金属元素原子的最外层都有1个电子,它们的化学性
质彼此相似 ,它们都能与 水 等非金属单质以及氧气 反应,表现出金属性(还原性).
4Li+O2=2Li2O
2Na+O2=Na2O2 2Na+2H2O=2NaOH +H2↑
2K+2H2O=2KOH +H2↑
上述反应的产物中,碱金属元素的化合价都是 +1 。
49
卤族元素: 氟(F)
F +9 2 7
氯(Cl)
Cl + 1 7 2 8 7
溴(Br)
Br +35 2 8 18 7
碘(I)
I +53 2 8 1818 7
高三化学总复习之 元素周期律PPT课件
5
6
7
8
9
1 0
L K
8 2
3
11
1 2
III
B
IV B
VB
VI B
VII B
VIII
IB
II 1 B3
1 4
1 5
1 6
1 7
1 8
M L k
18 8 2
最4 外
1 9
2 0
2 1
2 2
2 3
24
25
26
2 7
2 8
2 9
3 0
3 1
3 2
3 3
3 4
3 5
3 6
层5 电
3
71
3
82
3 9
4 0
4 1
增 强
Rb Sr In Sn Sb Te I
酸 性 逐 渐 增 强
Cs Ba Tl Pb Bi Po At
碱性逐渐增强
第20页/共31页
3.气态氢化物的热稳定性
热稳定性增强
热 稳 定 性 减 弱
B CNO F
热
Si P S Cl
稳
定
As Se Br
性
Te I
增 强
At
热稳定性减弱
第21页/共31页
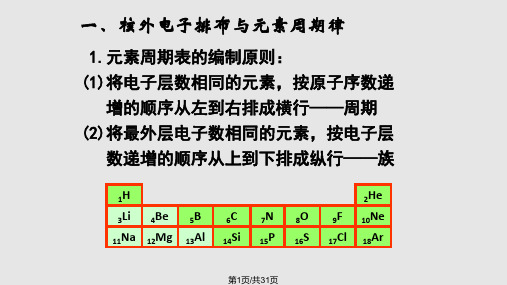
一、核外电子排布与元素周期律
1.元素周期表的编制原则: (1)将电子层数相同的元素,按原子序数递
增的顺序从左到右排成横行——周期 (2)将最外层电子数相同的元素,按电子层
数递增的顺序从上到下排成纵行——族
1H
2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
优秀课件——元素周期律(共45张PPT)

化学反应中不稳定结构总是通过各种方式(得失电子、
共用电子对)趋向达到稳定结构
(2)核外电子排布与元素性质的关系
质子数、电子层数 决定 元素的原子半径由________________
最外层电子数 决定 元素的化学性质主要由________________
最外层电子数 决定 元素的化合价主要由_________________ 金属元素的原子最外层电子数一般少于4,易失电子
N +5
-3
O
F
Ne 0
最低价
元素符号 最高价 Na +1 Mg +2 Al +3
-2
-1
Si +4
-4
P +5
-3
S +6
-2
Cl +7
-1
Ar 0
最低价
最高正价= 最外层电子数(F、O除外) 负价 = 最外层电子数-8
随着原子序数的递增
引起了
课堂总结
核外电子排布呈周期性变化 最外层电子数 1→8
• 【回顾】
• 1、碱金属元素的性质递变,其本质原因? • 2、卤素性质递变,其本质原因?
•【思考与交流】 元素的性质随着原子序数的递增而呈怎 样变化呢?
从今天开始,我们就通过来学习认清这些问题
一. 原子核外电子的排布
1. 电子层-表示运动着的电子离核远近及能量高低
含多个电子的原子中, 电子是分层排布的。能量较 低的电子运动在离核较近的 区域,能量较高的电子运动 在离核较远的区域。
深入探讨
原子半径受哪些因素制约?为什么随原子序数 的递增,原子半径出现从大到小的周期性变化?
①电子层数:电子层数越多,原子半径越大 最主要因素 影响原 子半径 大小的 因素 ②核电荷数: 核电荷数增多,使原子半径有减小的趋向
共用电子对)趋向达到稳定结构
(2)核外电子排布与元素性质的关系
质子数、电子层数 决定 元素的原子半径由________________
最外层电子数 决定 元素的化学性质主要由________________
最外层电子数 决定 元素的化合价主要由_________________ 金属元素的原子最外层电子数一般少于4,易失电子
N +5
-3
O
F
Ne 0
最低价
元素符号 最高价 Na +1 Mg +2 Al +3
-2
-1
Si +4
-4
P +5
-3
S +6
-2
Cl +7
-1
Ar 0
最低价
最高正价= 最外层电子数(F、O除外) 负价 = 最外层电子数-8
随着原子序数的递增
引起了
课堂总结
核外电子排布呈周期性变化 最外层电子数 1→8
• 【回顾】
• 1、碱金属元素的性质递变,其本质原因? • 2、卤素性质递变,其本质原因?
•【思考与交流】 元素的性质随着原子序数的递增而呈怎 样变化呢?
从今天开始,我们就通过来学习认清这些问题
一. 原子核外电子的排布
1. 电子层-表示运动着的电子离核远近及能量高低
含多个电子的原子中, 电子是分层排布的。能量较 低的电子运动在离核较近的 区域,能量较高的电子运动 在离核较远的区域。
深入探讨
原子半径受哪些因素制约?为什么随原子序数 的递增,原子半径出现从大到小的周期性变化?
①电子层数:电子层数越多,原子半径越大 最主要因素 影响原 子半径 大小的 因素 ②核电荷数: 核电荷数增多,使原子半径有减小的趋向
各种形式的元素周期表PPT课件

各种形式的元素周期表
化学元素周期表的简介
▪ 化学元素周期表是1869年俄国科学家门捷列夫(Dmitri
Mendeleev)首创的,他将当时已知的63种元素依原子量 大小并以表的形式排列,把有相似化学性质的元素放在同 一行,就是元素周期表的雏形。在周期表中,元素是以元 素的原子序排列,最小的排行最先。表中一横行称为一个 周期,一列称为一个族。
过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。刚嫁入门的那天,就被小姑
子号称“铁姑”狠狠地捏了一把,新娘一生气,当时就休克了。
▪
这下不得了,娘家要上告了。铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人
住的地方。
▪
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅 ,因为它们不喜欢冬天,所以要去
美,小心累着)
▪
硼铝镓铟铊 碰女嫁音他 (看来新郎新娘都
▪
氮磷砷锑铋 蛋临身体闭
▪
氧硫硒碲钋 养牛西蹄扑
▪
氟氯溴碘砹 父女绣点爱 (父女情深啊)
▪
氦氖氩氪氙氡 害耐亚克先动
▪
钽 钨 铼 锇 ---- 但(见)乌(鸦)(引)来鹅
▪
铱 铂 金 汞 铊 铅 ---- 一白巾 供它牵
▪
铋 钋 砹 氡 ---- 必不爱冬(天)
▪
第七周期:钫 镭 锕 ---- 防雷啊!
口诀背诵
▪ 纵列
▪
氢锂钠钾铷铯钫 请李娜加入私访 (李娜什么时候当
皇上啦)
▪
铍镁钙锶钡镭 媲美盖茨被累(呵!想和比尔.盖茨媲
箭环 头形 连, 接有 着点 各像 族四
驱 车 的 跑 道 ,
很有创意的元素周期表2
化学元素周期表的简介
▪ 化学元素周期表是1869年俄国科学家门捷列夫(Dmitri
Mendeleev)首创的,他将当时已知的63种元素依原子量 大小并以表的形式排列,把有相似化学性质的元素放在同 一行,就是元素周期表的雏形。在周期表中,元素是以元 素的原子序排列,最小的排行最先。表中一横行称为一个 周期,一列称为一个族。
过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。刚嫁入门的那天,就被小姑
子号称“铁姑”狠狠地捏了一把,新娘一生气,当时就休克了。
▪
这下不得了,娘家要上告了。铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人
住的地方。
▪
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅 ,因为它们不喜欢冬天,所以要去
美,小心累着)
▪
硼铝镓铟铊 碰女嫁音他 (看来新郎新娘都
▪
氮磷砷锑铋 蛋临身体闭
▪
氧硫硒碲钋 养牛西蹄扑
▪
氟氯溴碘砹 父女绣点爱 (父女情深啊)
▪
氦氖氩氪氙氡 害耐亚克先动
▪
钽 钨 铼 锇 ---- 但(见)乌(鸦)(引)来鹅
▪
铱 铂 金 汞 铊 铅 ---- 一白巾 供它牵
▪
铋 钋 砹 氡 ---- 必不爱冬(天)
▪
第七周期:钫 镭 锕 ---- 防雷啊!
口诀背诵
▪ 纵列
▪
氢锂钠钾铷铯钫 请李娜加入私访 (李娜什么时候当
皇上啦)
▪
铍镁钙锶钡镭 媲美盖茨被累(呵!想和比尔.盖茨媲
箭环 头形 连, 接有 着点 各像 族四
驱 车 的 跑 道 ,
很有创意的元素周期表2
初中化学元素周期表 PPT课件 图文

返回
锂
元素名称锂 元素符号Li 原子序数3 相对原子质量(12C = 12.0000)6.941 英文名称Lithium 物理性质:状态:软的银白色金属,是最轻的金属。
返回
铍
元素名称铍
返回
元素符号Be
原子序数4
相对原子质量(12C = 12.0000)9.012182
返回
氯
元素名称氯 元素符号Cl 原子序数17 相对原子质量(12C = 12.0000) 35.4527 英文名称Chlorine 物理性质:状态:黄绿色卤气。
返回
氩
元素名称氩 元素符号Ar 原子序数18 相对原子质量(12C = 12.0000)39.948 英文名称Argon 物理性质:状态:无色、无臭、无味的惰性气体。
返回
铝
元素名称铝 元素符号Al 原子序数13 相对原子质量(12C = 12.0000)26.981539 英文名称Aluminum 物理性质:状态:银色,轻质,非磁性的可锻金属。
返回
硅
元素名称硅 元素符号Si 原子序数14 相对原子质量(12C = 12.0000)28.0855 英文名称Silicon 物理性质:状态:硬的深灰色非金属。
返回
氮
元素名称氮 元素符号N 原子序数7 相对原子质量(12C =12.0000) 14.00674 英文名称Nitrogen 物理性质:状态:无色、无味、无臭的气体。
返回
氧
元素名称氧 元素符号O 原子序数8 相对原子质量(12C = 12.0000)15.9994 英文名称Oxygen 物理性质:状态:无色、无臭、无味的气体。
人教部编版九年级上:元素周期表课件 (共37张PPT)

周
5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
期
6 55 56 镧 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 Cs Ba 系 Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
镧 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 系 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
锕 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 系 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
B.电子数
C.中子数
D.最外层电子数
8
9
10
11
12
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
共有18纵行,分为16个族。第8、9、10纵行合为一个族,其余 镧 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 系 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
元素周期表_课件PPT

人类在长期的生产活动和科学实践中,逐步认识了元 素间的内在联系和元素性质变化的规律性。那么同族元素 间有哪些规律存在呢?让我们一起走进丰富多彩的物质世 界,共同探讨元素的性质与原子结构的关系。
●梳理导引 1.碱金属元素原子的最外层都有______________个 电子,都是活泼的金属;且随核电荷数增加,电子层数逐 渐______________,原子半径逐渐______________,金属 性逐渐____________。 2.碱金属单质的物理性质:都有______________的 金属光泽,质______________,密度______________,熔 点____________,导电性和导热性都____________;随着 核电荷数增加,碱金属单质的熔、沸点逐渐____________, 密度逐渐____________[特殊的ρ(K)<ρ(Na)]。
4.比较元素金属性强弱的方法 (1)根据金属活动性顺序表判断。自左至右金属性减弱, 即失电子能力减弱,如:Zn>Cu。 (2)根据元素周期表判断。同周期,从左至右金属性减 弱 。 同 主 族 , 自 上 而 下 金 属 性 增 强 。 如 : Na>Mg>Al , Na<K。 (3)根据元素的单质与水(或酸)反应置换出氢的难易程 度判断。置换反应越易发生的元素金属性越强。如钾与水 比钠与水反应剧烈,则K>Na(金属性)。
溶液分上 下两层,下层呈 红棕色
Cl2+ 2NaBr===2NaCl+Br2
b.将少量新制的饱 和氯水加入盛有KI溶液 的试管,振荡后加CCl4, 振荡,静置
溶液分上 下两层,下层呈 紫红色
+I2
Cl2+2KI===2KCl
实验
c.将少量溴水加 入盛有KI溶液的试管, 振荡后加CCl4,振荡,
元素周期表ppt课件

元素周期表揭示了元素在生物地球化学循环中的作用,有助于理解 生态系统的物质循环和能量流动。
05
元素周期表的未来发展
新的元素发现与合成
合成新元素
随着科学技术的不断进步,科学家们 可能会合成更多超重元素,进一步丰 富元素周期表。
探索新元素特性
新元素的发现将有助于深入了解元素 的性质和行为,为科学研究和技术创 新提供更多可能性。
元素周期表的完善与修正
修正元素性质
随着新元素的合成和性质研究,元素周期表中的元素性质可能会得到修正和完 善。
调整周期表结构
根据新发现和研究成果,元素周期表的排列和分类可能会进行相应的调整和优 化。
元素周期表在未来的应用前景
科学研究
元素周期表在化学、物理、材料科学等领域的研究中发挥着重要作用,未来仍将 是科学家们的重要工具。
技术创新
元素周期表中的元素是许多技术和产品的关键组成部分,随着新元素的发现和应 用,将有助于推动技术创新和产业发展。
THANKS
感谢观看
材料分类与鉴别
元素周期表为材料分类和鉴别提 供了依据,有助于对不同材料进
行科学分类和鉴别。
在生命科学领域的应用
生物分子结构研究
元素周期表在解析生物分子结构中发挥了重要作用,例如蛋白质 和核酸的结构研究。
药物设计与研发
通过元素周期表,可以预测药物分子的性质和行为,有助于新药的 研发和优化。
生物地球化学循环
通过元素周期表,科学家可以了解材料的物理和 化学性质,从而在材料科学和工程领域进行有效 的应用。
促进化学和其他学科的发展
元素周期表为化学学科提供了基础框架,同时也 为其他学科提供了重要的参考和借鉴。
02
元素周期表中的元素
05
元素周期表的未来发展
新的元素发现与合成
合成新元素
随着科学技术的不断进步,科学家们 可能会合成更多超重元素,进一步丰 富元素周期表。
探索新元素特性
新元素的发现将有助于深入了解元素 的性质和行为,为科学研究和技术创 新提供更多可能性。
元素周期表的完善与修正
修正元素性质
随着新元素的合成和性质研究,元素周期表中的元素性质可能会得到修正和完 善。
调整周期表结构
根据新发现和研究成果,元素周期表的排列和分类可能会进行相应的调整和优 化。
元素周期表在未来的应用前景
科学研究
元素周期表在化学、物理、材料科学等领域的研究中发挥着重要作用,未来仍将 是科学家们的重要工具。
技术创新
元素周期表中的元素是许多技术和产品的关键组成部分,随着新元素的发现和应 用,将有助于推动技术创新和产业发展。
THANKS
感谢观看
材料分类与鉴别
元素周期表为材料分类和鉴别提 供了依据,有助于对不同材料进
行科学分类和鉴别。
在生命科学领域的应用
生物分子结构研究
元素周期表在解析生物分子结构中发挥了重要作用,例如蛋白质 和核酸的结构研究。
药物设计与研发
通过元素周期表,可以预测药物分子的性质和行为,有助于新药的 研发和优化。
生物地球化学循环
通过元素周期表,科学家可以了解材料的物理和 化学性质,从而在材料科学和工程领域进行有效 的应用。
促进化学和其他学科的发展
元素周期表为化学学科提供了基础框架,同时也 为其他学科提供了重要的参考和借鉴。
02
元素周期表中的元素
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.
7
11.1 单质
• 卤素与水的作用 F2、Cl2、Br2与水的作用 2X2+2H2O=4HX+O2↑ (氧化水的作用) Cl2、Br2、I2在水中的歧化反应 X2+H2O =H++X-+HXO (可逆反应,碱性严重)
注:除卤素外大部分非金属元素不与水反应
.
8
11.1 单质
3. 与酸的反应性
• 大部分金属元素可以与酸反应,置换出氢气 如:2Al+6HCl=2AlCl3+3H2↑
.
9
11.1 单质
4. 与碱的反应性 • Be、Al、Ge、Sn等两性金属与碱的反应
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ Sn+2NaOH+4H2O=Na2[Sn(OH)6]+2H2↑ Be+NaOH+2H2O=Na[Be(OH)3]+H2↑ Ge+2NaOH+4H2O=Na2[Ge(OH)6]+2H2↑ • B、Si等与碱的反应 Si+2NaOH+H2O=Na2SiO3+2H2↑ 2B+2NaOH(热浓)+2H2O=2NaBO2+3H2↑
第11章 主族元素(6h)
11.1 单质 11.2 氢化物 11.3 卤化物 11.4 含氧酸的种类及性质 11.5 简单含氧酸的结构 11.6 含氧酸酸性强弱 11.7 非金属含氧酸及其盐的性质 本章作业
.
1
.
2
11.1 单质
11.1.1 单质概述 11.1.2 单质的化学性质 11.1.3 氟、氯、溴、碘单质的制备
(偏硼酸钠)
.
置换反应
10
11.1 单质
• Cl2、Br2、I2、S、P与碱的反应
常温下 Cl2+2OH-=Cl-+ClO-+H2O 3Br2+6OH-=3Br-+BrO3-+3H2O 3I2+6OH-=3I-+IO3-+3H2O
加热条件下 Cl2+6OH-=Cl-+ClO3-+3H2O 3S+6OH-=2S2-+SO32-+3H2O 4P+3OH-+3H2O=3H2PO2-+PH3
.
3
11.1 单质
11.1.1 单质概述
金属单质:原子间以金属键结合 非金属单质:原子间以共价键结合,非金属除H之外都在p区。
n族非金属的每个原子可以提供8-n个价电子,可以与相邻的 8-n个原子形成8-n个共价单键, 称为8-n规则 (氢元素2-n个)。
稀有气体:8-n=0,单原子分子,范氏力形成分子晶体
2LiH TiO2 Ti 2LiOH 4NaH TiCl4 Ti 4NaCl 2H2
MHn nH2O M(OH)n nH2 (g) NaH H2O NaOH H2 (g) CaH2 2H 2O Ca(OH)2 2H 2 (g)
3) 形成配位氢化物
4LiH AlCl3 (无水)乙醚 Li[AlH4 ] 3LiCl
. 铝氢化锂
14
11.2 氢化物
11.2.2 共价型氢化物 非金属元素或少数金属元素与氢的化合物
CH4
NH3
ቤተ መጻሕፍቲ ባይዱ
H2O
HF
SiH4
PH3
H2S
HCl
GeH4 AsH3 H2Se HBr
SnH4 SbH3
H2Te HI
.
15
11.2 氢化物
1. 共价型氢化物的还原性及HX的制备
• 还原性
共价型氢化物HnA中氢的氧化值为+1,所以其还原性来自An-。 An-失去电子的能力与元素A的电负性及离子半径有关:
工制业少上量HH2C流l:在CNla2中Cl+燃H烧2S:O4(浓C). =lH2+CHl2+=N2aHHCSlO4
ⅦA族元素:8-7=1,形成双原子分子,范氏力成分子晶体
ⅥA族:8-6=2,形成多原子分子,如S8等
s
s s
s s
s s
s
ⅤA族:8-5=3等,形成多原子分子,如P4等 只有O2、N2不以单键键合,其它. 均符合8-n规则
P
P
P
P
4
11.1 单质
非金属单质
小分子物质:稀有气体、X2、H2、O2、N2等 多原子分子物质:S8、P4、As4等 巨型分子物质:金刚石、石墨、C60等
• 非金属一般不和稀酸反应,I2、S、P、C、B可与浓HNO3或热 的浓H2SO4反应,反应方程式如下:
S+2HNO3=H2SO4+2NO↑ 3P4+8H2O+20HNO3=12H3PO4+20NO↑ 3C+4HNO3=3CO2↑ +4NO↑ +2H2O
3I2+10HNO3=6HIO3+10NO↑+2H2O B+3HNO3=B(OH)3 +3NO2 ↑ 2B+3H2SO4(热浓)=2B(OH)3 +3SO2↑
同周期:从左至右半径减小,电负性增大,还原性减弱
同主族: 从上到下半径增大,电负性减小,还原性增强
如:PH3在空气中自燃,H2S是可燃气体; HCl不与O2作用,而:
4HBr+O2=2Br2+2H2O
4HI+O2=2I2+2H2O H2S和HI是重要的还原剂 • HX的制备:单质合成法、复分解法、卤化物的水解法
.
5
11.1 单质
11.1.2 单质的化学性质
1. 单质的氧化还原性
s区元素单质均为活泼金属,具有很强的还原性易形成阳离子 盐
p区绝大多数非金属元素即具有氧化性,又具有还原性:
与金属作用时表现出氧化性,形成负氧化值,如:氧化物 、硫化物、氮化物、碳化物、卤化物、硅化物、硼化物、含氧 酸盐(如:NaBiO3)等
.
歧化反应
11
11.2 氢化物 11.2.1 离子型氢化物及性质 11.2.2 共价型氢化物
.
12
11.2 氢化物
11.2.1 离子型氢化物及性质
1. 离子型氢化物的形成 除Be和Mg外,其它碱金属及碱土金属在高温下与氢直接化合,
生成离子型氢化物LiH、NaH、KH…. CaH2….. H2+2Na=2NaH H2+Ca=CaH2
2. 离子型氢化物的性质
1) 均为白色晶体, 热稳定性差
LiH NaH KH RbH CsH NaCl
Δ
r
H
θ f
/ kJ mol1
-90.4 -57.3
-57.7 -54.3
-411.3 -441
2)
还原性强
Eθ
性质及用途:H2
/H
2.23V
.
13
11.2 氢化物
(1) 钛的冶炼:
(2)剧烈水解: 如:
与活泼非金属反应时表现出还原性,形成正氧化值,如:氧 化物、卤化物、氢化物、含氧酸等
.
6
11.1 单质
2.与水的反应性 • 金属单质与水的作用:s区元素与水作用
2M + 2H2O → 2MOH + H2↑ (IA族元素) M + 2H2O → M(OH)2+ H2↑ (IIA族元素)
Li
Na
K
Ca
