第一节元素周期表第一课时 ppt课件
合集下载
人教版高中化学必修二第一章完整ppt课件

第一章 物质结构 元素周期律 第一节 元素周期表
ppt精选版
1
第1课时 元素周期表
ppt精选版
2
学习目标
1.简单了解元素周期表的发展历程。 2.了解元素周期表的编排规则及结构。 3.能描述元素在元素周期表中的位置。
ppt精选版
3
一、元素周期表的完善历程 1. 第一张元素周期表 (1)时间 1869 年,俄国化学家门__捷__列__夫__绘制出第一张元素周期 表,是化学发展史上的重要里程碑。 (2)编排原则 ①将元素按照_相__对__原__子__质__量_____由小到大依次排列。 ②将_化__学__性__质_相似的元素放在一个纵行。
答案:C
ppt精选版
28
解析:考查元素周期表的结构。对主族元素,其族序数 等于最外层电子数,但副族则不是;18 列构成 16 个族,其 中第Ⅷ族包含 3 列。
ppt精选版
29
3. 已知某离子的结构示意图为 的是( )
A. 该元素位于第二周期第ⅡA 族 B. 该元素位于第二周期第Ⅷ族 C. 该元素位于第三周期第ⅡA 族 D. 该元素位于第三周期 0 族
ppt精选版
18
4. 确定该元素在周期表中的位置,形式为“第几周期第 几族”,要注意分清主族、副族、0 族、第Ⅷ族
在应用上述方法推断元素的族序数时,要特别注意第 六、七周期第ⅢB 族的锕系和镧系元素,它们的每个空格都 有 15 种元素,其后的元素需再减去 14,然后定位。
ppt精选版
19
例 2 俄罗斯科学家用含 20 个质子的钙的一种原子轰击 含 95 个质子的镅原子,结果 4 次成功合成 4 个第 115 号元 素的原子。这 4 个原子生成数微秒后衰变成第 113 号元素。 下列有关叙述正确的是( )
ppt精选版
1
第1课时 元素周期表
ppt精选版
2
学习目标
1.简单了解元素周期表的发展历程。 2.了解元素周期表的编排规则及结构。 3.能描述元素在元素周期表中的位置。
ppt精选版
3
一、元素周期表的完善历程 1. 第一张元素周期表 (1)时间 1869 年,俄国化学家门__捷__列__夫__绘制出第一张元素周期 表,是化学发展史上的重要里程碑。 (2)编排原则 ①将元素按照_相__对__原__子__质__量_____由小到大依次排列。 ②将_化__学__性__质_相似的元素放在一个纵行。
答案:C
ppt精选版
28
解析:考查元素周期表的结构。对主族元素,其族序数 等于最外层电子数,但副族则不是;18 列构成 16 个族,其 中第Ⅷ族包含 3 列。
ppt精选版
29
3. 已知某离子的结构示意图为 的是( )
A. 该元素位于第二周期第ⅡA 族 B. 该元素位于第二周期第Ⅷ族 C. 该元素位于第三周期第ⅡA 族 D. 该元素位于第三周期 0 族
ppt精选版
18
4. 确定该元素在周期表中的位置,形式为“第几周期第 几族”,要注意分清主族、副族、0 族、第Ⅷ族
在应用上述方法推断元素的族序数时,要特别注意第 六、七周期第ⅢB 族的锕系和镧系元素,它们的每个空格都 有 15 种元素,其后的元素需再减去 14,然后定位。
ppt精选版
19
例 2 俄罗斯科学家用含 20 个质子的钙的一种原子轰击 含 95 个质子的镅原子,结果 4 次成功合成 4 个第 115 号元 素的原子。这 4 个原子生成数微秒后衰变成第 113 号元素。 下列有关叙述正确的是( )
第一节元素周期表(共40张PPT)
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
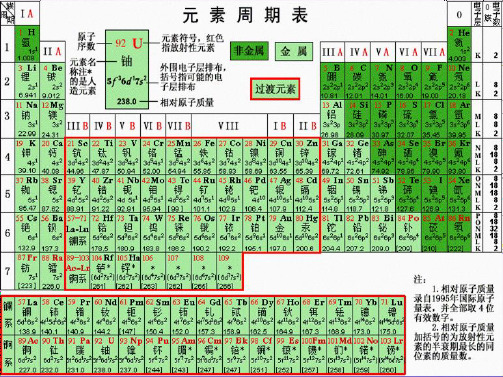
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
《元素周期表》(元素周期表的结构) ppt课件

30
ppt课件
5.甲、乙是周期表中同主族相邻元素,若甲的原子序数为
x,则乙的原子序数不可能是( B )
A.x+2
B.x+4
C.x+8
D.x+18
解析:同一主族相邻两元素的原子序数可以相差2(H和Li)、
8(如O和S)、18(如Cl和Br),但不能相差4。
31
ppt课件
6.我国的纳米技术研究能力已跻身于世界前列,曾制得一种氮
(1)表中所列元素,属于短周期元素的有_7_______种,属于主 族元素的有____6____种;g元素位于第____三____周期 _____0_________族。 (2)元素f是第_三_______周期第__Ⅵ__A____族元素。
ppt课件
ⅡA
2
8
8
ⅢB ⅣB ⅤB ⅥB ⅦB
18
18
32
0
ⅢA ⅣA ⅤA ⅥA ⅦA
Ⅷ ⅠB ⅡB
17
ppt课件
阅读教材第四、五页,思考并填空:
二、现行元素周期表
1.原子序数 (1)含义:按照元素在_元__素__周__期__表__中的顺序给元素的编号。
(2)原子序数与原子结构的关系 原子序数=_核__电__荷__数___=__质__子__数_____=__核__外__电__子__数______。
顺序由上而下排成纵行。
11
ppt课件
根据元素周期律,把已知的一百多种元
素中 电子层数目相同 的各种元素,按原 子序数递增的顺序从左到右排成 横行 ,
再把不同横行中最外电子层的电子数相同 的元素按电子层数递增的顺序由上而下排
成 纵行 ,这样得到的一个表,叫做元素周
期表。
12
人教版高中化学必修二第一章第一节 《元素周期表 》课件(共15张PPT)

B.原子的核外电子数
C.原子核内的质子数
√D.原子的中子数
1.原子序数为 x 的元素位于第IA族,那么原子序 数为 x+2 的元素肯定不会在( )
√ A.第 IA 族 B.第ⅢB族 C.第ⅢA族 D.0族
【提示】若x为氢元素,则A正确;若x为锂或钠, 则C正确;若x在第4、5、6、7周期,则B项正确。 故答案为D。
3.第ⅠA族和0族元素的原子序数
4.每周期元素的种数
一、元素周期表的结构 “三短”“四长”;“七主”“七副”“0族和Ⅷ族” 二、元素原子结构与其在周期表中位置的关系.
周期序数=电子层数 主族序数=最外层电子数
原子序数
核外电子排布
周期表中位置
1.不能作为元素周期表中元素排列顺序的依据是
A.原子的核电荷数
螺旋式元素周期表
金字塔式元素周期表
1869年,俄国化学家门捷列夫将 元素按照相对原子质量由小到大 依次排列,制出了第一张元素周 期表,这就是现代元素周期表的 雏形。
第一章 物质结构 元素周期律
第一节 元素周期表
【思考与交流】
周期表的结构
阅读教材P4、5页并结合周期表,讨论以下问题
1.元素周期表的编排原则是什么?周期表有多 少横行,多少纵行,多少族?
A.若X是氢,则Y是氦
√C.若X是氟,则W是硫
B.若Y是氦,则Z是钠 D.若Y是氟,则Z是铝
例.已知某主族元素的原子结构示意图如下,判断 其位于第几周期,第几族?
【提示】X为第4周期,第ⅠA族;Y为第5周期,第 ⅦA族。
【记一记】
周期表的结构
1.原子序数=核电荷数=质子数=核外电子数
2.周期序数=电子层数 主族序数=最外层电子数
第一章第一节元素周期表1PPT课件

8
[实验1]将一干燥的坩埚加热,同时取一小块钾,擦干 表面的煤油后,迅速的投入到热坩埚中,观察现象。同 钠与氧气的反应比较。
[实验2]在培养皿中放入一些水,然后取绿豆大的钾, 吸干表面的煤油,投入到培养皿中,观察现象。同钠 与水的反应进比较.
钠
钾
与氧气的反应 生成淡黄色的固体, 钾熔化成小球,剧烈燃烧,
中X为17的是 B、D
7 X
33
A
8 B
X34 C
9 10 10X X
36 36
D 7
二、元素性质与原子结构的关系 1、碱金属
[科学探究] 分析碱金属原子结构的共同之处:
从碱金属原子的结构可推其化学性质如何?是否完全相同? 元素化学性质与元素原子的最外层电子数密切相关. 碱金属元素原子的最外层上都只有一个电子,因此它 们应该具有相似的化学性质.
长周期 不完全
周期
周期 序数
1 2 3 4 5 6
7
起止元素
H—He Li—Ne Na—Ar K—Kr Rb—Xe Cs—Rn
起止原 包括元 核外电 子序数 素种数 子层数
1—2
2
1
3—10 8
2
11—18 8
3
19—36 18
4
37—54 18
5
55—86 32
6
Fr—112号 87—112 26
ቤተ መጻሕፍቲ ባይዱ
金属性逐渐 增强 .因此,它们与氧气或水反应时,钾比
钠的反应 剧烈 ,铷、铯的反应 更剧烈 。
除了化学性质上的相似与递变外,碱金属在物理 性质上也表现出一些相似形和递变性。P7
11
2、卤族元素
阅读课文,完成P7[学与问]
[实验1]将一干燥的坩埚加热,同时取一小块钾,擦干 表面的煤油后,迅速的投入到热坩埚中,观察现象。同 钠与氧气的反应比较。
[实验2]在培养皿中放入一些水,然后取绿豆大的钾, 吸干表面的煤油,投入到培养皿中,观察现象。同钠 与水的反应进比较.
钠
钾
与氧气的反应 生成淡黄色的固体, 钾熔化成小球,剧烈燃烧,
中X为17的是 B、D
7 X
33
A
8 B
X34 C
9 10 10X X
36 36
D 7
二、元素性质与原子结构的关系 1、碱金属
[科学探究] 分析碱金属原子结构的共同之处:
从碱金属原子的结构可推其化学性质如何?是否完全相同? 元素化学性质与元素原子的最外层电子数密切相关. 碱金属元素原子的最外层上都只有一个电子,因此它 们应该具有相似的化学性质.
长周期 不完全
周期
周期 序数
1 2 3 4 5 6
7
起止元素
H—He Li—Ne Na—Ar K—Kr Rb—Xe Cs—Rn
起止原 包括元 核外电 子序数 素种数 子层数
1—2
2
1
3—10 8
2
11—18 8
3
19—36 18
4
37—54 18
5
55—86 32
6
Fr—112号 87—112 26
ቤተ መጻሕፍቲ ባይዱ
金属性逐渐 增强 .因此,它们与氧气或水反应时,钾比
钠的反应 剧烈 ,铷、铯的反应 更剧烈 。
除了化学性质上的相似与递变外,碱金属在物理 性质上也表现出一些相似形和递变性。P7
11
2、卤族元素
阅读课文,完成P7[学与问]
第1课时元素周期表ppt课件

质子 原子核
原子
中子
核外电子 2.元素: 具有相同 核电荷数 (即 质子数 )的同一类原
子的总称。
严 格 执 行 突 发事件 上报制 度、校 外活动 报批制 度等相 关规章 制度。 做到及 时发现 、制止 、汇报 并处理 各类违 纪行为 或突发 事件。
一、元素周期表的发展历程
门捷列夫
核电荷数
严 格 执 行 突 发事件 上报制 度、校 外活动 报批制 度等相 关规章 制度。 做到及 时发现 、制止 、汇报 并处理 各类违 纪行为 或突发 事件。
严 格 执 行 突 发事件 上报制 度、校 外活动 报批制 度等相 关规章 制度。 做到及 时发现 、制止 、汇报 并处理 各类违 纪行为 或突发 事件。
纸牌→元素周期表
1867年,俄国圣彼德堡大学里来了一位年轻的化学教授,他就 是门捷列夫。他手里总捏着一副纸牌,颠来倒去。两年后的一天, 俄罗斯化学会专门邀请专家进行一次学术讨论。主持人问:“门捷 列夫先生,可有什么高见?”门捷列夫在桌子上列成一个牌阵,竖 看就是红、橙、黄、绿、青、蓝、紫各一列,横看7种颜色的纸牌 就像画出的光谱段,有规律地每隔七张就重复一次。坐在旁边的老 师气得胡子都撅了起来,一拍桌子站了起来,以师长的严厉声调说 道:“快收起你这套魔术吧,摆摆纸牌就想发现什么规律,这些元 素难道就由你这样随便摆布吗?”但是,门捷列夫坚信自己是对的, 回家后继续摆着这副纸牌,遇到什么地方连接不上时,他就断定还 有新元素没被发现,暂时补一张空牌,就这样他一口气预言了11种 未知元素,制出了第一张元素周期表。
棱 台 型 元 素 周 期 表
严 格 执 行 突 发事件 上报制 度、校 外活动 报批制 度等相 关规章 制度。 做到及 时发现 、制止 、汇报 并处理 各类违 纪行为 或突发 事件。
第一课时元素周期表(共19张PPT)
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB
Ⅷ
ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0
1H
He
2 Li Be
3 Na Mg
B C N O F Ne Al Si P S Cl Ar
4 K Ca
Br
5 Rb
I
6 Cs
7
课堂练习:
1)已知A是a号元素,则An -中的核外电子数为:
,a + n
核内质子数为:
Bi=210
F=19 Cl=35.5 (4)充分运用分类方法的知识。
1、将族序数填在最上一行中,周期序数填在第一列
Br=80
I=127
核内质子数L为i=:7 。 Na=23
K=39
(3)最好能对未知新元素的存在和性质进行预测。
Rb=85.4
核内质子数为:
。
Ca=40
Sr=87.6
?=45 Ce=92 1955年科学家们为了纪念元素周期律的发现者门捷列夫,将101号元素命名为钔。
核外电子数之间有什么关系? 5、了解周期表的结构特点
[思考与交流](观察元素周期表 )
• 我们按照元素在周期表中的顺序给元素编号, 得到原子序数。
• 元素周期表的编排原则 ?
把相同电子层数的元素排列在一个横行里,把最外 层电子数相同的元素按照原子序数递增的顺序排在 同一纵行
原子中:
原子序数、核电荷数、质子数、核外电子数之间的关系
(纵向) 零族:稀有气体元素(最外层电子数为8的元素)
第VIII 族: 三个纵行,位于Ⅶ B 与ⅠB中间
主族序数 = 最外层电子数
1H 氢
1.008
(1)原子序数: 原子序数 = 核电荷数 = 原子的核外电子数
元素周期表第一课时优秀PPT课件
11
Cl 17
17
17
17
原子中:原子序数=核电荷数=质子数=核外电子数
11
CHENLI
2.现行元素周期表编排原则:
周期 H
He
1 +1 1 前18号元素的原子结构示意图 +2 2
1L、i 把电Be子层数B 相同C 的元N素按原O子序F数递N增e的顺
2 序+3由21左+4到2右2 +排52、成2 3把一+6不个2 同横4 +横行7 行。2 5中+8最2外6 层+9电2 7子+数10 2 8 相同的元素按电子层数递增的顺
Na Mg Al Si P S Cl Ar
序由上到下排成纵行。
3 +11 2 8 1+12 2 8 2+13 2 8 3+14 2 8 4+15 2 8 5+16 2 8 6 +17 2 8 7 +18 2 8 8
12
CHENLI
3、元素周期表的结构 (1)周期 三短四长
第1周期:2 种元素
元素周期表中短具周有期相同的第电2子周期层:数8的种元元素素 ,
意义--- 揭示了化学元素间的内在联系 现行----编排依据由相对原子质量改为 原子的核电荷数
9
CHENLI
【学习任务二】
二、现行元素周期表的编排原则及结构
【学与问】
1.什么是原子序数?原子序数、核电荷数、质子数、 核外电子数之间有什么关系? 2. 现行元素周期表的编排原则是什么? 3.元素周期表中有多少横行?多少纵行?共多少周 期、多少族?周期和族如何分类的?
C、8、18、18、18
D、8、 8、18、18
《元素周期表》课件ppt课件
观察,可得 A是氮元素
B是 氧元素
C是
二、元素的性质与原子结构
1.碱金属元素
元素 元素 名称 符号
核电 荷数
最外层电子 电子
数
层数
原子结构
相同点
递变性
锂
碱
金 属
钠
元
素钾
铷
Li
3
Na
11
K
19
Rb
37
1
2
最
1
3
1
外 层 都 有
核电 原 电子 子 荷层 半 数数 径
1
4
个
逐逐 逐
电
渐渐 渐
子
增增 增
1
原子 序数
6
13 34 53 88
周期 2 3 4 5 7
族 IVA IIIA VIA VIIA IIA
课 堂 练
4.下列各表为周期表的一部分(表中为 原子序数),其中正确的是(D )
习 (A)
(B)
234
2
11
10 11
19
(C) 6
18 19
(D) 67
11 12 13
14
24
31 32
课 堂 5、元素X的原子获得3个电子或元素Y的原 练 子失去2个电子后,它们的电子层结构与 习 氖原子的电子层结构相同。X、Y两种元
H、Be 、 Al
。
族序数等于周期序数2倍的元素
有: C S
。
周期序数=族序数2倍的有: Li、Ca
。
课 堂 7. A、B、C是周期表中相邻的三种元素, 练 其中A、B是同周期,B、C是同主族。此三 习 种元素原子最外层电子数之和为17,质子数
元素周期表完整(33张)ppt课件
短周期元素中,族序数等于周期序数的元素有 ___H__、__B_e_、__A_l__,族序数等于周期序数2倍的元素有 ___C__、__S_,周期序数等于族序数2倍的元素有__L_i___。
ppt精选版
28
4.判断正误
× (1)最外层电子数为2的元素一定在第ⅡA族。( )
2He
如:氦
10Ne
√ (2)若发现了115号元素,则该元素肯定位于第7周期第ⅤA族。( 18Ar)
6个横行 6个周期
第Ⅷ族
18个纵行,16个族 ppt精选版
金属与 非金属 分界线
26
2.下列各图为元素周期表的一部分,表中的数字为原子序数, 其中M为37的是( C )
35 36
35
×
×
37 38
√
ppt精选版
27 45
×
27
3.第3周期第ⅣA族的元素是__S_i_____;Na元素的原子 序数为11,其相邻的同族元素的原子序数是__3_、__1_9__;
6
ppt精选版
螺
旋
时
钟
式
元
素
周
期
表
7
ppt精选版
塔 式 元 素 周 期 表
8
棱
台
型
元
素
周
期
ppt精选版
表
9
ppt精选版
层 式 元 素 周 期 表
10
ppt精选版
螺 旋 式 元 素 周 期 表
11
ppt精选版
透 视 式 元 素 周 期 表
12
ppt精选版
螺 旋 式 元 素 周 期 表
13
Mn= 55 Rh=104.4 Pt= 197.4
ppt精选版
28
4.判断正误
× (1)最外层电子数为2的元素一定在第ⅡA族。( )
2He
如:氦
10Ne
√ (2)若发现了115号元素,则该元素肯定位于第7周期第ⅤA族。( 18Ar)
6个横行 6个周期
第Ⅷ族
18个纵行,16个族 ppt精选版
金属与 非金属 分界线
26
2.下列各图为元素周期表的一部分,表中的数字为原子序数, 其中M为37的是( C )
35 36
35
×
×
37 38
√
ppt精选版
27 45
×
27
3.第3周期第ⅣA族的元素是__S_i_____;Na元素的原子 序数为11,其相邻的同族元素的原子序数是__3_、__1_9__;
6
ppt精选版
螺
旋
时
钟
式
元
素
周
期
表
7
ppt精选版
塔 式 元 素 周 期 表
8
棱
台
型
元
素
周
期
ppt精选版
表
9
ppt精选版
层 式 元 素 周 期 表
10
ppt精选版
螺 旋 式 元 素 周 期 表
11
ppt精选版
透 视 式 元 素 周 期 表
12
ppt精选版
螺 旋 式 元 素 周 期 表
13
Mn= 55 Rh=104.4 Pt= 197.4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8 6
1
7
8 7
8 8
89 - 10 10 10 10 4 5 6
10 10 10 11 11 11 78 9 0 1 2
3
过渡元素
镧 系 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
锕 系
89
90
91
92
93
94
95
96
97
98
99
10 0
10 1
10 2
高一化学必修2多媒体教学课件
第一章 第一节《元素周期表》
桃源九中高一化学备课组
1869年门捷列夫在继承和分析了 前人工作的基础上,对大量实验事实 进行了订正、分析和概括,成功地对 元素进行了科学分类。将化学性质相 似的元素放在一个纵行制出了第一张 元素周期表,揭示了化学元素的内在 联系,使其构成一个完整的体系成为 化学发展史上重要的里程碑之一。
Li=7
Na=23
K=39
Ca=40
?=45
?Er=56
?Yt=66
In=75
Ti=50 V=51 Cr=52 Mn=55 Fe=56 Ni=Co=59 Cu=63.4 Zn=65.2 ?=68 ?=70 As=75 Se=79.4 Br=80 Rb=85.4 Sr=87.6 Ce=92 La=94 Di=95 Th=118?
第三周期VIIA族
第III周期 第3周期 第三周期
第七主族
VII族 VIIA族
电子层数周期数 最外层电子 主 数族序数
3、元素在周期表中位置确定方法
①结构简图法
本方法常用于原子序数小于18号元素或已知某 微粒的核外电子排布。其步骤为:原子序数→
电子层数周期数
原子结构简图→ 最外层电子 主 数族序数
ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
11 12 13 14 15 16 17 18
②过渡元素:
从ⅢB族到ⅡB族10个纵行的元素。它包括 了第Ⅷ族和全部副族元素,这些元素都是金属 元素。
第ⅠA族(除氢外):碱金属元素 第ⅣA族:碳族元素 第ⅤA称:氮族元素 第ⅥA族:氧族元素 第ⅦA族:卤族元素 0族:稀有气体元素
+3
+11 +19 +37 +55
结论:主族序数 = 最外层电子数
短周期:3个(第1、2、3周期)
周期:7个 长周期:3个(第4、5、6周期)
(7个横行) 不完全周期:1个(第7周期)
周期表
主族:7个
族:16个 副族:7个
(18个纵行)
第Ⅷ 族:1个
0族:1个
周期序数=电子层数 元素位置
主族序数=最外层电子数
(1)周期(横行) 具有相同的电子层数而又按原子序数递
增的顺序排列的一系列元素,称为一个周期。
周期序数 = 电子层数
练习
2、结构
(1)周期(横行)
周期
短周期:第一、二、三周期
(元素种数:分别为:2、8、8)
长周期:第四、五、六周期
(元素种数:分别为:18、18、32)
不完全周期:第七周期
(现已有元素26种)
2 2
2 3
2 4
2 5
2 6
2 7
2 2
3 3
3 4
3 5
3 6
5
3 7
3 8
3 9
4 0
4 1
4 2
4 3
4 4
4 5
4 6
4 7
4 8
4 9
5 0
5 1
5 2
5 3
5 4
5
6
5 5
5 767
7 2
7 3
7 4
7 5
7 6
7 7
7 8
7 9
8 0
8 1
8 2
8 3
8 4
8 5
10 3
横行叫周期,共有7周期;3、4分长短,第7不完全。 纵行称作族,总共十六族;一八依次现,一零再一遍; Ⅷ族最特殊,三行是一族:二三分主副,先主后副族; 镧锕各十五,均属ⅢB族;构位性一体,相互可推断。
①各族在元素周期表中的位置:
ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ,
1 2 3 4 5 6 7 8910
三短三长一不全
2、结构
(2)族(纵行) 七主七副零八族
①主族:
由短周期元素和长周期元素共同构成的族。 表示方法:在族序数后面标一“A”字。ⅠA、ⅡA、 ⅢA、…
②副族:
完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB、ⅡB、 ⅢB、…
③第VⅢ族:(“八、九、十” 三个纵行) ④0族:稀有气体元素
原子结构或原子序数
周
期
I A
1 1 II
A
23 4
主 族
元素周期表
0
2 III IV V VI VI
K2
A A A A IA
副
族
5
6
7
8
9
1 0
L K
8 2
3
1 1
1 2
II I IV BB
V B
V
I
VI
IB
B
VIII
I II BB
1
1
1
1
1
1
M L
18 8
345678 k 2
4
1 9
2 0
2 1
Au=197?
Bi=210
Tl=204 Pb=207
棱台型元素周期表
扇形元素周期表
螺旋型周期表
实物元素周期表
一、元素周期表
请同学们仔细观察元素周期表,阅读4-5页, 思考: 1、最早的元素周期表是以什么原则编排? 2、什么是原子序数?原子序数与原子结构有何关
系? 3、现在的周期表以什么原则编排?有多少横行?
他还预言了一些未知元素的性质都 得到了证实。但是由于时代的局限, 门捷列夫揭示的元素内在联系的规律 还是初步的,他未能认识到形成元素 性质周期性变化的根本原因。
门捷列夫的第一张周期表
H=1
Be=9.4
Mg=24
B=11
Al=27.4
C=12
Si=28
N=14
P=31
O=16
S=32
F=19
Cl=35.5
多少周期?每周期有多少元素?有多少纵行? 有多少族?如何分布?
原子序数=核电荷数=质子数=核外电子数
一、元素周期表
1、编排原则:
① 按原子序数递增原则,从左到右排布
② 横行: 将电子层数相同的元素排成一个横行
③纵行: 把最外层电子数相同的元素按电子层数递增 的顺序从上到下排成纵行
2、结构
2、结构
Zr=90 Nb=94 Mo=96 Rh=104.4 Ru=104.4 Pd=106.6 Ag=108 Cd=112 Ur=116 Sn=118 Sb=122 Te=128? I=127 Cs=133 Ba=137
?=180 Ta=182 W=186 Pt=197.44 Ir=198 Os=199 Hg=200
本节基本规律 ➢原子序数=核电荷数=质子数=核外电子数 ➢周期序数=电子层数 ➢主族序数=最外层电子数 ➢各周期的元素数目:2,8,8,18,
18,32,26(32) ➢稀有气体的原子序数:2,10,18, 36,54,86 ➢记住1~20号元素的名称和符号 ➢记住0族元素的序号
思考:Cl的位置描述:
