苏教版高中化学选修4化学反应的焓变教案
江苏省江阴市澄西中学高中化学选修四教案化学反应的焓变

【学习目标】:1、了解反应热和焓变的含义,知道放热反应和吸热反应的概念,理解化学反应过程中能量变化的原因。
2、知道热化学方程式的概念,能通过比较的方法理解热化学方程式与化学方程式的区别,能正确书写热化学方程式并利用热化学方程式进行简单计算【学习过程】:一。
个体自研(一)化学反应的焓变1.在化学反应过程中,当反应物和生成物具有 时,所 或 的热量称为化学反应的反应热。
2.化学反应中有能量变化的本质原因是化学键的 和 。
3.在 的条件下,化学反应过程中 或 的热量称为反应的 ,用 表示,单位常采用 。
4.在化学反应中能量变化通常以 等形式表现。
吸收热量的反应称为反应,其△H 0;放出热量的反应称为 反应,其△H 0。
5.将学过的放热反应与吸热反应举例说明。
(二)热化学方程式阅读教材简要总结热化学方程式与化学方程式有什么不同?书写热化学方程式应注意的问题:6.标明物质状态:7.热化学方程式中计量数的意义及其与△H 的关系:二.同伴互研1.“加热”常作为化学反应的条件,需要加热的反应一定是吸热反应吗?放热反应一定都不需要加热吗?2.简要说明物质在发生三态变化时吸热与放热的状况。
3.请说出热化学方程式:H 2(g)+2102(g)=H 2O (1) △H =-285.8 kJ .mol -1的意义。
如方程式计量数改为2、1、2,则其意义作何变化?三、要点突破[问题思考]一个化学反应是吸收热量还是放出能量,取决于什么?1、放热反应和吸热反应若反应物的总能量小于生成物的总能量,则反应过程中,吸热反应△H 0若反应物的总能量大于生成物的总能量,则反应过程中,放热反应△H 0常见的吸热反应:常见的放热反应:[问题思考]某一个反应的反应热的大小与哪些因素有关?2、键能与反应热反应过程有能量变化的本质原因:。
利用键能估算反应热:△H=[问题解决]已知N2分子中键能是946 kJ/mol,O2分子中键能是498 kJ/mol,NO分子中键能是632 kJ/mol,估算反应N2(g)+ O2(g)= 2 NO(g)的反应热。
苏教版高中化学选修四课件第1课时化学反应的焓变

的关系,而ΔH的值与参加反应的物质的物质的量有关,故热化 学方程式中化学计量数不同时,ΔH亦不同,一个化学反应,可 有多种形式的热化学方程式。
一、焓变与物质能量及键能的关系 焓变与反应物和生成物的能量有何关系? [学生交流] 【提示】 (1)若反应物的总能量小于生成物的总能量,则
恒温、恒压 吸收 在的条件下,化学反应过程中或的热量。符号,常用单位。
释放
ΔH
kJ· mol-1
3.ΔH与吸热反应、放热反应的关系 小于 > (1)ΔH 0时,反应物的总能量生成物的总能量,反应过程热 吸收 量,为吸热反应。 < 大于 (2)ΔH 0时,反应物的总能量生成物的总能量,反应过程热 放出 量,为放热反应。 4.化学键与化学反应中能量变化的关系 吸收 发生化学反应时,断开反应物中的化学键要能量,形成生 成物中的化学键要能量。 放出
ΔH<0。
【归纳小结】
书写热化学方程式应注意的问题
1.注意ΔH的符号 ΔH只能写在热化学方程式的右边,且中间留空格。若为放 热反应, ΔH为 “-”;若为吸热反应, ΔH为“ +”。 ΔH的单 位一般为kJ/mol或kJ· mol-1。 2.注意测定条件 反应热 ΔH与测定条件 ( 温度、压强等 ) 有关,因此书写热化
1.小结:
2.点拨:任何一个化学反应不仅存在物质的变化,同时也 伴随着能量的变化。热化学方程式要注意以下三要素:
(1)把握一个定义 表示反应所放出或吸收的热量的化学方程式叫做热化学方 程式。它是反映了参加反应的物质的物质的量和反应热关系的
化学方程式。能量的释放或吸收是以发生变化的物质为基础的, 二者密不可分,但以物质为主。能量的多少则以反应物和生成 物的量及状态为基础。
高中化学专题1第一单元第1课时化学反应的焓变学案苏教版选修4

第一单元化学反应中的热效应第1课时化学反应的焓变[学习目标定位] 1.熟知能量转化形式及反应热和焓变的含义、吸热反应和放热反应的本质。
2.学会热化学方程式的书写与应用。
1.化学反应过程中既有物质变化,又有能量变化。
2.化学反应中的能量变化有多种形式,释放或吸收热量是化学反应中能量变化的主要形式之一。
因此化学反应分为两类:放热反应和吸热反应。
下列图中,图1表示放热反应,图2表示吸热反应。
3.有下列反应:①氧化钙与水反应②碳酸氢钠受热分解③硫酸与氢氧化钠溶液混合④燃烧煤炭取暖⑤钠与水反应⑥胆矾受热失去结晶水,其中为吸热反应的是②⑥,放热反应的是①③④⑤。
探究点一化学反应的焓变1.N2(g)+O2(g)===2NO(g)反应的能量变化如图所示:由图可知:1 mol N2分子中的化学键断裂吸收的能量是946_kJ;1 mol O2分子中的化学键断裂吸收的能量是498_kJ;2 mol NO分子中的化学键形成释放的能量是1264_kJ;则N2(g)+O2(g)===2NO(g)的反应吸收的热量为180_kJ。
2.反应热、焓变的概念(1)反应热是化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量。
(2)在恒温、恒压条件下,化学反应过程中吸收或释放的热量称为反应的焓变(即:化学反应中生成物所具有的焓与反应物所具有的焓之差)。
符号是ΔH,单位是kJ·mol-1。
3.ΔH的正、负和吸热、放热反应的关系(1)放热反应是反应完成时,反应物的总能量大于生成物的总能量的反应。
由于反应后放出热量(释放给环境)而使反应体系的能量降低,故ΔH<0(填“<”或“>”,下同)。
(2)吸热反应是反应完成时,反应物的总能量小于生成物的总能量的反应。
由于反应时吸收环境能量而使反应体系的能量升高,故ΔH>0。
[归纳总结][活学活用]1.由右图分析,有关叙述正确的是( )A.A―→B+C和B+C―→A两个反应吸收或放出的能量不等B.A―→B+C是放热反应C.A具有的能量高于B和C具有的能量总和D.A―→B+C是吸热反应,则B+C―→A必然是放热反应答案 D解析本题考查化学反应中的能量变化,由图可知,B+C的能量高于A的能量,则反应B +C―→A一定是放热反应;反之,A―→B+C则是吸热反应。
化学反应的焓变教学设计

化学反应的焓变教学设计一、教学目标1.了解焓变的概念和计算方法;2.掌握焓变的正负判断规则和计算过程;3.培养学生的实验设计和数据处理能力。
二、教学重点焓变的概念和正负判断规则。
三、教学难点焓变的计算方法和实验设计。
四、教学流程1.导入(5分钟)引入焓变的概念,与学生讨论一下他们对焓变的认识,并给出一些简单的例子。
2.理论讲解(15分钟)-给出焓的定义:焓是系统对外界做的非体积功,记为ΔH;-介绍焓变的概念:反应物到生成物之间焓的变化,记为ΔH;-介绍焓变正负的判断规则:-反应物生成物中,化学键的断裂为吸热过程,焓变为正值;-反应物生成物中,化学键的形成为放热过程,焓变为负值;-反应物生成物中,物质的状态发生变化,如气体生成液体为放热过程,焓变为负值。
3.计算方法(10分钟)-介绍焓变的计算方法:根据反应物生成物的化学方程式中的系数,按摩尔计算反应物和生成物的焓变值,再根据各物质的量比计算焓变值;-通过示例演示焓变的计算过程。
4.实验设计(20分钟)-提供一个简单的实验设计任务:测定溶解固体NaOH过程中的焓变;-学生分组进行实验设计,包括实验器材和步骤,预测实验结果以及计算焓变的过程;-学生逐一汇报实验设计并进行讨论,老师给予指导和建议。
5.实验操作(30分钟)-学生按照实验设计完成实验操作,记录实验数据;-实验结束后学生交换数据,对数据进行校正和处理。
6.数据处理和分析(10分钟)-学生根据实验数据计算焓变,并进行数据的处理和分析;-学生将结果进行汇报和讨论,老师进行指导和辅导。
7.总结(5分钟)-学生总结焓变的概念、计算方法和实验设计的过程;-学生提出自己对焓变的问题和疑惑。
五、教学工具和材料教辅资料、实验室器材、NaOH固体、量热器(热量计)、容量瓶、电子天平等。
六、教学评价1.学生的参与度和表现;2.学生实验设计的合理性和创意性;3.学生数据处理和分析的准确性和逻辑性;4.学生对焓变的应用和扩展的能力。
高中化学选修4反应热焓变教案.docx
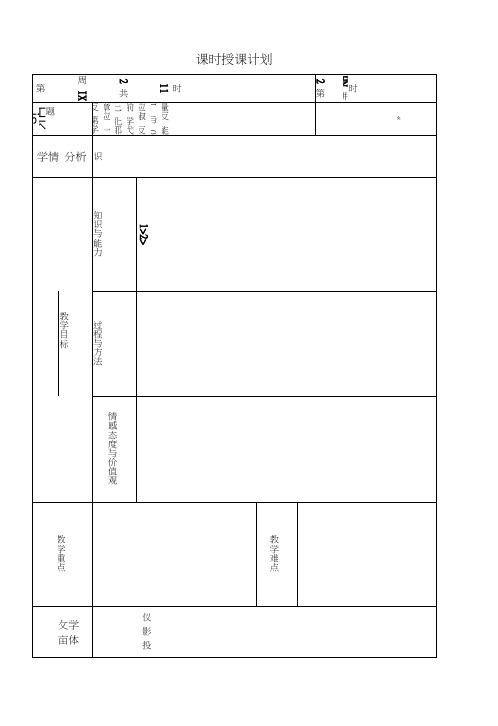
课时授课计划时112 共周 IX第时HN 讲2 第题HK is量反能I与0应俶 反前学弋匕化耶章应一反 第学«学情 分析 识知识与能力1>2>教学目标过程与方法情感态度与价值观教学重点教学难点攵学 亩体仪 影 投教师活动引言:我们知道:一个化学反应过程中,除了生成了新物质外,还有/热能 能凰变化屮电能 I 光能思考(1) 你所知道的化学反应中有哪些是放热反应?能作一个简单的总结吗?活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应反应物具有的总能量 > 生成物具有的总能量(2) 你所知道的化学反应中有哪些是吸热反应?能作一个简单的总结 吗?多数的分解反应、氯化镀固体与氢氧化锁晶体的反应、水煤气的 生成反应、炭与二氧碳生成一氧化碳反应物具有的总能量〈 生成物具有的总能量1、 当能量变化以热能的形式表现时:我们知道:一个化学反应同时遵守质量守恒定律和能量守恒,那 么一个反应屮的质量与能量冇没冇关系呢?有能量的释放或吸收是以发生变化的物质为基础,二者密不可分, 但以物质为主。
能量的多少则以反应物和产物的质量为基础。
那么化学反应中能 量到底怎样变化2、 反应热,熠变化学反应过程屮为什么会冇能量的变化?(用学过的知识回答)化学反应的实质就是反应物分子中化学键断裂,形成新的化学键, 从新组合成生成物的分了的过程。
川键断裂需耍吸收能量,新键形成 需要放出能量。
而一般化学反应屮,旧键的断裂所吸收的总能量与新 键形成所放出的总能量是不相等的,而这个差值就是反应中能量的变 化。
所以化学反应过程屮会冇能量的变化。
反应热焰变化学反应过程屮所释放或吸收的能量,都可以热量(或换算成相 应的热量)来表述,叫做反应热,又称为“焙变”。
符号:All ,单 位:kj/mol 或 kJ ・molT学生活动思考讨论后回答 {放热反应:吸热反应:1) ImolC 与 lmolI^O (g)反应失成 lmol CO (g)和 lmol 也(g),需要 吸收131.5kJ 的热量,该反应的反应热为△!!二 _____ kj/mol o2)拆开lmol H —H 键、lmol N —H 键、ImolN 三N 键分别需要的能量是436kJ 、391kJ> 946kJ ,则lmol 网生成NH3的反应热为 ________,lmol 也生成NH3的反应热为 __________3)巴 + F2 二 2HF 巴 + C12 二 2HC1 预测当生成 2 mol HF 和 2 mol HC1时,哪个反应放出的热量多?HCNOFCl11 436C 415 331N 389 293153O 465 343201 138F 568 486 272 184 157CI 432327 201205252243C=C 620 C=O 708若干化学键的键能(kj/mol, 25 °C )1 >下列说法正确的是A 、 需耍加热方能发生的反应一定是吸热反应B 、 放热的反应在常温下一定很易发生C 、 反应是放热的还是吸热的必须看反应物和生成物所具有的总能 量的相对大小D 、 吸热反应在一定的条件下也能发生AH 为“一”为放热反应,AH 为“ + ”为吸热反应思考:能量如何转换的?能量从哪里转移到哪里?体系的能量如 何变化?升高是降低?环境的能量如 何变化?升高还是降低?规定放热反 应的AH 为“一”,是站在谁的角 度?体系还是环境? 放热反应 AH 为“一”或4 H < 0 吸热反应 AH 为“ + ”或) 0△H = E (生成物的总能量)一 E (反应物的总能量) △H = E (反应物的键能)一 E (生成物的键能)3、练习△ H 为“ 练习2、反应C (石墨)一C (金刚石)是吸热反应,由此可知A、石墨比金刚石更稳定B、金刚石和石墨可以相互转化C、金刚石比石墨稳定D、金刚石和石墨不能相互转化课堂小结朋量覆") //匕匕厶冃成厶冃自癖朋物俎或i z(x h-t)仮E E垣nr-g二•9二/量紀霆能示表能僦踊总表”/^K1:一一二“7z(x z(x Jly「"Hp反饥宏微恰熾课堂反馈内容- -•o D> \7 // 6KB.j= X--@ H ' 2 △<)! H ¥m : 3第/ 1匕匕LI J O厶目+<OK/m键\7卜o J H g仑8 K z(x 1 6「1里+4 -L 2 E 2.N 从A.一作业布置预习内容板书设计JIB)^0屮3、wor V /\-取\7 FT 1」z nV TfM沖阿/&<△H JF彳审或△y:H蚕忿”或反人化“+变號量⑵醫为焙在测号件A^H触热X:囂符栽应定可和恰恒就融反反} >焙>>眠眠•■4 0/^ 1x扌八扌八一L ( ( 9- ( {放吸教思学反。
高中化学 专题1 第1单元 第1课时 化学反应的焓变教案 苏教版选修4-苏教版高二选修4化学教案

第1课时化学反应的焓变目标与素养:1.知道化学键的断裂和形成是化学反应中能量变化的主要原因。
(宏观辨识与微观探析)2.通过生产、生活中的实例了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。
(宏观辨识与微观探析)3.了解热化学方程式的含义并能正确书写热化学方程式。
(宏观辨识与微观探析)一、反应热焓变1.反应热焓变(1)反应热:在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量。
(2)焓变:在恒温、恒压的条件下,化学反应过程中吸收或释放的热量,符号为ΔH,常用单位为kJ·mol-1。
微点拨:(1)焓变为恒压条件下的反应热。
(2)反应热、焓变的单位均为kJ·mol-1,热量的单位为kJ。
2.ΔH与吸热反应和放热反应的关系(1)当ΔH>0时,反应物的总能量小于生成物的总能量,反应过程吸收热量,为吸热反应。
(2)当ΔH<0时,反应物的总能量大于生成物的总能量,反应过程放出热量,为放热反应。
3.化学反应伴随能量变化的原因(1)从反应物和生成物总能量相对大小角度分析如下图吸热反应放热反应反应热的计算公式:ΔH=E(生成物)-E(反应物)。
(2)从反应物断键和生成物成键角度分析N2(g)+O2(g)===2NO(g)反应的能量变化如下图:由图可知:1 mol N2分子中的化学键断裂吸收的能量是946_kJ,1 mol O2分子中的化学键断裂吸收的能量是498_kJ,2 mol NO分子中的化学键形成释放的能量是1_264_kJ,那么N2(g)+O2(g)===2NO(g)的反应吸收的热量为180_kJ。
反应热的计算公式:ΔH=反应物的键能总和-生成物的键能总和。
二、热化学方程式1.定义:能够表示反应热的化学方程式。
2.书写热化学方程式需注意的问题(1)书写热化学方程式时应指明反应的温度和压强,假设在25 ℃(即298 K)、101 kPa时进行的反应,可不注明。
苏教版高中化学选修四1.1《化学反应的焓变》参考教案

教学过程1、如何既能体现物质的转变有能体现能量
的变化?
2、什么是热化学方程式?
3、书写化学方程式的规则是什么呢?
【例题】
等物质的量上述三种燃料放出热量哪个
多?
(扩展)
示
能体现物质的转变
又能体现热量的变
化的化学方程式叫
热化学方程式
1.表明反应的温度
和压强
2.主明反应物与生
成物的聚集状态
3.用△H(焓变)的
“+”、“-”表
示吸热、放热。
4。
热化学方程式
前面的化学计量数
不表示分子数,表
示的是物质的量,
可以是整数可以是
分数
5.如果正反应是吸
热那么逆反应必是
放热放应。
苏教版高中化学选修四《化学反应原理》《化学反应的焓变》学案1-新版

第一单元化学反应中的热效应第一课时化学反应的焓变学习目标:1.了解反应热和焓变的含义;2.知道吸热反应和放热反应;3.能正确书写热化学方程式并理解热化学方程式的含义学习重点反应热和焓变的含义,能正确书写热化学方程式【自学准备与知识导学】1.人们研究化学反应的目的是2.吸热反应定义:常见的放热反应有举例:常见的吸热反应有:举例:【新课探究】学点1 化学反应的焓变1.反应热:当生成物与反应物的温度相同时,化学反应过程中叫做化学反应的热效应,化学反应的热效应一般被称为。
记做,单位用。
△H=∑E(生成物)∑E(反应物)∑E(反应物)>∑E(生成物),反应,△H0为“”值;∑E(反应物)<∑E(生成物),反应,△H0为“”值;〖课堂练习1〗关于吸热反应和放热反应,下列说法中错误的是()A.需要加热才能进行的化学反应一定是吸热反应B.化学反应中能量变化,除了热量外,还可以是光能、电能等C.化学反应过程中的能量变化,也服从能量守恒定律D.反应物的总能量高于生成物的总能量时,发生放热反应2.化学键与化学反应中的能量变化物质发生化学反应的实质是。
旧化学键的断裂要吸收能量,新化学键的形成要放出能量,这两部分能量一般不相等,其差就是。
根据键能求化学反应的反应热和焓变△H= 一。
△H>0,化学反应为吸热反应;△H<0,化学反应为放热反应。
学点2 热化学方程式(1)定义:。
(2)表示意义:不仅表明了化学反应中的变化,也表明了化学反应中的。
例如:H2(g)+1/2O2(g)=H2O(1) △H (298K)= 一285.8 kJ·mol—1。
〖课堂练习2〗说说下列热化学方程式的意义H2(g) +1/2 O2(g) =H2O(g);△H =-241.8 kJ /molH2(g) +1/2 O2(g) =H2O(l) ;△H =-285.8 kJ /mol〖课堂练习3〗如下两方程式有何不同:H2(g) +1/2 O2(g) =H2O(l) ;△H =-285.8 kJ /mol2H2(g) +O2(g) =2H2O(l) ;△H =-571.6 kJ /mol〖课堂练习4〗如下两方程式有何不同:2H2(g) +O2(g) =2H2O(l) ;△H =-571.6 kJ /mol2H2O(l) =2H2(g) +O2(g) ;△H = + 571.6 kJ /mol(3)热化学方程式的书写必须注意以下几点:①标明物质的,用分别代表气态(gas)、液态(liquid)、固态(solid)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应的焓变
教学目标:1.了解反应热和焓变的含义,知道放热反应和吸热反应的概念。
2.理解能量变化实质,键能的含义。
3.知道热化学方程式的概念,正确书写热化学方程式。
教学重点:使学生初步理解焓变的概念,会书写热化学方程式。
教学难点:从微观的角度讨论能量变化实质。
教学模式:自学探究讲练结合
教学过程:
一、自学探究
1.叫反应热。
2.定义:称为反应的焓变。
用符号表示,单位一般采用。
3.称为放热反应。
称为吸热反应。
4.为什么有些反应是放热的,而有些反应是吸热的?
5.请回忆学过的化学反应中,哪些是放热反应,哪些是吸热反应?
二、总结
1.化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热。
2.在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变。
反应热用符号△H表示,单位一般为kJ/mol。
3.化学反应中放出热量的反应称为放热反应。
当△H<0 时,为放热反应。
化学反应中吸收热量的反应称为吸热反应。
当△H>0 时,为吸热反应。
4.(宏观解释)任何一个化学反应中,反应物所具有的总能量与生成物所具有的总能量总不会相等的。
在新物质产生的同时总是伴随着能量的变化。
一个化学反应是放出能量还是吸收能量,取决于反应物的总能量与生成物的总能量的相对大小。
(1)当反应物的总能量大于生成物的总能量为放热反应。
(2)当反应物的总能量小于生成物的总能量为吸热反应。
(微观解释)化学反应的本质:旧键的断裂和新键的形成,断键要吸收能量,成键要释放能量,总能量的变化取决于上述两个过程能量变化的相对大小。
(1)前者大于后者为吸热反应。
(2)前者小于后者为放热反应。
5.常见的放热反应:
常见的吸热反应:
三、自学探究
1. 叫做热化学方程式。
2.热化学方程式的书写注意点有哪些?
3.热化学方程式与一般的化学方程式有什么区别?
能量
反应过程 反应过程
能量
四、总结
1.能够表示反应热的化学方程式,叫做热化学方程式。
2.热化学方程式的书写注意点
(1)反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。
(2)物质的聚集状态不同,反应吸收和放出的热量不同,因此要注明反应物和生成物的聚集状态。
(3)要注明ΔH的“+”和“-”。
(4)方程式和ΔH之间用“;”隔开。
(5)热化学方程式中的热量数据,是与各化学计量数为物质的量时相对应的,不是几个分子反应的热效应。
因此式中化学计量数可以是整数,也可以是
分数。
一般出现分数时是以某一反应物或生成物为“1mol”时其它物质才
出现的。
(6)无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H 的数值与反应式中的系数有关。
3.热化学方程式与普通化学方程式的区别有三点:
(1)热化学方程式必须标有热量变化。
(2)热化学方程式中必须标明反应物和生成物的状态,因为反应热除跟物质的量有关外,还与反应物和生成物的聚集状态有关。
(3)热化学方程式中各物质的系数只表示各物质对应的物质的量,因此,有时可用分数表示,但要注意反应热也发生相应变化。
巩固练习:
1.下列说法不正确的是 ( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需要加热即可发生
C.需要加热条件的化学反应都是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
E.分解反应肯定是吸热反应
F.物质燃烧放出热量
2.氢气在氧气中燃烧产生蓝色火焰,已知
破坏1molH-H键消耗的能量为Q
1
kJ,
破坏1molO = O键消耗的能量为Q
2
kJ,
形成1molH-O键释放的能量为Q
3
kJ。
下列关系式中正确的是()
A.2 Q
1 + Q
2
> 4 Q
3
B .2 Q 1 + Q 2 < 4 Q 3
C .Q 1 + Q 2 < Q 3
D .Q 1 + Q 2 = Q 3
3.在同温同压下,下列各组热化学方程式中Q 2> Q 1的是 ( )
A.H 2(g)+Cl 2(g)=2HCl(g); △H =- Q 1
1/2 H 2 (g)+1/2 Cl 2 (g)=HCl(g);△H =- Q 2
B .C(s)+1/2O 2(g)=CO (g); △H =- Q 1 C(s)+ O 2 (g)=CO 2 (g); △H =- Q 2
C .2 H 2 (g)+ O 2 (g)=2H 2O(l); △H =- Q 1
2 H 2 (g)+ O 2 (g)=2 H 2O (g); △H =- Q 2
D .S(g)+ O 2 (g)=SO 2 (g); △H =- Q 1
S(s)+ O 2 (g)= SO 2 (g); △H =- Q 2
4.1mol C 与1mol 水蒸气反应生成1mol CO 和1mol H 2,需要吸收 131.5 kJ 的热量。
写出
此反应的热化学方程式。
5.沼气是一种能源,它的主要成分是CH 4。
0.5 mol CH 4完全燃烧生成CO 2和H 2O 时,放出
445 kJ 的热量。
则下列热化学方程式中正确的是
A .2CH 4 ( g )+4O 2 ( g ) = 2CO 2 ( g ) + 4H 2O ( l ) ΔH = +890 kJ/mol
B .CH 4 +2 O 2 = CO 2 + H 2O ΔH = -890 kJ/mol
C .CH 4 ( g )+2 O 2 ( g ) = CO 2 ( g ) + 2 H 2O ( l ) ΔH = -890 kJ/mol
D .1/2CH 4 ( g )+O 2 ( g ) = 1/2CO 2 ( g ) + H 2O ( l ) ΔH = -890 kJ/mol 6.已知
(1)H 2 ( g )+1/2 O 2 ( g ) =H 2O ( g ) ΔH 1 = a kJ/mol (2)2 H 2 ( g )+O 2 ( g ) =2 H 2O ( g ) ΔH 2 = b kJ/mol (3)H 2 ( g )+1/2 O 2 ( g ) =H 2O ( l ) ΔH 3 = c kJ/mol (4) 2 H 2 ( g )+O 2 ( g ) =2 H 2O ( l ) ΔH 14= d kJ/mol
则a 、b 、c 、d 的关系正确的是 。
A .a<c<0 B .b>d>0 C .2a=b< 0 D .2c=d>0。
