cacl2是沉淀吗
【名师导航2024】化学二轮专题解读与强化训练——专题04 实验探究题(学生版)

专题04 实验探究题实验探究题目是每年的必考题目,分为两个题目,第一个题目为基础实验题,考察内容多为教材中出现的实验,只要牢固掌握住教材知识,难度并不大。
第二个题目为探究型实验题,试题开放性较大,有些题目还会涉及到课外的内容,即在试题下方写上“查阅内容”等字样。
这种题目是以物质的性质为依托,考察的是知识的发散性,考查特点: 信息材料→发散思维→设计实验→猜想→分析→实验验证→得出结论→完成报告。
实验探究命题思路:挖掘教材已有实验,增强知识迁移能力。
所以答题的时候要认真的分析题目与所学知识的关联。
考点解读:第一步:作出猜想——根据试题提供的物质,分析混合物中含有的成分是所提供的一部分还是全部,确定混合物可能含有的物质,然后根据题干将所给的物质自由组合,如可能含有A 、B 、C 三种物质中的两种或三种,则可能的组合有:AB 、AC 、BC 、ABC(注意:必须排除组内能够直接发生反应的物质组合)。
第二步:探究验证——设计实验方案,检验各物质是否存在。
第三步:根据实验操作(试剂选择)、实验现象、实验结论中的一种或两种互相确定混合物的成分。
检验物质成分的解题关键点如下:(1)探究某物质中是否含有某种酸(或碱或盐),常通过该酸(或碱或盐)的阴、阳离子的特征性质确定是否存在,两种离子均存在时,才说明存在该物质。
(2)探究某物质中是否含有某种金属时,可以利用该金属与酸反应产生气体、与盐溶液反应后是否析出晶体及溶液的颜色变化来判断。
(3)判断某物质中是否含有某一种气体时,常结合该气体的性质,通常为与其他物质反应产生的明显现象(如沉淀、遇酸碱指示剂变色等)。
[典例1](2018·广东广州·一模)广东粤东地区有端午吃“灰水粽”的习俗。
所谓“灰水粽”是用草木灰的浸出液浸泡糯米做成的粽子,清香软糯。
草木灰中富含K 2CO 3,还含有少量的K 2SO 4和KCl 。
某化学兴趣小组为了确定草木灰的成分,进行了如下实验。
粗盐提纯的化学方程式

粗盐提纯的化学方程式
粗盐是指含有多种无机物质的天然盐矿石,其中包括氯化钠、氯化钾、氯化镁等。
在工业生产和日常生活中,需要提纯粗盐以获得高纯度的氯化钠,这个过程称为盐的提纯。
盐的提纯过程可以分为三个步骤:溶解、沉淀和烘干。
首先,将粗盐与水混合,形成一个盐水溶液。
然后,加入一种化学物质,称为“沉淀剂”,例如硫酸钙或硫酸钠。
沉淀剂的作用是吸附盐水中的杂质和离子,使其变成固体,并沉淀在溶液中。
化学方程式如下:
NaCl + CaSO4 → Na2SO4 + CaCl2
在这个反应中,硫酸钙(CaSO4)与氯化钠(NaCl)反应,生成硫酸钠(Na2SO4)和氯化钙(CaCl2)。
硫酸钠是可溶于水的,而氯化钙是不可溶于水的,它会和其它杂质一起沉淀到盐水中,从而被分离出来。
最后,用热空气将沉淀物烘干,剩下的就是高纯度的氯化钠。
在盐的提纯过程中,沉淀剂的选择非常重要。
硫酸钙和硫酸钠都是常用的沉淀剂,但它们对于不同种类的盐石有不同的适用性。
例如,硫酸钠在提纯氯化钾时效果更好,而硫酸钙则更适用于提纯氯化镁。
盐的提纯是一种重要的工业生产过程,通过沉淀反应可以将杂质和离子从盐水中分离出来,得到高纯度的氯化钠。
化学方程式NaCl + CaSO4 → Na2SO4 + CaCl2展示了这个过程的反应机理,同时也说明了沉淀剂的作用。
在实际生产中,需要根据不同的盐石种类选择不同的沉淀剂,以保证盐的提纯效果。
变质问题的探究-2021年中考化学实验探究题大盘点(解析版)
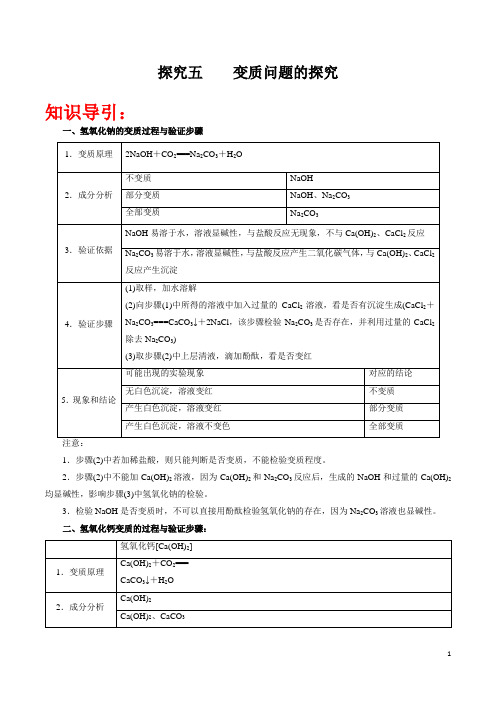
(1)取样,加水溶解
(2)向步骤(1)中所得的溶液中加入过量的CaCl2溶液,看是否有沉淀生成(CaCl2+Na2CO3===CaCO3↓+2NaCl,该步骤检验Na2CO3是否存在,并利用过量的CaCl2除去Na2CO3)
(3)取步骤(2)中上层清液,滴加酚酞,看是否变红
5.现象和结论
【进行试验】
试验操作
试验现象
试验分析
老师试验
略
略
没有产生NaHCO3
学生试验
a,取一定量的待测液于试管中,加入足量CaCl2溶液
产生白色沉淀
反应的化学方程式为______
b,充分反应后静置,取上层清液加入无色酚酞溶液
溶液变红
原待测液中含有______
【表达交流】有同学认为上述实验a中的CaCl2溶液可改为澄清石灰水,你是否同意这种看法?_____(填“同意”或“不同意”)。
【实验结论】有白色沉淀生成,说明有碳酸钠存在,加入足量氯化钙溶液后,加入酚酞,溶液变红,说明有氢氧化钠存在,因此猜想Ⅱ成立;
【反思评价】根据题目信息碳酸钠不溶于酒精,因此可以取样品溶解于酒精中,然后过滤,得到沉淀,洗涤干燥后,称量固体质量是否发生变化,得出固体是否全为碳酸钠;
3.(2020•齐齐哈尔)某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们进行了以下探究:
2两份完全变质的氢氧化钠溶液样品即碳酸钠溶液于试管中向其中一份加入盐酸有气泡产生同时生成氯化钠另一份加入氢氧化钙溶液有碳酸钙白色沉淀产生然后将两支试管中所有物质一起倒入废液缸中得到无色澄清溶液说明白色沉淀的碳酸钙与剩余的盐酸反应生成了氯化钙因此所得溶液中溶质一定有氯化钠氯化钙
探究五变质问题的探究
化学中盐的判断方式

化学中盐的判断方式一盐是颗粒状,味咸;碱是粉末状,味涩。
化学区分的话可以将盐和碱分别放入两支试管中,再分别向两支试管中滴加CaCL2(氯化钙)溶液,若有沉淀生成的为碱,没有则为食盐。
碱指在水溶液中电离出的阴离子全部都是OH-的物质;盐主要成分是氯化钠,还有有钡盐、氯化物、镁、铅、砷、锌、硫酸盐等杂质。
二区分酸碱盐的方法:阳离子全是H+的化合物是酸,阴离子全是OH-的化合物是碱,金属离子和酸根离子组成的化合物是盐。
怎么区分酸碱盐酸:电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸,或者溶于水并能释放质子形成H3O+(水合氢离子)的物质也是酸。
如盐酸、硫酸、碳酸、硝酸等。
碱:在水溶液中电离出的阴离子全部都是OH-的物质是碱。
如氢氧化锂、氢氧化钠、氢氧化铷、氢氧化铯、氢氧化钫等。
盐:金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物是盐。
如氯化钠,硝酸钙,硫酸亚铁和乙酸铵硫酸钙,氯化铜,醋酸钠等。
有关酸碱盐的口诀酸类多数都易溶,硅酸微溶是独种。
碱类钾钠钡铵溶,钙是微溶余不溶。
硫酸铅钡沉水中,微溶钙银与亚汞。
盐类溶有钾钠铵,外加易溶硝酸盐。
碳酸能溶钾钠铵,其余俱沉水中间。
盐酸沉淀银亚汞,还有微溶氯化铅。
三盐在化学中,是指一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物,如硫酸钙,氯化铜,醋酸钠,一般来说盐是复分解反应的生成物,如硫酸与氢氧化钠生成硫酸钠和水,也有其他的反应可生成盐,例如置换反应等。
含有相同阳离子或阴离子的一类盐一般都会统称为“某盐”,例如“钠盐”、“硫酸盐”等。
常见的形成盐类的阳离子包括:铵根NH4+钙离子Ca2+铁离子Fe2+或Fe3+镁离子Mg2+钾离子K+吡啶翁C5H5NH+季铵阳离子NR4+钠离子Na+常见的形成盐类的阴离子包括:乙酸根CH3COO−(乙酸)碳酸根CO32−(碳酸)氯离子Cl−(盐酸)氰化物CN−(氰化氢)硝酸根NO3−(硝酸)亚硝酸根NO2−(亚硝酸)磷酸根PO43−(磷酸)硫酸根SO42−(硫酸)。
氯化钙

氯化钙一、产品说明Calcium Chloride氯化钙化学式CaCl2,为白色粉状、粒状、片状、块状物。
熔点782℃,沸点1600℃,密度2.15克/厘米3(25℃)。
氯化钙在水中的溶解度很大,0℃时100克水能溶解59.5克氯化钙,100℃时溶解159克。
能形成含1、2、4、6个结晶水的水合物,它们存在的温度范围是:CaCl2•6H2O低于29℃;CaCl2•4H2O,29~45℃;CaCl2•2H2O,45~175℃;CaCl2•H2O,200℃以上。
它也溶于乙醇,生成CaCl2•4C2H5OH,与氨作用,形成CaCl2•8NH3。
无水氯化钙是工业和实验室常用干燥剂,但不能用来干燥乙醇和氨。
氯化钙易潮解,可用于浇洒道路以消尘。
二、产品用途1、道路、高速公路、停车场、机场、高尔夫球场等冬季除雪;2、石油钻探、钻井工作液、完井液、石油化工脱水液;3、防除尘埃、煤尘、矿尘;4、建筑行业早强剂,提高混凝土强度,生产涂料的凝固剂;5、用于防潮用干燥剂;工艺中气体和液体的干燥介质;6、橡胶行业乳胶凝结剂;7、黑色冶金工业氯化剂和添加剂;8、造纸工业添加剂及废纸张脱墨;9、化学工业的无机化工原料及硫酸根脱除剂,海藻酸钠的凝固剂;10、制冷工业用于制冷;11、用于防治小麦、苹果、白菜等腐烂及食品防腐剂;12、用于染料及印染工业生产中。
三、产品品种(一)液体氯化钙(二)固体氯化钙1、按氯化钙所含含量结晶水的多少分为:(1)二水氯化钙a、二水片状氯化钙,含量为70% min ;72%min;74%min;77%minb、二水粒状氯化钙,含量为74%min;77%minc、二水粉状氯化钙,含量为74%min;77%min(2)无水氯化钙a、无水片状氯化钙,含量为90%min;92%min;94%minb、无水粒状氯化钙,含量为90%min;92%min;94%minc、无水粉状氯化钙,含量为90%min;92%min;94%min2、按级别分为:(1)工业级氯化钙(2)食品级氯化钙都要反应因为硅酸钙是沉淀所以第一个方程会置换生成新盐Na2SiO3 + CaCl2 = CaSiO3↓ + 2NaCl第二个反应也会生成不溶于碱的强碱弱酸盐(呈碱性)沉淀所以反应可以发生Na2SiO3 + Ca(OH)2 = CaSiO3↓ + 2NaOH利用生成不溶于碱的强碱弱酸盐(呈碱性)沉淀的反应是生成强碱的重要途径之一氯化钙一硅酸钠双液法调剖剂这种双液法调剖剂主要发生如下反应:CaC12+Na2 O ·mSi02一CaO ·mSiC~+ 2NaC1CaCl2具有吸水性,溶于水并大量放热,化学性质稳定,溶于浓硫酸中放出氯化氢气体水玻璃为硅酸钠溶液状态,南方多称水玻璃,北方多称泡花碱。
东莞备战中考化学专题题库∶推断题的综合题

一、中考初中化学推断题1.某白色固体A可能含有碳酸钠、氯化钡(水溶液呈中性)、氢氧化钠中的一种或几种,进行如下实验:完成下列填空:①操作I是________。
根据上述实验分析,A中一定含有的物质是_____________,C中一定含有的溶质是___________。
②为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成下表。
实验操作现象结论_________________________________A中有氢氧化钠【答案】过滤 BaCl2和NaCO3 NaCl 向滤液C中加入足量的氯化钡溶液,充分反应后静置,取上层清液加入无色酚酞试液无色酚酞溶液变红【解析】【分析】【详解】①操作I能够得到固体和液体的分离,所以是:过滤;因为能够产生沉淀,所以物质中一定含有:碳酸钠和氯化钡,二者反应产生碳酸钡沉淀和氯化钠,所以C中一定含有的溶质是:氯化钠。
②为进一步测定其中是否含有氢氧化钠,应该首先排除碳酸钠的干扰,所以取一定量的滤液首先加入足量的氯化钡溶液,然后取上层清液于试管中,并且滴入无色的酚酞试液,因为氯化钠和氯化钡溶液都呈中性,此实验的结论是含有氢氧化钠,所以实验现象是:无色酚酞溶液变红。
【点睛】2.图中A~F是初中化学常见的物质,A俗称苏打;B可用于改良酸性土壤;C可用作补钙剂;E、F的物质类别相同。
图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
请回答:(1)物质A 的用途有_________________(只需填写一条)。
(2)物质D 的化学式_________________。
(3)写出下列反应的化学方程式:①E 转化为B_________________,②C 转化为F_________________。
【答案】玻璃、造纸、纺织和洗涤剂的生产等(只需回答其中一条) NaOH 22H O+CaO=Ca(OH) 3222CaCO +2HCl=CaCl +CO +H O ↑或32CaCO CaO+CO 高温↑(其他合理答案均给分)【解析】【详解】A 俗称苏打;B 可用于改良酸性土壤;C 可用作补钙剂;故A 是碳酸钠,B 是氢氧化钙,C 是碳酸钙,碳酸钠能生成E ,E 能生成氢氧化钙,故E 是水,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,故D 是氢氧化钠,碳酸钙能生成F ,F 和E 是同类物质,F 能和氢氧化钠的反应,故F 是二氧化碳。
cacl2与na2co3反应方程式

CaCl2与Na2CO3反应是一种常见的化学反应,这种反应是一种双替换反应,也被称为沉淀反应。
在这个反应中,CaCl2和Na2CO3相互作用,产生沉淀和溶液。
1. 反应方程式该反应的化学方程式如下所示:CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl在这个方程式中,CaCl2是氯化钙的化学式,Na2CO3是碳酸钠的化学式,CaCO3是碳酸钙的化学式,NaCl是氯化钠的化学式。
箭头表示化学反应的方向,反应物放在箭头的左边,产物放在箭头的右边,而↓表示产生的物质为沉淀。
2. 反应条件CaCl2与Na2CO3的反应是在水溶液中进行的,通常在常温下进行。
当CaCl2和Na2CO3溶解在水中时,它们会发生化学反应,产生沉淀和溶液。
3. 反应机理CaCl2与Na2CO3反应的机理是钙离子和碳酸根离子之间的双替换反应。
在该反应中,CaCl2中的钙离子与Na2CO3中的碳酸根离子发生交换,形成CaCO3沉淀和NaCl溶液。
4. 反应产物在CaCl2与Na2CO3反应中,产生的主要产物是CaCO3沉淀和NaCl溶液。
CaCO3是白色的固体沉淀物,而NaCl是无色的溶液。
5. 应用CaCl2与Na2CO3反应通常用于实验室中制备碳酸钙。
由于CaCO3是一种重要的工业原料,因此该反应也在工业生产中得到广泛应用。
该反应还可以用于水处理和废水处理过程中,用来去除水中的碳酸钙。
6. 注意事项在进行实验时,应小心处理CaCl2和Na2CO3,因为它们都是腐蚀性的化学物质。
在进行反应时应注意控制反应条件,以避免产生不必要的危险。
在处理和处置产生的化学物质时,也需要遵循相应的安全操作规程。
总结CaCl2与Na2CO3的反应是一种重要的化学反应,产生的CaCO3沉淀和NaCl溶液在实验室和工业生产中具有广泛的应用价值。
在进行该反应时,需要注意操作安全,并严格控制反应条件,以确保实验过程安全可靠。
也需要合理处理和处置产生的化学物质,以防止对环境造成不必要的影响。
高中沉淀物质表

高中沉淀物质表在高中化学学习中,学习沉淀物质表是非常重要的,因为它不仅能帮助我们更好的理解沉淀反应的特点,而且能够帮助我们更好地掌握相关实验动手操作。
下面给出的就是高中化学沉淀物质表,以便大家在学习和掌握沉淀反应时更轻松一些。
一、无机沉淀物质1、氯化物沉淀物:氯化钠(NaCl)、钙氯化物(CaCl2)、氯化钙(CaCl2)、氯化钴(CoCl2)、氯化锌(ZnCl2)、氯化铜(CuCl2)、氯化硫酸盐(H2SO4)。
2、硫化物沉淀物:硫酸铜(CuSO4)、硫酸锌(ZnSO4)、硫酸铜(CuSO4)、硫酸钙(CaSO4)、硫酸钾(K2SO4)、硫酸钠(Na2SO4)、硫酸钛(TiSO4)、硫酸铅(PbSO4)。
3、氧化物沉淀物:氧化钙(CaO)、氧化铜(CuO)、氧化锌(ZnO)、氧化铁(FeO)、氧化锰(MnO2)、氧化钛(TiO2)、氧化钒(V2O5)、氧化铝(Al2O3)。
4、其他无机沉淀物:碳酸钙(CaCO3)、碳酸钠(Na2CO3)、氯氢化钙(Ca(OH)2)、氢氧化钾(KOH)、氢氧化钠(NaOH)、硼砂(B2O3)、硫酸铵(NH4HSO4)。
二、有机沉淀物质1、甘油三酯(triglyceride):甘油三酯是沉淀的有机物质,其中包含酒精、醇和油分子。
2、酸性沉淀物:酸性沉淀物是指在酸性环境下沉淀的有机物质,如醛(aldehydes)、酮(ketones)、酯(esters)、醚(ethers)等。
3、羧酸沉淀物:羧酸沉淀物是指在碱性环境下沉淀的有机物质,如甘油酯(fatty acid esters)、脂肪酸酯(fatty acids)等。
4、其他有机沉淀物质:其他有机沉淀物质还包括油酸酯(fatty acid esters)、烷基胺(alkyl amines)、硝基化合物(nitro compounds)、二硫键化合物(disulfide compounds)等。
以上就是关于高中沉淀物质表的全部内容,无论是从物理性质上还是化学上,这些沉淀物质都是十分重要的,所以大家在学习沉淀反应时,一定要熟练掌握这些沉淀物质的性质及其相应的实验操作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
cacl2是沉淀吗
CaCl2不是沉淀,易溶于水。
20℃时溶解度为74.5g/100g水,同时放出大量的热(氯化钙的溶解焓为-176.2cal/g),其水溶液呈微酸性。
它是典型的离子型卤化物,室温下为白色固体。
它常见应用包括制冷设备所用的盐水、道路融冰剂和干燥剂。
氯化钙的用途
氯化钙的用途包括防止食物变质,人们常用它作为食物防腐剂。
它还有助于保持食品新鲜度。
巴氏奶在加工过程中消减了大量钙,而添加少量氯化钙可以帮助凝固。
氯化钙也是奶酪很重要的添加剂。
氯化钙溶液可以应用于冰箱,它是必不可少的冷却剂。
