硝酸钾溶解热数据处理
KNO3的积分溶解热数据记录数据处理表
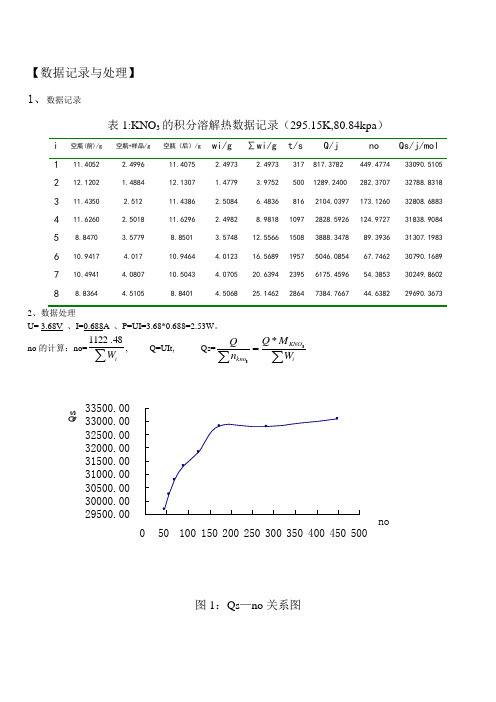
【数据记录与处理】 1、数据记录表1:KNO 3的积分溶解热数据记录(295.15K,80.84kpa )i 空瓶(前)/g空瓶+样品/g空瓶(后)/gwi/g ∑wi/g t/sQ/j noQs/j/mol1 11.4052 2.4996 11.4075 2.4973 2.4973 317 817.3782449.477433090.5105 2 12.1202 1.4884 12.1307 1.4779 3.9752 500 1289.2400 282.3707 32788.8318 3 11.4350 2.512 11.4386 2.5084 6.4836 816 2104.0397 173.1260 32808.6883 4 11.6260 2.5018 11.6296 2.49828.9818 1097 2828.5926 124.972731838.9084 5 8.8470 3.5779 8.8501 3.5748 12.5566 1508 3888.3478 89.3936 31307.1983 6 10.9417 4.017 10.9464 4.0123 16.5689 1957 5046.0854 67.7462 30790.1689 7 10.4941 4.0807 10.5043 4.0705 20.6394 2395 6175.4596 54.3853 30249.8602 88.83644.51058.84014.5068 25.1462 2864 7384.7667 44.638229690.36732、数据处理U= 3.68V 、I=0.688A 、P=UI=3.68*0.688=2.53W 。
no 的计算:no=∑i W 48.1122, Q=UIt, Qs=∑∑=iKNO kno W M Q n Q33*29500.0030000.0030500.0031000.0031500.0032000.0032500.0033000.0033500.00050100150200250300350400450500noQ s图1:Qs —no 关系图1、本实验的装置可从以下几个方面改进:本实验采用杜瓦瓶作为反应装置,可视性不好,可以考虑用透明的绝热玻璃装置,增强反应的透明度,更容易观察硝酸钾的溶解性。
大学溶解热实验报告

一、实验目的1. 了解溶解热的定义、分类及其测定方法。
2. 掌握电热补偿法测量溶解热的基本原理和操作步骤。
3. 通过实验,测定硝酸钾在水中的积分溶解热,并计算微分溶解热、积分冲淡热和微分冲淡热。
4. 分析实验误差,提高实验操作技能。
二、实验原理溶解热是指在恒温、恒压条件下,将一定量的溶质溶解于溶剂中时所产生的热效应。
溶解热分为积分溶解热和微分溶解热。
积分溶解热是指在恒温、恒压条件下,1mol 溶质溶解在一定量的溶剂中时所产生的热效应。
微分溶解热是指在恒温、恒压条件下,在大量给定浓度的溶液中加入1mol溶质时所产生的热效应。
溶解热可以通过绝热测温式量热计进行测量。
该量热计在绝热恒压条件下工作,通过测量溶液温度的变化,计算出溶解热。
三、实验仪器与药品1. 仪器:保温瓶、磁力搅拌器、热敏电阻测温装置、加热器、直流稳压稳流电源、精密毫安表、秒表、容量瓶(500ml)、烧杯(1000ml)、温度计、研钵、称量瓶、分析天平(公用)、高精度万用表(公用)。
2. 药品:KNO3(AR)。
四、实验步骤1. 搭建实验装置,要求装置具有良好的绝热性能。
2. 量取500mL去离子水注入保温瓶中,开动磁力搅拌器,用电加热方法调节水温,使之尽量接近室温,输出温度基本保持不变。
3. 调节惠斯通电桥的调节旋钮,使输出温度为5度。
待温度基本稳定后,记录约4min。
4. 打开电源开关,设定电源输出的电压值(20V以上)和电流值(0.95A)。
5. 按下电源的输出按键,开始加热,温度上升至7度时(以无纸记录仪上显示的数值为准)停止加热。
待温度稳定后,记录温度。
6. 重复步骤4-5,进行多次实验,求取平均值。
五、数据处理1. 计算硝酸钾的摩尔质量。
2. 根据实验数据,计算硝酸钾在水中的积分溶解热。
3. 根据积分溶解热,计算微分溶解热、积分冲淡热和微分冲淡热。
六、实验结果与分析1. 硝酸钾的摩尔质量为101.1g/mol。
2. 硝酸钾在水中的积分溶解热为-10.26 kJ/mol。
硝酸钾溶解热测定实验的改进

连接好线路 。用容量瓶量取 3 0 0 m L蒸 馏水倒 入杜 瓦瓶 中, 放入磁子 ,拧紧瓶 盖。用 台秤粗 称 已研细 的样 品约 3 . 6 g ,倒 人称量瓶 中,用分析天平准确称 出称量瓶和样 品的质量 m。 。打 开 电源开关 ,同时按下秒 表 ,每隔 1 a r i n记 录一 次温 度。 当温
3 5 . 3 2 9 k J・mo l b y t h e e x p e r i me n t .
Ke y wo r ds :di s s o l ut i o n h e a t ;me a s u r e me n t me t h o d;me a s u r e me n t o n—l i n e;n i t e r
可靠的实验结果 。由实验测得 硝酸钾的积分溶解 热为 3 5 . 3 2 9 k J・ m o l ~。
关键 词 :溶解热; 测定方法; 联机检测;硝酸钾
【清华】011890-雍有-溶解热

4 结论
根据表 4 中数据可以看出,随着 KNO3 浓度的增大,摩尔积分溶解热不断增大,摩尔微分溶解热不断增 大,而摩尔微分稀释热不断减小
5 参考文献
[1] 《基础物理化学实验》贺德华麻英张连庆编高等教育出版社 [2] 《化工原理(上册)》(第三版)蒋维钧戴猷元顾忠君编著清华大学出版社
14441.90
31.0905
36.0000
ΔsolHm/(kJ/mol)
35.0000 34.0000
△solHm
33.0000
32.0000
31.0000
30.0000 0.00
200.00
400.00 n0
600.00
800.00
图2 ∆
-n0 图
利用 origin 在图上画出 n0=80,100,200,300,400 时对应点的切线,根据切点坐标、切线斜率、切线截距可
雍有 2010011890 化 03
以
( sol H nA
)T
, P,nB
表示,简写为
( sol H nA
) nB
。
在恒温恒压下,对于指定的溶剂 A 和溶质 B,溶解热的大小取决于 A 和 B 的物质的量,即
sol H (nA , nB )
(3)
由(3)式可推导得:
sol H
sol H nB
(1)
式中, nB 为溶解于溶剂 A 中的溶质 B 的物质的量。
摩尔微分溶解热 在恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,
以
(
sol H nB
)T
, P, nA
表示,简写为
(
sol H nB
溶解热实验数据处理-origin 8.0

下面以一组学生实验数据(表1)为例,详细介绍Origin软件在溶解热数据处理的应用。
表1.硝酸钾溶解热的实验数据水0 用Origin 8.0软件处理实验数据的步骤(1)绘制散点图。
打开Origin 8.0,点击项目“Book1”中的A(X)列,从行“1”开始依次输入n0值,同样在B(Y)列输入Q s值。
选中所有数据,右击选择“Plot/Symbol/Scatter”或者直接点击工具条上的Scatter按钮,得到散点图,如图1所示。
图1. 用Origin绘制散点图(2)非线性拟合。
左键单击“Graph1”窗口中任意一个散点,依次选择菜单栏中“Analysis/Fitting/Fit Exponential”,在弹出的对话框中的“Function”下拉菜单中选择“ExpDec1”(Exponential Decay1,即一次指数衰减)进行拟合,并在“Settings”选项卡中选择“Advanced”,找到“Find Specific X/Y”,勾选“Find Y from X”项,以便寻找拟合曲线上任意X坐标所对应的Y值,这一步操作较为关键。
如图2所示,点击“Fit”完成拟合。
图2.用Origin对数据进行非线性拟合与此同时,在“Book1”中会自动生成三个工作表:“fitexp1”用来记录拟合情况,“fitexpCurves1”则记录拟合曲线中数据点的坐标值,“fitexpFindYfrom X”用来输入任意的X值,程序自动计算出其对应的Y值。
同时,在“Graph1”中生成了包含方程详细信息的表格,由如图3可知,本实验数据所得到的拟合曲线方程为Qs = -10.515*exp(-n0/46.848) + 37.372,R2=0.99157(R2即Adj. R-Square的值)。
图3. Origin拟合曲线的方程和偏差点击工具栏中的“Text Tool”按钮,可在“Graph1”的文本框中插入曲线方程和R2的值,选中文本框,单击右键选择“properties”可进行美化,如字体、字号和颜色的设置等。
实验九 溶解热的测定
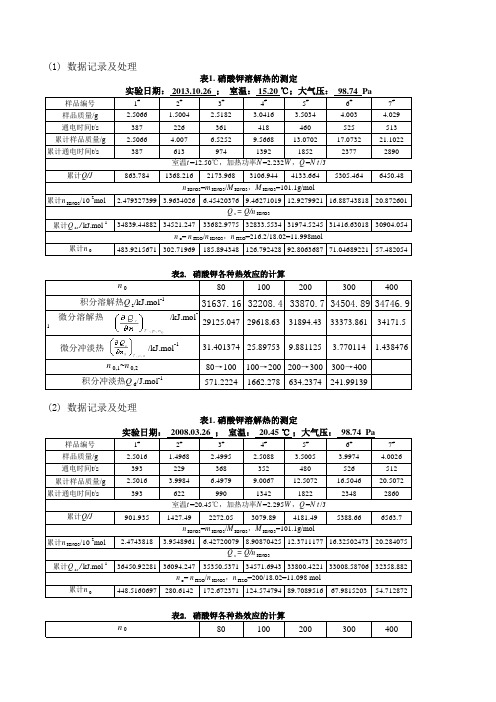
样品编号1#2#3#4#5#6#7#样品质量/g 2.5066 1.5004 2.5182 3.0416 3.5034 4.003 4.029通电时间t/s 387226361418460525513累计样品质量/g 2.5066 4.007 6.52529.566813.070217.073221.1022累计通电时间t/s3876139741392185223772890累计Q/J 863.7841368.2162173.9683106.9444133.6645305.4646450.48累计n KNO3/10-2mol 2.479327399 3.9634026 6.454203769.4627101912.927992116.8874381820.872601累计Q s s /kJ.mol -134839.4488234521.24733682.977532833.553431974.524531416.6301830904.054累计n 0483.9215671302.71969185.894348126.79242892.806368771.0468922157.4820548010020030040031637.1632208.433870.734504.8934746.980→100100→200200→300300→400571.22241662.278634.2374241.99139样品编号1#2#3#4#5#6#7#样品质量/g 2.5016 1.4968 2.4995 2.5088 3.5005 3.9974 4.0026通电时间t/s 393229368352480526512累计样品质量/g 2.5016 3.9984 6.49799.006712.507216.504620.5072累计通电时间t/s3936229901342182223482860累计Q/J 901.9351427.492272.053079.894181.495388.666563.7累计n KNO3/10-2mol 2.47438183.95489616.427200798.9087042512.371117716.3250247320.284075累计Q s s /kJ.mol -136450.9228136094.24735350.537134571.694333800.422133008.5870632358.882累计n 0448.5160697280.6142172.672371124.57479489.708951667.981520354.7128728010020030040034171.51.43847633373.8613.77011431894.439.88112529618.6325.8975329125.04731.401374n o = n H2O /n KNO3,n H2O =200/18.02=11.098 moln 0(2) 数据记录及处理表1. 硝酸钾溶解热的测定实验日期: 2008.03.26 ; 室温: 20.45 ℃ ;大气压: 98.74 Pa室温t =20.45℃,加热功率N =2.295W ,Q =N t /J n KNO3=m KNO3/M KNO3,M KNO3=101.1g/molQ s = Q/n KNO3n o = n H2O /n KNO3,n H2O =216.2/18.02=11.998moln 0积分溶解热Q s /kJ.mol -1n 0,1~n 0,2积分冲淡热Q d /J.mol-1微分溶解热/kJ.mol -1微分冲淡热 /kJ.mol -1(1) 数据记录及处理表1. 硝酸钾溶解热的测定实验日期: 2013.10.26 ; 室温: 15.20 ℃;大气压: 98.74 Pa室温t =12.50℃,加热功率N =2.232W ,Q =N t /J n KNO3=m KNO3/M KNO3,M KNO3=101.1g/molQ s = Q/n KNO333473.6734058.135607.836174.4836395.180→100100→200200→300300→400584.4341549.652566.7199220.66232样品编号1#2#3#4#5#6#7#样品质量/g 2.5044 1.5068 2.5079 2.5061 3.5068 4.0003 4.0129通电时间t/s 373219356344457505485累计样品质量/g 2.5044 4.0112 6.51919.025212.53216.532320.5452累计通电时间t/s3735929481292174922542739累计Q/J 856.7811359.8242177.5562967.7244017.4535177.4386291.483累计n KNO3/10-2mol 2.477151335 3.9675569 6.448170138.9270029712.395647916.3524233420.321662累计Q s s /kJ.mol -134587.349934273.58633770.138833244.348832410.189831661.5946830959.491累计n 0448.0146143279.71874172.110844124.31943989.531423667.8676167354.6116768010020030040032137.8432734.933959.634332.3834521.880→100100→200200→300300→400597.101471224.699372.733189.38388样品编号1#2#3#4#5#6#7#样品质量/g 2.5044 1.5068 2.5079 2.5061 3.5068 4.0003 4.0129通电时间t/s 373219356344457505485累计样品质量/g 2.5044 4.0112 6.51919.025212.53216.532320.5452累计通电时间t/s3735929481292174922542739累计Q/J856.7811359.8242177.5562967.7244017.4535177.4386291.483微分冲淡热 /kJ.mol-1微分溶解热 /kJ.mol -1 微分冲淡热 /kJ.mol -1微分溶解热 /kJ.mol -135851.541.35900133932.851.47227335161.3653.377052333592.9282.464833733831.038.88365132810.425.74612531511.9825.461330272.8924.6205330771.78233.77365729262.18335.945768(4) 数据记录及处理表1. 硝酸钾溶解热的测定实验日期: 2008.03.26 ; 室温: 25.39 ℃ ;大气压: 98.74 Pa室温t =25.39℃,加热功率N =2.297W ,Q =N t /Jn o = n H2O /n KNO3,n H2O =200/18.02=11.098 moln 0积分溶解热Q s /kJ.mol -1n 0,1~n 0,2积分冲淡热Q d /J.mol-1(3) 数据记录及处理表1. 硝酸钾溶解热的测定实验日期: 2008.03.26 ; 室温: 25.39 ℃ ;大气压: 98.74 Pa室温t =25.39℃,加热功率N =2.297W ,Q =N t /J n KNO3=m KNO3/M KNO3,M KNO3=101.1g/molQ s = Q/n KNO3积分溶解热Q s /kJ.mol-1n 0,1~n 0,2积分冲淡热Q d /J.mol -1累计n KNO3/10-2mol 2.477151335 3.9675569 6.448170138.9270029712.395647916.3524233420.321662累计Q s s/kJ.mol-134587.349934273.58633770.138833244.348832410.189831661.5946830959.491累计n0448.0146143279.71874172.110844124.31943989.531423667.8676167354.6116768010020030040032137.84432734.94533959.64534332.377934521.7680→100100→200200→300300→400597.101471224.6994372.73304189.38388累计n0481.4`185.23126.8592.7570.9957.48累计Q s s/kJ.mol-136968.236714.236274.135825.535236.334659.834049.58010020030040031639.45332210.77433873.48434507.990734750.1280→100100→200200→300300→400 571.321741662.7102634.50625242.133********.34 1.439459微分溶解热 /kJ.mol-1微分冲淡热 /kJ.mol-1微分溶解热 /kJ.mol-1微分冲淡热 /kJ.mol-133376.36953.772070733932.851.47227331896.5589.884631633592.92782.4648336729620.52725.90246832810.425.746125429126.94631.40633730272.89224.620532n0积分溶解热Q s/kJ.mol-1n0,1~n0,2积分冲淡热Q d/J.mol-1n o= n H2O/n KNO3,n H2O=200/18.02=11.098 moln0积分溶解热Q s/kJ.mol-1n0,1~n0,2积分冲淡热Q d/J.mol-129262.18335.945768n KNO3=m KNO3/M KNO3,M KNO3=101.1g/molQ s= Q/n KNO3PaPaPaPa。
溶解热的测定实验报告

溶解热测定姓名 学号 班级 实验日期1 实验目的(1)了解电热补偿法测定热效应的基本原理。
(2)用电热补偿法测定硝酸钾在水中的积分溶解热,通过计算或作图求出硝酸钾在水中的微分溶解热、积分溶解热和微分冲淡热。
(3)掌握用微机采集数据、处理数据的实验方法和实验技术。
2 实验原理溶解热:恒温恒压下,物质的量为2n 的溶质溶于物质的量为1n 的溶剂(或溶于某浓度溶液)中产生的热效应,用Q 表示。
积分溶解热:恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用s Q 表示。
微分溶解热:恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以12nn Q ⎪⎪⎭⎫⎝⎛∂∂表示。
冲淡热:恒温恒压下,一定量的溶剂A 加到某浓度的溶液使之稀释所产生的热效应。
积分冲淡热:恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液的过程中产生的热效应,以d Q 表示。
微分冲淡热:恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以21n n Q ⎪⎪⎭⎫⎝⎛∂∂或20n s n Q ⎪⎪⎭⎫ ⎝⎛∂∂表示。
它们之间关系可表示为:s Q n Q =2 令021n n n= 21002n s n s n Q n n Q Q ⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎪⎭⎫ ⎝⎛∂∂= ()()0201n s n s d Q Q Q -=积分溶解热s Q 可由实验测得,其他三种热效应则可通过0n Q s -曲线求得,曲线某点的切线的斜率为该浓度下的摩尔微分稀释热,切线与纵坐标的截距,为该浓度下的摩尔微分溶解热(即OC )。
显然,图中A 点的摩尔溶解热与B 点的摩尔溶解热之差为该过程的摩尔积分稀释热(即BE )。
欲求溶解过程的各种热效应,应测定各种浓度下的摩尔积分溶解热。
实验中采用累加的方法,先在纯溶剂中加入溶质,测出溶解热,然后在这溶液中再加入溶质,测出热效应,根据先后加入溶质总量可求出,各次热效应总和即为该浓度下的溶解热。
溶解热的测定实验报告

溶解热的测定 实验报告姓名/学号:何一白/2012011908 班级:化22 同组实验者姓名:苏剑晓 实验日期:2014年12月4日 提交报告日期:2014年12月10日带实验的老师姓名:王溢磊1 引言(简明的实验目的/原理)1.1 实验目的1.测量硝酸钾在不同浓度水溶液的溶解热,求硝酸钾在水中溶解过程的各种热效应。
2。
掌握量热装置的基本组合及电热补偿法测定热效应的基本原理。
3。
复习和掌握常用的测温技术.1。
2 实验原理物质溶于溶剂中,一般伴随有热效应的发生。
盐类的溶解通常包含着几个同时进行的过程:晶格的破坏、离子或分子的溶剂化、分子电离(对电解质而言)等。
热效应的大小和符号决定于溶剂及溶质的性质和它们的相对量。
在热化学中,关于溶解过程的热效应,需要了解以下几个基本概念。
溶解热 在恒温恒压下,溶质B 溶于溶剂A (或溶于某浓度溶液)中产生的热效应,用sol H ∆表示。
摩尔积分溶解热 在恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用sol m H ∆表示.sol sol m BHH n ∆∆=(1) 式中, B n 为溶解于溶剂A 中的溶质B 的物质的量。
摩尔微分溶解热 在恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以,,()A sol T P n B H n ∂∆∂表示,简写为()A sol n BHn ∂∆∂。
稀释热 在恒温恒压下,一定量的溶剂A 加到某浓度的溶液中使之稀释,所产生的热效应。
摩尔积分稀释热 在恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液,这个过程产生的热效应,以dil m H ∆表示。
21dil m sol m sol m H H H ∆=∆-∆(2)式中,2sol m H ∆、1sol m H ∆为两种浓度的摩尔积分溶解热。
摩尔微分稀释热 在恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以,,()B sol T P n A Hn ∂∆∂表示,简写为()B sol n AHn ∂∆∂. 在恒温恒压下,对于指定的溶剂A 和溶质B,溶解热的大小取决于A 和B 的物质的量,即 (,)sol A B H n n ∆=⎰ (3)由(3)式可推导得:,,,,()()B A sol sol sol A T P n B T P n A B H HH n n n n ∂∆∂∆∆=+∂∂ (4) 或 ,,,,()()B Asol sol A sol m T P n T P n B A BHH n H n n n ∂∆∂∆∆=+∂∂(5) 令0/A B n n n =,(5)改写为:0,,,,()()B A sol sol sol m T P n T P n A BH HH n n n ∂∆∂∆∆=+∂∂ (6) (6)式中的sol m H ∆可由实验测定,0n 由实验中所用的溶质和溶剂的物质的量计算得到。
