第十六章d区元素一
无机分析12第十六章d区元素

Fe2+
浅绿色
Co2+
酒红色
Ni2+
绿色
Cu2+
蓝色
Zn2+
无色
上页 下页 目录 返回
许多二价过渡元素金属离子 M 2+ (aq)的 颜色与d-d 跃迁或 f-f 跃迁有关。这种 跃迁发生在金属离子本身,通常强度都 很弱,不能解释无机颜料的颜色。副篇 介绍了荷移跃迁和价层间跃迁。
第一过渡系金属水合离子的颜色
●熔点、沸点高
同周期元素单质的熔 点,从左到右一般是先逐渐
升高,然后又缓慢下降。在
同一族中,第二过渡系元素 的单质的熔点、沸点大多高 于第一过渡系,而第三过渡 系的熔点、沸点又高于第二 过渡系(第 3 族除外),熔点 最高的单质是钨。 熔点最高的单质: 钨(W) 3683±20℃
上页 下页 目录 返回
(4)
金属元素的电极电势
φθ的单位为V
元素
Ca -2.87 Sc Ti V Cr Mn Fe Co Ni Cu 0.34 Zn -0.76
φθ(M2+/M)
Φθ (M3+/M2+)
- -1.63 -1.18
-0.91 -1.18 -0.44 -0.28 -0.23
-
-
-0.37 -0.256 -0.41 +1.51
d 电子组态 M2+(aq)
d1 d2 Sc2+ Ti2+
d3 d4 V2+ Cr2+
d5 d6 d7 Mn2+ Fe2+ Co2+
d8 d9 d10 Ni2+ Cu2+ Zn2+
稳 定 性 增 大
无机化学完整16-d区元素(一)PPT

K sp (Ag2CrO4) 1.1×1012 K sp (Ag2Cr2O7 )2.0×107
4Ag Cr2O72 H2O 2Ag2CrO4 (s,砖红) 2H
2Ba2 Cr2O72 H2O 2BaCrO4 (s,柠檬黄)2H
2Pb2 Cr2O72 H2O 2PbCrO4 (s,黄) 2H
可 氧 化 物 种SO 32- I- C l- H 2S Fe2+ 产 物 SO 42- I2 C l2 S或 SO 42- Fe3+
Sn2+ Sn4+
溶液的酸度不同,MnO4—被还原的产物不同:
2M 4 53 2 S n 6 O O H 22 M 52 4 S n 3 2 O O H
族族
4(第一 过渡系)
Sc
Ti
V
Cr
Mn
Fe Co Ni
铁系
Cu
Zn
5(第二
Ru Rh Pd
过渡系) Y Zr Nb Mo Tc 轻铂组 Ag Cd
6 (第三 La过渡系) Lu
Hf
Ta
W
Re
Os Ir Pt
重铂组
Au
Hg
7(第四 Ac过渡系) Lr
Rf
Db
Sg
Bh Hs Mt Uun Uuu Uub
6Fe3 2Cr3 7H2O 3Sn 4 2Cr3 7H2O
K 2Cr2O7 (s) 14HCl(浓)
.
3Cl2 2CrCl3 2KCl 7H2O
21
2.铬(Ⅲ)的化合物 (1) Cr2O3的制备与性质 性质:C2rO36H C3r3H 2O
3H 2OC2rO32OHCr(O 4 H)
(n-1)d1-10ns1-2 (Pd为5s0)
第十六章 d区元素复习提纲,及试题

第十六章d区元素(一)预习提纲1、d区元素性质变化的一般规律,包括原子半径,电离能,物理性质,化学性质,氧化态及颜色。
2、钛,钒及其化合物。
3、铬的化合物,铬离子的反应,多酸型配合物结构。
4、锰的重要化合物性质。
水溶液中锰离子的反应。
5、铁,钴,镍重要化合物性质及相应反应。
第十六章复习题一、是非题:1、从元素钪开始,原子轨道上填3d电子,因此第一过渡系列元素原子序数的个位数等于3d上的电子数。
2、除ⅢB外,所有过渡元素在化合物中的氧化态都是可变的,这个结论也符合与ⅠB族元素。
3、ⅢB族是副族元素中最活泼的元素,它们的氧化物碱性最强,接近于对应的碱土金属氧化物。
4、第一过渡系列的稳定氧化态变化,自左向右,先是逐渐升高,而后又有所下降,这是由于d轨道半充满以后倾向于稳定而产生的现象。
5、元素的金属性愈强,则其相应氧化物水合物的碱性就愈强;元素的非金属性愈强,则其相应氧化物水合物的酸性就愈强。
6、低自旋型配合物的磁性一般来说比高自旋型配合物的磁性相当要弱一些。
二、选择题:1、过渡元素原子的电子能级往往是(n-1)d > ns,但氧化后首先失去电子的是ns 轨道上的,这是因为:A、能量最低原理仅适合于单质原子的电子排布。
B、次外层d上的电子是一个整体,不能部分丢失。
C、只有最外层的电子或轨道才能成键。
D、生成离子或化合物,各轨道的能级顺序可以变化。
2、下列哪一种元素的(Ⅴ)氧化态在通常条件下都不稳定A、Cr(Ⅴ)B、Mn(Ⅴ)C、Fe(Ⅴ)D、都不稳定3、Cr2O3,MnO2,Fe2O3在碱性条件下都可以氧化到(Ⅵ)的酸根,完成各自的氧化过程所要求的氧化剂和碱性条件上A、三者基本相同B、对于铬要求最苛刻C、对于锰要求最苛刻D、对于铁要求最苛刻4、下列哪一体系可以自发发生同化反应而产生中间氧化态离子?A、Cu(s) + Cu2+(aq)B、Fe(s) + Fe3+(aq)C、Mn2+(aq) + MnO42-(aq)D、Hg(l) + HgCl2(饱和)5、下列哪一种关于FeCl3在酸性水溶液的说法是不妥的?A、浓度小时可以是水合离子的真溶液B、可以形成以氯为桥基的多聚体C、可以形成暗红色的胶体溶液D、可以形成分子状态的分子溶液。
d区元素的应用原理

D区元素的应用原理1. 什么是D区元素D区元素是指周期表中的第三行(即d区)的元素,也被称为过渡元素。
这些元素具有一些特殊的性质,使其在许多领域中具有广泛的应用。
2. D区元素的特性D区元素有以下几个特性:•较高的熔点和沸点:D区元素通常具有较高的熔点和沸点,这是由于它们之间的金属键相对较强导致的。
•多种氧化态:D区元素可以形成多种不同的氧化态,这是由于其外层d电子的不稳定性决定的。
例如,铁可以形成+2和+3的氧化态,铜可以形成+1和+2的氧化态。
•良好的催化作用:D区元素常常具有良好的催化作用,能够加速化学反应的速度。
这是由于其d电子可以提供额外的反应中心。
•磁性:D区元素通常具有磁性,这是由于其d电子的自旋和轨道角动量相互作用导致的。
铁、镍和钴是常见的具有磁性的D区元素。
3. D区元素的应用D区元素由于其特殊的性质,被广泛应用于各个领域。
以下是D区元素在不同领域中的主要应用:3.1 冶金工业•钢铁生产:铁是冶金工业中最重要的D区元素,它被用于制造钢铁。
由于铁具有较高的熔点和良好的硬度,使得钢铁在建筑、交通、机械等领域得到广泛应用。
•合金制备:D区元素常常与其他金属元素形成合金,以改善金属的性能。
例如,铜和锌形成的黄铜具有良好的可加工性和耐腐蚀性。
3.2 化学催化剂D区元素在化学催化剂中具有广泛应用。
催化剂是能够加速化学反应速率但不参与反应的物质。
以下是几个常见的D区元素催化剂及其应用场景:•铁催化剂:在氨基酸合成、氨合成等反应中广泛应用。
•钯催化剂:用于氢化反应、烯烃的部分氢化等。
•铂催化剂:在有机合成反应中具有广泛应用,如氢化、氧化、加成等。
3.3 电子行业•电池制造:D区元素的氧化态变化使其非常适合作为电池的正负极材料。
例如,锂作为锂离子电池的正极材料,具有高储能密度和较长的循环寿命。
•电子器件制造:D区元素在半导体领域中具有重要应用。
例如,硅是最常用的半导体材料之一,它具有稳定的半导体性能,在电子芯片和光电器件制造中得到广泛应用。
无机化学大连理工第十六章-d区元素(一)-习题解

第十六章 d区元素(一) 习题解1.完成并配平下列反应方程式。
(1)2TiO2+ + Zn + 4H+→2Ti3+ + Zn2+ + 2H2O(2)2Ti3+ + 3CO32- + 3H2O →2Ti(OH)3(s) + 3CO2(g)(3)TiO2 + H2SO4(浓) →TiOSO4 + H2O(4)TiCl4 + 3H2O →H2TiO3(s) + 4HCl(5)TiCl4 + 2Mg →2MgCl2 + Ti(s)2.完成并配平下列反应方程式。
(1)V2O5 + 2Cl- + 6H+→2VO2+ + Cl2(g) + 3H2O(2)2NH4VO3→V2O5 + 2NH3(g) + H2O (加热)(3)2VO2+ + SO32- + 2H+→ 2VO2+ + SO42- + H2O(4)5VO2+ + MnO4- + H2O →5VO2+ + Mn2+ + 2H+3.已知下列电对的标准电极电势:VO2+ + 2H++ e-→VO2+ + H2O φθ = 0.9994VVO2+ + 2H++ e-→V3+ + H2O φθ = 0.337VV3+ + e-→V2+φθ = -0.255VV2+ + 2e-→V φθ = -1.2V在酸性溶液中分别用1mol·L-1Fe2+,1mol·L-1Sn2+和Zn还原1mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?解:查附表六可知:Fe3+ + e-→Fe2+φθ(Fe3+/ Fe2+) = 0.769VSn4+ + 2e-→Sn2+φθ(Sn4+/ Sn2+) = 0.1539VZn2+ + 2e-→Zn φθ(Zn2+/ Zn) = -0.7621V当用1mol·L-1 Fe2+还原1mol·L-1的VO2+时,只能得到VO2+离子;当用1mol·L-1 Sn2+Z 在酸性溶液中还原1mol·L-1的VO2+时,首先被还原为VO2+离子,可继续被被还原为V3+离子。
d区元素一(相关知识

d区元素一(相关知识d区元素是指周期表中4d及5d轨道上的元素,通常也被称作过渡金属。
它们在化学性质上表现出中等电负性、高离子化能、高化合价、易氧化以及形成带有镍白色或银白色的亮泽金属外观等特点。
这些元素的最外层电子组态为ns2(n-1)d,在化学反应中,它们借助着这些d轨道上的电子来提高反应速率、稳定物种的结构以及调节电荷分布。
这些元素在生命过程中扮演着很重要的角色,同时也是一些基础材料和高科技产业的重要组成部分,例如高温合金、电池、合成纤维以及电子器件等。
d区元素从第四周期开始,元素逐渐变得稀有,其中的超过一半元素被定性为稀有金属元素。
这些元素的多项化学性质受到它们的外层d轨道上电子的影响。
这些d轨道上的电子数量众多,容易形成配合物,因此它们具有强的络合能力和催化活性。
另外,d区元素之间的相互作用也属于d-d键,因此它们的反应机理也具有研究价值。
d区元素的原子半径比p区的元素要大,因为它们拥有更多的电子,同时原子序数越大,原子半径也会越来越小。
在同一周期内,d区元素的离子半径比p区元素要小,这是因为它们已经失去了一部分电子,离子半径因此变小。
在化学反应中,d区元素通常会表现出它们的多价性,这是因为d轨道上电子的容易发生氧化还原反应,进而形成不同价态的离子。
在配位化学中,d区元素能够形成大量的稠合配合物,因为它们的d轨道可以用来接受配体的配位键,从而形成稳定的配合物。
d区元素中金属的环境共价能力有时候很强,这也是它们常被用来作为催化剂的主要原因。
例如,在氧化反应中,d区元素可以很容易地释放出氧分子,进而形成氧化物。
在还原反应中,d区元素则可以发生电子传递,将电子传递到其他离子或者分子上。
在这些反应中,p区元素通常没有这样的作用。
从原始形态到纯粹化学物质,d区元素产生了众多的应用。
在纯净状态下,它们被用来制造带有镍白色或银白色的亮泽金属外观,这些金属被广泛应用在制造飞机、汽车和高速列车等交通设施中。
大学无机化学d区元素介绍
3.物理性质
(1) 熔点、沸点高
熔点最高的单质:钨(W)
(2) 硬度大 (3) 密度大
熔点: 3410℃ 沸点: 5900℃
硬度最大的金属:铬(Cr)
以金刚石为10,铬为9
密度最大的单质:锇(Os)
(4) 导电性,导热性,延展性好
22.7gcm-3
4.离子呈现多种颜色
物质显色的原因是由于可见光作用到物质上以后物质
12.2.3(2)钒的化学性质
•价电子层结构3d34s2,主要氧化态+5,也能形成氧化态为 +4,+3,+2的化合物。化学性质相当复杂。
VO2+ 1.0 VO2+ 0.36 V3+
-0.25
-0.25
V2+ -1.2 V
17
12.2.3(3)钒的氧化物(V2O5)
•酸碱性: VO碱O2+ 2C +2Cl2 = TiCl4 +2CO 四氯化钛是无色液体,有剌鼻的气味,极易水解, 在潮湿的空气中由于水解而发烟——利用此反应可 制造烟幕:
•TiCl4高温氧化制备优质钛白——氩气氛保护下得Ti: TiCl4(l) +Mg = Ti +2MgCl2
16
12.2.3(1) 钒
•钒在地壳中的含量比锌、铜、铅等普通元素还要多,但分 布很分散,属稀有元素。 •钒被广泛用于制造特种钢和催化剂。
在钛的化合物中,以+4氧 化态的化合物最稳定。二 氧化钛在自然界中有三种 晶型:金红石、锐钛矿和 板钛矿。其中最重要的是 金红石,天然金红石中因 含少量杂质而呈红色或橙 色。
金红石的结构
13
12.2.1(3) 化学性质
•室温下金属钛较稳定,但受热时,钛可与许多非金属,如: 氧、氮、碳、卤素等反应。 •钛在室温下不能与水或稀酸反应,但可溶于浓盐酸或热的 稀盐中形成三价钛离子:
湖南理工学院无机化学习题库第16章d 区元素(一)

第16章 d 区元素(一)一是非题1.按照酸碱质子理论,[Fe(H2O)5(OH)]2+的共轭酸是[Fe(H2O)6]3+, 其共轭碱是[Fe(H2O)4(OH)2]+。
()2. 由Fe3+能氧化I-,而[Fe(CN)6]3-不能氧化 I-,可知[Fe(CN)6]3-的稳定常熟小于[Fe(CN)6]4-的稳定常数。
()3. 某溶液中共存有NO− , Cr O 2− , K + , Fe3+ , Cl −I 和I-,并无任何反应。
()GAGGAGAGGAFFFFAFAF4. 在[Ti(H2O)6]3+配离子中,Ti3+的d轨道在H2O的影响下发生能级分裂,d 电子可吸收可见光中的绿色光而发生d-d 跃迁,散射出紫红色光。
()5. 在 M n+ +ne ====M 电极反应中,加入M n+的沉淀剂,可使标准电极电势Eθ的代数值增大,同类型的难溶盐的K sp值越小,其Eθ的代数值越大。
()二选择题1. 下列过渡元素中能呈现最高氧化数的化合物是()⑴ Fe⑵ CoGAGGAGAGGAFFFFAFAF⑶ Ni⑷ Mn2. Fe3O4与盐酸作用的产物为()⑴ FeCl3+H2O ⑵ FeCl2+H2O⑶ FeCl3+FeCl2+H2O ⑷ FeCl3+Cl2GAGGAGAGGAFFFFAFAF3. Co3O4与盐酸作用的产物为()⑴ CoCl2+H2O ⑵ CoCl3+CoCl2+H2O ⑶CoCl2+Cl2+H2O ⑷ CoCl3+ H2O4. 欲除去 FeCI3中含有的少量杂质 FeCI2,应加入的物质是()⑴通 CI2⑵KMnO4⑶HNO3⑷ K2C r2O75. 下列哪个溶液中,当加入 NaOH 溶液后,仅有颜色发生变化而无沉淀生成的是()⑴ FeSO4⑵KMnO4⑶GAGGAGAGGAFFFFAFAFNiSO4⑷ K2 Cr2O76. 欲制备Fe2+的标准溶液,应选择的最合适的试剂是()⑴ FeCI2溶于水⑵硫酸亚铁铵溶于水⑶ FeCI3溶液中加铁屑⑷铁屑溶于稀酸7. 用来检验 Fe2+离子的试剂为()GAGGAGAGGAFFFFAFAF⑴ NH4SCN ⑵ K3[Fe(CN)6]⑶ K4[Fe(CN)6]⑷ H2S8. 用来检验 Fe3+离子的试剂为()⑴ KI ⑵NH4SCN ⑶ NaOH⑷ NH3·H2O9. [Co(CN)6]4-与[Co(NH3)6]2+的还原性相比较()⑴ [Co(NH3)6]2+还原性强⑵ [Co(CN)6]4-还原性强GAGGAGAGGAFFFFAFAF⑶两者都强⑷两者都不强10 CoCl3·4NH3用H2SO4溶液处理再结晶, SO 可取代化合物中的 Cl-,但NH3的含量不变,用过量AgNO3处理该化合物溶液,每摩尔可得到1mol的AgCl沉淀这种化合物应该是()⑴ [Co(NH3)4]Cl3⑵ [Co(NH3)4Cl]Cl2⑶ [Co(NH3)4Cl2]Cl⑷ [Co(NH3)4Cl3]GAGGAGAGGAFFFFAFAF11. 由 Cr2O3出发制备铬酸盐应选用的试剂是()⑴浓 HNO3⑵ KOH(s) +KCIO3(s) ⑶CI2⑷H2O212. 下列哪一种元素的氧化数为+ IV 的氧化物,通常是不稳定的()⑴ Ti ( IV ) ⑵V( IV ) ⑶Cr( IV ) ⑷ Mn ( IV ) 13. 镧系收缩的后果之一,是使下列哪些元素的性质相似()GAGGAGAGGAFFFFAFAF⑴ Sc 和 La ⑵Cr 和Mo ⑶ Fe、Co 和Ni ⑷ Nb 和 Ta14. 下列各组元素中最难分离的是()⑴ Li 和 Na ⑵ K 和Ca ⑶ Cu 和Zn ⑷ Zr 和 Hf15. 在酸性介质中,欲使 Mn2+氧化为 MnO4,采用的氧化剂应为()⑴ H2O2⑵王水⑶ K2C r2O7+ H2SO4⑷ NaBiO3GAGGAGAGGAFFFFAFAF16 . 向 FeCl3溶液中加入氨水生成的产物之一是()⑴Fe(NH)⑵Fe(OH)Cl2⑶Fe(OH)2Cl ⑷ Fe(OH)317. 下列物质不能在溶液中大量共存的是()⑴ Fe(CN)和OH-⑵Fe(CN)和I-⑶ Fe(CN)和I-⑷Fe3+和Br18. 下列新制出的沉淀在空气中放置,颜色不发生变化的是()GAGGAGAGGAFFFFAFAF⑴ Mg (OH)2⑵Fe(OH)2⑶Co(OH)2⑷ Ni(OH)219. 下列化合物中与浓盐酸作用没有氯气放出的是()⑴ Pb2O3⑵Fe2O3⑶ C o2O3⑷ Ni2O320. 酸性条件下 H2O2与 Fe2+作用的主要产物是()GAGGAGAGGAFFFFAFAF⑴ Fe, O2 和 H+⑵ Fe3+和H2O ⑶ Fe 和H2O ⑷ Fe3+和O2三填空题1. 在地壳中储量居前十位的元素中属于过渡金属的有2. 向 FeCl3溶液中加入KSCN溶液后,溶液变为色,再加入过量的NH4F溶液后,溶液又变为色,最后滴加NaOH溶液时,又有生成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十六章d区元素(一)[教学要求]1.了解过渡元素的原子结构特征和通性。
2.了解钛、钒及其重要化合物的性质。
3.了解铬单质的性质。
掌握Cr(Ⅲ)、Cr(Ⅵ)化合物的酸碱性、氧化还原性及其相互转化。
*了解钼、钨的重要化合物。
4.掌握Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的性质。
5.掌握Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)重要化合物的性质及其变化规律。
掌握Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)重要化合物的性质及其变化规律。
熟悉铁、钴、镍的重要配合物。
[教学重点]1.过渡元素的价电子构型特点及其与元素通性的关系。
2.Ti、V、Cr、Mn、Fe、Co、Ni的单质及化合物的性质。
[教学难点]第四周期d区金属元素氧化态、最高氧化态氧化物及其水合氧化物的酸碱性、氧化还原稳定性、水合离子以及含氧酸根颜色等变化规律。
[教学时数]10学时[主要内容]1.第一过渡系元素的基本性质。
2.Ti、TiO2、H4TiO4、TiCl4、TiCl3的性质。
3.V、V2O5、钒酸盐和多钒酸盐的性质。
4.Cr的性质,Cr(III)、Cr(VI)化合物的性质。
5.Mn的性质,Mn(II)、Mn(IV)、Mn(VI)、Mn(VII)化合物的性质。
6.Fe、Co、Ni的单质及化合物的性质和用途。
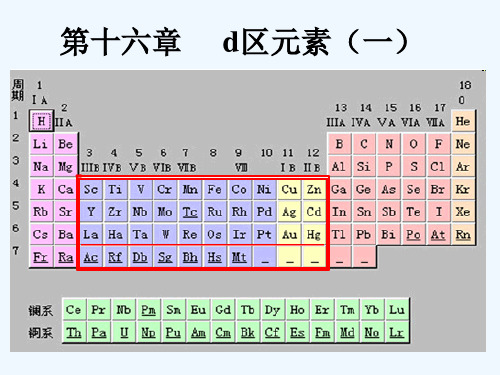
[教学内容]§16.1 d区元素概述16.1.1 d区元素概述1.d区元素在周期表中的位置d区元素(d区金属):周期表中具有部分填充d壳层电子的元素.第一过渡系:周期表中第四周期的d区(3d)元素包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni.第二过渡系:周期表中第五周期的d区(4d)元素包括Zr、Nb、Mo、Tc、Ru、Rh、Pd.第三过渡系:周期表中第六周期的d区(5d)元素包括Hf、Ta、W、Re、Os、Ir、Pt.第四过渡系:周期表中锕(89号)到112号元素。
镧系元素:镧(57号)和镥( 71号)之间的15种元素。
锕系元素:锕(89号)和铹(102号)之间的15种元素。
f区元素:镧系元素和锕系元素的总称(f区金属,内过渡元素.d区元素显示出许多区别于主族元素的性质:a.熔、沸点高,硬度、密度大的金属大都集中在这一区b.不少元素形成有颜色的化合物c.许多元素形成多种氧化态从而导致丰富的氧化还原行为d.形成配合物的能力比较强,包括形成经典的维尔纳配合物和金属有机配合物e.参与工业催化过程和酶催化过程的能力强d 区元素所有这些特征不同程度上与价层d 电子的存在有关,因而有人将d 区元素的化学归结为d 电子的化学.2. d区元素原子的价电子层构型(n-1)d1-10ns1-2(Pd为5s0)3. d区元素的原子半径总趋势: 同周期左→右大→小,第Ⅷ族后增大变化原因:同一周期:r变化受两因素的制约:核电荷数增加,引力增强,r变小;核外电子数增加,斥力增强,r变大;随原子序数的增加原子半径逐渐减小:增加的电子不足以完全屏蔽核电荷;左--右,有效核电荷Z*增加,r变小。
长周期中部(d区)各元素的原子半径随核电苛增加减小缓慢:电子填入(n-1)d层,屏蔽作用大,Z*增加不多,r减小缓慢。
10构型,屏蔽ⅠB,ⅡB(ds区)原子半径略有增大,此后又逐渐减小:d显著, r略有增大。
同一族:主族:从上到下,外层电子构型相同,电子层增加的因素占主导r增加。
副族:第四周期到第五周期r增大,第五周期到第六周期r接近。
例如:4.d区元素的第一电离能总趋势:同周期左→右由小→大,幅度不大。
同副族不规律。
16.1.2 d区元素的物理性质●熔点、沸点高熔点最高的单质:钨(W) 3683±20℃●硬度大硬度最大的金属:铬(Cr) 摩氏9.0●密度大密度最大的单质:锇(Os)●导电性,导热性,延展性好原子化焓集中地反映了单质的物理性质,下表给出d 区金属的原子化焓。
过渡金属的原子化焓一般高于主族金属元素,原子化焓特高的那些元素处于第二、第三过渡系中部,而钨则是所有金属中最高的。
金属钨由于在高温下挥发得极慢而被用作灯丝材料。
Zn,Cd,Hg 明显不同于其他过渡元素,原子化焓接近于碱金属。
Hg 和Na 的蒸气被用于荧光灯(即日光灯)和路灯。
金属元素的原子化焓是金属内部原子结合力强弱的一种标志,较高的原子化焓可能是由于较多的价电子(特别是较多的未成对电子)参与形成金属键.这种结合力似乎也应该反映在过渡元素的上述物理性质上.16.1.3 d区元素的化学性质(1)第一过渡系的单质比第二过渡系的单质活泼;总趋势:同族从上到下活泼性降低。
例:第一过渡系除Cu外均能与稀酸作用,第二、三过渡系仅能溶于王水、氢氟酸,而Ru,Rh,Os,Ir不溶于王水。
(2)与活泼非金属(卤素和氧)直接形成化合物。
(3)与氢形成金属型氢化物如:VH18,TaH0.76,LaNiH5.7 。
(4)与硼、碳、氮形成间充型化合物。
16.1.4 d区元素的氧化态过渡金属元素有可变氧化态,通常有小于它们族数的氧化态。
1. 第一过渡系元素除钪外都可失去4s 2形成+II氧化态阳离子。
2. 由于3d和4s轨道能级相近,因而可失去一个3d 电子形成+III氧化态阳离子。
3. 随着原子序数的增加,氧化态先是逐渐升高,达到与其族数对应的最高氧化态,从Ti到Mn的最高氧化态往往只在氧化物、氟化物或氯化物中遇到,随后出现低氧化态。
4. 同一元素氧化态的变化是连续的。
5. 第一过渡系列后半部的元素(V,Cr,Mn,Fe,Co)能出现零氧化态,它们与不带电的中性分子配位体形成羰基配合物第一过渡系元素的族氧化态和实际达到的最高氧化态如下:●红色为常见的氧化态●同同期自左至右形成族氧化态的能力下降●由图清楚说明了由Sc 至Cu 族氧化态的热力学稳定性趋势16.1.5 d区元素离子的颜色水合离子呈现多种颜色。
过渡元素的水合离子大部分都有一定的颜色,这是因为d电子的跃迁能级一般在可见光的范围(d10, d0结构的离子无色):§16.2 钛钒16.2.1 钛及其化合物1.概述(1)含量并不十分短缺的元素钛虽被列为稀有元素,但在地壳中的丰度仅次于氧、硅、铝、铁、钙、钠、钾、镁、氢而居第10 位,比某些“普通元素”(例如锌、铅、锡、铜)高得多。
与3d 左部其他几种元素一样,钛也是亲氧元素,自然界主要以氧化物或含氧酸盐的形式存在。
最重要的矿物是金红石(TiO2)和钛铁矿(FeTiO3)。
(2)有多种优异性质● d = 4.54g· cm-3,比钢轻43% ●强度大:合金抗拉强度达180kg· mm-2,适应温度宽●耐腐蚀(不怕酸、碱、海水、体液)(3)用途广泛:飞机、潜艇材料, 可增加深度80% 达4500 m 以下;Ni-Ti 记忆合金;人造关节等。
(4)制备:钛的化合物是第一过渡系中最难被还原为金属的化合物。
例如铬、锰、铁的氧化物均可被碳还原,但在电化学法建立之前, 还原钛化合物只能采用价格昂贵的强还原剂(如金属钠和金属镁)。
以金红石为原料制备金属钛时,首先通过氯化法制得四氯化钛,然后在氩气氛中用熔融的金属镁还原制得海绵钛:海绵钛再经真空电弧熔炼得钛锭。
2 .钛的重要化合物钛形成+4,+3 和+2 氧化态化合物,其中以族氧化态化合物最稳定和最常见。
1. 二氧化钛TiO2最重要的钛化合物,自然界以矿物(金红石)形式存在,工业上可用钛铁矿(FeTiO3)为原料制备硫酸分解钛铁矿的反应如下:反应式中含有钛酰离子(TiO2+)的化合物叫硫酸钛酰。
将反应后的溶液冷至5℃使FeSO4以水合晶体形式从体系中分离,含有硫酸钛酰的滤液经浓缩、水蒸气加热水解制得白色的偏钛酸:偏钛酸是TiO2 的水合物(TiO2·H2O), 经过滤、洗涤并在高温下脱水得产物:新制得的热的TiO2粉末呈浅黄色,冷却后呈白色,俗称钛白。
TiO2不溶于水,在强酸和强碱中均可缓慢溶解,分别生成钛酰盐(例如TiOCl2)和偏钛酸盐(例如Na2TiO3)。
TiO2虽然显两性,但仍属化学性质稳定的物质。
用作高级白色颜料时除安全性(无毒)外, 还兼有铅白颜料的遮盖性和锌白颜料的持久性。
此外,钛白还在造纸工业中用作增白剂,在合成纤维工业中用作消光剂。
2. 四氯化钛TiCl4钛的最重要的卤化物,以它为原料可制备一系列钛化合物和金属钛。
常温下TiCl4为无色液体(b.p. 136℃)并具有刺激性臭味。
TiCl4极易水解,暴露在潮湿空气中发白烟。
部分水解生成钛酰氯,完全水解生成偏钛酸:3. 钛酸钡具有钙钛矿型晶体结构的BaTiO3是最重要的电陶瓷材料。
BaTiO3陶瓷主要用作电容器的介电体,全世界陶瓷电容器年产值在20 亿美元以上。
BaCO3 与TiO2通过高温固相反应制备BaTiO3:16.2.1 钒及其化合物1. 概述(1)存在丰度0.45%,含量不少,但分散。
主要有矾钛铁矿,钒酸钾铀矿,钒铅矿。
(2)性质和用途电子构型为(n-1)d3ns2价态有+V、+IV、+III、+II, V、Nb、Ta以+V价最稳定,V的+IV价也较稳定。
物性:高mp. 延展性高,硬度大。
化性:它们的单质容易呈钝态、都溶于硝酸和氢氟酸的混合酸中,钽不溶于王水。
(3)用途:制钒钢,含钒0.1~0.2%的钒钢韧性、弹性好,强度高,2.钒的重要化合物(1)钒的氧化物(2)五氧化二钒V2O5a.酸碱两性b.酸介质中,中等氧化剂c.重要催化剂:(3)钒酸盐和多钒酸盐钒酸盐可分为:偏钒酸盐NaVO3 ;正钒酸盐Na3VO4 ;焦钒酸盐Na4V2O7 ;多钒酸盐Na3V3O9钒的比色测定:在钒酸盐的溶液中加过氧化氢,若溶液是弱碱性、中性或弱酸性时,得黄色的二过氧钒酸离子[VO2(O2)2]3-,此法可用于鉴定钒。
§16.3 铬钼钨多酸型配合物16.3.1 铬、钼、钨的单质铬分族(VIB):Cr, Mo, W, Sg价层电子构型:(n-1)d 4-5n s1-2灰白色金属,熔沸点高,硬度大,表面易形成氧化膜。
室温时纯铬溶于稀HCl,H2SO4,在浓HNO3中钝化。
高温下与活泼的非金属及C,B,N反应。
16.3.2 铬的化合物1.Cr2O3(铬绿)制备:性质:两性2.Cr(OH)33.Cr(III)盐和亚铬酸盐Cr2(SO4)3·6H2O(绿色)、Cr2(SO4)3·18H2O(紫色)、Cr2(SO4)3(桃红色),K2SO4·Cr2(SO4)3·24H2O。
在碱性溶液中,Cr(III)有较强的还原性,能被过氧化氢、过氧化钠、Br2等氧化。
在酸性条件下,三价铬以Cr3+离子形式存在,要使其氧化为六价铬则需强氧化剂。
如KMnO4、HIO4、(NH4)2S2O8等Cr(Ⅲ)形成配合物的能力特强,凡能提供电子对的物种如H2O,CN-,NH3,C2O42-等都可作为配位体。
