无机化学16-d区元素(一) ppt课件
无机分析12第十六章d区元素

Fe2+
浅绿色
Co2+
酒红色
Ni2+
绿色
Cu2+
蓝色
Zn2+
无色
上页 下页 目录 返回
许多二价过渡元素金属离子 M 2+ (aq)的 颜色与d-d 跃迁或 f-f 跃迁有关。这种 跃迁发生在金属离子本身,通常强度都 很弱,不能解释无机颜料的颜色。副篇 介绍了荷移跃迁和价层间跃迁。
第一过渡系金属水合离子的颜色
●熔点、沸点高
同周期元素单质的熔 点,从左到右一般是先逐渐
升高,然后又缓慢下降。在
同一族中,第二过渡系元素 的单质的熔点、沸点大多高 于第一过渡系,而第三过渡 系的熔点、沸点又高于第二 过渡系(第 3 族除外),熔点 最高的单质是钨。 熔点最高的单质: 钨(W) 3683±20℃
上页 下页 目录 返回
(4)
金属元素的电极电势
φθ的单位为V
元素
Ca -2.87 Sc Ti V Cr Mn Fe Co Ni Cu 0.34 Zn -0.76
φθ(M2+/M)
Φθ (M3+/M2+)
- -1.63 -1.18
-0.91 -1.18 -0.44 -0.28 -0.23
-
-
-0.37 -0.256 -0.41 +1.51
d 电子组态 M2+(aq)
d1 d2 Sc2+ Ti2+
d3 d4 V2+ Cr2+
d5 d6 d7 Mn2+ Fe2+ Co2+
d8 d9 d10 Ni2+ Cu2+ Zn2+
稳 定 性 增 大
无机化学完整16-d区元素(一)PPT

K sp (Ag2CrO4) 1.1×1012 K sp (Ag2Cr2O7 )2.0×107
4Ag Cr2O72 H2O 2Ag2CrO4 (s,砖红) 2H
2Ba2 Cr2O72 H2O 2BaCrO4 (s,柠檬黄)2H
2Pb2 Cr2O72 H2O 2PbCrO4 (s,黄) 2H
可 氧 化 物 种SO 32- I- C l- H 2S Fe2+ 产 物 SO 42- I2 C l2 S或 SO 42- Fe3+
Sn2+ Sn4+
溶液的酸度不同,MnO4—被还原的产物不同:
2M 4 53 2 S n 6 O O H 22 M 52 4 S n 3 2 O O H
族族
4(第一 过渡系)
Sc
Ti
V
Cr
Mn
Fe Co Ni
铁系
Cu
Zn
5(第二
Ru Rh Pd
过渡系) Y Zr Nb Mo Tc 轻铂组 Ag Cd
6 (第三 La过渡系) Lu
Hf
Ta
W
Re
Os Ir Pt
重铂组
Au
Hg
7(第四 Ac过渡系) Lr
Rf
Db
Sg
Bh Hs Mt Uun Uuu Uub
6Fe3 2Cr3 7H2O 3Sn 4 2Cr3 7H2O
K 2Cr2O7 (s) 14HCl(浓)
.
3Cl2 2CrCl3 2KCl 7H2O
21
2.铬(Ⅲ)的化合物 (1) Cr2O3的制备与性质 性质:C2rO36H C3r3H 2O
3H 2OC2rO32OHCr(O 4 H)
(n-1)d1-10ns1-2 (Pd为5s0)
无机化学大连理工第十六章-d区元素(一)-习题解

第十六章 d区元素(一) 习题解1.完成并配平下列反应方程式。
(1)2TiO2+ + Zn + 4H+→2Ti3+ + Zn2+ + 2H2O(2)2Ti3+ + 3CO32- + 3H2O →2Ti(OH)3(s) + 3CO2(g)(3)TiO2 + H2SO4(浓) →TiOSO4 + H2O(4)TiCl4 + 3H2O →H2TiO3(s) + 4HCl(5)TiCl4 + 2Mg →2MgCl2 + Ti(s)2.完成并配平下列反应方程式。
(1)V2O5 + 2Cl- + 6H+→2VO2+ + Cl2(g) + 3H2O(2)2NH4VO3→V2O5 + 2NH3(g) + H2O (加热)(3)2VO2+ + SO32- + 2H+→ 2VO2+ + SO42- + H2O(4)5VO2+ + MnO4- + H2O →5VO2+ + Mn2+ + 2H+3.已知下列电对的标准电极电势:VO2+ + 2H++ e-→VO2+ + H2O φθ = 0.9994VVO2+ + 2H++ e-→V3+ + H2O φθ = 0.337VV3+ + e-→V2+φθ = -0.255VV2+ + 2e-→V φθ = -1.2V在酸性溶液中分别用1mol·L-1Fe2+,1mol·L-1Sn2+和Zn还原1mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?解:查附表六可知:Fe3+ + e-→Fe2+φθ(Fe3+/ Fe2+) = 0.769VSn4+ + 2e-→Sn2+φθ(Sn4+/ Sn2+) = 0.1539VZn2+ + 2e-→Zn φθ(Zn2+/ Zn) = -0.7621V当用1mol·L-1 Fe2+还原1mol·L-1的VO2+时,只能得到VO2+离子;当用1mol·L-1 Sn2+Z 在酸性溶液中还原1mol·L-1的VO2+时,首先被还原为VO2+离子,可继续被被还原为V3+离子。
大学无机化学d区元素介绍
3.物理性质
(1) 熔点、沸点高
熔点最高的单质:钨(W)
(2) 硬度大 (3) 密度大
熔点: 3410℃ 沸点: 5900℃
硬度最大的金属:铬(Cr)
以金刚石为10,铬为9
密度最大的单质:锇(Os)
(4) 导电性,导热性,延展性好
22.7gcm-3
4.离子呈现多种颜色
物质显色的原因是由于可见光作用到物质上以后物质
12.2.3(2)钒的化学性质
•价电子层结构3d34s2,主要氧化态+5,也能形成氧化态为 +4,+3,+2的化合物。化学性质相当复杂。
VO2+ 1.0 VO2+ 0.36 V3+
-0.25
-0.25
V2+ -1.2 V
17
12.2.3(3)钒的氧化物(V2O5)
•酸碱性: VO碱O2+ 2C +2Cl2 = TiCl4 +2CO 四氯化钛是无色液体,有剌鼻的气味,极易水解, 在潮湿的空气中由于水解而发烟——利用此反应可 制造烟幕:
•TiCl4高温氧化制备优质钛白——氩气氛保护下得Ti: TiCl4(l) +Mg = Ti +2MgCl2
16
12.2.3(1) 钒
•钒在地壳中的含量比锌、铜、铅等普通元素还要多,但分 布很分散,属稀有元素。 •钒被广泛用于制造特种钢和催化剂。
在钛的化合物中,以+4氧 化态的化合物最稳定。二 氧化钛在自然界中有三种 晶型:金红石、锐钛矿和 板钛矿。其中最重要的是 金红石,天然金红石中因 含少量杂质而呈红色或橙 色。
金红石的结构
13
12.2.1(3) 化学性质
•室温下金属钛较稳定,但受热时,钛可与许多非金属,如: 氧、氮、碳、卤素等反应。 •钛在室温下不能与水或稀酸反应,但可溶于浓盐酸或热的 稀盐中形成三价钛离子:
无机化学课件——第十九章 d区元素

OH
H
(亮绿色)
Cr(OH)
4
H2O Cr2O3 (绿)
19.2.3. 水溶液中离子及其反应
1.Cr(Ⅲ)的盐
Cr(2 SO
4)3,KCr(SO
)
42
12H
2O,
CrCl3
•水解
[Cr(H 2O)6 ]3
[Cr(OH)(H 2O)5 ]2 H
K 104
2Cr3 3S2 6H2O Cr(OH)3(s) 3H2S(g) 2Cr3 3CO32- 3H2O 2Cr(OH)3(s) 3CO2 (g)
2
O
-0.91 Cr
-0.74
EB / V
CrO
2 4
-0.12
Cr(OH)
4
-1.1
Cr(OH) 2
-1.4
Cr
-1.3
•性质 ① 灰白色, 熔点沸点高,硬度大。
② 活泼金属,表面已形成一层氧化膜,活 泼性下降。 ③ 无膜金属与酸的反应
2Cr 2H 2SO4 (浓) Cr(2 SO4)3 3SO2 H2O 在冷、浓硝酸中钝化。
•Cr(Ⅲ)的配合物的多种颜色
[Cr(H2O)6 ]Cl3紫色,[Cr(H2O)5Cl]Cl2 H2O蓝绿色 [Cr(H2O)4Cl2 ]Cl 2H2O绿色
2.Cr2O72-与CrO42-间的转化
•pH值的影响
2CrO
2 4
2H
(黄)
2HCrO
4
Cr2O
2 7
H
2
O
(橙)
pH<2:Cr2O72-为主 pH>6:CrO42-为主
•还原性
酸性条件:E (Cr2O72 / Cr3 ) 1.33V
无机化学课件:第8章 d区、ds区元素

稳定性增大
2 V2+(aq) + 2 H3O+(aq)
2V3+(aq) + H2(g) + 2 H2O(l)
2 Cr2+(aq) + 2 H3O+(aq) Mn2+(aq)
2 Cr3+(aq) + H2(g) + 2 H2O(l)
Ni和Cu(当然还有Zn)的稳定水合离子只能是二价的
3. 同族元素族氧化态稳定性变化趋势
8.1.1 金属单质的物理性质
(1) 原子的价电子层构型 (n-1)d1-10ns1-2
(2) 原子半径和电离能
总趋势: 同周期 左→右 小→大 同副族 不规律
(3) 金属单质的物理性质 ●熔点、沸点高
熔点最高的单质: 钨(W) 3683±20℃
●硬度大 硬度最大的金属:铬(Cr) 摩氏 9.0
d 区金属自左至右族氧化态稳定性下降和低氧 化态稳定上升的趋势可以理解为核电荷逐渐增加, 对价层电子控制能力逐渐加大的结果。
d 电子组态 d1 d2
d3
d4
d5 d6 d7 d8
d9 d10
M2+(aq) Sc2+ Ti2+ V2+ Cr2+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ Zn2+
d区元素显示出许多区别于主族元素的性质
● 熔、沸点高,硬度、密度大的金属大都集中在这一区 ● 不少元素形成有颜色的化合物 ● 许多元素形成多种氧化态从而导致丰富的氧化还原行为 ● 形成配合物的能力比较强,包括形成经典的维尔纳配合物
和金属有机配合物 ● 参与工业催化过程和酶催化过程的能力强
《无机化学》课件
酸碱反应与沉淀反应
总结词
酸碱反应和沉淀反应是无机化学中常见的反应类型,需要掌握其 基本原理和规律。
酸碱反应
理解酸碱质子理论,掌握酸碱反应的规律和特点,如强酸制备弱酸 、水解反应等。
沉淀反应
研究沉淀的形成和溶解,了解沉淀的生成、转化和溶解等基本规律 。
氧化还原反应与配位反应
总结词
01
氧化还原反应和配ቤተ መጻሕፍቲ ባይዱ反应是无机化学中的重要反应类型,需要
酸碱反应与离子平衡
酸碱反应
酸和碱之间的中和反应,生成盐和水 。
酸碱指示剂
离子平衡
溶液中离子间的相互作用和平衡状态 ,如水的电离平衡、沉淀溶解平衡等 。
用于指示溶液酸碱度的指示剂,如酚 酞、甲基橙等。
氧化还原反应与电化学
氧化还原反应
电子转移的反应,包括氧化和还 原两个过程。
原电池
将化学能转化为电能的装置,由 正负极和电解质溶液组成。
存储材料,为新能源技术的发展提供重要的支撑。
无机化学在环保领域的应用
总结词
无机化学在环保领域的应用主要涉及大气、水体和土壤的污染控制与治理,以及废物处理和资源化利用等方面。
详细描述
随着工业化和城市化进程的加速,环境污染问题日益严重。无机化学在环保领域的应用主要涉及大气、水体和土 壤的污染控制与治理,以及废物处理和资源化利用等方面。通过研究无机物质的性质和反应机制,可以开发出高 效、低成本的污染物处理技术和资源化利用方案,为环境保护事业的发展做出重要贡献。
无机化学在生物医学领域的应用
总结词
无机化学在生物医学领域的应用主要涉及药物设计与 合成、生物成像技术和生物医用材料等方面。
详细描述
生物医学领域的发展对于人类的健康和生活质量的提高 具有重要意义。无机化学在生物医学领域的应用主要涉 及药物设计与合成、生物成像技术和生物医用材料等方 面。通过研究无机化合物的生物活性和反应机制,可以 开发出高效、低毒的药物和生物医用材料,为疾病诊断 和治疗提供新的手段和途径。同时,无机化学在生物成 像技术方面也具有广泛的应用前景,如荧光探针、磁共 振成像等,为生物医学研究提供重要的技术支持。
无机化学课件第8章d区元素
(2)其它各族与酸作用:
第一过渡系:E(M2+/M) < 0 V M + 非氧化性酸 → M2+ + H2↑
能与氧化性酸作用, 但 Ti、V“钝化”(致密氧化膜)。
第二、三过渡系
大多数不与非氧化性酸作用,表现出高的化学稳定 性。钌、铑、铌、钽等甚至在常温下不溶于王水。
(3)能与活泼的非金属(如卤素和氧等)直接化合。 例如: 加热条件下
d区
f区
2020/10/28
元素过渡系的划分
第一过渡系 第二过渡系 第三过渡系 第四过渡系
2020/10/28
8-1-2 d区元素单质的性质
1. 物理性质
溶、沸点高;
Tf(W):3410℃
d区元素的熔点
硬度大;
莫氏硬度(Cr):9
密度大;
d(Os):22.59 g/cm3
有金属光泽; 延展性、导电性、导热性好。
[Cr(NH3)6]3+ 黄
向Cr3+的溶液中滴加氨水,先生成Cr(OH)3沉淀,当 氨水过量时沉淀可部分溶解
NH3·H2O
NH3·H2O+NH4+
Cr3+
2020/10/28
Cr(OH) 3
[Cr(NH3)6] 3+
Cr3+在酸性溶液中很稳定,需要过硫酸铵、高锰酸
钾等强氧化剂才能将其氧化,但在碱性溶液中CrO2-却有 较强的还原性:
2020/10/28
(2)含氧酸根离子的颜色
d0和d10构型的过渡金属有色化合物主要发 生电荷跃迁。
MnO4-
(紫色)
CrO42-
(黄色)
VO43-
无机化学(第六版)电子教案——大连理工大学 (16)
-1.18
可溶该金 属的酸
元素
各种酸 热HCl, HF
Fe Co
HNO3, HF,浓 H2SO4
Ni
稀HCl, 稀HCl,
H2SO4
H2SO4 等
Cu Zn
E
M2+/M V
-0.409
-0.282
-0.236
+0.339 -0.762
可溶该金 稀HCl, 缓慢溶
属的酸 H2SO4 解在
等
HCl
等酸中
熔融不分解
不分解
失去结晶水
稀HCl, H2SO4
等
HNO3, 稀HCl,
浓热 H2SO4
H2SO4
等
1. 第一过渡系的单质比第二过渡系的单质 活泼;
例如:第一过渡系除 Cu 外均能与稀酸 作用,第二、三过渡系仅能溶于王水、氢氟 酸,而Ru, Rh, Os, Ir 不溶于王水。 2. 与活泼非金属(卤素和氧)直接形成化合物。 3. 与氢形成金属型氢化物:
钛合金牙托 钛骨头
钛合金瓷牙
2. 钛的化合物 钛的价层电子构型:3d24s2 钛可以形成氧化值为 +4,+3,+2,0,-1
的化合物。氧化值为 +4 的化合物比较稳定, 应用较广。如:TiO2。
二氧化钛在工业上用作白色涂料,更重 要的是二氧化钛可以用来制备钛的其他化合 物。
自然界存在的金红石主要成分是TiO2, 由于含有少量的铁、铌、钽、钒等而呈红色 或黄色。金红石的硬度高,化学稳定性好。
16.3.2 铬的化合物
颜色 熔点/℃
CrO3 (铬酐) 暗红色
K2CrO4
黄色
K2Cr2O7 (红矾) 橙红色
大学无机化学 d区元素介绍
16.3.2 铬的化合物
Cr2O3 (铬绿)
颜色 CrO3 (铬酐) 暗红色
熔点/℃ 受热时的变化 198 250℃分解为 Cr2O3与O2 熔融不分解 熔融不分解 不分解 失去结晶水 失去结晶水
K2CrO4
K2Cr2O7 (红矾) Cr2O3 (铬绿) CrCl3· 2O 6H
黄色
橙红色 绿色 紫色
Ac, (104-112,人工合成元素)
57-71
89-103
2
第十六章
d区元素(一)
§16.1 d区元素概述
§16.2 钛 钒
§16.3 铬 钼 钨 多酸型配合物 §16.4 锰
§16.5 铁 钴 镍
§16.1 d区元素概述
16.1.1 d区元素通性
1.原子的价电子层构型:
(n-1)d1-10ns1-2
•常温下,Cr, Mo, W表面因形成致密的氧化膜而降低了化学 活性,在空气中或水中都相当稳定。
21
16.3.1 铬、钼、钨的单质
铬分族(VIB):Cr, Mo, W 价电子构型:(n-1)d 4-5ns1-2 灰白色金属,熔沸点高,硬度大。 表面易形成氧化膜。 室温时纯铬溶于稀HCl,H2SO4,在浓 HNO3中钝化。高温下与活泼的非金属及 C,B,N反应。
(4) Cr(Ⅲ)的还原性与氧化性
酸性条件:E (Cr2 O / Cr ) = 1.33V 2Cr 3S2O 7 H 2 O
24
4 27 3
3
28
Ag
2Cr2O 7 SO 2 14H 4
E (CrO / Cr(OH)-4 ) = -0.12V 碱性条件: 3H 2 O 2 2OH 2Cr(OH)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ppt课件
15
16.3.1 铬、钼、钨的单质
铬分族(VIB):Cr, Mo, W, Sg 价层电子构型:(n-1)d 4-5ns1-2
灰白色金属,熔沸点高,硬度大。 表面易形成氧化膜。
室温时纯铬溶于稀HCl,H2SO4,在浓 HNO3中钝化。高温下与活泼的非金属及 C,B,N反应。
氢氟酸,而Ru,Rh,Os,Ir不溶于王水。 2. 与活泼非金属(卤素和氧)直接形成化合物。 3. 与氢形成金属型氢化物:
如:VH18,TaH0.76,LaNiH5.7 。 4. 与硼、碳、氮形成间充型化合物。
ppt课件
11
E (Ni2+/Ni) =-0.2363V
E (Pd2+/Pd) = +0.92V E (Pt2+/Pt) = +1.2V(估计值)
4
2. d区元素原子的价电子层构型
(n-1)d1-10ns1-2 (Pd为5s0)
ppt课件
5
3. d区元素的3原. 同六子族周半元期径素(除从Ⅲ上B往)外下由原于子镧半系径收增缩大使,其但同五、
Cs 250 Rb
过族 性渡元质元素相素原似的子。半原径子十半分接径近,导致其元素
原子半径/pm
K 200
ppt课件
2
§16.1 d区元素概述
16.1.1 d区元素的原子半径和 电离能
16.1.2 d区元素的物理性质 16.1.3 d区元素的化学性质 16.1.4 d区元素的氧化态 16.1.5 d区元素离子的颜色
ppt课件
3
16.1.1 d区元素的原子半径和电离能
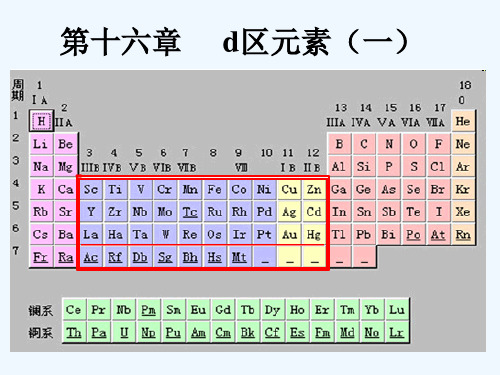
1.d区元素在周期表中的位置
ppt课件
第十六章 d区元素(一)
§16.1 d区元素概述
§16.2 钛 钒 §16.3 铬 钼 钨 多酸型配合物
§16.4 锰
§16.5 铁 钴 镍
*§16.6 铂系元素简介
*§16.7 金属有机化合物
ppt课件
1
族 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠBⅡB
周
钪 钛钒铬 锰 分 分分分 分
铜锌 分分
期 族族族族族
ppt课件
16
16.3.2 铬的化合物
水溶液中铬的各种离子
Cr2+(aq)
颜色 存在的pH
Cr2O
27
橙红
CrO
24
黄
Cr3+(aq) 紫
<2 >6 酸性
Cr(OH)
4
亮绿
Cr2+(aq) 蓝 ppt课件
强碱 酸性
Cr3+(aq)
17
• 铬元素的电势图
EA
/V
Cr
2
O
2 7
1.33
Cr 3 -0.41 Cr 2 -0.91 Cr
ppt课件
9
16.1.3 d区元素的化学性质
元素
M2/M
EV
可
Sc ---
各种酸
Fe -0.409 稀 HCl H2SO4
等
Ti
-1.63
热 HCl HF Co
-0.282 缓慢溶解 在 HCl 等
酸中
V -1.2 (估算值) HNO3, HF 浓 H2SO4 Ni
注:红色为常见的氧化态。
ppt课件
13
16.1.5 d区元素离子的颜色
Mn (Ⅱ) Fe(Ⅱ) Co(Ⅱ) Ni(Ⅱ) Fe(Ⅲ)
水合离子呈现多种颜色。
ppt课件
Cu(Ⅱ)
14
§16.3 铬 钼 钨 多酸型配合物
16.3.1 铬、钼、钨的单质 16.3.2 铬的化合物 *16.3.3 钼、钨的化合物 *16.3.4 多酸型配合物
2H
(黄)
2HCrO
4
Cr2O72 H2O (橙)
pH<2:Cr2O72-为主,pH>6:CrO42-为主。
-0.236
稀 HCl H2SO4 等
Cr -0.90
稀 HCl H2SO4
Cu +0.339
HNO3,浓 热 H2SO4
Mn
-1.18
稀 HCl H2SO4
等 Zn
-0.762
稀 HCl H2SO4
等
ppt课件
10
1. 第一过渡系的单质比第二过渡系的单质 活泼;
例:第一过渡系除Cu外均能与稀酸作用, 第二、三过渡系仅能溶于王水、
(3) Cr(Ⅵ) 含氧酸及其离子在溶液中的转化
•H2Cr2O7, H2CrO4均为强酸,仅存在于稀溶液
HCr 2O7
H
Cr2O
2 7
Ka2 0.85
H2CrO 4
H
HCrO
4
Ka1 9.55
HCrO
4
H
CrO
2 4
•pH的影响
Ka2 3.2×107
2CrO
2 4
族族
4(第一 过渡系)
Sc
Ti
V
Cr
Mn
Fe Co Ni
铁系
Cu
Zn
5(第二 过渡系)
Y
Ru Rh Pd Zr Nb Mo Tc 轻铂组 Ag Cd
6 (第三 La过渡系) Lu
Hf
Ta
W
Re
Os Ir Pt
重铂组
Au
Hg
7(第四 Ac过渡系) Lr
Rf
Db
Sg
Bh Hs Mt Uun Uuu Uub
150
2. 同一周期元素从左到右原子半径缓慢
Ba Sr
减小,到铜族元素又稍增第大一。过渡系
第二过渡系
Ca
1. 过渡元素原子半径第一三般过比渡系
Y
较小。
Lu
Zr
Hg
Sc Hf Ti
Ta
Nb
W Re Os
Ir
Au
Cd
Pd
Ag
V
Mo Tc Ru Rh Pt Cr Mn Fe Co Ni Cu
Zn
100
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ Ⅷ Ⅷ ⅠB ⅡB
E Zn2/Zn 0.762 V E Cd 2/Cd 0.402 V E Hg 2/Hg 0.852 V
总趋势:从上到下活泼性降低。
ppt课件
12
16.1.4 d区元素的氧化态
多种氧化态。例如:Mn的氧化态呈连续状,
Mn(CO)5Cl(+1),Mn(CO)5,NaMn(CO)5(-1)。
族 ppt课件
6
4.d区元素的第一电离能
总趋势:同周期 左右由小大,幅度不大。
同副族 不规律。
ppt课件
7
16.1.2 d区元素的物理性质
•熔点、沸点高 熔点最高的单质:钨(W)
•硬度大
硬度最大的金属:铬(Cr)
•密度大
密度最大的单质:锇(Os)
•导电性,导热性,延展性好。
ppt课件
8
熔 点 变 化 示 意 图
-0.74
EB
/
V
CrO
2 4
-0.12
Cr(OH)
4
-1.1
Cr(OH) 2
-1.4
Cr
-1.3
酸Cr性O24溶无液氧中化,性Cr2O
2 7
有强氧化性碱性溶液中,
酸性溶液中, Cr3+稳定
碱性溶液中, [Cr(OH)4]-有还原性
无论酸性或碱性溶液,Cr(Ⅱ)均不稳定
ppt课件
18
1.铬(Ⅵ)的化合物
