物化部分思维导图及总结教学内容
物理化学上热力学第一定律知识框架图总结
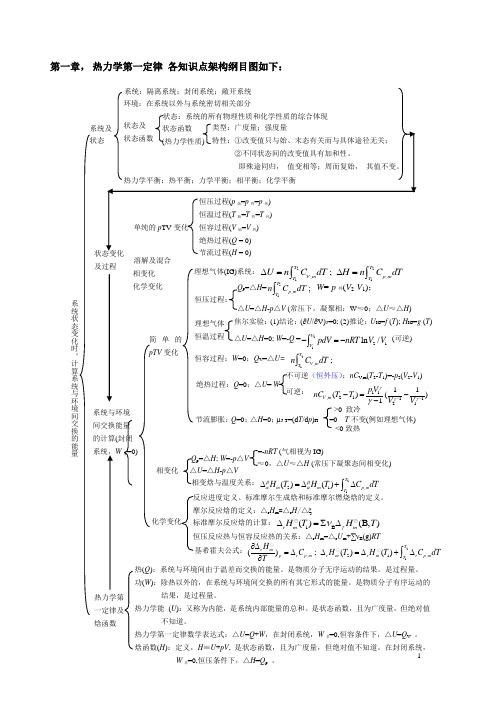
1第一章, 热力学第一定律 各知识点架构纲目图如下:及过程 溶解及混合 化学变化 相变化 热(Q ):系统与环境间由于温差而交换的能量。
是物质分子无序运动的结果。
是过程量。
功(W ):除热以外的,在系统与环境间交换的所有其它形式的能量。
是物质分子有序运动的结果,是过程量。
热力学能 (U ):又称为内能,是系统内部能量的总和。
是状态函数,且为广度量,但绝对值不知道。
热力学第一定律数学表达式:△U =Q +W ,在封闭系统,W 非=0,恒容条件下,△U =Q V 。
焓函数(H ):定义,H ≡U +pV , 是状态函数,且为广度量,但绝对值不知道。
在封闭系统,W 非=0,恒压条件下,△H =Q p 。
热力学第一定律及 焓函数系统与环境间交换能量 的计算(封闭 系统,W 非=0)简单的pTV 变化 理想气体(IG)系统:2211,,;T TV m p mT T U n C dT H n C dT ∆=∆=⎰⎰ 理想气体 恒温过程 焦尔实验:(1)结论:(∂U /∂V)T =0; (2)推论:U IG =f (T ); H IG =g (T ) △U =△H =0; W =-Q =2121ln /VVpdV nRT V V -=-⎰ (可逆)恒容过程:W =0;Q V =△U= 21,;TV mT n C dT ⎰绝热过程:Q =0;△U = W 不可逆(恒外压):nC V ,m (T 2-T 1)=-p 2(V 2-V 1) 可逆: 11,21112111()()1V m p V nC T T V V γγγγ---=-- Q p =△H =21,;T p m T n C dT ⎰W =-p 外(V 2-V 1); △U =△H -p △V (常压下,凝聚相:W ≈0;△U ≈△H )恒压过程: 节流膨胀:Q =0;△H =0;μJ-T =(d T /d p )H =0 T 不变(例如理想气体) <0致热 >0 致冷 相变化 △U =△H -p △VQ p =△H ; W =-p △V≈0,△U ≈△H (常压下凝聚态间相变化)=-nRT (气相视为IG) 相变焓与温度关系:2121,()()Tm m p mT H T H T C dT ββαα∆=∆+∆⎰化学变化 摩尔反应焓的定义:△r H m =△r H /△ξ 恒压反应热与恒容反应热的关系:△r H m =△r U m +∑νB (g)RT标准摩尔反应焓的计算:1B ()(B,)r m f mH T H T ν∆=∑∆反应进度定义、标准摩尔生成焓和标准摩尔燃烧焓的定义。
高一化学思维导图归纳总结

高一化学思维导图归纳总结化学作为一门自然科学,研究了物质的组成、性质、结构、转化以及与能量的关系。
在高中化学的学习中,形成思维导图可以帮助学生将知识点归纳总结,并提高对知识点之间的联系和脉络的把握。
本文将从无机化学、有机化学和化学实验三个方面,对高一化学的思维导图归纳总结进行探讨。
一、无机化学思维导图归纳总结1. 元素的分类思维导图中可以将元素分为金属、非金属和过渡金属三大类,然后再进一步归纳每一类元素的特性和周期表中的排列规律。
2. 化学键的形成化学键的形成包括离子键、共价键和金属键。
我们可以用思维导图将这三种化学键的特点、形成过程以及应用进行总结。
3. 化学反应化学反应可以分为氧化还原反应、酸碱中和反应、置换反应、分解反应等。
可以用思维导图将每种反应的条件、实例以及反应方程式归纳总结起来。
4. 高一无机化学实验总结通过实验,我们可以更好地理解无机化学的知识点。
思维导图可以帮助我们将实验的目的、步骤、结果以及实验操作技巧进行归纳总结。
二、有机化学思维导图归纳总结1. 有机化合物的命名有机化合物的命名包括根据官能团进行命名、以及根据碳链进行命名等。
思维导图可以将不同的命名规则、常见的官能团和碳链进行整理和总结。
2. 有机化合物的反应有机化合物的反应种类繁多,可以归纳总结为取代反应、加成反应、消除反应等。
思维导图可以将每种反应的条件、实例以及反应机理进行细致的归纳总结。
3. 高一有机化学实验总结有机化学实验可以加深对有机化合物的理解,帮助学生掌握有机化学的基本操作技巧。
思维导图可以将实验的目的、步骤、结果以及实验注意事项进行总结归纳。
三、化学实验思维导图归纳总结1. 化学实验常用仪器和玻璃器皿思维导图可以将实验中常用的仪器和玻璃器皿进行分类和整理,包括容量瓶、烧杯、试管、滴定管等,并记录其使用方法和注意事项。
2. 化学实验中的操作技巧化学实验过程中常用的操作技巧包括称量、加热、过滤、取样等。
思维导图可以将每种操作技巧的步骤和注意事项进行清晰的归纳总结。
九年级化学知识点归纳 思维导图

九年级化学知识点归纳思维导图化学作为一门自然科学,研究的是物质的组成、性质以及它们之间的变化。
在九年级学习化学的过程中,我们接触到了许多重要的知识点。
为了更好地理解和记忆这些知识,我们可以使用思维导图的方法整理归纳,将复杂的概念和关系以图形化的方式呈现,提升学习效果。
以下是九年级化学知识点的思维导图。
1. 物质的分类- 纯物质和混合物- 纯物质:由同一种组分构成,具有一定的固定化学组成和独特的性质。
分为元素和化合物。
- 元素:由相同类型的原子组成,不能分解为其他物质。
- 化合物:由两种以上不同类型的原子按照一定比例结合而成,可以分解为其他物质。
- 混合物:由两种或两种以上的物质按照一定比例混合而成,可以根据混合的均匀程度分为均质混合物和非均质混合物。
2. 常见物质的性质和变化- 物质的性质:可以分为物理性质和化学性质。
- 物理性质:物质在不改变化学组成的情况下表现出来的性质,如颜色、硬度、熔点、沸点等。
- 化学性质:物质在发生化学反应时表现出来的性质,如燃烧性、氧化性等。
- 物质的变化:可以分为物理变化和化学变化。
- 物理变化:物质在不改变化学组成的情况下改变外观或状态的变化,如溶解、凝固、融化等。
- 化学变化:物质在与其他物质发生反应时改变化学组成和性质的变化,如燃烧、酸碱中和等。
3. 原子和分子- 原子:是物质的基本粒子,由质子、中子和电子组成。
- 质子:带有正电荷的基本粒子,质量约为1个原子质量单位。
- 中子:不带电荷的基本粒子,质量约为1个原子质量单位。
- 电子:带有负电荷的基本粒子,质量很轻,约为1/1836个原子质量单位。
- 分子:是原子的组合形式,是能保持化学性质的最小粒子。
4. 元素周期表- 元素周期表:是按照原子序数的大小和元素性质进行排列的表格。
元素周期表按照一定的规律分为周期和族。
- 周期:是指元素周期表中横向的行,代表了元素的原子轨道。
周期越往下,电子层越多。
- 族:是指元素周期表中纵向的列,代表了元素的化学性质。
物理化学相平衡思维导图

物理化学相平衡思维导图物理化学相平衡是这一领域研究的重要组成部分,是一种重要的热力学过程。
它是指在物理和化学系统中,能量的流动是平衡的,使系统处于一种动态的稳定状态。
这种相平衡的状态意味着,尽管物质不断在系统中流动,但物质的总量保持不变。
物理化学相平衡的概念可以追溯到19世纪末,当时的物理学家和化学家开始探讨这一概念。
他们发现,当物质在反应中发生变化时,能量是平衡的,而不是损失或获得。
这一发现为其他科学领域,如热力学、动力学和化学反应等,奠定了基础。
思维导图可以帮助我们更好地理解物理化学相平衡的概念。
思维导图中,物理化学相平衡的概念由三个主要元素组成,即热力学、动力学和化学反应。
这三个元素相互联系,形成一个完整的系统,使物质能够在反应中相互平衡。
从热力学角度,物理化学相平衡指的是热量在反应中的平衡。
热量通过反应中的物质来流动,当热量流动量变化时,物质也会发生变化。
这意味着反应一旦发生,热量流动量就会自动平衡,使反应处于稳定状态。
从动力学角度,物理化学相平衡是指物质在反应过程中的流动量。
物质的流动量受到热量的影响,当热量发生变化时,物质的流动量也会发生变化。
当物质的流动量变化得太快时,热量就会受到影响,从而使系统处于不稳定的状态。
最后,从化学反应的角度,物理化学相平衡指的是化学反应发生时,物质的总量。
当反应发生时,物质的总量会发生变化,但是最终会通过热量和动力学的作用使物质的总量保持不变,使系统处于一种稳定的状态。
从上面我们可以看出,物理化学相平衡是一种复杂的热力学过程,它由热力学、动力学和化学反应三者组成。
它涉及到物质的流动、能量的流动和物质的总量等,是一个复杂的动态系统。
物理化学相平衡的概念不仅在热力学中具有重要意义,而且在其他科学领域也有重要的意义。
高一化学知识点小思维导图

高一化学知识点小思维导图化学是一门重要的科学学科,它研究的是物质的组成、性质和变化规律。
作为高中学科之一,化学的学习内容较为丰富。
为了帮助同学们整理化学知识,下面给出高一化学知识点的小思维导图。
一、化学基础知识1. 原子结构- 原子的构成部分:质子、中子、电子- 原子核的电荷和质量- 原子序数和质量数的概念2. 元素与化合物- 元素的定义和分类- 化合物的定义和分类- 元素符号和化学式的表示方法3. 化学方程式- 反应物和生成物的表示方法- 平衡化学方程式的写法和原则二、物质的组成与性质1. 离子与离子化合物- 离子的概念和特征- 阴离子和阳离子的命名和表示方法- 离子化合物的性质和应用2. 原子与共价化合物- 共价键的形成和特点- 共价化合物的性质和应用- 共价键中的单键、双键和三键3. 元素周期表- 周期表的组成和排列规律- 元素周期表的应用- 周期表中的主族元素和过渡元素三、化学反应与能量变化1. 化学反应类型- 合成反应、分解反应、置换反应等- 氧化还原反应的特点和应用- 酸碱中和反应的特点和应用2. 速率与平衡- 反应速率的影响因素和示意图- 动态平衡的定义和条件- 浓度、温度、催化剂对平衡的影响3. 热化学- 热力学第一定律的表达式和应用- 反应焓的计算方法和热化学方程式- 热化学中的放热反应和吸热反应四、溶液与离子反应1. 溶液的浓度- 溶液浓度的表示方法- 溶液稀释计算和浓度的定义- 溶液浓度与物质的相互关系2. 酸碱溶液与中和反应- 酸碱的定义和性质- pH值的计算方法和酸碱指示剂- 中和反应和盐的生成3. 氧化还原反应- 氧化还原反应的特征和分类- 氧化剂和还原剂的定义和示例- 氧化还原反应的应用和实验方法这是高一化学知识点的小思维导图。
通过整理和归纳这些知识点,同学们可以更好地理解化学的基本概念和原理。
希望这个导图能为同学们的学习提供一些帮助,让化学学习更加简洁明了。
最后,祝愿同学们在化学学习中取得优异成绩!。
化学必修一思维导图

化学必修一思维导图一、物质及其变化1. 物质的结构原子结构:由原子核和核外电子组成,原子核由质子和中子组成。
分子结构:由原子通过化学键连接而成。
晶体结构:由原子、分子或离子按照一定的规律排列而成。
2. 物质的分类纯净物:由同种元素或化合物组成,具有固定的组成和性质。
3. 物质的性质物理性质:不涉及物质组成和结构变化的性质,如颜色、状态、密度等。
化学性质:涉及物质组成和结构变化的性质,如可燃性、氧化性等。
二、化学键与化学反应1. 化学键离子键:由正负离子之间的静电作用力形成。
共价键:由原子间共享电子对形成。
金属键:由金属原子间的自由电子云形成。
2. 化学反应化学反应类型:合成反应、分解反应、置换反应、复分解反应等。
化学反应条件:温度、压力、催化剂等。
化学反应速率:反应物浓度、温度、催化剂等。
三、元素周期表1. 元素周期律元素周期表按照原子序数排列,具有周期性变化的规律。
元素周期表中,同一周期的元素具有相似的化学性质,同一族的元素具有相似的物理性质。
2. 元素周期表的应用元素周期表可以用于预测元素的化学性质和物理性质。
元素周期表可以用于解释元素的电子结构和化学键的形成。
四、化学计量学1. 物质的量物质的量:表示物质中含有的基本粒子数,单位为摩尔。
摩尔质量:表示1摩尔物质的质量,单位为克/摩尔。
2. 化学反应的计量关系化学方程式:表示化学反应的物质及其量的关系。
化学方程式的平衡:反应物和物的物质的量保持一定的比例。
3. 化学反应的热力学焓变:表示化学反应中能量的变化,单位为焦耳。
反应热:表示化学反应中吸收或释放的热量,单位为焦耳。
五、溶液与胶体1. 溶液溶液的定义:由溶质和溶剂组成的均匀混合物。
溶液的浓度:表示溶液中溶质的含量,单位为摩尔/升。
2. 胶体胶体的定义:由分散相和分散介质组成的混合物,分散相粒子的大小介于分子和宏观粒子之间。
胶体的性质:具有丁达尔效应、布朗运动等特性。
六、酸碱反应1. 酸碱理论酸碱质子理论:酸是质子(H+)的供体,碱是质子的受体。
初中化学思维导图(精讲版)
第一单元走进化学世界a 学研究的领域:①制造新物质②合成新药物③开发新能源④防止环境污染。
「物理变化:没有生成其他物质的变化。
如:水的沸腾、汽物质的1油挥发、铁水铸成锅、湿衣服晾干。
变化]化学变化:生成其他物质的变化。
如:燃烧反应、铁生、锈、酒的酿制、食物腐败。
'物理性质:物质不需要发生化学变化就表现出来的性质。
如: 物质的 <色、态、味、沸点、熔点、硬度、密度、导电性、导热性。
性京 I 化学性质:物质在化学变化中表现出来的性质。
如:可燃【性、助燃性、氧化性、还原性、酸碱性、稳定性、毒性。
保存:广口瓶固体,取用:药匙、纸槽(粉末状)<一斜二送三直立〉 镶子(块状、金属颗粒)<一横二放三直立)〃保存:细口瓶取用:量多f 倾倒(瓶塞、瓶口、标签)量少一►胶头(垂直、悬空、不能横放或倒置) 定量一量简(平视)7吏用方法:火柴点燃,外焰加热。
注意事项:绝对禁止向燃着的酒精灯里添加酒精, 以免失火;绝对禁止用酒精灯引燃另一只酒精灯; 、用完酒精灯后,必须用灯帽盖灭,不可用嘴吹。
可直接加热的:试管、蒸发皿、燃烧匙 可间接加热的:烧杯、烧瓶方法:保持试管干燥,先预热再用酒精灯的外焰均 匀加热,试管口不可对着人。
液体体积不超过试管<容积的1/3o仪器干净的标准:玻璃仪器内壁附着的水既不聚成水滴,也不成股 、流下。
物质的 变化和《 性质走进化学世界化学是 一门以 实验为《 基础的 科学蜡烛燃 烧的探< 究’点燃前:白色固体,略有气味,质软,不溶于水,密度 不水小。
燃着时:石蜡熔化并发光发热,火焰分三层:外焰、内 焰、焰心,外层最明亮,里层最暗,火柒从中间到两端 逐渐变黑,烧杯内壁出现水珠,石灰水变浑浊。
I 熄灭后:产生白烟,用火柴点燃白烟,蜡烛重新被点燃。
人体呼出气体的探究:与空气中的气体相比,人体呼出的气体中含 有较多的二氧化碳和水蒸气,较少的氧气。
药品的取用规则(三不准原则、节约原则、处理原则、保护原贝D化学实 验的基 以操作仪器]给物质J 加热第二单元我们周囹的空军物理性质:无色无味的气体,密度比空气大,不易溶于水。
《物理化学》读书笔记思维导图
参考文献
谢谢观看
4
第四节 乳状液
5
习题
物理化学实训
实训一 基本知识的 准备
实训二 常用仪器操 作技能训练
实训三 基础实训 实训四 设计性实训
附录
1
附录一 某些气 体范德华常数
2
附录二 某些物 质的临界参数
3 附录三
25.0℃时物质 的标准热力学 数据
4 附录四 某些有
机化合物的标 准摩尔燃烧焓
5 附录五 25℃
绪论
一、物理化学 1
课程性质和地 位
2
二、物理化学 的研究内容
3
三、物理化学 的研究方法
4
四、物理化学 的建立与发展
5
五、物理化学 的学习要求
第一章 气体状态方程
1
第一节 理想气 体
2
第二节 混合气 体分压定律
3
第三节 混合气 体分体积定律
4 第四节 范德华
方程与压缩因 子
5
习题
第二章 热力学第一定律
第二节 温度对化学 平衡的影响
第三节 其他因素对 理想气体反应平衡的 影响
习题
第五章 物质分离提纯基础
1
第一节 相律
2
第二节 单组分 体系的相图
3 第三节 双组分
体系气-液平衡 相图
4
第四节 双组分 凝聚体系相图
5
习题
第六章 电化学基础
第一节 电解质溶液 第二节 原电池
第三节 电解与极化 习题
06
第五章 物质分离提纯 基础
目录
07 第六章 电化学基础
08 第七章 动力学基础
09
第八章 表面现象与胶 体
20张思维导图详解初中物理所有知识点,超实用,学霸们都在学!
20张思维导图详解初中物理所有知识点,超实用,学霸们都在
学!
近来,总是听到家长们这样说:'初中物理难,知识点多,孩子怎么也学不好'或者“孩子也很努力的学习物理,但成绩就是提不起来”。
为了让同学们更好的掌握物理知识,小编找到了名校物理老师做的一份思维导图,对于孩子们建立自己的框架体系非常有帮助。
用思维导图复习,查漏补缺,考试做题的时候也能游刃有余。
老师和家长们看到的话,快替孩子们存下来吧。
1、声现象
2、光现象
3、透镜及其应用
4、物态变化
5、电流和电路
6、电压和电阻
7、欧姆定律
8、电功率(一)——电能与电功率
9、电功率(二)——电热与安全用电
10、电与磁
11、信息的传递
12、多彩的物质世界
13、运动和力
14、力和机械(一)——常见的力
15、力和机械(一)——简单机械
16、压强和浮力(一)——压强
17、压强和浮力(二)——浮力
18、功和机械能
19、热和能
20、能源与可持续发展
可以先收藏起来,勤奋的同学最好手写整理到笔记本上,“纸上得来终觉浅,绝知此事要躬行”,自己画一遍,写一遍,印象会更深刻哦。
加油!。
完整版生物化学思维导图
体会:生物大分子是生物信息的载体(携带、体现、传递、表达);有序性是信息载体的基础;链的长短、数组成:元素组成特点、构件分子组成特点(可修饰性)目、缠绕方式等是信息携带量的基础。
结构:一级结构、空间结构、作用力(共价与非共价)、静态生物化学糖类、脂类、蛋白质、核酸主干链的单调重复性、支链的多变性、异构与构象、结构的主次性。
(生物大分子结构与功能)(酶、维生素、激素)性质:物理、化学、生物学功能:生物学功能的主次性物质代谢:细胞定位、关键酶、代谢物、反应特点、调节。
体会:各代谢途径的意义、生理功能。
合成代谢:从头合成、半合成(补救合成)分解代谢:水解、磷酸解、硫解、焦磷酸解生动态生物化学糖代谢、脂类代谢、氨基酸物化(物质代谢与调节)代谢、核苷酸代谢学能量代谢(能量变化)放能反应、吸能反应(偶联)核酸、蛋白质生物合成的定义、体系(模板、体会:基因表达的内容、调控及意义。
酶、原料、辅助因子)、方向、方式、特点、程(起始、延长。
终止)、加工修饰复制、转录、翻基础分子生物学基因表达的调控、操纵子模式(概念、结构、调合成、蛋白质合成)DNA合成、RNA((基因的表达与调控)控方式)。
生物化学课程体系1 思维导图)、直链及环状结构的书写方式α、βL重要单糖结构:构型(D、、物理性质:旋光性(比旋光度)、变旋性单糖化学性质:还原性、氧化性、成脎、成苷、成酯、颜色反应、鉴定等衍生物:磷酸糖、氨基糖、糖醇、糖苷、脱氧糖等糖重要双糖结构:单糖种类、构型、序列、糖苷键寡糖类重要双糖性质:旋光性、氧化还原性、分析鉴定化学重要多糖组成特点:二糖单位、方向性、糖苷键、分支多糖糖胺聚糖:类型、组成、功能肽聚糖:组成、功能复合多糖糖蛋白:组成、功蛋白聚糖:组成、功2 思维导糖类化学知识体系思维导图3 糖蛋白与蛋白聚糖中性脂结构、性质、生物学功能脂肪酸:结构特点、命名、性质,如碳链的长度、饱和度、空间结构、溶解度、熔点等中性脂油脂:结构特点、性质,如乳化现象、皂化作用、卤化作用、酸败等常见甘油磷脂及生物学功能脂磷脂组成单位、化学键、解离情况类化固醇组成特点、衍生物、功能学分类、组成特点、功能脂蛋白结构:由脂质双分子层、蛋白质镶嵌而成,脂质是骨架,决定膜的流动性、排列方式生物膜生物学功能:蛋白质决定生物膜的生物学功能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
m
def
Vm
c
电池常数 Kcell
l A
电导率、摩尔电导率与浓度的关系
(1)强电解质溶液的电导率随着浓度的增加而升高。弱电解质溶液电导率随浓度变化不
显著,
(2)摩尔电导率均随浓度的升高而降低
强电解质的 Kohlrausch 经验式: m m (1 c) 可用外推法求强电解质的 无限稀释摩尔电导率(弱电解质不适用) 5、离子独立移动定律(强、弱电解质无限稀释溶液均适用)
H+ (a+ )|Ag2O(s)|Ag(s)
A g2 O + 2+ Ha +( )- +2作 作e正 负 极 极
2 A 2g ( s ) + H O
(3)第三类电极及其反应
Fe3+(a1), Fe2+(a2)|Pt Fe3+(a1)+Cu+(a2)|Pt Cu2+(a1)+e- →Cu+(a2)
O2 (g)+4H+ (a+ )+4e- 作 作正 负 极 极2H2O Cl2(g)+2e- 作 作正 负 极 极2Cl-(a)
Cl-(a )|AgCl(s)|Ag(s) AgCl(s)+e- 作 作正 负极 极 Ag(s)+Cl-(a )
OH-(a )|Ag2O|Ag(s)
Ag2O(s)+H2O+2 e- 作 作正 负极 极 2Ag(s)+2OH-(a )
m
m,
m,
推论:弱电解质的无限稀释摩尔电导率可由强电解质的
无限稀释摩尔电导率求得)
6、平均活度和平均活度因子
aB aa a
平均活度: a def (aa )1 =+
离子平均活度因子; def ( )1
lg A | z z | I
离子平均质量摩尔浓度: m def (mm )1
a
第八章 电解质溶液
1、电化学的基本概念
装置
电极
电势高低 电极反应 电极确定
原电池 负极(阳极) 低
氧化反应 易失电子
正极(阴极) 高
还原反应 易得电子
电解池 阴极(负极) 低
还原反应 与电源负极相接
阳极(正极) 高
氧化反应 与电源正极相接
2、法拉第定律
在电极界面上物质发生化学变化物质的物质的量与通入的电荷量成正比。
氧电极 OH- (a )|O2(g)|Pt
Mz+(a+)+ze- 作 作正 负极 极M(s) 2H+ (a+ )+2e- 作 作正 负极 极 H2 (g) 2H2O+2e- 作 作正 负极 极 H2 (g)+2OH- (a ) O2 +2H2O+4e- 作 作正 负 极 极4OH-(a)
H+ (a+ )|O2 (g)|Pt 卤素电极 Cl-(a )|Cl2(g)|Pt (2)第二类电极及其反应
nB
Q zF
mB
nB
M
B
Q zF
M
B
3、 离子的电迁移和迁移数
离子 B 所运载的电流与总电流之比。用符号 tB 表示。 tB def
IB I
如果溶液中有多种电解质,共有 i 种离子,则: ti t+ t 1
4、电解质溶液的电导、电导率和摩尔电导率及相互关系
G 1 R
G I U
1 G l 1 l A RA
些
即:
阴,析出
阴,可逆
阳,析出
阳,可逆
4、金属的析出电势
不考虑氢超电势时
(MZ |M)
(MZ |M)
RT zF
ln
1 aMZ
( H
RT ln 1
|H) F
aH
考虑氢超电势时 阴,不可逆 阴,可逆 阴
阳,不可逆 阳,可逆 阳
5、通过计算,判断电极上析出物质的先后顺序、金属的分离
第九章 可逆电池的电动势及其应用
1、形成可逆电池的必要条件 (1)化学反应可向正、反两个方向进行 (2) 电池工作时,通过的电流必须无限小 2、可逆电极的类型及电极反应式
(1)第一类电极及其反应
金属电极 Mz+ (a+ )|M(s) 氢电极 H+ (a+ )|H2 (g)|Pt OH-(a )|H2(g)|Pt
由电动势E及其温度系数求反应的r H m和r Sm
(3)求难溶盐的溶度积
E
RT zF
ln
Ka
第十章 电解与极化作用
1. 理论分解电压 等于可逆电池电动势
E理论 E可逆 阳,可逆 阴,可逆 2.实际分解电压 电解池不断工作所必需外加的最小电压。
E分解 阳,不可逆 阴,不可逆 3. 超电势 不可逆电极电势与平衡电极电势之间的差值称为超电势 极化作用的分类 浓差极化和电化学极化 极化曲线 电极的极化及极化结果:阴极的电势比可逆电势更负一些,阳极的电势比可逆电势更正一
和金属的同时析出
阴极上:阳离子或氢离子还原,电极电势最大的首先析出。从大到小依次析出
m m
aB
(
m m
)
7、电导测定的应用计算
(1)计算弱电解质的解离度和解离常数
AB
A+ B
起始 c
00
平衡时 c(1 ) c c
m m
(2)测定难溶盐的溶解度
Kc
c c
2
1
c c
2m
m
(
m
m
)
P26 例题
(难溶盐) (溶液) (H2O)
难溶盐饱和溶液的浓度极稀,可认为
m
m
,的值可由离子无限稀释摩尔电导率相加
得到
m (难溶盐)
(难溶盐)
c
(溶液) (H2O)
c
8、离子强度和离子平均活度因子的计算
I
1 2
mB zB2
B
德拜-休克尔极限定律的常用表示式:
lg A | z z | I P28 例题 作业 19 9、强电解质溶液理论
(1)Debye-Hückel 离子互吸理论要点 强电解质的稀溶液完全电解 离子之间的相互作用可归结为中心离子与离子氛间的作用 (2)Debye-Hückel-Onsager 电导理论 在 Debye-Hückel 离子互吸理论基础上解释了离子氛对中心离子 运动的影响的两个原因:弛豫效应和电泳效应
Sn4+(a1), Sn2+(a2)|Pt Sn4+(a1)+2e- →Sn2+(a2)
3、电极反应、电池反应及电池表示式的正确书写(互译)
4、标准电极、标准电池表示式及反应
标准氢电极: Pt|H2 (p ) | H (aH 1)
H2 (P
)作 作负 正极 极 2H
a( H
1 ) e 2
5、计算
(1)用 Nernst 方程计算电极电势和电池电动势
Ox|Red
Ox|Red
RT zF
ln
aRed aOx
对任意反应: cC dD gG hH
E
Ox|Red
()
Ox|Red
()
E
RT zF
ln
aGg aHh aCc aDd
(2)由电池电动势求反应的热力学函数
rGm zEF rGm RT ln Ka
