红外光谱IR
合集下载
红外光谱(IR)分析

4. 空间效应: (1)环状化合物的环张力效应:环张力越大,羰 基C=O频率越高。 环张力 四元环 五元环 六元环 (2)空间位阻效应:空间位阻使羰基与双键之间 的共轭受限制,故使C=O频率增高。 5. 氢键效应:氢键的形成,通常可使伸缩振动 频 率向低波数方向移动。
6. 振动偶合效应:当两个基团靠得很近时,产 生振动相互作用,使吸收峰发生分裂。
第三章 红 外 吸 收 光 谱 法
Infrared Absorption Spectrometry
§1 关于红外光谱
红外光谱在可见光区域微波区之间,其波长范 围约为0.75~1000m。
分为三个区: ◆近红外区 0.75~2.5m; ◆中红外区 2.5~25 m; ◆远红外区 25~1000 m
若分子由N个原子组成,则 需3N个坐标(自由度)确定N个原子位置; 分子自由度总数=平动、振动、转动自由度 总和 故 3N=平动自由度+转动自由度+振动自由度 即 振动自由度=3N-(平度自由度+转动自由度) 问题:怎样确定一个分子的平动自由度和 转动自由度?
(1) 平动自由度:分子的质心可沿x、y、z三 个坐标轴方向移动,故平动自由度=3。
2. 共轭效应(C效应):该效应使共轭体系具有 共平面性,电子云密度平均化,造成双键略有 伸长,单键略有缩短。故双键的吸收峰频率向 低波数方向移动。
例. C=O C=O 1715 cm-1 1685~1665 cm-1
3. 中介效应(M效应): 例. C=O 在1680cm-1附近。 若用诱导效应看,则电负性大的N原子应使 C=O键力常数增加,吸收峰位应大于1715cm-1; 但实际情况相反,这是因中介效应造成的。 即N原子上的孤对电子与C=O的电子发生重 叠(p- 共轭),使电子云密度平均化,造成C=O 键力常数降低,故使吸收峰频率移向低波数。
红外光谱(IR)

k 大,化学键的振动波数高 。
δ
1 2c
K
如:K值:单键4-6×102N/m < 双键8-10×102N/m < 叁键12-18×102 N/m
kCC(2222cm-1) > kC=C(1667cm-1) > kC-C(1429cm-1)(质量相近)
如:
质量m大, μ 增大,化学键的振动波数低 。
远红外
(ΔE=0.05~0.005ev; =25-250μm)
红外光谱区
区域 近红外 中红外 远红外 λ(μm) 0.75~2.5 2.5~50 50~1000 σ(cm-1 ) 13000 ~4000 4000~200 200~10 ν (Hz) 4.0×1014 ~ 1.2×1014 1.2×1014 ~ 6.0×1012 6.0×1012 ~ 3.0×1011 能级跃迁类型
R—C
3
⑥ 费米共振
一基团的倍频或合频与另一基团的基频相近,且具有相同的对称性时,他们可能 产生共振,使谱带分裂,并使强度很弱的倍频或合频谱带变得异常强,这一现象称为 费米共振。 2780cm-1 O 2700cm-1 如: C-H伸缩:2800cm-1
—C—H
C-H的面内弯曲(1400cm-1)的第一倍频:2700~2800cm-1
E c h c
波长:m,cm;h-普朗克常数 波数:σ =1/ ——横坐标 红外吸收谱带的强度——纵坐标 E分子=E电子+E振动+E转动 紫 外 红外
(ΔE=0.05~1ev; =1.252 -125μm)
(ΔE=1~20ev; =0.06-1.25μm)
1942cm-1
‖
O
电负性增强,频率增大
IR

1725cm-1 (液态)
● 外部因素
1.溶剂影响 ——极性基团,如,C=O
伸缩振动波数随溶剂极性增大而减小。
如,羧酸中的νC=0 气体 1780cm-1(游离) 非极性溶剂 1760cm-1(游离) 乙醚 1735cm-1 乙醇 1720cm-1 碱溶液中 νas C=0 1610~1500cm-1 νsC=0 1400cm-1
● 红外光谱谱带强度(峰强)
● 影响红外光谱的内外因素
一、分子振动特性描述(峰位)
● 谐振子模型 —— 描述分子振动特性
力学的Hoocke定律
◆ 谐振子恢复力(f): 谐振子恢复力与质点离开平衡位置的位 移或正比,但方向则与位移的方向相反。
f = - K(dA + dB)2 / 2
式中,K为键力常数(force constant)
药物波谱解析 第二章 红外光谱(IR)
红外光谱(IR)
IR:属于分子的振转光谱 IR光谱特征:指纹性 IR谱图: 横坐标 —— 波数为( )
纵坐标 —— 透光率(T%)
IR光谱分三种
① 近红外光谱:0.8~2.5um 即1250~4000cm-1
——分子中O-H、N-H、C-H振动倍频和组频;
◆ 分子振转能级示意图:
◆ IR 能级跃迁类型: V0→V1:产生的IR谱带 —— 基频峰 V0→ niVi —— 倍频峰 V0→miVi+niVi —— 合频峰 V0→V1- V2 , 2V1- V2 等 —— 差频峰
※ 泛频峰(组频峰):倍频峰、合频
峰与差频峰的总称。
四、影响IR光谱的的其他因素
弯曲振动引起的吸收
如,C—X(X=C,N,O)
—— 指纹区域
● 外部因素
1.溶剂影响 ——极性基团,如,C=O
伸缩振动波数随溶剂极性增大而减小。
如,羧酸中的νC=0 气体 1780cm-1(游离) 非极性溶剂 1760cm-1(游离) 乙醚 1735cm-1 乙醇 1720cm-1 碱溶液中 νas C=0 1610~1500cm-1 νsC=0 1400cm-1
● 红外光谱谱带强度(峰强)
● 影响红外光谱的内外因素
一、分子振动特性描述(峰位)
● 谐振子模型 —— 描述分子振动特性
力学的Hoocke定律
◆ 谐振子恢复力(f): 谐振子恢复力与质点离开平衡位置的位 移或正比,但方向则与位移的方向相反。
f = - K(dA + dB)2 / 2
式中,K为键力常数(force constant)
药物波谱解析 第二章 红外光谱(IR)
红外光谱(IR)
IR:属于分子的振转光谱 IR光谱特征:指纹性 IR谱图: 横坐标 —— 波数为( )
纵坐标 —— 透光率(T%)
IR光谱分三种
① 近红外光谱:0.8~2.5um 即1250~4000cm-1
——分子中O-H、N-H、C-H振动倍频和组频;
◆ 分子振转能级示意图:
◆ IR 能级跃迁类型: V0→V1:产生的IR谱带 —— 基频峰 V0→ niVi —— 倍频峰 V0→miVi+niVi —— 合频峰 V0→V1- V2 , 2V1- V2 等 —— 差频峰
※ 泛频峰(组频峰):倍频峰、合频
峰与差频峰的总称。
四、影响IR光谱的的其他因素
弯曲振动引起的吸收
如,C—X(X=C,N,O)
—— 指纹区域
ir(红外光谱)的原理

ir(红外光谱)的原理
红外光谱法(IR)的原理是:分子能选择性吸收某些波长的红外线,而引起分子中振动能级和转动能级的跃迁,检测红外线被吸收的情况可得到物质的红外吸收光谱,又称分子振动光谱或振转光谱。
在红外线照射下,当辐射能量与分子振动、转动频率相一致时,被测物质分子会产生其特定的红外光谱,据此可鉴定出化合物中各种原子团。
IR具有测定快速、特征性强、试样用量少、操作简便等优点。
但是,红外光谱一般只提供物质分子中官能团的相关信息,而对于一些复杂化合物,特别是新化合物,单靠IR 检测技术并不能解决问题,需要与其他分析手段互相配合,才能确定分子结构。
如需了解更多关于IR的原理,建议查阅相关文献或咨询专业化学家。
红外吸收光谱法——IR光谱的基本原理

IR光谱法的基本原理:一、红外光谱产生的条件
满足两个条件:
1、辐射应具有能满足物质产生振动跃迁所需的能量;
2、辐射与物质间有相互偶合作用,即物质振动时偶极矩发生改变
= q ·d
IR光谱法的基本原理
(1)红外活性
分子振动引起偶极矩的变化,从而产生红外吸收的性质,称为红
外活性。其分子称为红外活性分子。相关的振动称为红外活性振动。
2)应用范围广,除单原子分子及单核分子外,几乎所有的有机物均有红外吸收;
3)分子结构更为精细的表征:通过波谱的波数位置、 波峰数目及强度确定
分子基团和分子结构;
4)气体、液体、固体样品都可测定;
5)具有用量少;分析速度快;不破坏样品
因此,红外光谱法不仅与其它许多分析方法一样,能进行定性和定量分
析,而且是鉴定化合物和测定分子结构的用效方法之一
3、峰位、峰数与峰强
(1)峰位:
化学键的力常数K越大,原子折合质量越小,键的振动频率越大,
吸收峰将出现在高波数区(短波长区);反之,出现在低波数区(高
波长区)。
例1
水分子
(2)峰数 :理论值为 3n-6(3n-5)
实际峰数不等于此值
苯的简正振动的数目:3×12-6=30,应有30个吸收谱带。
但实际上出现的基频谱带要少于这个数目。其原因是:
激发态( =2)、第三激发态( =3),所产生的吸收峰称为倍频峰
由=0跃迁至=2时, △=2,产生的吸收峰称为二倍频峰
由=0跃迁至=3时, △=3,产生的吸收峰称为三倍频峰。其它类推。
在倍频峰中,二倍频峰还比较强。三倍频峰以上,因跃迁几率很小,一般
都很弱,常常不能测到。
除此之外,还有合频峰(1+2,21+2,),差频峰( 1-2,
红外光谱(IR)分析copy

与红外光谱比较,Raman光谱用于有机化合 物分析有一定优点。
∗因Raman光谱与红外光谱的选择定则不同,
对红外吸收很弱的C≡C、C=C、C-S、S-S等 键的伸缩振动及其它对称振动,都有很强的 Raman散射光。
∗拉曼光谱的另一大优点是不要求样品具有
光透性,可以很容易地得到浑浊样品的拉曼光 谱。 Raman光谱制样简单,很多情况下样品不 需处理,粉、块、薄膜状的固体、液态、溶 液及溶液中的沉淀物均可直接得到散射光谱。 特别是FI-Raman光谱可用作合适的非破 坏现场测试方法,在有机化合物、高分子材 料、医学、文物保护和生物分子研究中的应用 具有其独到之处。
∗特别重要的是:可用水作溶剂。(水是弱的散射
体)因此有利于生物分子、络合物、水污染等问题 的研究。 水分子是一种极性分子,有十分明显的红外吸收 谱带,要得到含水样品的红外吸收光谱却很困难。 相反,水分子的拉曼光谱信号很弱,可以较容易 地得到含水样品的拉曼光谱。因此,拉曼光谱可被 广泛地用于研究含水分的生物体系中,作为一种鉴 别物质结构的分析测试手段。
(问题:键力常数K还表明了红外谱峰位置与什 么因素有密切的关系?)
1-2 多原子分子的振动 在多原子分子中,由于组成原子数目多,以 及分子中原子排布情况不同,故多原子分子的 振动光谱远比双原子分子复杂得多。
1-4 影响峰位变化的因素 虽然基团吸收峰的频率主要由原子的质量和 原子的力常数决定,但基团的特征吸收峰并不 能固定在一个频率位置上,而是在一定范围内 波动。 (为什么?) 分子内部结构和外部环境的改变都可使其频 率发生改变。
4. 空间效应: (1)环状化合物的环张力效应:环张力越大,羰 基νC=O频率越高。 环张力 四元环 > 五元环 > 六元环 (2)空间位阻效应:空间位阻使羰基与双键之间 的共轭受限制,故使νC=O频率增高。 5. 氢键效应:氢键的形成,通常可使伸缩振动 频 率向低波数方向移动。
红外光谱 (IR)

正己烯中C=C键伸缩振动频率实测值为1652 cm-1
16:13:34
2. 非谐振子:
*真实分子并非严格遵守谐振子规律, 其 势能曲线不是抛物线。
*由量子力学求得非谐振子的能级为:
E振=(V+1/2) ν- -(V+1/2)2Xe ν-
式中V:振动量子数, 其值可取0, 1, 2….
Xe:非谐性修正系数
(二).多原子分子的振动类型
2. 分子振动自由度与峰数
*基本振动的数目称为振动自由度; 由N个原子构成的分子,其总自由度 为3N个。
*分子作为一个整体,其运动状态可 分为:平动、转动和振动。
*分子自由度数(3N)=平动自由度+ 转动自由度+振动自由度
*振动自由度=分子自由度数(3N)(平动自由度+转动自由度)
(1) 伸缩振动: 以ν表示, 又可分: 对称(νs) 不对称(νas)
(2) 弯曲振动:以δ表示, 又可为4种。 面内弯曲振动δ ip:剪式;平面摇摆 面外弯曲振动δ 0.0.p:扭曲;非平面摇摆
νas > νs> δ S > δ 0.0.p
亚甲基的振动模式:
谱图解析——正己烷
在 2962cm-1 处 的 峰 是 CH3 基 团的不对称伸缩振动。这种 不对称伸缩振动范围 2962±10cm-1 , 事 实 上 , 存 在两个简并的不对称伸缩振 动(显示其中一个)。
*振动频率(ν)是键的力常数(K)及两 个原子(mA与mB)的质量的函数。
这些式子表明:双原子分子的振动频率 (波数)随着化学键力常数的增大而 增加, 同时也随着原子折合质量的 增加而降低。
表: 某些键的伸缩力常数(毫达因/埃)
✓ 例: ✓ 例:
16:13:34
2. 非谐振子:
*真实分子并非严格遵守谐振子规律, 其 势能曲线不是抛物线。
*由量子力学求得非谐振子的能级为:
E振=(V+1/2) ν- -(V+1/2)2Xe ν-
式中V:振动量子数, 其值可取0, 1, 2….
Xe:非谐性修正系数
(二).多原子分子的振动类型
2. 分子振动自由度与峰数
*基本振动的数目称为振动自由度; 由N个原子构成的分子,其总自由度 为3N个。
*分子作为一个整体,其运动状态可 分为:平动、转动和振动。
*分子自由度数(3N)=平动自由度+ 转动自由度+振动自由度
*振动自由度=分子自由度数(3N)(平动自由度+转动自由度)
(1) 伸缩振动: 以ν表示, 又可分: 对称(νs) 不对称(νas)
(2) 弯曲振动:以δ表示, 又可为4种。 面内弯曲振动δ ip:剪式;平面摇摆 面外弯曲振动δ 0.0.p:扭曲;非平面摇摆
νas > νs> δ S > δ 0.0.p
亚甲基的振动模式:
谱图解析——正己烷
在 2962cm-1 处 的 峰 是 CH3 基 团的不对称伸缩振动。这种 不对称伸缩振动范围 2962±10cm-1 , 事 实 上 , 存 在两个简并的不对称伸缩振 动(显示其中一个)。
*振动频率(ν)是键的力常数(K)及两 个原子(mA与mB)的质量的函数。
这些式子表明:双原子分子的振动频率 (波数)随着化学键力常数的增大而 增加, 同时也随着原子折合质量的 增加而降低。
表: 某些键的伸缩力常数(毫达因/埃)
✓ 例: ✓ 例:
第三章红外光谱IR
烷烃吸收峰
正己烷的红外光谱图
2,2,4-三甲基戊烷的红外光谱图
2、不饱和烃
• 烯烃 • 炔烃 • 芳香烃
2、1 烯烃 烯烃双键的特征吸收
影响双键碳碳伸缩振动吸收的因素
• 对称性:对称性越高,吸收强度越低。 • 与吸电子基团相连,振动波数下降,吸
收强度增加。 • 取代基的质量效应:双键上的氢被氘取
代后,波数下降10-20厘米-1。质量效应 • 共轭效应:使波数下降约30厘米-1 。
1-己烯的红外光谱图
~3060cm-1: 烯烃C—H伸缩振动;~1820:910cm-1倍频; ~1650cm-1: C=C伸缩振动;~995,905cm-1: C=CH2 非平面摇摆振动
顺式和反式2,2,5,5-四甲基己烯红外光谱 a 顺式 b 反式
v~
=
1
——
K
2C M
M = m1 m2 m1 + m2
双原子分子红外吸收的频率决定于折合质量和键力常数。
C-H C-C C-O C-Cl C-Br C-I
-1 cm
3000
1200 1100
800
550
500
v cm-1
力常数/g.s-2
CC 2200~2100
12~18105
C=C 1680~1620
C-H面外弯曲振动吸收峰位置(cm-1) 670
770-730,710-690 770-735
810-750,710-690 833-810
780-760,745-705 885-870,825-805 865-810,730-675
810-800 850-840 870-855
870
各类取代苯的倍频吸收和面外弯曲振动吸收
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
的吸收强度显著增加。 • 氢键使参与形成氢键的化学键伸缩振动吸收显
著增加。
外在因素
制各样品的方法、溶剂的性质、氢键、样品所处物态、 结晶条件、吸收池厚度、色散系统以及测试温度等
正己酸在液态和气态的红外光谱 a 蒸气(134℃)b 液体(室温)
红外光谱仪及样品制备技术
• 色散型红外光谱仪 • 傅立叶变换红外光谱仪(FTIR) • 红外样品的制备
强度 很强
强 中等
弱 很弱
符号 VS S M W VW
影响红外光谱吸收强度的因素
振动中偶极矩的变化幅度越大,吸收强度越大
• 极性大的基团,吸收强度大 • 使基团极性降低的诱导效应使吸收强度减小,
使基团极性增大的诱导效应使吸收强度增加。 • 共轭效应使π电子离域程度增大,极化程度增
大,吸收强度增加。 • 振动耦合使吸收增大,费米振动使倍频或组频
基团
吸收位置(cm-1)
说明
υO—H δC—O δH—O
3650~3580(游离) 3550~3450(二聚体) 3400~3200(多聚体) 3600-2500(分子内缔合)
1050(伯) 1100(仲) 1150(叔) 1200(酚)
1500~1250 650
尖 中强,较尖
强,宽 宽,散 强,有时发生裂分
面内弯曲,强,宽 面外弯曲,宽
正丁醇的红外光谱
~3450cm-1:缔合O—H伸缩振动;~1350cm-1:O—H面内弯曲振动
苯酚的红外光谱图
乙醇在CCl4中浓度变化对红外吸收的影响
代后,波数下降10-20厘米-1。质量效应 • 共轭效应:使波数下降约30厘米-1 。
1-己烯的红外光谱图
~3060cm-1: 烯烃C—H伸缩振动;~1820:910cm-1倍频; ~1650cm-1: C=C伸缩振动;~995,905cm-1: C=CH2 非平面摇摆振动
顺式和反式2,2,5,5-四甲基己烯红外光谱 a 顺式 b 反式
8~12105
CC 1200~700
4~6105
力常数表示了化学键的强度,其大小与键能、键长有关。
键能大,键长短,K值大,振动吸收频率移向高波数; 键能小,键长长,K值小,振动吸收频率移向低波数。
三.不同官能团的特征吸收频区
红外光谱可分为两个区域
官能团区 4000~1350cm-1 指纹区 1350~650cm-1
O
O
R C R' R C C=C
VC=O ~1715
1685~1670
()
O RC
~1695
()
O
R C NH2 ~1675cm-1
(p)
试比较下列两个化合物中哪一个羰基的振动波数相对较高?
CHO
(CH3)2N
CHO
A
B
共轭效应:共轭效应使不饱和键的波数显著降低
3. 氢键的影响
使基团化学键的力常数减小, 伸缩振动波数降低、峰形变宽。
CH 3100
CH 2900
8. 振动的偶合
分子内两基团位置很近并且振动频率相同或相近时, 它们之 间发生强相互 作用, 结果产生两个吸收峰, 一个向高频移动, 一个向低频移动。
8、振动耦合效应
• 含有若干个相同的化学键的振动频率发生 分裂的现象称为耦合效应。当一个化学键 的伸缩振动与另一个化学键的振动吸收频 率很接近时,就会发生振动耦合。
=CH的面外弯曲振动
烯烃类型 R1CH=CH2 R1R2C=CH2 R1CH=CHR2(顺) R1CH=CHR2(反) R1R2C=CHR3
CH面外弯曲振动吸收位置 (cm-1)
995-985,910-905
895-885
730-650
980-965
840-790
2、2 炔烃
• C-H伸缩振动:3340-3300厘米-1,波数高于烯 烃和芳香烃,峰形尖锐。
• 一个化学键的某一种振动的基频和他自己 或另一个连在一起的化学键的某一种振动 的倍频或组频很接近时,可以发生耦合, 这种耦合成为费米共振。
五. 红外吸收峰的强度
红外吸收强度取决于跃迁的几率:
跃迁几率
ab
2
E
2
o
ab 跃迁偶极矩
E
2
o
红外电磁波的电场矢量
强度决定于振动时偶极矩变化大小。偶极矩变化愈大,吸收 强度愈大;偶极矩变化愈小,吸收强度愈小;没有偶极矩变 化, 则不产生红外吸收。
1、烷烃
• C-H伸缩振动:对称伸缩振动(νs)和反对称 伸缩振动(νas) ,在2800-3000cm-1之间, νas较νs在较高频率。
• C-H弯曲振动:1475-700 cm-1 ,甲基的对称变 形振动出现在1375 cm-1处 ,对于异丙基和叔 丁基,吸收峰发生分裂。
• 碳碳骨架振动:750-720cm-1为-(CH2)2-的骨架 振动,1253-1000cm-1为分叉甲基的骨架振动。
甲苯的红外光谱图
苯乙烯的红外光谱图
~1630cm-1:C=C伸缩振动;~1600,1580,1450cm-1:苯环骨架振动
α-甲基萘的红外光谱图
苯环二取代的红外光谱 (a. 邻位 b. 间位 c. 对位)
3 醇、酚和醚
醇和酚存在三个特征吸收:羟基OH 伸缩振动和弯曲 振动,C-O伸缩振动。
VC=C
1645
H
1610 H
1560 H
υ C=C υ =C H
1645cm-1 3017cm-1
1610cm-1 3040cm-1
1565cm-1 3060cm-1
5、空间位阻
一般共轭使振动频率降低
6、跨环共轭效应
7. 成键碳原子的杂化状态(杂化轨道中S成分越高,其电负性越强)
VC-H
CH 3300
烷烃吸收峰
正己烷的红外光谱图
2,2,4-三甲基戊烷的红外光谱图
2、不饱和烃
• 烯烃 • 炔烃 • 芳香烃
2、1 烯烃 烯烃双键的特征吸收
影响双键碳碳伸缩振动吸收的因素
• 对称性:对称性越高,吸收强度越低。 • 与吸电子基团相连,振动波数下降,吸
收强度增加。 • 取代基的质量效应:双键上的氢被氘取
四. 影响官能团吸收频率的因素 主要讨论分子结构变化时,官能团红外吸收频率的变化。
2. 电子效应
1)诱导效应
O
O
R C R' R C Cl
O RCF
VC=O ~1715
~1800
~1869cm-1
卤原子吸电子诱导效应,使羰基双键极性增强,C=O的力常数 变大,吸收向高波数移动。
1、质量效应
X-H键的伸缩振动波数(cm-1)
v~
=
1
——
K
2C M
M = m1 m2 m1 + m2
双原子分子红外吸收的频率决定于折合质量和键力常数。
C-H C-C C-O C-Cl C-Br C-I
-1 cm
3000
1200 1100
800
550
500
v cm-1
力常数/g.s-2
CC 2200~2100
12~18105
C=C 1680~1620
化学键
波数(cm-1)
化学键
波数(cm-1)
C-H
3000
F-H
4000
Si-H
2150
Cl-H
2890
Ge-H
2070
Br-H
2650
Sn-H
1850
I-H
2310
诱导效应
注意与前面谱图的差别:在3000cm-1附近的峰
2)共轭效应 羰基与双键共轭,C=O键长增加,降低了羰基的双键性, 使吸收频率移向低波数。
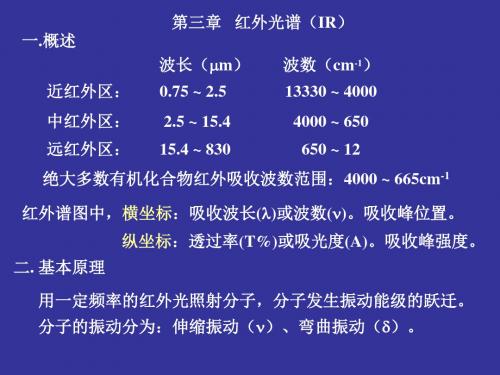
二. 基本原理
用一定频率的红外光照射分子,分子发生振动能级的跃迁。 分子的振动分为:伸缩振动()、弯曲振动()。
分子振动
伸缩振动 (键长改变)
弯曲振动
(键角改变)
对称 伸缩振动 不对称 伸缩振动 面内弯曲振动 面外弯曲振动
• 双原子分子振动
多原子分子振动
常见术语
• 基频峰、倍频峰、合频峰、热峰
色散型红外光谱仪
傅立叶变换红外光谱仪
迈克逊干涉仪
干涉图
FTIR光谱仪的优点
• 光学部件简单,只有一个动镜在实验中运动, 不易磨损。
• 测量波长范围宽,其波长范围可达到 45000~6cm-1
• 精度高,光通量大,所有频率同时测量,检测 灵敏度高。
• 扫描速度快,可作快速反应动力学研究,并可 与GC、LC联用。
一.概述
第三章 红外光谱(IR) 波长(m) 波数(cm-1)
近红外区: 0.75 ~ 2.5
13330 ~ 4000
中红外区: 2.5 ~ 15.4
4000 ~ 650
远红外区: 15.4 ~ 830
650 ~ 12
绝大多数有机化合物红外吸收波数范围:4000 ~ 665cm-1
红外谱图中,横坐标:吸收波长()或波数()。吸收峰位置。 纵坐标:透过率(T%)或吸光度(A)。吸收峰强度。
• C-C叁键伸缩振动:2100厘米-1 ,峰形尖锐, 强度中到弱。干扰少,位置特征。末端炔基该 吸收强。分子对称性强时,该吸收较弱。
• 腈类化合物,C-N叁键伸缩振动出现在23002220厘米-1,波数比炔烃略高,吸收强度大。
苯基乙炔
~3340cm-1 :叁键上C—H伸缩振动,~3020cm-1: 苯环=C—H伸缩振动 ~2115cm-1: 三键伸缩振动
例:VC=O 吸收强度大于 VC=C 。 对称烯、炔等无吸收峰或吸 收峰很弱。
吸收强度的表示: vs (ε> 200)、s(ε= 75~200)、 m(ε= 25~75)、w(ε= 5~25)、vw(ε< 5)。
著增加。
外在因素
制各样品的方法、溶剂的性质、氢键、样品所处物态、 结晶条件、吸收池厚度、色散系统以及测试温度等
正己酸在液态和气态的红外光谱 a 蒸气(134℃)b 液体(室温)
红外光谱仪及样品制备技术
• 色散型红外光谱仪 • 傅立叶变换红外光谱仪(FTIR) • 红外样品的制备
强度 很强
强 中等
弱 很弱
符号 VS S M W VW
影响红外光谱吸收强度的因素
振动中偶极矩的变化幅度越大,吸收强度越大
• 极性大的基团,吸收强度大 • 使基团极性降低的诱导效应使吸收强度减小,
使基团极性增大的诱导效应使吸收强度增加。 • 共轭效应使π电子离域程度增大,极化程度增
大,吸收强度增加。 • 振动耦合使吸收增大,费米振动使倍频或组频
基团
吸收位置(cm-1)
说明
υO—H δC—O δH—O
3650~3580(游离) 3550~3450(二聚体) 3400~3200(多聚体) 3600-2500(分子内缔合)
1050(伯) 1100(仲) 1150(叔) 1200(酚)
1500~1250 650
尖 中强,较尖
强,宽 宽,散 强,有时发生裂分
面内弯曲,强,宽 面外弯曲,宽
正丁醇的红外光谱
~3450cm-1:缔合O—H伸缩振动;~1350cm-1:O—H面内弯曲振动
苯酚的红外光谱图
乙醇在CCl4中浓度变化对红外吸收的影响
代后,波数下降10-20厘米-1。质量效应 • 共轭效应:使波数下降约30厘米-1 。
1-己烯的红外光谱图
~3060cm-1: 烯烃C—H伸缩振动;~1820:910cm-1倍频; ~1650cm-1: C=C伸缩振动;~995,905cm-1: C=CH2 非平面摇摆振动
顺式和反式2,2,5,5-四甲基己烯红外光谱 a 顺式 b 反式
8~12105
CC 1200~700
4~6105
力常数表示了化学键的强度,其大小与键能、键长有关。
键能大,键长短,K值大,振动吸收频率移向高波数; 键能小,键长长,K值小,振动吸收频率移向低波数。
三.不同官能团的特征吸收频区
红外光谱可分为两个区域
官能团区 4000~1350cm-1 指纹区 1350~650cm-1
O
O
R C R' R C C=C
VC=O ~1715
1685~1670
()
O RC
~1695
()
O
R C NH2 ~1675cm-1
(p)
试比较下列两个化合物中哪一个羰基的振动波数相对较高?
CHO
(CH3)2N
CHO
A
B
共轭效应:共轭效应使不饱和键的波数显著降低
3. 氢键的影响
使基团化学键的力常数减小, 伸缩振动波数降低、峰形变宽。
CH 3100
CH 2900
8. 振动的偶合
分子内两基团位置很近并且振动频率相同或相近时, 它们之 间发生强相互 作用, 结果产生两个吸收峰, 一个向高频移动, 一个向低频移动。
8、振动耦合效应
• 含有若干个相同的化学键的振动频率发生 分裂的现象称为耦合效应。当一个化学键 的伸缩振动与另一个化学键的振动吸收频 率很接近时,就会发生振动耦合。
=CH的面外弯曲振动
烯烃类型 R1CH=CH2 R1R2C=CH2 R1CH=CHR2(顺) R1CH=CHR2(反) R1R2C=CHR3
CH面外弯曲振动吸收位置 (cm-1)
995-985,910-905
895-885
730-650
980-965
840-790
2、2 炔烃
• C-H伸缩振动:3340-3300厘米-1,波数高于烯 烃和芳香烃,峰形尖锐。
• 一个化学键的某一种振动的基频和他自己 或另一个连在一起的化学键的某一种振动 的倍频或组频很接近时,可以发生耦合, 这种耦合成为费米共振。
五. 红外吸收峰的强度
红外吸收强度取决于跃迁的几率:
跃迁几率
ab
2
E
2
o
ab 跃迁偶极矩
E
2
o
红外电磁波的电场矢量
强度决定于振动时偶极矩变化大小。偶极矩变化愈大,吸收 强度愈大;偶极矩变化愈小,吸收强度愈小;没有偶极矩变 化, 则不产生红外吸收。
1、烷烃
• C-H伸缩振动:对称伸缩振动(νs)和反对称 伸缩振动(νas) ,在2800-3000cm-1之间, νas较νs在较高频率。
• C-H弯曲振动:1475-700 cm-1 ,甲基的对称变 形振动出现在1375 cm-1处 ,对于异丙基和叔 丁基,吸收峰发生分裂。
• 碳碳骨架振动:750-720cm-1为-(CH2)2-的骨架 振动,1253-1000cm-1为分叉甲基的骨架振动。
甲苯的红外光谱图
苯乙烯的红外光谱图
~1630cm-1:C=C伸缩振动;~1600,1580,1450cm-1:苯环骨架振动
α-甲基萘的红外光谱图
苯环二取代的红外光谱 (a. 邻位 b. 间位 c. 对位)
3 醇、酚和醚
醇和酚存在三个特征吸收:羟基OH 伸缩振动和弯曲 振动,C-O伸缩振动。
VC=C
1645
H
1610 H
1560 H
υ C=C υ =C H
1645cm-1 3017cm-1
1610cm-1 3040cm-1
1565cm-1 3060cm-1
5、空间位阻
一般共轭使振动频率降低
6、跨环共轭效应
7. 成键碳原子的杂化状态(杂化轨道中S成分越高,其电负性越强)
VC-H
CH 3300
烷烃吸收峰
正己烷的红外光谱图
2,2,4-三甲基戊烷的红外光谱图
2、不饱和烃
• 烯烃 • 炔烃 • 芳香烃
2、1 烯烃 烯烃双键的特征吸收
影响双键碳碳伸缩振动吸收的因素
• 对称性:对称性越高,吸收强度越低。 • 与吸电子基团相连,振动波数下降,吸
收强度增加。 • 取代基的质量效应:双键上的氢被氘取
四. 影响官能团吸收频率的因素 主要讨论分子结构变化时,官能团红外吸收频率的变化。
2. 电子效应
1)诱导效应
O
O
R C R' R C Cl
O RCF
VC=O ~1715
~1800
~1869cm-1
卤原子吸电子诱导效应,使羰基双键极性增强,C=O的力常数 变大,吸收向高波数移动。
1、质量效应
X-H键的伸缩振动波数(cm-1)
v~
=
1
——
K
2C M
M = m1 m2 m1 + m2
双原子分子红外吸收的频率决定于折合质量和键力常数。
C-H C-C C-O C-Cl C-Br C-I
-1 cm
3000
1200 1100
800
550
500
v cm-1
力常数/g.s-2
CC 2200~2100
12~18105
C=C 1680~1620
化学键
波数(cm-1)
化学键
波数(cm-1)
C-H
3000
F-H
4000
Si-H
2150
Cl-H
2890
Ge-H
2070
Br-H
2650
Sn-H
1850
I-H
2310
诱导效应
注意与前面谱图的差别:在3000cm-1附近的峰
2)共轭效应 羰基与双键共轭,C=O键长增加,降低了羰基的双键性, 使吸收频率移向低波数。
二. 基本原理
用一定频率的红外光照射分子,分子发生振动能级的跃迁。 分子的振动分为:伸缩振动()、弯曲振动()。
分子振动
伸缩振动 (键长改变)
弯曲振动
(键角改变)
对称 伸缩振动 不对称 伸缩振动 面内弯曲振动 面外弯曲振动
• 双原子分子振动
多原子分子振动
常见术语
• 基频峰、倍频峰、合频峰、热峰
色散型红外光谱仪
傅立叶变换红外光谱仪
迈克逊干涉仪
干涉图
FTIR光谱仪的优点
• 光学部件简单,只有一个动镜在实验中运动, 不易磨损。
• 测量波长范围宽,其波长范围可达到 45000~6cm-1
• 精度高,光通量大,所有频率同时测量,检测 灵敏度高。
• 扫描速度快,可作快速反应动力学研究,并可 与GC、LC联用。
一.概述
第三章 红外光谱(IR) 波长(m) 波数(cm-1)
近红外区: 0.75 ~ 2.5
13330 ~ 4000
中红外区: 2.5 ~ 15.4
4000 ~ 650
远红外区: 15.4 ~ 830
650 ~ 12
绝大多数有机化合物红外吸收波数范围:4000 ~ 665cm-1
红外谱图中,横坐标:吸收波长()或波数()。吸收峰位置。 纵坐标:透过率(T%)或吸光度(A)。吸收峰强度。
• C-C叁键伸缩振动:2100厘米-1 ,峰形尖锐, 强度中到弱。干扰少,位置特征。末端炔基该 吸收强。分子对称性强时,该吸收较弱。
• 腈类化合物,C-N叁键伸缩振动出现在23002220厘米-1,波数比炔烃略高,吸收强度大。
苯基乙炔
~3340cm-1 :叁键上C—H伸缩振动,~3020cm-1: 苯环=C—H伸缩振动 ~2115cm-1: 三键伸缩振动
例:VC=O 吸收强度大于 VC=C 。 对称烯、炔等无吸收峰或吸 收峰很弱。
吸收强度的表示: vs (ε> 200)、s(ε= 75~200)、 m(ε= 25~75)、w(ε= 5~25)、vw(ε< 5)。
