文件更改通知单
合集下载
技术文件更改评估通知单

是否需要顾客补偿 是否增加投资 供方交货时间 验证报告编号: 是 否 供方 过程流程图 作业指导书
是 DFMEA 检验文件
否
日期:
质量: 财务: 销售: 总工:
编制:
日期:
更改后:
更改对顾客、产品组成部分及供方的评估:
顾客 是否需要顾客确认 内部 单价是否发生变化 供方 是否有报废费用 是否需要进行验证 是 否 是否需要重新提交PPAP: 顾客 同时更改文件: 产品图纸 技术条件 控制计划 PFMEA 分发单位 (原文件分 发单位) 资料管理者签名:
会签: 技术: 采购:
编号:
技术文件更改评估/通知单
名称: 更改生效日期: 更改期限: 更改类型: 顾客 更改原因: 内部 供应商 Байду номын сангаас件号: 更改后标识: 更改涉及产品数量: 产品更改 过程更改
Q P W 4.2.3-6
临时 永久 (让步)
制品处理:(供方产品、在制品、库存产品、在途产品、顾客处产品)
更改内容: 更改前:
文件更改通知单

文件更改通知单
日期:年月日编号:
申请单位申请人主管核准
文件名称文件编号版次
变更理由讨论内容□客户要求
□设计改善
□降低成本
□作业改善
□法律法规要求
建议变更内容: □如附件。
变更方式:
□永久性(须变更现有书面规格、文件)
□暂时性(无须变更现有书面规格、文件)
变更有效数量:
变更有效时段:自年月日起变
更
等
级
□A‧只变更文件
□B‧旧料用完后换用新料
□C‧立即变更但不追溯
□D‧追溯至成品仓
□E‧追溯至客户
纠正方法:(不必需)
受
影
响
文
件
文件名称文件编号/ 版次负责人完成修改期限
原文件制定部门意见
核准审核申请
版次1.0。
文件更改通知单的填写方法
测设备以及支持性服务(水、电、气 试验设备以及支持性服务(水、电、
供应),通风设施、运输设备等;工 气供应),通风设施、运输设备等;
作环境包括人和物 的因素。
工作环境包括人和 物的因素。
a7 7.1.2.2 对常规产品进行策划时应考 7.1.2.2 在对产品进行策划时应考虑 换页
虑以下方面的内容 :
换页
增加了技术部、质量 部、生产部评审
的栏目
拟制 审核
标准化 批准
第1页 共1 页
文件更改通知单
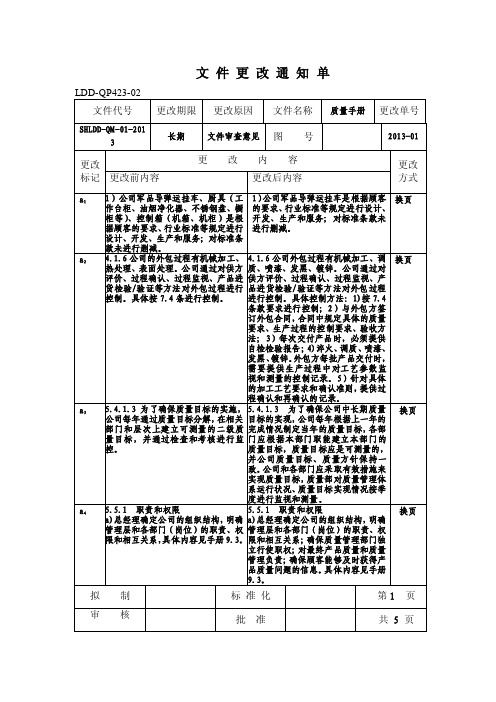
LDD-QP423-02 文件代号
更改期限
更改原因
文件名称 记录控制程序 更改单号
HLDD-QP- 02-201 3
顾客,并做好记录 。
告顾客,并做好记 录。
b) 生产部 负责 对顾客 提供的 原材
料、检测设备等顾客财产进 行管理。
顾 客财产进 公司时, 由生产部 委托
质 量部按合 同或协议 书的规定 进行
检 查、验收 ,如有不 符,须作 标识
并 及时向生 产部汇报 并作记录 ,顾
客 财产在使 用过程中 发现有不 适用
柜等)、控制箱(机箱、机柜)是根 开发、生产和服务;对标准条款未
据顾客的要求、行业标准等规定进行 进行删减。
设计、开发、生产和服务;对标准条
款未进行删减。
a2 4.1.6 公司的外包过程有机械加工、 4.1.6 公司外包过程有机械加工、调 换页 热处理、表面处理。公司通过对供方 质、喷漆、发黑、镀锌。公司通过对
a14 7.5.4 顾客财产
7.5.4 顾客财产
技术部负责对顾客提供的产品技术 a)技术部负责对顾客提供的产品技
文件资料进行管理, 一旦当顾客提 术文件资料进行管理, 一旦当顾客
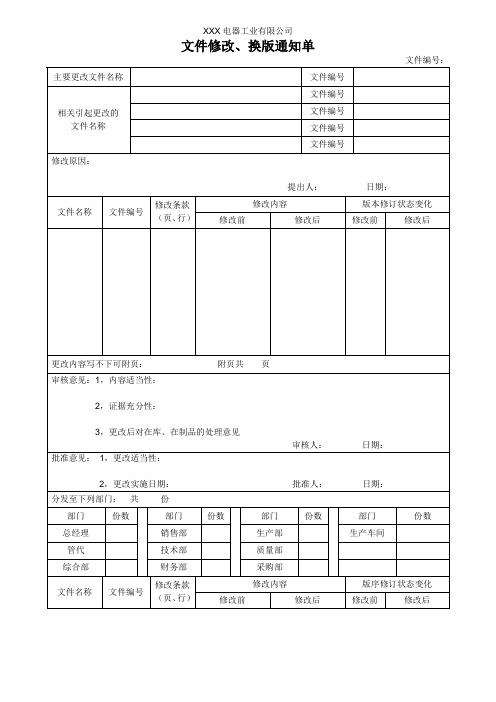
文件修改换版通知单
批准意见:1,更改适当性:
2,更改实施日期Байду номын сангаас批准人:日期:
分发至下列部门:共份
部门
份数
部门
份数
部门
份数
部门
份数
总经理
销售部
生产部
生产车间
管代
技术部
质量部
综合部
财务部
采购部
文件名称
文件编号
修改条款(页、行)
修改内容
版序修订状态变化
修改前
修改后
修改前
修改后
主要更改文件名称
文件编号
相关引起更改的
文件名称
文件编号
文件编号
文件编号
文件编号
修改原因:
提出人:日期:
文件名称
文件编号
修改条款(页、行)
修改内容
版本修订状态变化
修改前
修改后
修改前
修改后
更改内容写不下可附页:附页共页
审核意见:1,内容适当性:
2,证据充分性:
3,更改后对在库、在制品的处理意见
审核人:日期:
2,更改实施日期Байду номын сангаас批准人:日期:
分发至下列部门:共份
部门
份数
部门
份数
部门
份数
部门
份数
总经理
销售部
生产部
生产车间
管代
技术部
质量部
综合部
财务部
采购部
文件名称
文件编号
修改条款(页、行)
修改内容
版序修订状态变化
修改前
修改后
修改前
修改后
主要更改文件名称
文件编号
相关引起更改的
文件名称
文件编号
文件编号
文件编号
文件编号
修改原因:
提出人:日期:
文件名称
文件编号
修改条款(页、行)
修改内容
版本修订状态变化
修改前
修改后
修改前
修改后
更改内容写不下可附页:附页共页
审核意见:1,内容适当性:
2,证据充分性:
3,更改后对在库、在制品的处理意见
审核人:日期:
技术文件(图纸)变更通知单

图名图号项目更改类型原版本号变更质量反馈单变更日期变更原因序号图名图号原版本号12345678在制品处理意见技术文件图纸变更通知单图纸错误结构错误制造工艺设计规范产品改良其它变更原因文字说明
技术文件(图纸)变更通知单
表格编号: 表格序号: 产品名称 项目名称 原版本号 质量反馈单 □图纸错误 □结构错误 (变更原因文字说明。) 变更原因 □制造工艺 产品件号 更改类型 变 更
设计错误 优化设计
变更日期 □设计规范 □产品改良 □其它
变更前:(变更前内容文字说明。)
变更后:(变更后内容文字说明。)
对应变更其它零部件 序号 变更内容 1 2 3 4 5 6 7 8 在制品 处理意见 图名 图 号 原版本号 变更内容
设计:
校对:
审核:
批准:
填写说明: 1. 此表为通知类文件,文件编号是技术部唯一编号,编号由序号组成,如001; 2. 所有变更由设计责任人跟踪,并负责填写、传递变更单的审批; 3. 此表随变更图一起存档、发放、收回,更改单必须以《质量反馈单》为依据; 4. 一般情况会签与图纸会签人员一致,重大修改需要生产技术总监和总经理批准。
技术文件(图纸)变更通知单
表格编号: 表格序号: 产品名称 项目名称 原版本号 质量反馈单 □图纸错误 □结构错误 (变更原因文字说明。) 变更原因 □制造工艺 产品件号 更改类型 变 更
设计错误 优化设计
变更日期 □设计规范 □产品改良 □其它
变更前:(变更前内容文字说明。)
变更后:(变更后内容文字说明。)
对应变更其它零部件 序号 变更内容 1 2 3 4 5 6 7 8 在制品 处理意见 图名 图 号 原版本号 变更内容
设计:
校对:
审核:
批准:
填写说明: 1. 此表为通知类文件,文件编号是技术部唯一编号,编号由序号组成,如001; 2. 所有变更由设计责任人跟踪,并负责填写、传递变更单的审批; 3. 此表随变更图一起存档、发放、收回,更改单必须以《质量反馈单》为依据; 4. 一般情况会签与图纸会签人员一致,重大修改需要生产技术总监和总经理批准。
文件更改通知单

9.已明确基础设施和设备的维护管理要求并保留相应记录。
10.未识别环境条件对于产品的影响,未建立控制文件。
10程策划的内容和要求,未建立风险管理文件,未保留相关记录。
11.已明确产品实现过程策划的内容和要求,并建立风险管理文件,已保留相关记录。
14.未明确产品交付和交付后活动的要求,包括服务的要求。
14.已明确产品交付和交付后活动的要求,包括服务的要求。
15.未结合公司识别的特殊过程明确确认和再确认的时机和要求。
15.已结合公司识别的特殊过程明确确认和再确认的时机和要求。
16.未进一步明确产品追溯的范围和路径,未明确返回产品的管理要求。
16.已进一步明确产品追溯的范围和路径,并明确返回产品的管理要求。
12.未确定公司对与产品有关的要求的确定和评审的活动要求,未明确各种合同的评审方法。
12.已确定公司对与产品有关的要求的确定和评审的活动要求,已明确各种合同的评审方法。
13.未对设计和开发的更改进行适当的评审、验证和确认,未在实施前得到批准。
13.已对设计和开发的更改进行适当的评审、验证和确认,并在实施前得到批准。
23.已明确利用质量方针、质量目标、审核结果、数据分析、纠正和预防措施以及管理评审持续改进体系的要求。
更改人
(起草人)
日期
制表:朱明杰审核:张俊蓉批准:宋强
4.手册覆盖范围未涵盖需要认证的全部产品。
4.手册覆盖范围已涵盖需要认证的全部产品。
5.未在文件中明确公司关于质量目标分解及体系策划活动的具体要求。
5.已在文件中明确公司关于质量目标分解及体系策划活动的具体要求。
6.职能分配表中缺少7.3条款,设计开发控制职责不清;《职责和权限》中质管部缺少产品检验的职责。
10.未识别环境条件对于产品的影响,未建立控制文件。
10程策划的内容和要求,未建立风险管理文件,未保留相关记录。
11.已明确产品实现过程策划的内容和要求,并建立风险管理文件,已保留相关记录。
14.未明确产品交付和交付后活动的要求,包括服务的要求。
14.已明确产品交付和交付后活动的要求,包括服务的要求。
15.未结合公司识别的特殊过程明确确认和再确认的时机和要求。
15.已结合公司识别的特殊过程明确确认和再确认的时机和要求。
16.未进一步明确产品追溯的范围和路径,未明确返回产品的管理要求。
16.已进一步明确产品追溯的范围和路径,并明确返回产品的管理要求。
12.未确定公司对与产品有关的要求的确定和评审的活动要求,未明确各种合同的评审方法。
12.已确定公司对与产品有关的要求的确定和评审的活动要求,已明确各种合同的评审方法。
13.未对设计和开发的更改进行适当的评审、验证和确认,未在实施前得到批准。
13.已对设计和开发的更改进行适当的评审、验证和确认,并在实施前得到批准。
23.已明确利用质量方针、质量目标、审核结果、数据分析、纠正和预防措施以及管理评审持续改进体系的要求。
更改人
(起草人)
日期
制表:朱明杰审核:张俊蓉批准:宋强
4.手册覆盖范围未涵盖需要认证的全部产品。
4.手册覆盖范围已涵盖需要认证的全部产品。
5.未在文件中明确公司关于质量目标分解及体系策划活动的具体要求。
5.已在文件中明确公司关于质量目标分解及体系策划活动的具体要求。
6.职能分配表中缺少7.3条款,设计开发控制职责不清;《职责和权限》中质管部缺少产品检验的职责。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.增加计算机软件确认程序,文件编号HBM/CX-7-14-2012;
5.增加生产过程控制程序,文件编号HBM/CX-7-15-2012;
6.增加医疗器械不良事件监测和再评价控制程序,文件编号HBM/CX-8-9-2012;
7.最终灭菌医疗器械包装验证控制程序增加5包装系统的再验证;
8.增加灭菌验证控制程序(适应于伽玛射线灭菌)
新增加以下文件:
序号
文件名称
文件编号
01
分散剂制备作业指导书
HBM/GZ-WS/JS-01
02
凝固剂制备作业指导书
HBM/GZ-WS/JS-02
03
乳胶硫化、停放作业指导书
HBM/GZ-WS/JS-03
04
生产联动线作业指导书
HBM/GZ-WS/JS-04
05
浸泡、烘干作业指导书
HBM/GZ-WS/JS-05
06
检验吹气作业指导书
HBM/GZ-WS/JS-06
07
单包装作业指导书
HBM/GZ-WS/JS-07
08
封口作业指导书
HBM/GZ-WS/JS-08
09
包装作业指导书
HBM/GZ-WS/JS-09
序号
文件名称
文件编号
01
配料
HBM/GS-01
02
乳胶硫化、熟成停放
HBM/GS-02
03
生产线
HBM/GS-03
更改文件名称
工艺流程图、作业指导书、工艺守则、操作规程、产品图纸、工艺过程卡、表单
更改文件编号
HBM/GG-WS-OO、HBM/GZ-××、HBM/GS-××、HBM/GC-××、HBM/TZ-WS-××、HBM/GG-WS-00、HBM/BD-××
相关责任部门
生计部
更改日期
2012.05.03
更改容:
HBM/GJ-01-13
14
外购协件检验规程-单包装
HBM/GJ-01-14
15
外购协件检验规程-中包装
HBM/GJ-01-15
16
外购协件检验规程-纸箱
HBM/GJ-01-16
备注:
批准人
批准日期
2012.05.03
更改人
更改日期
2011.05.03
宜兴市恒保乳胶制品
文件更改通知单
编号:005-01表码:HBM/BD-4-005
备注:
批准人
批准日期
2012.05.03
更改人
更改日期
2011.05.03
宜兴市恒保乳胶制品
文件更改通知单
编号:003表码:HBM/BD-4-005
更改文件名称
制度及管理规定汇编
更改文件编号
HBM/GLZD-00
相关责任部门
各部门
更改日期
2012.05.03
更改容:
1.根据洁净室检测新标准,GB/T16292-16294-2010医药工业洁净室(区)沉降菌的测试方法修订HBM/GLZD-03《洁净区环境检测管理制度》;
3.文件中3.0企业简介中”固定资产”500多万元”更改为”1000多万元”,”占地面积6882.6平米,建筑面积2285平方米”更改为”占地面积12000平方米,建筑面积4000平方米”,公司地址:”宜兴市丁蜀镇大浦泽村”更改为”宜兴市丁蜀镇宜浦路136号”;
3.文件中3.1质量管理体系组织机构图,原”总经理”更名为”董事长”,董事长变更为胡国祥;原“生产部”更名为“生技部”;原“销售部”与”生产部下的采购”合并为“供销部”;
备注:
批准人
批准日期
2012.05.03
更改人
更改日期
2011.05.03
宜兴市恒保乳胶制品
文件更改通知单
编号:004表码:HBM/BD-4-005
更改文件名称
外购件检验规程
更改文件编号
HBM/GJ-01-××
相关责任部门
品管部
更改日期
2010.12.25
更改容:
序号
文件名称
文件编号
01
外购协件检验规程-天然乳胶
4.文件中3.2质量方针与目标中2.1年度质量目标出厂合格率提升为98%;
5.文件中质量手册增加附录二体系流程图,附录三-适用标准对照表。
备注:
批准人
批准日期
2012.05.03
更改人
更改日期
2011.05.03
宜兴市恒保乳胶制品
文件更改通知单
编号:002表码:HBM/BD-4-005
更改文件名称
程序文件
3.2按照《生产质量管理规无菌医疗器械实施细则和检查评定标准(试行)》要求,新增加以下管理制度:
人员考核、评价和再评价制度、生产过程清场管理制度、产品清洁管理制度、技术文档管理制度、产品销售管理制度、工作环境条件要求及控制规定、产品返工管理规定、灭菌过程控制管理规定、员工业绩考核、评价和再评价制度、员工培训制度、检验室环境设施管理制度、净化系统验证管理制度、工艺用气验证管理制度、消毒剂管理办法、清洁工具的清洁及存放管理规定、初始污染管理办法、供方的选择和评价及再评价管理规定、无菌产品的清洁和防污染控制管理规定、批号的规定、批记录管理规定、生产区工位器具工艺卫生控制。
HBM/GJ-01-01
02
外购协件检验规程-氧化锌
HBM/GJ-01-02
03
外购协件检验规程-硫磺
HBM/GJ-01-03
04
外购协件检验规程-抗氧剂264
HBM/GJ-01-04
05
外购协件检验规程-促进剂ZDC
HBM/GJ-01-05
06
外购协件检验规程-干酪素
HBM/GJ-01-06
07
外购协件检验规程-分散剂
HBM/GJ-01-07
08
外购协件检验规程-氯化钙
HBM/GJ-01-08
09
外购协件检验规程-PU
HBM/GJ-01-09
10
外购协件检验规程-硬脂酸钙
HBM/GJ-01-10
11
外购协件检验规程-变形淀粉
HBM/GJ-01-11
12
外购协件检验规程-瓷模具
HBM/GJ-01-12
13
外购协件检验规程-单包装折纸
更改文件编号
HBM/CX-00
相关责任部门
管理者代表
更改日期
2012.05.03
更改容:
1.原”总经理”更名为”董事长”, 董事长变更为胡国祥;原“生产部”更名为“生技部”;原“销售部”与”生产部下的采购”合并为“供销部”;
2.增加设计和开发控制程序,文件编号HBM/CX-7-3-2012;
3.设计和开发更改控制程序,文件编号HBM/CX-7-4-2012;
宜兴市恒保乳胶制品
文件更改通知单
编号:001表码:HBM/BD-4-005
更改文件名称
质量手册
更改文件编号
HBM/SC-2012
相关责任部门
管理者代表
更改日期
2012.05.03
更改容:
1.文件编号:HBM/QM 01-2008更正为HBM/SC-2012。
2.文件中2.2应用围中增加医疗器械生产质量管理规无菌医疗器械实施细则和检查评定标准(试行)中不适用条款及说明;
5.增加生产过程控制程序,文件编号HBM/CX-7-15-2012;
6.增加医疗器械不良事件监测和再评价控制程序,文件编号HBM/CX-8-9-2012;
7.最终灭菌医疗器械包装验证控制程序增加5包装系统的再验证;
8.增加灭菌验证控制程序(适应于伽玛射线灭菌)
新增加以下文件:
序号
文件名称
文件编号
01
分散剂制备作业指导书
HBM/GZ-WS/JS-01
02
凝固剂制备作业指导书
HBM/GZ-WS/JS-02
03
乳胶硫化、停放作业指导书
HBM/GZ-WS/JS-03
04
生产联动线作业指导书
HBM/GZ-WS/JS-04
05
浸泡、烘干作业指导书
HBM/GZ-WS/JS-05
06
检验吹气作业指导书
HBM/GZ-WS/JS-06
07
单包装作业指导书
HBM/GZ-WS/JS-07
08
封口作业指导书
HBM/GZ-WS/JS-08
09
包装作业指导书
HBM/GZ-WS/JS-09
序号
文件名称
文件编号
01
配料
HBM/GS-01
02
乳胶硫化、熟成停放
HBM/GS-02
03
生产线
HBM/GS-03
更改文件名称
工艺流程图、作业指导书、工艺守则、操作规程、产品图纸、工艺过程卡、表单
更改文件编号
HBM/GG-WS-OO、HBM/GZ-××、HBM/GS-××、HBM/GC-××、HBM/TZ-WS-××、HBM/GG-WS-00、HBM/BD-××
相关责任部门
生计部
更改日期
2012.05.03
更改容:
HBM/GJ-01-13
14
外购协件检验规程-单包装
HBM/GJ-01-14
15
外购协件检验规程-中包装
HBM/GJ-01-15
16
外购协件检验规程-纸箱
HBM/GJ-01-16
备注:
批准人
批准日期
2012.05.03
更改人
更改日期
2011.05.03
宜兴市恒保乳胶制品
文件更改通知单
编号:005-01表码:HBM/BD-4-005
备注:
批准人
批准日期
2012.05.03
更改人
更改日期
2011.05.03
宜兴市恒保乳胶制品
文件更改通知单
编号:003表码:HBM/BD-4-005
更改文件名称
制度及管理规定汇编
更改文件编号
HBM/GLZD-00
相关责任部门
各部门
更改日期
2012.05.03
更改容:
1.根据洁净室检测新标准,GB/T16292-16294-2010医药工业洁净室(区)沉降菌的测试方法修订HBM/GLZD-03《洁净区环境检测管理制度》;
3.文件中3.0企业简介中”固定资产”500多万元”更改为”1000多万元”,”占地面积6882.6平米,建筑面积2285平方米”更改为”占地面积12000平方米,建筑面积4000平方米”,公司地址:”宜兴市丁蜀镇大浦泽村”更改为”宜兴市丁蜀镇宜浦路136号”;
3.文件中3.1质量管理体系组织机构图,原”总经理”更名为”董事长”,董事长变更为胡国祥;原“生产部”更名为“生技部”;原“销售部”与”生产部下的采购”合并为“供销部”;
备注:
批准人
批准日期
2012.05.03
更改人
更改日期
2011.05.03
宜兴市恒保乳胶制品
文件更改通知单
编号:004表码:HBM/BD-4-005
更改文件名称
外购件检验规程
更改文件编号
HBM/GJ-01-××
相关责任部门
品管部
更改日期
2010.12.25
更改容:
序号
文件名称
文件编号
01
外购协件检验规程-天然乳胶
4.文件中3.2质量方针与目标中2.1年度质量目标出厂合格率提升为98%;
5.文件中质量手册增加附录二体系流程图,附录三-适用标准对照表。
备注:
批准人
批准日期
2012.05.03
更改人
更改日期
2011.05.03
宜兴市恒保乳胶制品
文件更改通知单
编号:002表码:HBM/BD-4-005
更改文件名称
程序文件
3.2按照《生产质量管理规无菌医疗器械实施细则和检查评定标准(试行)》要求,新增加以下管理制度:
人员考核、评价和再评价制度、生产过程清场管理制度、产品清洁管理制度、技术文档管理制度、产品销售管理制度、工作环境条件要求及控制规定、产品返工管理规定、灭菌过程控制管理规定、员工业绩考核、评价和再评价制度、员工培训制度、检验室环境设施管理制度、净化系统验证管理制度、工艺用气验证管理制度、消毒剂管理办法、清洁工具的清洁及存放管理规定、初始污染管理办法、供方的选择和评价及再评价管理规定、无菌产品的清洁和防污染控制管理规定、批号的规定、批记录管理规定、生产区工位器具工艺卫生控制。
HBM/GJ-01-01
02
外购协件检验规程-氧化锌
HBM/GJ-01-02
03
外购协件检验规程-硫磺
HBM/GJ-01-03
04
外购协件检验规程-抗氧剂264
HBM/GJ-01-04
05
外购协件检验规程-促进剂ZDC
HBM/GJ-01-05
06
外购协件检验规程-干酪素
HBM/GJ-01-06
07
外购协件检验规程-分散剂
HBM/GJ-01-07
08
外购协件检验规程-氯化钙
HBM/GJ-01-08
09
外购协件检验规程-PU
HBM/GJ-01-09
10
外购协件检验规程-硬脂酸钙
HBM/GJ-01-10
11
外购协件检验规程-变形淀粉
HBM/GJ-01-11
12
外购协件检验规程-瓷模具
HBM/GJ-01-12
13
外购协件检验规程-单包装折纸
更改文件编号
HBM/CX-00
相关责任部门
管理者代表
更改日期
2012.05.03
更改容:
1.原”总经理”更名为”董事长”, 董事长变更为胡国祥;原“生产部”更名为“生技部”;原“销售部”与”生产部下的采购”合并为“供销部”;
2.增加设计和开发控制程序,文件编号HBM/CX-7-3-2012;
3.设计和开发更改控制程序,文件编号HBM/CX-7-4-2012;
宜兴市恒保乳胶制品
文件更改通知单
编号:001表码:HBM/BD-4-005
更改文件名称
质量手册
更改文件编号
HBM/SC-2012
相关责任部门
管理者代表
更改日期
2012.05.03
更改容:
1.文件编号:HBM/QM 01-2008更正为HBM/SC-2012。
2.文件中2.2应用围中增加医疗器械生产质量管理规无菌医疗器械实施细则和检查评定标准(试行)中不适用条款及说明;
