几种常见金属及其化合物之间的相互转化关系
第三章第12讲铁及其化合物的转化关系2025年高考化学一轮复习

第三章 金属及其化合物
第12讲 铁及其化合物的转化关系
化学
高考总复习精准备考方案
— 返回 —
— 返回 —
[复习目标] 1.基于“价—类”二维图认识铁及其重要化合物之间的转化关系,并应 用于分析、解决相关问题。2.通过实验探究亚铁盐、铁盐的化学性质及相互转化关系。
— 2—
考点一 基于“价—类”二维图理 解铁及其化合物的转化 考点二 “铁三角”的相互转化及实 验探究
棕黄色溶液
+Cu2+
化性
— 21 —
答案
— 返回 —
【解析】 向 FeCl2 溶液中通入 Cl2,Fe2+被氧化为 Fe3+,溶液变成棕黄色,Fe2+作还原 剂,表现还原性,A 正确;向 FeCl2 溶液中加入锌片,Zn 将 Fe2+还原为 Fe,溶液变成无色, Fe2+作氧化剂,表现氧化性,B 正确;向 FeCl3 溶液中加入铁粉,发生反应:2Fe3++Fe===3Fe2 +,Fe 作还原剂,表现还原性,C 正确;向 FeCl3 溶液中加入铜粉,发生反应:2Fe3++Cu===2Fe2 ++Cu2+,溶液由棕黄色变为蓝色,Fe3+作氧化剂,表现氧化性,D 错误。
2Fe3++Cu===2Fe2++Cu2+
。
(3)向 FeSO4 溶液中滴加 KMnO4(H+):
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
。
(4)将 FeCl2 溶液滴入稀硝酸中,有无色气体放出:
3Fe2++NO- 3 +4H+===3Fe3++NO↑+2H2O
。
— 13 —
— 20 —
解析
— 返回 —
二、实验探究“铁三角”的转化关系
3.(教材改编题)为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验
高考化学一轮复习(第二辑)考点26 铝的冶炼及含铝化合物之间的转化(含解析)
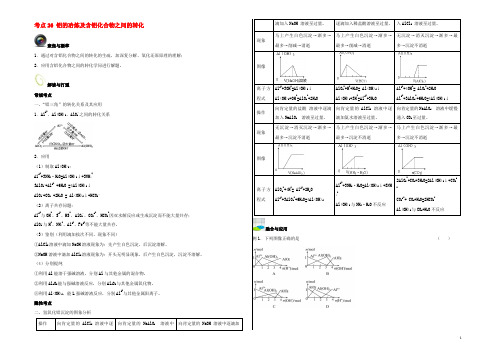
考点26 铝的冶炼及含铝化合物之间的转化聚焦与凝萃1.通过对含铝化合物之间的转化的生疏,加深复分解、氧化还原原理的理解;2.应用含铝化合物之间的转化学问进行解题。
解读与打通常规考点一、“铝三角”的转化关系及其应用1.Al3+、Al(OH)3、AlO-2之间的转化关系2.应用(1)制取Al(OH)3:A13++3NH3·H2O=Al(OH)3↓+3NH4+3AlO-2+Al3+ +6H2O =4Al(OH)3↓AlO-2+CO2 +2H2O = Al(OH)3↓+HCO3-(2)离子共存问题:Al3+与OH-、S2-、HS-、AlO-2、CO32-、HCO3-因双水解反应或生成沉淀而不能大量共存;AlO-2与H+、NH4+、Al3+、Fe3+等不能大量共存。
(3)鉴别(利用滴加挨次不同,现象不同)①AlCl3溶液中滴加NaOH溶液现象为:先产生白色沉淀,后沉淀溶解。
②NaOH溶液中滴加AlCl3溶液现象为:开头无明显现象,后产生白色沉淀,沉淀不溶解。
(4)分别提纯①利用Al能溶于强碱溶液,分别Al与其他金属的混合物。
②利用Al2O3能与强碱溶液反应,分别Al2O3与其他金属氧化物。
⑧利用Al(OH)3,能L强碱溶液反应,分别Al3+与其他金属阳离子。
隐性考点二、氢氧化铝沉淀的图象分析操作向肯定量的AlCl3溶液中逐向肯定量的NaAlO2溶液中向肯定量的NaOH 溶液中逐滴加滴加入NaOH 溶液至过量。
逐滴加入稀盐酸溶液至过量。
入AlCl3溶液至过量。
现象马上产生白色沉淀→渐多→最多→削减→消逝马上产生白色沉淀→渐多→最多→削减→消逝无沉淀→消灭沉淀→渐多→最多→沉淀不消逝图像离子方程式Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2OAlO2-+H++H2O= Al(OH)3↓Al(OH)3+3H+=Al3++3H2OAl3++4OH-= AlO2-+2H2OAl3++3AlO2-+6H2O=4Al(OH)3↓操作向肯定量的盐酸溶液中逐滴加入NaAlO2溶液至过量。
碳硅及其重要化合物间的转化关系

碳硅及其重要化合物间的转化关系全文共四篇示例,供读者参考第一篇示例:碳硅是一种重要的元素,它们在自然界中广泛存在并且具有许多重要的化合物。
碳和硅是两种非金属元素,它们在化学性质上有一些相似之处,因此在一些化学反应中可以相互转化。
在本文中,我们将探讨碳硅及其重要化合物之间的转化关系。
让我们来看一下碳的化合物。
碳是一种非金属元素,它在自然界中存在于多种形式中,如石墨、金刚石和全新炭等。
碳在化学反应中通常以四价的形式存在,它可以与氧、氢、氮等元素形成许多不同的化合物。
碳酸盐是碳循环中的一个重要环节,它在地壳中有着广泛的存在,并且可以通过各种化学反应转化为其他碳化合物,如石灰石、煤炭等。
硅是一种具有金属性质的元素,它在自然界中存在于硅石、石英和硅酸盐等形式中。
硅与氧形成的硅酸盐是地壳中的主要组成,它们可以通过地球内部的热液作用、熔融作用等过程来形成。
硅也可以与其他元素形成许多重要化合物,如硅烷、硅酸等。
碳硅在化学性质上有一些相似之处,因此它们在一些化学反应中可以相互转化。
碳可以与硅直接反应,生成碳硅化合物,如碳化硅。
碳化硅是一种重要的半导体材料,它具有优良的导电性能和热导率,被广泛应用于电子器件、太阳能电池等领域。
碳硅材料还可以通过不同的方法制备,如化学气相沉积、烧结等。
碳硅及其重要化合物之间存在着多种转化关系,它们在材料科学、化工等领域中有着广泛的应用前景。
通过深入研究碳硅化学性质及其相互转化关系,我们可以更好地利用这些重要元素和化合物,推动科学技术的发展,实现材料的创新和应用。
希望本文能够帮助读者更深入地了解碳硅及其重要化合物之间的转化关系,激发对这一领域的兴趣和热情。
希望碳硅化学的研究能够为人类社会的可持续发展做出更大的贡献。
【2000字】。
第二篇示例:碳硅是一种重要的元素,其在自然界中的存在形式有许多,包括石墨、金刚石等,而碳硅也是一种重要的金属loid,其在化学反应中具有独特的性质和作用。
碳硅及其重要化合物间的转化关系,既包括碳硅之间的相互转化,也包括碳硅与其他元素形成的化合物之间的转化关系。
高三化学一轮复习:元素或物质推断题 (1)

高考化学一轮复习:元素或物质推断题1.(2022·湖北·高三期中)分类思想以及用分类思想研究一类物质的通性和特殊性是学习化学的一种重要思维方式和手段。
以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。
请根据你所学的知识,已知:2233NO H O 2HNO NO +=+。
按要求填空:(1)上述第一级分类标准(分成A 、B 组的依据)是_______。
(2)B 组中既不是电解质也不是非电解质的是_______。
(3)E 组中物质有_______(填化学式)。
(4)2SO 属于酸性氧化物,类似于2CO ,从而认为2SO 可以归于C 组。
预测2SO 可以和足量NaOH 溶液反应,反应的离子方程式为_______。
(5)F 组中有一种物质常用来制备“84”消毒液,制备“84”消毒液的离子方程式为_______。
(6)饱和的3FeCl 溶液滴入沸水可得到以()3Fe OH 为分散质的红褐色胶体。
①该红褐色胶体中()3Fe OH 粒子的直径大小范围是_______。
①3FeCl 溶液滴入沸水可得到()3Fe OH 红褐色胶体的反应的离子方程式是_______。
2.(2022·浙江·高三期中)盐X 只含四种短周期元素,按如下流程进行实验:已知:气体C 能使湿润红色石蕊变蓝。
请回答:(1)盐X 含_______(填元素符号),气体C 的VSEPR 模型为_______。
(2)盐X 与足量NaOH 溶液在加热条件下的离子方程式_______。
(3)盐B 对应的酸常温常压下为无色结晶性粉末,主要用于氧化剂、磺化剂及硝化反应中的脱水剂,制染料、炸药,石油产品精制和其他有机磺酸化合物。
根据以上信息判断,下列物质中一定条件下能与该酸反应的是_______。
A .甲苯B .224KC O C .2SOD .Cu(4)工业上盐B 重要的用途之一是溶解难溶氧化物生成常见的盐,请写出盐B 与23Al O 反应的化学方程式_______。
高中化学第7讲 常见元素及其化合物的性质及转化(教案)

第7课时 核心价值——常见元素及其化合物的性质及转化(学科本质价值)常见元素及其化合物的性质及转化是高考命题的热点,该类试题体现《化学课程标准》对“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”等学科核素素养的要求,要求考生能从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“性质决定性质”的观念,能从宏观和微观相结合的视角分析与解决实际问题。
1.直线型转化关系A ――→XB ――→XC (1)X 为O 2Na ―→Na 2O ―→Na 2O 2N 2―→NO ―→NO 2或NH 3―→NO ―→NO 2 S ―→SO 2―→SO 3或H 2S ―→SO 2―→SO 3 C ―→CO ―→CO 2或CH 4―→CO ―→CO 2 醇―→醛―→羧酸 (2)X 为CO 2NaOH ――→CO 2Na 2CO 3――→CO 2NaHCO 3 (3)X 为强酸,如HClNaAlO 2――→HCl Al(OH)3――→HCl AlCl 3Na 2CO 3――→HClNaHCO 3――→HClCO 2 (4)X 为强碱,如NaOHAlCl 3――→NaOHAl(OH)3――→NaOHNaAlO 2 2.交叉型转化3.三角型转化4.注意反应形式与物质的关系,特别是置换反应 (1)金属―→金属:金属+盐―→盐+金属,铝热反应。
(2)金属―→非金属:活泼金属+H 2O(或H +)―→H 2,2Mg +CO 2=====点燃2MgO +C 。
(3)非金属―→非金属:2F 2+2H 2O===4HF +O 2,2C +SiO 2=====高温Si +2CO ↑,C +H 2O(g)=====高温CO +H 2,X 2+H 2S===2HX +S ↓。
(4)非金属―→金属:用H 2、C 冶炼金属。
(2020·江苏卷)下列选项所示的物质间转化均能实现的是( )A .NaCl(aq)――→电解Cl 2(g)――→石灰水漂白粉(s)B .NaCl(aq)――→CO 2(g )NaHCO 3(s)――→加热Na 2CO 3(s)C .NaBr(aq)――→Cl 2(g )Br 2(aq)――→NaI (aq )I 2(aq)D .Mg(OH)2(s)――→HCl (aq )MgCl 2(aq)――→电解Mg(s)C [由Cl 2制备漂白粉应通入石灰乳而不是石灰水中,A 项错误。
中考复习 [初中化学解题思路与训练] 酸、碱、盐、氧化物之间的相互转化
![中考复习 [初中化学解题思路与训练] 酸、碱、盐、氧化物之间的相互转化](https://img.taocdn.com/s3/m/04286a7ace2f0066f53322c9.png)
第12讲酸、碱、盐、氧化物之间的相互转化【知识要点】1.单质、氧化物、酸、碱、盐之间的相互转化关系金属单质→某些金属氧化物→碱→盐例如:Ca→CaO→Ca(OH)2→CaCO3非金属单质某些非金属氧化物→酸→盐盐例如:C→CO2→H2CO3→CaCO3酸、碱、盐溶液之间可以发生复分解反应。
判断酸、碱、盐溶液中两种化合物之间能发生复分解反应的依据是:反应物互相交换成分,生成的另外两种化合物中有一种是沉淀或是气体或是水。
某些非金属氧化物可与水发生化合反应生成对应的酸,如CO2、SO3。
CO2+H2O==H2CO3SO3+H2O==H2SO4某些金属氧化物可以与水发生化合反应生成对应的可溶性碱,如CaO、Na2O等。
CaO+H2O==Ca(OH)2Na2O+H2O==2NaOH2.化学反应的现象之一是颜色的变化,要熟记一些常见物质的颜色(1)溶液的颜色①蓝色溶液:含Cu2+的溶液,如CuSO4溶液、CuCl2溶液(带绿色)。
②浅绿色溶液:含Fe2+的溶液,如FeSO4溶液、FeCl2溶液。
(2)沉淀的颜色①不溶于水也不溶于稀硝酸的白色沉淀物是AgCl、BaSO4。
②不溶于水但能溶于酸,且能产生大量气泡,生成的气体能使澄清石灰水变浑浊的白色沉淀物是CaCO3、MgCO3、BaCO3。
⑤不溶于水的蓝色沉淀物是Cu(OH)2。
④不溶于水的红褐色沉淀物是Fe(OH)3。
⑤不溶于水的白色沉淀物是Mg(OH)2、Al(OH)3。
【试题精析】1.(2009年广州)A、B、C、D、E五瓶无色透明溶液,分别是HCl溶液、Na2CO3溶液、MgCl2溶液、NaNO3溶液、NaOH溶液中的一种。
分别进行下列实验:I.将A分别滴入B、C、D、E中,均没有明显现象。
II.将B分别滴入A、C、D、E中,C、E中均产生白色沉淀,其余没有明显现象。
III.将C分别滴入A、B、D、E中,B中产生白色沉淀,D中有气泡冒出,其余没有明显现象。
各类物质之间的相互转化关系
天才在于勤奋,聪明在于积累。
班级姓名小组专题复习之各类物质之间的相互转化关系〖复习目标〗:掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。
1.酸、碱、盐、氧化物之间相互转化关系网络图2.理解两种反应条件复分解反应发生的条件:(1)从定以上分析:复分解反应是两种化合物相互交换成份生成另外两种化合物的反应。
判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。
如:2NaOH + CO2=Na2CO3+H2O就不属于复分解反应,因为两种反应物没有相互交换成份。
再如:CaCO3+2HCl=CaCl2+H2O+CO2↑,从形式上来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO3+2HCl=CaCl2+H2CO3,H2CO3不稳定分解为H 2O和CO2,因此该却反应属于复分解反应。
(2)复分解反应发生的条件是:①对于反应物来说:盐与碱、盐与盐反应时,两种反应物必须全部溶于水。
②对于生成物来说要么有水生成,要么有沉淀生成,要么有气体生成。
金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。
(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。
酸、碱、盐及氧化物、金属和非金属单质等物质之间的相互转化关系——八圈图记忆口诀:两条纵线通到底(6条规律)四条横线相联系(5条规律)六条交叉成网络(6条规律)17条规律要牢记(横、纵各有1条重复6+5+6=17)规律:天才在于勤奋,聪明在于积累。
班级姓名小组分解反应以上规律的应用:①可知某物质性质②某物质制法(箭尾)(箭头指向)③各类物质间相互关系从上述规律中可以总结出制盐的十种方法,包括:(2)~(16)【典型例题】[例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。
铁、铁的氧化物和铁的氢氧化物铁及其化合物之间的转化关系

解析:检验药品中是否含有铁离子,应先将药品溶解,然后 再向其中加入 KSCN 溶液,观察溶液是否变红。 答案:剥去糖衣,取出药片溶解于适量的蒸馏水中配成溶液, 取少量溶液于试管中,滴加 2~3 滴 KSCN 溶液,如果溶液出 现红色,则证明 FeSO4 已被氧化;如果不出现红色,则证明 FeSO4 未 被 氧 化 。 有 关 化 学 方 程 式 为 Fe2(SO4)3 + 6KSCN===2Fe(SCN)3+3K2SO4
(2) 根 据 乙 的 上 述 实 验 , 说 明 补 铁 剂 中 的 铁 为 __________________________________。 (3)向补铁剂溶液中滴加 KSCN 溶液,显淡红色的原因: ________________________。 (4)请根据乙同学的实验现象进一步推断,氯、溴的单质可将 铁单质氧化成________价铁,而 Fe 与 I2 反应的产物应该是 ________。 答案:(1)不合理 (2)+2 价铁 (3)少量的 Fe2+被氧化成 Fe3+ (4)+3 FeI2
解析:选 C。铁粉与氯化铜溶液反应生成氯化亚铁和单质铜; FeO 与稀硫酸反应生成硫酸亚铁和水;Fe(OH)3 与过量稀盐酸 反应生成氯化铁和水,氯化铁与过量铁粉反应生成氯化亚铁, 滴入 KSCN 溶液不会显红色,选项 A、B、D 错误;Fe 与稀 盐酸反应生成氯化亚铁和氢气,氯化亚铁与氯气反应生成氯 化铁,滴入 KSCN 溶液,溶液显红色,选项 C 正确。
1.(2019·宜良一中高一月考)下列关于铁与盐酸反应的叙述不 正确的是( ) A.该反应是置换反应 B.铁是还原剂 C.HCl 是氧化剂 D.产物是氯化铁和氢气
解析:选 D。铁与盐酸发生置换反应生成氯化亚铁和氢气,化 学方程式为 Fe+2HCl===FeCl2+H2↑,该反应的还原剂是铁, 氧化剂是 HCl,所以 D 错误。
