化学氧化还原反应的专项培优练习题(含答案)及答案.docx
备战高考化学培优专题复习氧化还原反应练习题附答案
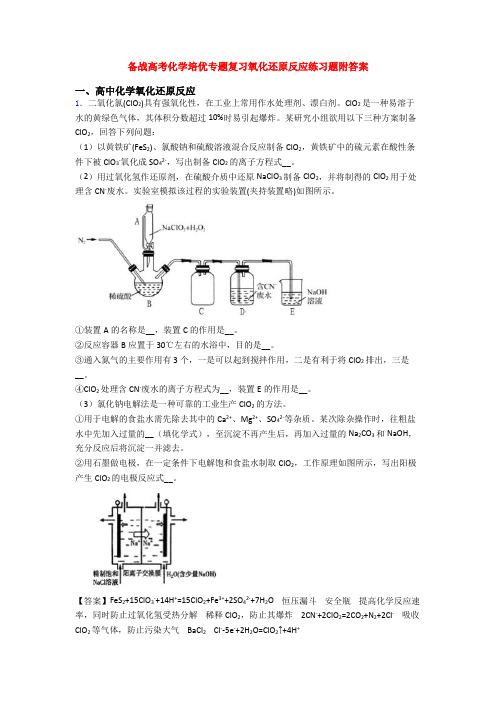
备战高考化学培优专题复习氧化还原反应练习题附答案一、高中化学氧化还原反应1.二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。
ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸。
某研究小组欲用以下三种方案制备ClO2,回答下列问题:(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备ClO2的离子方程式__。
(2)用过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2用于处理含CN-废水。
实验室模拟该过程的实验装置(夹持装置略)如图所示。
①装置A的名称是__,装置C的作用是__。
②反应容器B应置于30℃左右的水浴中,目的是__。
③通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是__。
④ClO2处理含CN-废水的离子方程式为__,装置E的作用是__。
(3)氯化钠电解法是一种可靠的工业生产ClO2的方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。
某次除杂操作时,往粗盐水中先加入过量的__(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,工作原理如图所示,写出阳极产生ClO2的电极反应式__。
【答案】FeS2+15ClO3-+14H+=15ClO2+Fe3++2SO42-+7H2O 恒压漏斗安全瓶提高化学反应速率,同时防止过氧化氢受热分解稀释ClO2,防止其爆炸 2CN-+2ClO2=2CO2+N2+2Cl-吸收ClO2等气体,防止污染大气 BaCl2 Cl--5e-+2H2O=ClO2↑+4H+【解析】【分析】二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。
分别利用无机反应和电解原理制备二氧化氯,三种方法均利用了氧化还原反应。
培优氧化还原反应辅导专题训练附答案

钟不恢复原色94注偏低偏低OH H15一、高中化学氧化还原反应练习题(含详细答案解析)1.工业上处理含苯酚废水的过程如下。
回答下列问题:I •测定废水中苯酚的含量。
测定原理:DH +3Br 2T fkJ +3HBr测定步骤:步骤1:准确量取25.00mL 待测废水于250mL 锥形瓶中。
步骤2:将5.00mL amol L 1浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入 bmL 0.i0mol L 1 KI 溶液(过量),塞紧瓶塞,振荡。
步骤4滴入2~3滴指示剂,再用0.010mol L 1 Na zE O ?标准溶液滴定至终点,消耗Na 22 3 4 5 62O 3溶液V 1mL (反应原理:丨2 2Na 2S 2O 3 2NaI Na 2S 4O 6 )o 待测废水换为蒸馏 水,重复上述步骤(即进行空白实验),消耗Na z S z O s 溶液V z mL 。
(1)步骤1 ”量取待测废水所用仪器是 _____ 。
⑵为了防止溴的挥发,上述步骤中采取的措施包括迅速加入试剂和 _______ 。
(3)步骤4”滴定终点的现象为 ______ 。
⑷该废水中苯酚的含量为 __________ mg L 1(用含V 1、V 2的代数式表示)。
如果空白实验中 步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量 ___________ (填 偏高”偏低”或 无影响” 下同);如果空白实验中 步骤4”滴定至终点时俯视读数,则测得的废水中苯酚的含量C 6H 5OH 14H 2O 2 6CO 217H 2O【解析】 【分析】向呈有待测废水加入浓溴水反应后得到三溴苯酚的沉淀,再加入 KI 溶液与剩下的B 「2发生氧化还原反应得到I 2,方程式为Br 2+2「===l 2+2Br -,再用Na 2S2Q 标准溶液滴定 b,可根据消 耗的Na 2S 2O 3标准溶液的体积和浓度算出溶液中剩余的Br 2的物质的量,再设置一个空白实n .处理废水。
化学氧化还原反应的专项培优练习题(含答案)附详细答案

一、高中化学氧化还原反应练习题(含详细答案解析)1.阳极泥处理后的沉渣中含AgCl,工业上可用Na2SO3溶液作浸取剂浸出回收。
某小组在实验室模拟该过程。
已知:i.25o C时,部分物质的溶解度:AgCl 1.9×10–4 g;Ag2SO3 4.6×10–4 g;Ag2SO40.84 g。
ii.25o C时,亚硫酸钠溶液酸化过中含4S+微粒的物质的量分数随pH变化如图所示。
Ⅰ.浸出氯化银取AgCl固体,加入1 mol/L Na2SO3溶液作浸取剂,充分反应后过滤得到浸出液(pH=8),2SO- [Ag(SO3)2]3– + Cl–。
该过程中发生的反应为AgCl +23(1)用平衡移动原理解释AgCl溶解的原因是___。
Ⅱ. 酸化沉银(2)经检测,沉淀m为AgCl,则溶液m中含4S+微粒的主要存在形式是________。
(3)探究沉淀n的成分。
①甲同学认为沉淀n一定不含Ag2SO4,其依据是________。
②乙同学认为沉淀n可能含Ag2SO3,进行实验验证。
i. 本实验设计的依据是:Ag2SO3具有________性。
ii. 乙同学观察到________,得出结论“沉淀n不含Ag2SO3”。
③丙同学从溶液n的成分角度再次设计实验证明沉淀n不含Ag2SO3。
i. 本实验设计的依据是:若沉淀n含Ag2SO3,则溶液n中含1Ag+微粒的总物质的量___(填“>”、“=”或“<”)Cl–物质的量。
ii. 结合实验现象简述丙同学的推理过程:____。
Ⅲ.浸取剂再生(4)溶液m经处理后可再用于浸出AgCl,请简述该处理方法____。
【答案】AgCl(s)Ag+(aq)+ Cl-(aq) ,Ag+与SO 32- 结合生成[Ag(SO3)2]3–,促进AgCl的溶解平衡正向移动 HSO3- Ag2SO4的溶解度远大于AgCl或Ag2SO3,溶液中Ag+ 的浓度很小还原b.中清液的颜色与..,均为浅紫色溶液< e中无沉淀生成,说明清液中没有Cl-,则.......c.相同溶液n中加入稀硝酸使[Ag(SO3)2]3–全部转化为Ag+,Ag+将Cl–全部沉淀,由此可知溶液n中含Ag元素的微粒总物质的量不小于n(Cl–) 加NaOH溶液调节pH至9~10【解析】【分析】I、(1)利用平衡移动的知识答题即可;II、(2)生成沉淀m时,溶液m的pH为5,观察图像,可以得知HSO3-的物质的量分数占100%;(3)①溶液中Ag+的浓度很小,而Ag2SO4的溶解度较大,故不会形成Ag2SO4沉淀;②依据Ag2SO3的还原性答题;③e中无沉淀生成,说明清液中没有Cl-,则溶液n中加入稀硝酸使[Ag(SO3)2]3–全部转化为Ag+,Ag+将Cl–全部沉淀,由此可分析出溶液n中含Ag元素的微粒总物质的量不小于n(Cl–);III、(4)m溶液中的溶质为NaHSO3,浸取剂为Na2SO3溶液,需要加入NaOH溶液将NaHSO3转化为Na2SO3。
高考化学培优专题复习氧化还原反应练习题含答案

高考化学培优专题复习氧化还原反应练习题含答案一、高中化学氧化还原反应1.阳极泥处理后的沉渣中含AgCl,工业上可用Na2SO3溶液作浸取剂浸出回收。
某小组在实验室模拟该过程。
已知:i.25o C时,部分物质的溶解度:AgCl 1.9×10–4 g;Ag2SO3 4.6×10–4 g;Ag2SO40.84 g。
ii.25o C时,亚硫酸钠溶液酸化过中含4S+微粒的物质的量分数随pH变化如图所示。
Ⅰ.浸出氯化银取AgCl固体,加入1 mol/L Na2SO3溶液作浸取剂,充分反应后过滤得到浸出液(pH=8),2SO- [Ag(SO3)2]3– + Cl–。
该过程中发生的反应为AgCl +23(1)用平衡移动原理解释AgCl溶解的原因是___。
Ⅱ. 酸化沉银(2)经检测,沉淀m为AgCl,则溶液m中含4S+微粒的主要存在形式是________。
(3)探究沉淀n的成分。
①甲同学认为沉淀n一定不含Ag2SO4,其依据是________。
②乙同学认为沉淀n可能含Ag2SO3,进行实验验证。
i. 本实验设计的依据是:Ag2SO3具有________性。
ii. 乙同学观察到________,得出结论“沉淀n不含Ag2SO3”。
③丙同学从溶液n的成分角度再次设计实验证明沉淀n不含Ag2SO3。
i. 本实验设计的依据是:若沉淀n含Ag2SO3,则溶液n中含1Ag+微粒的总物质的量___(填“>”、“=”或“<”)Cl–物质的量。
ii. 结合实验现象简述丙同学的推理过程:____。
Ⅲ.浸取剂再生(4)溶液m经处理后可再用于浸出AgCl,请简述该处理方法____。
【答案】AgCl(s)Ag+(aq)+ Cl-(aq) ,Ag+与SO 32- 结合生成[Ag(SO3)2]3–,促进AgCl的溶解平衡正向移动 HSO3- Ag2SO4的溶解度远大于AgCl或Ag2SO3,溶液中Ag+ 的浓度很小还原b.中清液的颜色与..,均为浅紫色溶液< e中无沉淀生成,说明清液中没有Cl-,则.......c.相同溶液n中加入稀硝酸使[Ag(SO3)2]3–全部转化为Ag+,Ag+将Cl–全部沉淀,由此可知溶液n中含Ag元素的微粒总物质的量不小于n(Cl–) 加NaOH溶液调节pH至9~10【解析】【分析】I、(1)利用平衡移动的知识答题即可;II、(2)生成沉淀m时,溶液m的pH为5,观察图像,可以得知HSO3-的物质的量分数占100%;(3)①溶液中Ag+的浓度很小,而Ag2SO4的溶解度较大,故不会形成Ag2SO4沉淀;②依据Ag2SO3的还原性答题;③e中无沉淀生成,说明清液中没有Cl-,则溶液n中加入稀硝酸使[Ag(SO3)2]3–全部转化为Ag+,Ag+将Cl–全部沉淀,由此可分析出溶液n中含Ag元素的微粒总物质的量不小于n(Cl–);III、(4)m溶液中的溶质为NaHSO3,浸取剂为Na2SO3溶液,需要加入NaOH溶液将NaHSO3转化为Na2SO3。
化学氧化还原反应的专项培优练习题(含答案)附答案解析.docx

一、高中化学氧化还原反应练习题(含详细答案解析)1.碘酸钾(KIO3)是重要的微量元素碘添加剂。
实验室设计下列实验流程制取并测定产品中 KIO 3的纯度:其中制取碘酸(HIO 3)的实验装置见图,有关物质的性质列于表中物质性质3白色固体,能溶于水,难溶于CCl4HIOKIO①白色固体,能溶于水,难溶于乙醇-+ Cl-②碱性条件下易发生氧化反应:ClO-+IO3- =IO43回答下列问题(1)装置 A 中参加反应的盐酸所表现的化学性质为______________。
(2)装置 B 中反应的化学方程式为 ___________________ 。
B 中所加 CCl4的作用是_________从而加快反应速率。
(3)分离出 B 中制得的HIO 3水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低KIO 3的产率。
(4)为充分吸收尾气,保护环境,C 处应选用最合适的实验装置是____________(填序号)。
(5)为促使KIO3晶体析出,应往中和所得的KIO 3溶液中加入适量的___________。
(6)取 1.000g KIO3产品配成 200.00mL 溶液,每次精确量取20.00mL 溶液置于锥形瓶中,加入足量KI 溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L Na 2S2 O3溶液滴定。
滴定至终点时蓝色消失(I 2 +2S2 O32- =2I - +S4O 62-),测得每次平均消耗Na 2S2O3溶液25.00mL。
则产品中KIO3的质量分数为 ___(结果保留三位有效数字)。
【答案】还原性、酸性5CI 2 +I 2 +6H 2O==2HIO 3 +10HCl充分溶解 I 2和 Cl 2,以增大反应物浓度分液除去 Cl 2(或ClO-),防止氧化KIO 3 C 乙醇(或酒精)89.5%。
【解析】【分析】装置 A 用于制取Cl2,发生的反应为:KClO3+6HCl(浓 )=KCl+3Cl2↑+3H2O,装置 B 中发生的是制取 HIO3的反应,装置 C 为尾气处理装置,既要吸收尾气中的HCl 和 Cl2,还要防止倒吸。
备战高考化学氧化还原反应(大题培优 易错 难题)含详细答案

一、高中化学氧化还原反应练习题(含详细答案解析)1.叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的主要成分。
NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。
实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。
(1)制备亚硝酸叔丁酯取一定NaNO2溶液与50%硫酸混合,发生反应H2SO4+2NaNO2===2HNO2+Na2SO4。
可利用亚硝酸与叔丁醇(t-BuOH)在40℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:____________。
(2)制备叠氮化钠(NaN3)按如图所示组装仪器(加热装置略)进行反应,反应的化学方程式为:t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH。
①装置a的名称是______________;②该反应需控制温度在65℃,采用的实验措施是____________________;③反应后溶液在0℃下冷却至有大量晶体析出后过滤。
所得晶体使用无水乙醇洗涤。
试解释低温下过滤和使用无水乙醇洗涤晶体的原因是____________。
(3)产率计算①称取2.0g叠氮化钠试样,配成100mL溶液,并量取10.00mL溶液于锥形瓶中。
②用滴定管加入0.10mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00mL(假设杂质均不参与反应)。
③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。
已知六硝酸铈铵[(NH4)2Ce(NO3)6]与叠氮化钠反应生成硝酸铵、硝酸钠、氮气以及Ce(NO3)3,试写出该反应的化学方程式____________________________;计算叠氮化钠的质量分数为________(保留2位有效数字)。
化学氧化还原反应的专项培优练习题(含答案)含详细答案.doc

化学氧化还原反应的专项培优练习题( 含答案 ) 含详细答案一、高中化学氧化还原反应1.Na2S2O4(连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。
制取Na2S2 O4的方法很多,(1)在碱性溶液中用NaBH 4还原NaHSO3法制备Na2S2O4的反应原理为:NaBH 4 NaHSO 3 NaOH Na 2S2O4 NaBO 2 H 2O (未配平)反应装置如图所示:①实验开始及整个过程中均需通入N 2,其目的是__________________________________ 。
②制备过程中温度需控制在10~45℃,采用水浴加热的主要优点是______________________ 。
③为使 NaHSO 3尽可能完全被还原,加入三口烧瓶中的反应液,应控制n NaHSO 3______________。
n NaBH 4(2)用HCOONa还原SO2制备Na2S2O4的装置(夹持加热仪器略)如下:①装置 a 烧瓶中发生反应的化学方程式为_________________________________ 。
②装置 b 用于净化SO2,适宜的试剂是______________________________ 。
③装置 c 在 70~83℃生成Na2S2O4并析出,同时逸出CO2,该反应的化学方程式为________________________ ,加入CH3OH的目的是 ________________________ ;利用反应后的浊液分离提纯Na2S2O4需经过的操作为_____________________________________________________ 。
【答案】排出装置内空气,使反应在无氧状况下进行使反应液均匀受热小于 8:1(或<8)Na2SO32HCl 2NaCl H 2 O SO2 饱和 NaHSO 3溶液2HCOONa 4SO2 Na2 CO3 2Na 2S2O4 H 2O 3CO2降低 Na 2S2O 4的溶解度过滤、洗涤、重结晶、过滤、干燥【解析】【分析】(1)①Na2S2O4在空气中极易被氧化,通入N 2其目的是排出装置内空气;②采用水浴加热的主要优点是使反应液均匀受热;③ NaBH 4 NaHSO 3 NaOH Na 2S2O4 NaBO 2 H 2O ,根据得失电子守恒可知,n NaHSO 3=8;n NaBH 4(2)①装置 a 烧瓶中发生 Na2 SO3与盐酸反应生成SO2的反应;②生成的SO2气体中含有HCl 气体,根据性质选择除杂溶液;③装置 c 在 70~83℃HCOONa和SO2、Na2CO3反应生成Na2S2O4并析出,同时逸出CO2;Na2S2O4不溶于甲醇,加入CH3OH可降低Na2S2O4的溶解度;利用反应后的浊液分离提纯 Na 2S2O4需重结晶。
化学氧化还原反应的专项培优练习题(含答案)附答案

一、高中化学氧化还原反应练习题(含详细答案解析)1.高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+ KClO3+ 6KOH熔融3K2MnO4+ KCl+3H2OK2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3将MnO2熔融氧化所得产物的热浸取液装入三颈烧瓶,再通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。
回答下列问题:(1)仪器a的名称是______。
(2)MnO2熔融氧化应放在______中加热(填仪器编号)。
①烧杯②瓷坩埚③蒸发皿④铁坩埚(3)为了能充分利用CO2,装置中使用了两个气囊。
当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。
待气囊F收集到较多气体时,关闭旋塞______,打开旋塞______,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。
然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
(4)除去K2MnO4歧化产物中MnO2的操作方法是______。
(5)将三颈烧瓶中所得产物经过一系列操作得到针状的高锰酸钾晶体,最后采用低温烘干的方法来干燥产品,原因是______。
【答案】长颈漏斗④ AC BDE 过滤高锰酸钾晶体受热易分解【解析】【分析】(1)由实验装置可知,仪器a为长颈漏斗;(2)熔融固体物质需要在坩埚内加热,加热熔融物含有碱性KOH应用铁坩埚;(3)该操作的目的是将气囊F中的二氧化碳排出,据此判断正确的操作方法;(4)高锰酸钾溶于水,二氧化锰不溶于水;(5)高锰酸钾晶体受热易分解。
【详解】(1)由实验装置可知,仪器a为长颈漏斗,故答案为:长颈漏斗;(2)熔融固体物质需要在坩埚内加热,加热熔融物中含有碱性KOH,瓷坩埚中含有二氧化硅,二氧化硅能够与氢氧化钾反应,所以应用铁坩埚,故答案为:④;(3)待气囊F收集到较多气体时,需要将气囊F中二氧化碳排出到热K2MnO4溶液中,所以需要关闭A、C,打开B、D、E,轻轻挤压气囊F,从而使CO2气体缓缓地压入K2MnO4溶液中再次反应,故答案为:AC;BDE;(4)高锰酸钾溶于水,二氧化锰不溶于水,固液分离应用过滤的方法,则除去高锰酸钾溶液中的二氧化锰应用过滤的方法,故答案为:过滤;(5)高锰酸钾晶体受热易分解,实验时应采用低温烘干的方法来干燥产品,避免高锰酸钾晶体受热发生分解,故答案为:高锰酸钾晶体受热易分解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、高中化学氧化还原反应练习题(含详细答案解析)1.ClO2是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成NaClO2 固体,模拟工业上用过氧化氢法制备NaClO2固体的实验装置如图所示。
已知: ClO2熔点-59℃、沸点11℃、H2O2沸点150℃A 中的化学方程式:2NaClO 3H 2O 2H 2SO42ClO 2O 2Na 2SO42H 2O(1)NaClO 3放入仪器A中,仪器B中的药品是__________(写化学式)。
如果仪器B改成分液漏斗,实验过程中可能会出现的实验现象__________。
(2)C 装置有明显缺陷,请绘出合理的装置图(标明气流方向 )__________。
(3)向A装置中通入空气,其作用是赶出ClO2,然后通过 C 再到 D 中反应。
通空气不能过快的原因是__________ ,通空气也不能过慢原因是__________。
(4)冰水浴冷却的目的是__________ 。
a.降低NaClO2的溶解度b.减少H 2 O2的分解c.使ClO2变为液态d.加快反应速率(5)写出D中发生反应的化学方程式__________ ,H2O2在反应起到 __________作用。
假设在反应中消耗掉H 2O2a g 则有__________mol电子转移。
【答案】 H2O2液体无法顺利滴落空气流速快时,ClO2不能被充分吸收空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解abc2ClO +H O +2NaOH=2NaClO +O ↑ +2H O 还原剂 a/17222222【解析】【分析】氯酸钠 (NaClO32)在酸性条件下与过氧化氢生二氧化氯,ClO 与氢氧化钠溶液和过氧化氢发生氧化还原反应生成 NaClO22的溶解度随温度升高而增大,通过冷却结晶,过滤洗涤, NaClO得到晶体NaClO2?3H2O。
【详解】(1)NaClO 3放入仪器A中,仪器B中的药品是H2O2,仪器B为滴液漏斗,其目的是平衡气压,使得溶液能够顺利滴入,如果仪器 B 改成分液漏斗,实验过程中可能会出现的实验现象是:分液漏斗中的液体无法顺利滴落,反应无法继续进行;(2)实验中 C 的作用是防止倒吸, C 装置中的右侧导管太短,不利于气体的流动,合理的装置图为:;(3)向A装置中通入空气,其作用是赶出ClO2,然后通过C再到D中反应。
空气流速不能过快,因为空气流速快时, ClO2不能被充分吸收;空气流速也不能过慢,空气流速过慢时, ClO2不能及时被移走,浓度过高导致分解;(4)NaClO2的溶解度随温度升高而增大,过氧化氢易分解,所以冰水浴冷却的目的是:降低NaClO2的溶解度、减少H 2 O2的分解,由于ClO2的沸点较低,所以还能使ClO2变为液态,方便使用;(5)写出D中发生反应的化学方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑ +2H2O,H2O2在反应中得电子,起到还原剂的作用。
反应中存在关系:H 2O2~2e-,若在反应中消耗掉-1H 2O 2 a g ,则转移的电子的物质的量为:2×a g/(34gmol·)= a/17mol。
2.高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO熔融3K MnO + KCl+3H O熔融氧化: 3MnO + KClO + 6KOH223242K2MnO 4歧化: 3K2MnO 4+2CO2= 2KMnO 4+MnO 2↓ +2K2CO3将 MnO 2熔融氧化所得产物的热浸取液装入三颈烧瓶,再通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、 B、 C、D、 E 为旋塞, F、 G 为气囊, H 为带套管的玻璃棒。
回答下列问题:(1)仪器 a 的名称是 ______。
(2)MnO 2熔融氧化应放在______中加热 (填仪器编号 )。
①烧杯②瓷坩埚③蒸发皿④铁坩埚(3)为了能充分利用CO2,装置中使用了两个气囊。
当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、 D,往热 K2MnO4溶液中通入CO2气体,未反应的 CO2被收集到气囊 F 中。
待气囊 F 收集到较多气体时,关闭旋塞______,打开旋塞______,轻轻挤压气囊F,使 CO2气体缓缓地压入 K2MnO 4溶液中再次反应,未反应的CO2气体又被收集在气囊G 中。
然后将气囊 G 中的气体挤压入气囊 F 中,如此反复,直至K2MnO 4完全反应。
(4)除去 K2MnO4歧化产物中MnO2的操作方法是______。
(5)将三颈烧瓶中所得产物经过一系列操作得到针状的高锰酸钾晶体,最后采用低温烘干的方法来干燥产品,原因是______。
【答案】长颈漏斗④AC BDE 过滤高锰酸钾晶体受热易分解【解析】【分析】(1)由实验装置可知,仪器 a 为长颈漏斗;(2)熔融固体物质需要在坩埚内加热,加热熔融物含有碱性KOH应用铁坩埚;(3)该操作的目的是将气囊 F 中的二氧化碳排出,据此判断正确的操作方法;(4)高锰酸钾溶于水,二氧化锰不溶于水;(5)高锰酸钾晶体受热易分解。
【详解】(1)由实验装置可知,仪器 a 为长颈漏斗,故答案为:长颈漏斗;(2)熔融固体物质需要在坩埚内加热,加热熔融物中含有碱性KOH,瓷坩埚中含有二氧化硅,二氧化硅能够与氢氧化钾反应,所以应用铁坩埚,故答案为:④;(3)待气囊 F 收集到较多气体时,需要将气囊 F 中二氧化碳排出到热 K2 MnO4溶液中,所以需要关闭 A、C,打开 B、 D、 E,轻轻挤压气囊F,从而使 CO2气体缓缓地压入K2MnO4溶液中再次反应,故答案为:AC; BDE;(4)高锰酸钾溶于水,二氧化锰不溶于水,固液分离应用过滤的方法,则除去高锰酸钾溶液中的二氧化锰应用过滤的方法,故答案为:过滤;(5)高锰酸钾晶体受热易分解,实验时应采用低温烘干的方法来干燥产品,避免高锰酸钾晶体受热发生分解,故答案为:高锰酸钾晶体受热易分解。
3.某工业废水中主要含有 Cr3+,同时还含有少量的 Fe3+、 Fe2+、Al3+、Ca2+和 Mg 2+等,且酸性较强。
为回收利用,通常采用如下流程处理:注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH 见下表。
氢氧化物Fe(OH)32Mg(OH)233Fe(OH)Al(OH)Cr(OH) pH 3.79.611.189(>9 溶解 )(1)氧化过程中可代替 H2O2加入的试剂是 ________(填序号 )。
A. Na O B. HNO C.FeCl D. KMnO42233(2)加入 NaOH 溶液调整溶液pH= 8 时,除去的离子是________;已知钠离子交换树脂的原理: M n++ nNaR→MR n+ nNa+,此步操作被交换除去的杂质离子是__________。
A. Fe3+B. Al3+ C. Ca2+ D. Mg2+(3)还原过程中,每消耗0.8 mol Cr2O72-转移 4.8 mol e -,该反应离子方程式为____________。
【答案】 A AB CD3S232—272—+42—3+2O+ 4Cr O+ 26H = 6SO+ 8Cr +13H O【解析】【分析】某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、 Al3+、 Ca2+和 Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为 Cr2O72-,加氢氧化钠调节pH=8,则 Fe3+、 Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2 72-、 Ca2+和 Mg2+等,通过钠离O子交换树脂,除去Ca2+和 Mg 2+,然后加 Na2 23272-还原为Cr3+,再调节pH得到S O把 Cr OCr(OH)(H2O)5SO4;(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,注意不能引入新的杂质;(2)根据表中数据判断;通过钠离子交换树脂,除去Ca2+和 Mg 2+;(3)每消耗 0.8mol Cr 2O72-转移 4.8mol e -,则 1molCr 2O72-转移 6mol 电子,所以生成Cr3+,2-被氧化为SO 2-,结合得失电子守恒和原子守恒写出离子方程式。
S2O34【详解】某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、 Al3+、 Ca2+和 Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为 Cr2O72-,加氢氧化钠调节 pH=8,则 Fe3+、 Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、 Ca2+和 Mg2+等,通过钠离子交换树脂,除去 Ca2+和 Mg 2+,然后加 Na2S2 O3把 Cr2O72-还原为 Cr3+,再调节 pH 得到Cr(OH)(H2O)5SO4;(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替 H2O2,故答案为: A;(2)根据表中数据可知, pH=8 时, Fe3+、 Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、 Al3+被除去;通过钠离子交换树脂,除去Ca2+和 Mg 2+;(3)每消耗 0.8mol Cr 2O72-转移 4.8mol e -,则 1molCr 2O72-转移 6mol 电子,所以生成Cr3+,2 32-被氧化为SO42-,则反应的离子方程式为:3S2 32—2 72—+42—3+S O O+ 4Cr O+ 26H = 6SO+ 8Cr 2+13H O。
4.二氧化氯 (ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。
ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸。
某研究小组欲用以下三种方案制备ClO2,回答下列问题:(1)以黄铁矿 (FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被 ClO 3-氧化成 SO 42-,写出制备 ClO 2 的离子方程式 __。
(2)用过氧化氢作还原剂,在硫酸介质中还原 NaClO 3 制备 ClO 2,并将制得的 ClO 2 用于处 理含 CN -废水。
实验室模拟该过程的实验装置(夹持装置略 )如图所示。
①装置 A 的名称是 __,装置 C 的作用是 __。
②反应容器 B 应置于 30℃左右的水浴中,目的是 __。
③通入氮气的主要作用有 3 个,一是可以起到搅拌作用,二是有利于将 ClO 2 排出,三是__。
④ClO 2 处理含 CN -废水的离子方程式为 __,装置 E 的作用是 __。
(3)氯化钠电解法是一种可靠的工业生产 ClO 2 的方法。
