羧酸及其衍生物的分类结构和物理性质
有机化学:12 羧酸及羧酸衍生物

C
+
O C O
H
(二)羧基上羟基的取代反应
O 酰卤 O 酸酐 O O 酯 O 酰胺 R C X R C O C R R C O R R C NH2(R)
1.成酯反应
O R C OH + H OR' H
+
O R C OR' + H2O
称酯化反应 反应特点:用酸做催化剂,反应可逆,速率慢
1.成酯反应
(1)诱导效应
HCOOH > CH3COOH > CH3CH2COOH
pKa 3.77 4.76 4.88
(一)酸性
如:卤素的位置——越靠近羧基影响越大
CH3CH2CHCOOH Cl
CH3CHCH2COOH CH2CH2CH2COOH Cl Cl
pKa
2.86
4.41
4.70
卤素的数目——越多,酸性越强
RCH2COOH + RCHCOX
X RCHCOOH
X X 该反应称为赫尔-佛尔哈德-泽林斯基(Hell-VolhardZelinsky)反应。 α-位如果还有H,可以进一步发生卤代反应,直至 所有α-H全部反应完。
问:
COOH CH3COOH 1 COOH 2 H2C COOH COOH 3
CH3COOH+SOCl2
pKa
4.20
3.83
4.09
4.10
2.电子效应的影响
邻位取代:
C和 I 都发挥作用,还有空间效应,情况复杂。
除氨基外,-X、-CH3、-OH、NO2酸性都比间 位或对位取代的强。邻位有取代时,羧基与 苯环不共平面,苯环电子云向羧基偏移少。
有机化学-羧酸及其衍生物

O CH3OC
O
H+
COCH3 + 2HOCH2CH2OH -2CH3OH
酯交换
O
O
O HOCH2CH2 OC
O
CH3OC
COCH3
COCH2CH2OH
HOCH2CH2OH
酯交换
O
O
C
C OCH2CH2O n n=80100
( 涤纶 )
16
4、酰胺的反应
酰胺的反应活性更小,需在酸或碱催化下长时间
加热回流才能水解
O
或 其它试剂
R CH
醛
水解反应 醇解反应 胺解反应
还原反应
11
1、酰氯的取代反应
H—OH O
R—C—Cl + H—OR'
H—NH2
O
R—C—OH O
HCl 水解
R—C—OR' + HCl 醇解
O
R—C—NH2 NH4Cl 氨解
(酰氯活性大是个优良的酰基化试剂)
O CH3CCl + CH3CH2CH2OH
RCH2
O CX
O
O
RCH2 C O C R
O RCH2 C OR'CH C
H
有弱酸性
可加成至 饱和
L
可被亲核 试剂取代
L: 离去基团 (Leaving group)
9
一、羧酸衍生物的取代反应
这类反应是羧酸衍生物与羧酸、以及羧酸衍生物 之间的相互转化。
O RCL
HOH
R C OH
RCOOH
OO
O
RC O C R HOR'
R C OR' RCOOH
《有机化学》第十一章 羧酸及其衍生物的结构与性质

第十一章羧酸及其衍生物的结构与性质引言羧基()是羧酸的官能团,是由羰基和羟基组成的。
由于羰基的碳氧双键与羟基氧原子的共轭效应的作用,使羟基中氧原子电子向羰基转移,羟基的氢易离解而显酸性。
羧基中羟基也能被其它基团取代生成羧酸衍生物。
羧基是吸电子基,α-H具有活性,可以被卤代。
此外羧酸还能被还原和发生脱羧反应。
这里所讨论的羧酸衍生物主要是指羧基中羟基被取代后生成的酰卤(),酸酐(),酯(),酰胺()以及由酰胺脱水后生成的产物腈()。
在羧酸衍生物中羰基与卤素,酰胺基,烷氧基和氨基相连,由于卤素,氧原子和氮原子的负电性以及孤对电子的作用,使羰基碳上正电性不同,因此它们发生亲核反应性质也有差别。
羧酸衍生物还能发生还原反应。
11.1 羧酸的酸性羧酸是弱酸,能与强碱反应生成盐:羧酸酸性的强弱与所连的基团有关,连吸电子基团的羧酸酸性较强,而连供电子基团的酸性相对较弱。
如下列化合物酸性强弱顺序为:11.2 羧酸衍生物的生成羧基中的羟基被卤素、酰胺基、烷氧基和氨基取代形成酰卤、酸酐、酯和酰胺等羧酸衍生物。
1、酰卤的形成羧酸与SO2Cl,PCl5,PCl3等氯化剂直接反应生成酰卤:因为POCl3沸点低易除去,此法可制备高沸点的酰氯。
H3PO3沸点高,可制备低沸点的酰氯。
该法产生的SO2,HCl易除去,因此生成的酰氯纯度高,后处理容易。
2、酸酐的形成羧酸在脱水剂(如乙酰氯、乙酸酐)存在下加热,失去一分子水而生成酸酐。
二元酸可以分子内脱水生成二酸酐:3、酯化反应羧酸和醇在催化剂(H2SO4、HCl或苯磺酸等)作用下回流生成酯:酯化反应由多种机理,在大多数情况下,是羧酸中羟基与醇中羟基氢结合生成水,表观上看是一种亲核取代反应,实际上是一个亲核加成-消除反应的机理:决定反应速度的一步是亲核加成,因此羧基中碳的正电性以及羧基所连的基团大小核亲核试剂R'OH中R'体积大小都影响反应的速度,下列羧酸与甲醇酯化反应的相对速度的快慢顺序为:4、形成酰胺的反应羧酸与氨立即反应生成盐,在加热条件下,脱水生成酰胺,生成酰胺的反应是可逆的,如果把生成的水从反应体系中除去,反应可趋于完全。
了解羧酸及其衍生物的性质

了解羧酸及其衍生物的性质羧酸及其衍生物是一类重要的有机化合物,具有许多独特的性质和广泛的应用。
本文将对羧酸及其衍生物的性质进行探讨,以便更好地了解这一类化合物。
一、羧酸的定义和结构羧酸是一类化合物,其分子结构中含有一个或多个羧基(-COOH)。
羧基是由一个碳原子与一个羟基(-OH)和一个氧原子形成的。
羧酸的结构式通常用R-COOH表示,其中R表示有机基团。
根据羧基所连接的碳原子数目不同,可以将羧酸分为单官能团羧酸和多官能团羧酸两类。
二、羧酸的物理性质1. 熔点和沸点:羧酸的熔点和沸点通常较高,这是因为羧基中的羧基氧原子具有较高的极性,导致分子间的相互作用增强。
2. 溶解性:大多数羧酸可以在水中溶解,形成羧酸离子和氢离子。
溶解度受到羧酸结构、环境条件以及其它物质的影响。
3. 酸性:羧酸具有明显的酸性,可以与碱反应生成盐和水。
强酸性主要来自羧基中的羟基和带负电荷的氧原子。
三、羧酸的化学性质1. 与碱的反应:羧酸可以与碱反应生成相应的盐。
反应中羧酸中的羧基给出一个负电荷,碱给出一个正电荷,形成盐并释放水。
2. 与醇的酯化反应:羧酸可以与醇反应生成酯。
在反应中,羧酸中的羧基与醇中的氢原子发生取代反应,生成酯和水。
3. 与卤素的取代反应:羧酸中的羟基和羧基都可以与卤素发生取代反应,生成相应的羧酸衍生物。
4. 与羟胺的芳香胺反应:羧酸中的羧基可以与羟胺反应生成相应的芳香胺。
四、羧酸衍生物的性质1. 酯:羧酸与醇反应生成的酯具有较好的挥发性和溶解性,常用于香料、溶剂和聚合物合成等领域。
2. 盐:羧酸与碱反应生成的盐通常具有较高的溶解度和稳定性,在药物、染料和表面活性剂等领域有广泛应用。
3. 胺:羧酸中的羧基与氨或胺反应生成的胺具有一定的碱性,可用于药物合成和化妆品生产中。
4. 酸酐:羧酸中的羧基与无水酸反应生成的酸酐具有良好的环境稳定性,广泛应用于有机合成反应中。
综上所述,羧酸及其衍生物具有多样的性质和广泛的应用价值。
第十章 羧酸及其衍生物

+ H OC2H5
18
H
+
O CH3C
18
OC2H5 + H2O
酰氧断裂
12
O CH3C OH
:OH
+H
+
OH CH3C OH 加成
-H2O
HOC2H5
OH CH3 C OH HOC2H5
OH CH3 C OC2H5
: : : : : : : :
质子迁 移
-H+
O CH3 C OC2H5
1
I 羧酸
一,结构 烃基与羧基相连的物质叫羧酸:一元羧酸通式为 RCOOH;羧基( COOH)就是羧酸的官能团 RCOOH;羧基(-COOH)就是羧酸的官能团. 就是羧酸的官能团.
O
ห้องสมุดไป่ตู้
中碳为SP 杂化, OH 中碳为SP2 杂化,氧原子与羰基双键间存 在着P― 共扼.由于共扼, P―л 在着P―л共扼.由于共扼,使羧基中的羰基失去了典 型的羰基的性质(如不与NH OH作用 作用) 型的羰基的性质(如不与NH2OH作用);―OH 氧原 子上的电子云向羰基偏移,这有利于―OH氢的离解 氢的离解. 子上的电子云向羰基偏移,这有利于―OH氢的离解.
14
Br2 / P
(2)芳香环的取代反应 (2)芳香环的取代反应
COOH Br2 FeBr3
COOH
Br
5. 二元羧酸的受热反应
乙 二 酸 HOOCCOOH 丙 二 酸 HOOCCH 2COOH 丁二酸 CH 2 COOH CH 2 COOH 戊 二 酸 CH 2 CH 2COOH CH 2COOH
CH 3 COOH + C 2H 5 OH : 1 1 1 : 10
有机化学羧酸及衍生物

有机化学羧酸及衍生物有机羧酸及其衍生物是有机化学中应用最广泛的重要化合物之一,几乎所有的有机物都是结构和功能性的羧酸衍生物。
它们由非常复杂的结构,从一种亲水性的、具有一个或者多个氢原子的,比较简单的醛与醇体积式羧酸,到脂溶性的、具有脂类或碳酸酯等有机基组成的、比较复杂的多羟基羧酸。
它们都具有很好的化学稳定性和匹配性,在生物体内具有独特的生物活性,因此被广泛应用于各种科学领域。
有机羧酸及其衍生物可分为两大类:一类是单羟基羧酸,它们是由醛与醇有机化合物组成;另一类是多羟基羧酸,它们含有一个以上的羟基,而且具有脂溶性的有机基。
单羟基羧酸有很多种,具体分类如下:呋喃酸、玻璃酸、环酸、乙醇酸、丙酸、乳酸、鞣酸等;多羟基羧酸也有很多种,主要有有机醋酸、有机磷酸、有机碳酸和有机磷脂等。
有机羧酸及其衍生物在化学领域有着广泛的应用。
羧酸及其盐是常用的表面活性剂,羧酸与碱可缓解环境中硫氧化物及酸雨的危害;多羟基羧酸的衍生物是生物体的重要组成部分,包括DNA及RNA的碱基,也是酶的活性中心及核糖体的结构化合物。
此外,它们也可进一步衍生出有机键、芳环等,与功能性化合物相连,用于制造药物和高科技中的医疗器械。
有机羧酸及其衍生物应用广泛,必将深刻影响人们的日常生活,是实现未来科学社会化十分重要的一环。
Organic carboxylic acids and their derivatives are one of the most widely used important compounds in organic chemistry, almost all organic compounds are structural and functional carboxylic acid derivatives. They have very complex structures, from a comparatively simple hydrophilic and one or more hydrogen small molecular alcohol aldehyde carboxylic acid, to lipophilic and composed of lipids or esters and other organic base, more complex polyhydroxy carboxylic acid. They all have good chemical stability and matching, unique biological activity in organisms, and are widely used in various scientific fields.Organic carboxylic acids and their derivatives can be divided into two categories: one is monohydroxy carboxylic acid, which is composed of aldehyde and alcohol organic compounds; the other is polyhydroxy carboxylic acid, which contains one or more hydroxyl groups, and has lipophilic organic base. Monohydroxy carboxylic acid has many kinds, the specific classification is following: furan carboxylic acid, glacial acetic acid, cyclo carboxylic acid, ethyl alcohol carboxylic acid, propionic acid, lactic acid, tannic acid and so on; polyhydroxy carboxylic acid also has many kinds, mainly include organic acetic acid, organic phosphoric acid, organic carbonic acid and organic phospholipid.Organic carboxylic acids and their derivatives have a wide range of applications in chemical field. Carboxylic acid and its salts are commonly used surfactants, and carboxylic acid and alkali。
有机化学羧酸及其衍生物
Organic Chemistry
Ⅰ羧酸
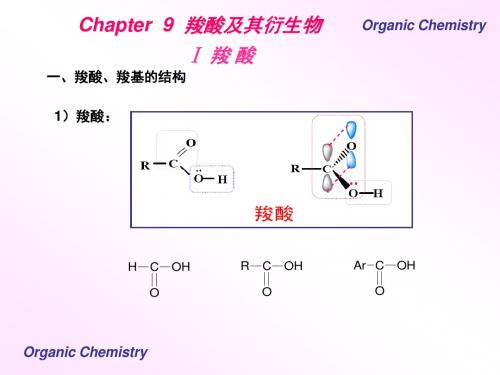
一、羧酸、羧基的结构 1)羧酸:
H
C O
OH
R
C O
OH
Ar C O
OH
Organic Chemistry
Chapter 9 羧酸及其衍生物
2)羧基的结构:
C O
R
Organic Chemistry
OH
O
..
R C O H
形式上看,羧基由羰基和羟基组成。羟基氧原子的未共用电子对所 占据的 p轨道和羰基的 π键形成 p-π共轭。羟基氧上电子云密度有所 降低,羰基碳上电子云密度有所升高。因此,羧酸中羰基对亲核试 剂的活性降低,不利于HCN等亲核试剂反应。 Organic Chemistry
对于含不饱和键的不饱和羧酸则取包括羧基和不饱和键的最长碳链为主链称某烯酸并注明不饱和键的位置命名含脂碳环羧酸和芳香羧酸时则把脂碳环和芳环当作取代基choh3乙基己酸3丙基4戊烯酸coohchcoohchcoohcoohcooh乙基丙二酸邻苯二甲酸环戊基甲酸四物理性质羧酸的沸点比相近分子质量的其它有机物要高
3—丙基—4—戊烯酸
COOH
COOH
乙基丙二酸
环戊基甲酸
邻苯二甲酸
Organic Chemistry
Chapter 9 羧酸及其衍生物
四、物理性质
羧酸的沸点比相近分子质量的其它有机物要高: 乙 丙 酸(60):117.9℃ 醛(58): 48.8℃ 8 ℃
Organic Chemistry
正丙醇(60): 97.4℃ 甲乙醚(60):
味道 沸点
酰氯和酸酐都对粘膜有刺激性,酯有香味。 酰氯、酸酐和酯由于不能形成氢键,熔沸点与分子量相近
有机化学:第十三章羧酸及其衍生物

2. 酸酐的生成
用P2O5作脱水剂制备酸酐
O CH3 C OH O O P2O5 CH3 C O O C CH3
+
HO
C CH3
+
H2O
用低沸点酸酐作脱水剂制备较高沸点的酸酐
O 2 COOH + (CH3CO)2O
(
C
) 2O + 2 CH COOH
3
能形成五元、六元环酸酐的二元羧酸可直接加热制备酸酐
羧酸与PX3 、PCl5(X=Cl、Br)、SOCl2反应
3CH3COOH + PCl3
3 CH3 COCl + H3PO3
COOH+PCl5
(CH3)2CHCH2COOH + SOCl 2
COCl + POCl3+ HCl
(CH3)2CHCH2COCl
+
SO2
+ HCl
注:HX不能与羧酸反应生成酰卤 。 应用:酰卤的反应活性比较高,广泛应于药物合成中 。
( 2)编号:从羧基碳原子开始用阿拉伯数字编号,按所含碳原
子数目称为某酸,取代基名称及位次写在某酸之前。
( 3)简单的酸酸,常用希腊字母表明取代基的位置,从羧基相 邻碳原子开始编号为 ,依次为 、 、 等,将编号写在取代基 名称前面。
CH3CH2CHCH2COOH CH3
-甲基戊酸(3-甲基戊酸)
第十三章
羧酸及其衍生物 主要内容
1、掌握羧酸和取代羧酸的结构、命名和化学性质 2、掌握羧酸衍生物的结构、分类及命名和化学性质
3、熟悉羧酸和取代羧酸的物理性质
4、掌握羟基酸、酮酸的命名及主要化学性质。
羧酸:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羧酸及其衍生物的分类结构和物理性质羧酸是一类具有羧基(-COOH)的有机化合物,它是碳链上的一个碳原子与一个羧基团相连形成的化合物。
羧基团由一个碳原子与一个氧原子以及一个氢原子组成。
根据羧基的位置不同,羧酸可以分为两类:取代羧酸和芳香羧酸。
取代羧酸是指羧基连接在碳链上,而芳香羧酸则是指羧基连接在芳香环上。
在取代羧酸中,根据羧基所连接到的碳原子的取代原子(或基团)的不同,可以进一步分为单取代羧酸、二取代羧酸和多取代羧酸。
单取代羧酸是指羧基所连接的碳原子上只有一个取代原子(或基团),如乙酸(CH3COOH)。
二取代羧酸是指羧基所连接的碳原子上有两个取代原子(或基团),如丙酸(CH3CH2COOH)。
多取代羧酸是指羧基所连接的碳原子上有多个取代原子(或基团),如苯甲酸(C6H5COOH)。
芳香羧酸是指羧基连接在芳香环上的羧酸化合物。
芳香羧酸通常以其常见的名称命名,如苯甲酸(C6H5COOH)和苯乙酸(C6H5CH2COOH)等。
羧酸及其衍生物通常具有一些共同的物理性质。
首先,羧酸具有高沸点和高熔点,这是因为羧酸分子之间通过氢键形成二聚体或多聚体结构。
其次,由于羧酸中的羧基是极性官能团,因此羧酸具有很强的溶解性。
它们可以与水中的氢氧根离子形成氢键,也可以通过与有机溶剂(如醇、醚和酯)的酯化反应溶解。
此外,羧酸还具有一定的酸性,可以在水中与碱进行中和反应。
羧酸的反应性与羧基的酸性和碳原子的电子密度有关。
具有更高电子密度的碳原子上的羧基更容易释放负电荷,在水溶液中呈现更强的酸性。
此外,羧基的芳香羧酸比取代羧酸更酸。
总之,羧酸及其衍生物是一类具有羧基的有机化合物。
根据羧基的位置和取代原子的不同,羧酸可以分为取代羧酸和芳香羧酸。
羧酸具有高沸点、高熔点、良好的溶解性和一定的酸性。
这些属性使得羧酸在许多领域都有广泛的应用,如有机合成、染料工业、食品添加剂等。
