曲线运动平抛运动PPT教学课件
合集下载
新人教版中学物理必修二:5.2平抛运动(共27张PPT)

正确的是(A )
A.甲和乙一定同时落地 B.乙和丙一定同时落地 C.甲和乙水平射程一定相同 D.乙和丙水平射程一定相同
平抛运动的物体,飞行时间只跟高度有关, 水平射程不仅与高度有关,还跟初速度大小有关。
4、 物体以20m/s初速度水平抛出,1s末 速度多少?2s末速度是多少?第1s速 度变化多少?第2s速度变化多少?
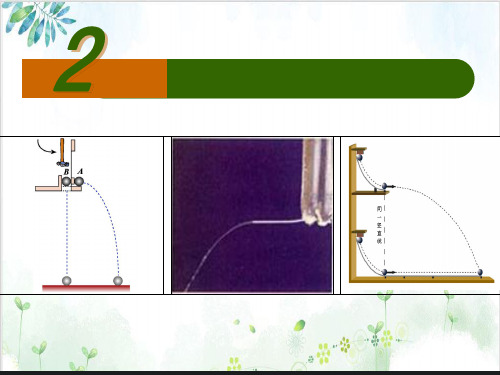
竖直方向分运动是自由落体运动 水平方向分运动是匀速直线运动
平 以抛出点为坐标原点;水平抛出的方向为x
抛 轴的正方向;竖直向下的方向为y 轴正方向
物 体
O v0
x
的
轨
P (x,y)
迹
平抛运动的轨
y
迹一条抛物线
物体的位置 x = v0 t
P 点的坐标 y =21 g t 2
y =2vg02 x2
平 抛
如何处理平抛运动?
轨迹是曲线
研究方法:
化曲为直
运动的分解
----将其分解为两个方向的运动
二、平抛运动竖直方向的运动规律
猜 想? 自由落体?
1.理论探究:
初速度 受力情况 运 动 性 质
竖直方向
0
G 自由落体运动
2. 实验验证
•11、凡为教者必期于达到不须教。对人以诚信,人不欺我;对事以诚信,事无不成。 •12、首先是教师品格的陶冶,行为的教育,然后才是专门知识和技能的训练。 •13、在教师手里操着幼年人的命运,便操着民族和人类的命运。2021/11/52021/11/5November 5, 2021 •14、孩子在快乐的时候,他学习任何东西都比较容易。 •15、纪律是集体的面貌,集体的声音,集体的动作,集体的表情,集体的信念。 •16、一个人所受的教育超过了自己的智力,这样的人才有学问。 •17、好奇是儿童的原始本性,感知会使儿童心灵升华,为其为了探究事物藏下本源。2021年11月2021/11/52021/11/52021/11/511/5/2021 •18、人自身有一种力量,用许多方式按照本人意愿控制和影响这种力量,一旦他这样做,就会影响到对他的教育和对他发生作用的环境。 2021/11/52021/11/5
A.甲和乙一定同时落地 B.乙和丙一定同时落地 C.甲和乙水平射程一定相同 D.乙和丙水平射程一定相同
平抛运动的物体,飞行时间只跟高度有关, 水平射程不仅与高度有关,还跟初速度大小有关。
4、 物体以20m/s初速度水平抛出,1s末 速度多少?2s末速度是多少?第1s速 度变化多少?第2s速度变化多少?
竖直方向分运动是自由落体运动 水平方向分运动是匀速直线运动
平 以抛出点为坐标原点;水平抛出的方向为x
抛 轴的正方向;竖直向下的方向为y 轴正方向
物 体
O v0
x
的
轨
P (x,y)
迹
平抛运动的轨
y
迹一条抛物线
物体的位置 x = v0 t
P 点的坐标 y =21 g t 2
y =2vg02 x2
平 抛
如何处理平抛运动?
轨迹是曲线
研究方法:
化曲为直
运动的分解
----将其分解为两个方向的运动
二、平抛运动竖直方向的运动规律
猜 想? 自由落体?
1.理论探究:
初速度 受力情况 运 动 性 质
竖直方向
0
G 自由落体运动
2. 实验验证
•11、凡为教者必期于达到不须教。对人以诚信,人不欺我;对事以诚信,事无不成。 •12、首先是教师品格的陶冶,行为的教育,然后才是专门知识和技能的训练。 •13、在教师手里操着幼年人的命运,便操着民族和人类的命运。2021/11/52021/11/5November 5, 2021 •14、孩子在快乐的时候,他学习任何东西都比较容易。 •15、纪律是集体的面貌,集体的声音,集体的动作,集体的表情,集体的信念。 •16、一个人所受的教育超过了自己的智力,这样的人才有学问。 •17、好奇是儿童的原始本性,感知会使儿童心灵升华,为其为了探究事物藏下本源。2021年11月2021/11/52021/11/52021/11/511/5/2021 •18、人自身有一种力量,用许多方式按照本人意愿控制和影响这种力量,一旦他这样做,就会影响到对他的教育和对他发生作用的环境。 2021/11/52021/11/5
新人教版物理必修2课件5.2平抛运动 (共12张PPT)

• 14、Thank you very much for taking me with you on that splendid outing to London. It was the first time that I had seen the Tower or any of the other famous sights. If I'd gone alone, I couldn't have seen nearly as much, because I wouldn't have known my way about.
(1)确定 ts 时物体的位置
(2)确定物体运动的轨迹方程(即y与x之间的关系式)
(3)求ts内的位移
解:(1)建立如图所示坐标系 物体做平抛运动
水平方向: X=v0t
①
0 V0 α s x
yx A
竖直方向: (3)
y
1 2
gt
2
②
y
(2) ①大 ②两: 小 式O 消A去时x间2t,y得2到轨迹方程
y
g
y g 2v0
2
2 x2
v
0
2
x2
位移是方否向能: 直斜 接用向O 下A向 与 v0 成 水 t 角平 1 2 且 gt方 t2 a公n= 式xy 计算?
求解平抛运动位移的常规思路
V0
α
化曲线运动为直线运动
s x
yx A
水平方向:匀速直线运动
平
抛 体 分解 运 动 位
位移
x v0t
y 1 gt 2 2
讨论总结:解决抛体运动的常规方法
解决抛体运动的常规方法
化曲线运动为直线运动
新人教版高一年级必修2第五章曲线运动5.2 平抛运动教学课件 (共15张PPT)

第五章 曲线运动
第二节 平抛运动
这些大致看做抛体运动 ……
铁饼 垒球
标枪
铅球
本节重点研究平抛运动的规律
水平管中喷出的水流
轨迹: 研究方法:
曲线 化曲为直
运动的分解
如何研究平抛运动?
将其分解 为两个方 向的运动
水平方向 竖直方向
平抛运动的规律
vy
y
x vx
速度:
vx v0
vy gt
vt vx2vy2v02(g)2t
tan vy
vx
gt v0
x
y
轨迹:
y
g 2v02
x2 (抛物线)
位移:
x v0t
y 2
gt2
x v0t
思考
1.平抛运动的运动时间由什么决定?
h1gt2 t 2h
2
g
高度h
2.平抛运动的射程由什么决定?
x v0t v0
2h g
高度h和初速度υ0
课堂练习
1.在一次摩托车跨越壕沟的表演中,摩托车从壕沟的一侧以速 度v=40m/s沿水平方向向另一侧,壕沟两侧的高度及宽度如 图所示,摩托车可看做质点,不计空气阻力。
(1)判断摩托车能否跨越壕沟?请计算说明 (2)若能跨过,求落地速度?
3.5m
2.0m
20m
课堂小结
一、平抛运动
概念:初速度为水平方向且只受重力作用的匀变速曲线运动
二、实验研究平抛运动
υ υ 水平方向:不受力,初速度为 0→以初速度 0做匀速直线运动
竖直方向:初速度为零,只受重力→做自由落体运动
三、平抛运动规律
课后思考
由本节学习知识,只用卷尺就可测出玩具手 枪子弹射出时的速度。请你设计此实验,说明 实验原理及需要测定的数据。
第二节 平抛运动
这些大致看做抛体运动 ……
铁饼 垒球
标枪
铅球
本节重点研究平抛运动的规律
水平管中喷出的水流
轨迹: 研究方法:
曲线 化曲为直
运动的分解
如何研究平抛运动?
将其分解 为两个方 向的运动
水平方向 竖直方向
平抛运动的规律
vy
y
x vx
速度:
vx v0
vy gt
vt vx2vy2v02(g)2t
tan vy
vx
gt v0
x
y
轨迹:
y
g 2v02
x2 (抛物线)
位移:
x v0t
y 2
gt2
x v0t
思考
1.平抛运动的运动时间由什么决定?
h1gt2 t 2h
2
g
高度h
2.平抛运动的射程由什么决定?
x v0t v0
2h g
高度h和初速度υ0
课堂练习
1.在一次摩托车跨越壕沟的表演中,摩托车从壕沟的一侧以速 度v=40m/s沿水平方向向另一侧,壕沟两侧的高度及宽度如 图所示,摩托车可看做质点,不计空气阻力。
(1)判断摩托车能否跨越壕沟?请计算说明 (2)若能跨过,求落地速度?
3.5m
2.0m
20m
课堂小结
一、平抛运动
概念:初速度为水平方向且只受重力作用的匀变速曲线运动
二、实验研究平抛运动
υ υ 水平方向:不受力,初速度为 0→以初速度 0做匀速直线运动
竖直方向:初速度为零,只受重力→做自由落体运动
三、平抛运动规律
课后思考
由本节学习知识,只用卷尺就可测出玩具手 枪子弹射出时的速度。请你设计此实验,说明 实验原理及需要测定的数据。
人教版必修二第五章曲线运动平抛运动(29张PPT+素材)-PPT优秀课件
l
x
yx P
平 抛 分解 运 动
人教版必修二 第五章曲线运动第2节平抛运动课件 (共29张PPT+素材)
y
水平方向:匀速直线运动
x v0t 合成 y 1 gt 2 2
合位移大小 合位移方向
竖直方向:自由落体运动
人教版必修二 第五章曲线运动第2节平抛运动课件 (共29张PPT+素材)
速度与水平方向上的夹角和位移与水平方向上的夹角的关系:
2.一架飞机水平地匀速飞行,从飞机上每隔1s释放 一个铁球,先后共释放5个,若不计空气阻力,则5 个球( C ) A.在空中任何时刻总是排成抛物线,它们的落地点 是等间距的 B.在空中任何时刻总是排成抛物线,它们的落地点 是不等间距的 C.在空中任何时刻总是在飞机正下方排成竖直的直 线,它们的落地点是等间距的 D.在空中任何时刻总是在飞机正下方排成竖直的直 线,它们的落地点是不等间距的
人教版必修二 第五章曲线运动第2节平抛运动课件 (共29张PPT+素材)
即时练习 人教版必修二 第五章曲线运动第2节平抛运动课件 (共29张PPT+素材)
3、实验体会
1.参考系不同,炸弹的运动不同 2.飞机投弹规律
人教版必修二 第五章曲线运动第2节平抛运动课件 (共29张PPT+素材)
即时练习 人教版必修二 第五章曲线运动第2节平抛运动课件 (共29张PPT+素材) 4.一物体以10m/s的初速度水平抛出,落地时 速度与水平方向成45°,求: (1)落地速度 (2)开始抛出时距地面的高度 (3)水平射程(g=10m/s²)
人教版必修二 第五章曲线运动第2节平抛运动课件 (共29张PPT+素材)
物体抛出时的速度不是沿水平方向
水平速度:vx=v0cosθ 竖直速度:vy=v0sinθ-gt 水平位移:x=v0cosθt 竖直位移:y=v0sinθt-1/2gt2
高中物理第五章曲线运动第2节平抛运动课件高中物理课件

2.平抛运动的性质:加速度为 g 的匀变速曲线运动。 3.平抛运动的三个特点: (1)理想化特点:平抛运动是一种理想化的模型,即把物体看成质 点,抛出后只考虑重力作用,忽略空气阻力。 (2)匀变速特点:平抛运动的加速度恒定,即始终等于重力加速度。
12/12/2021
(3)速度变化特点:任意两个相等的时间间隔内速度的变化相 同,Δv=gΔt,方向竖直向下,如图所示。
(1)运动员在空中飞行的时间 t。 (2)A、B 间的距离 s。
12/12/2021
[审题指导] 第一步:抓关键点
关键点
运动员由斜坡顶的A点沿水 平方向飞出
落点在斜坡上的B点,斜坡 倾角取37°
获取信息
运动员做平抛运动,A点为运动 起点
斜坡上A点到B点的距离即为运 动员的位移
第二步:找突破口 平抛运动的求解通法就是运动分解,结合题目情景,把运动员的 位移分解为水平方向的位移 x 和竖直方向的位移 y,则有 tan 37°=xy。
12/12/2021
3.[多选]关于平抛物体的运动,以下说法正确的是
()
A.做平抛运动的物体,速度和加速度都随时间的增加而增大
B.做平抛运动的物体仅受到重力的作用,所以加速度保持不变
C.平抛物体的运动是匀变速运动
D.平抛物体的运动是匀速运动
解析:做平抛运动的物体,速度随时间不断增大,但由于只受
恒定不变的重力作用,所以加速度是恒定不变的,选项 A 错误、
12/12/2021
(2)铅球运动员在推铅球时都是将铅球斜向上 用力推出,你知道这其中的道理吗? 提示:将铅球斜向上推出,可以延长铅球 在空中的运动时间,以使铅球运动得更远。
12/12/2021
对平抛运动的理解
12/12/2021
(3)速度变化特点:任意两个相等的时间间隔内速度的变化相 同,Δv=gΔt,方向竖直向下,如图所示。
(1)运动员在空中飞行的时间 t。 (2)A、B 间的距离 s。
12/12/2021
[审题指导] 第一步:抓关键点
关键点
运动员由斜坡顶的A点沿水 平方向飞出
落点在斜坡上的B点,斜坡 倾角取37°
获取信息
运动员做平抛运动,A点为运动 起点
斜坡上A点到B点的距离即为运 动员的位移
第二步:找突破口 平抛运动的求解通法就是运动分解,结合题目情景,把运动员的 位移分解为水平方向的位移 x 和竖直方向的位移 y,则有 tan 37°=xy。
12/12/2021
3.[多选]关于平抛物体的运动,以下说法正确的是
()
A.做平抛运动的物体,速度和加速度都随时间的增加而增大
B.做平抛运动的物体仅受到重力的作用,所以加速度保持不变
C.平抛物体的运动是匀变速运动
D.平抛物体的运动是匀速运动
解析:做平抛运动的物体,速度随时间不断增大,但由于只受
恒定不变的重力作用,所以加速度是恒定不变的,选项 A 错误、
12/12/2021
(2)铅球运动员在推铅球时都是将铅球斜向上 用力推出,你知道这其中的道理吗? 提示:将铅球斜向上推出,可以延长铅球 在空中的运动时间,以使铅球运动得更远。
12/12/2021
对平抛运动的理解
高一物理必修二第五章曲线运动5.2平抛运动教案课件PPT

(1)从受力情况看:
a. 竖直的重力与速度方向有夹角,作曲 线运动
b. 水平方向不受外力作用,是匀速运动 c. 竖直方向受重力作用,没有初速度,
是自由落体运动
结论:平抛运动是匀变速曲线运动。
h 1 gt2 2
o )α v0 s
y
x
X
)θ v0
vy
v
28
Y
运用运动的合成与分解 分析平抛运动
物体做平抛运动的条件: 1、初速度方向为水平 2、只受重力作用
6
★受力特点
• 只受重力
G
7
平抛运动研究方法
轨迹是曲线
研究方法:
化曲为直
采用运动的合成和分解
----将其分解为两个方向的运动
8
猜 想:平抛运动可以分解为哪几个直线运动?
理论探究:
初速度 受力情况
运动情况
水平方向
V0
竖直方向
0
不受力 匀速直线运动 G 自由落体运动
9
平抛运动与自由落体运动的比较
x v 0t y 1 gt 2
2
20
三、例题讲解
飞机离地面810米高度,以250千米/时的速度水平飞行,应该 在离轰炸目标的水平距离多远处投弹,才能击中地面目标。
x v 0t y 1 gt 2
2
21
三、例题讲解
飞机离地面810米高度,以250千米/时的速度水平飞行,应该 在离轰炸目标的水平距离多远处投弹,才能击中地面目标。
P (x,y)
α vx = v0
求P点的速度?
速y 度
vy v
l x2y2 (v0t)2(12gt2)2
vx v0
速度的大小 tan v y gt
a. 竖直的重力与速度方向有夹角,作曲 线运动
b. 水平方向不受外力作用,是匀速运动 c. 竖直方向受重力作用,没有初速度,
是自由落体运动
结论:平抛运动是匀变速曲线运动。
h 1 gt2 2
o )α v0 s
y
x
X
)θ v0
vy
v
28
Y
运用运动的合成与分解 分析平抛运动
物体做平抛运动的条件: 1、初速度方向为水平 2、只受重力作用
6
★受力特点
• 只受重力
G
7
平抛运动研究方法
轨迹是曲线
研究方法:
化曲为直
采用运动的合成和分解
----将其分解为两个方向的运动
8
猜 想:平抛运动可以分解为哪几个直线运动?
理论探究:
初速度 受力情况
运动情况
水平方向
V0
竖直方向
0
不受力 匀速直线运动 G 自由落体运动
9
平抛运动与自由落体运动的比较
x v 0t y 1 gt 2
2
20
三、例题讲解
飞机离地面810米高度,以250千米/时的速度水平飞行,应该 在离轰炸目标的水平距离多远处投弹,才能击中地面目标。
x v 0t y 1 gt 2
2
21
三、例题讲解
飞机离地面810米高度,以250千米/时的速度水平飞行,应该 在离轰炸目标的水平距离多远处投弹,才能击中地面目标。
P (x,y)
α vx = v0
求P点的速度?
速y 度
vy v
l x2y2 (v0t)2(12gt2)2
vx v0
速度的大小 tan v y gt
物理必修2人教版平抛运动(25张)-PPT优秀课件

a=gsinθ 水平方向的位移 s= a = v0t 沿斜面向下的位移 y= b = ½at2, v0=a· g s i n
2b
课堂练习
1、做平抛运动的物体,每秒的速度增量总是
(A )
A.大小相等,方向相同 B.大小不等,方向不同 C.大小相等,方向不同 D.大小不等,方向相同
2.在海边高45m的悬崖上,海防部队进行实弹演习, 一平射炮射击离悬崖水平距离为1200m,正以10m/s 的速度迎面开来的靶舰,击中靶舰(g取10m/s2)试 求:(1)炮弹发射的初速度
物理必修2人教版 5.2平抛运动 (共25张PPT)
照相机通过多次曝光,拍摄到汽车在经过最高点以后
的三副运动照片如图所示,相邻两次曝光时间间隔
相等,均为Δt,已知汽车的长度为l,则:(
)ቤተ መጻሕፍቲ ባይዱ
A. 从左边照片可推算出汽车的水平分速度的大小
B.从左边照片可推算出汽车曾经到达的最大高度
C.从中间照片可推算出汽车的水平分速度的大小
和汽车曾经到达的最大高度
D.从右边照片可推算出汽车的水平分速度的大小
11:如图所示,为一平抛物体运动的闪光照片示意图, 照片与实际大小相比缩小10倍.对照片中小球位置进行测 量得:1与4闪光点竖直距离为1.5 cm,4与7闪光点竖直 距离为2.5 cm,各闪光点之间水平距离均为0.5 cm.则 (1)小球抛出时的速度大小为多少? (2)验证小球抛出点是否在闪光点1处,若不在,则抛出 点距闪光点1的实际水平距离和竖直距离分别为多少? (空气阻力不计,g=10 m/s2)
sA =6.73m
物理必修2人教版 5.2平抛运动 (共25张PPT)
8、 两质点在空间同一点处同时水平抛出,速度分别 物理必修2人教版5.2平抛运动(共25张PPT)
2b
课堂练习
1、做平抛运动的物体,每秒的速度增量总是
(A )
A.大小相等,方向相同 B.大小不等,方向不同 C.大小相等,方向不同 D.大小不等,方向相同
2.在海边高45m的悬崖上,海防部队进行实弹演习, 一平射炮射击离悬崖水平距离为1200m,正以10m/s 的速度迎面开来的靶舰,击中靶舰(g取10m/s2)试 求:(1)炮弹发射的初速度
物理必修2人教版 5.2平抛运动 (共25张PPT)
照相机通过多次曝光,拍摄到汽车在经过最高点以后
的三副运动照片如图所示,相邻两次曝光时间间隔
相等,均为Δt,已知汽车的长度为l,则:(
)ቤተ መጻሕፍቲ ባይዱ
A. 从左边照片可推算出汽车的水平分速度的大小
B.从左边照片可推算出汽车曾经到达的最大高度
C.从中间照片可推算出汽车的水平分速度的大小
和汽车曾经到达的最大高度
D.从右边照片可推算出汽车的水平分速度的大小
11:如图所示,为一平抛物体运动的闪光照片示意图, 照片与实际大小相比缩小10倍.对照片中小球位置进行测 量得:1与4闪光点竖直距离为1.5 cm,4与7闪光点竖直 距离为2.5 cm,各闪光点之间水平距离均为0.5 cm.则 (1)小球抛出时的速度大小为多少? (2)验证小球抛出点是否在闪光点1处,若不在,则抛出 点距闪光点1的实际水平距离和竖直距离分别为多少? (空气阻力不计,g=10 m/s2)
sA =6.73m
物理必修2人教版 5.2平抛运动 (共25张PPT)
8、 两质点在空间同一点处同时水平抛出,速度分别 物理必修2人教版5.2平抛运动(共25张PPT)
人教版高中物理必修2平抛运动(24张)-PPT优秀课件

说明:
h 1 gt 2 2
x v0t
❖平抛运动的时间 t 仅由高度h决定, 与v0无关!
❖平抛运动的水平位移x由 高度h和v0 共同决定。
人教版高中物理必修2 5.2平抛运动(共24张PPT)【PPT优 秀课件 】-精美 版
人教版高中物理必修2 5.2平抛运动(共24张PPT)【PPT优 秀课件 】-精美 版
vx v 0
x P ( x,y)
θ vx
vy v
v vx2 vy2
tan y gt
y
x 2v0
v02 (gt)2 tan2tan
人教版高中物理必修2 5.2平抛运动(共24张PPT)【PPT优 秀课件 】-精美 版
人教版高中物理必修2 5.2平抛运动(共24张PPT)【PPT优 秀课件 】-精美 版
2、分类
v0
v0 v0
竖直上抛运动
平抛运动
斜抛运动
二、平抛运动
初速度沿水平方向的抛体运动叫平抛运动。
思考:
❖如果你是研究者,对并不了解的平 抛运动,你应当如何着手去研究?
❖你准备研究关于平抛运动的哪几个 方面的问题?
科学研究的一般过程:
观察与 猜想与 实验探 总结与 …… 思考 假设 究与验 理论提
二、平抛运动
理论探究二:平抛运动物体在竖直方向 做什么运动?
条件:竖直方向的初速度为0 受力分析:只受重力
竖直方向加速度为g
结论:竖直方向做自由落体运动
二、平抛运动
实验验证: 做平抛运动的物体
在水平方向做匀速直线运动 在竖直方向做自由落体运动
比较法、频闪照相法等
二、平抛运动
其它验证实验:
落球实验——比较法
人教版高中物理必修2 5.2平抛运动(共24张PPT)【PPT优 秀课件 】-精美 版
h 1 gt 2 2
x v0t
❖平抛运动的时间 t 仅由高度h决定, 与v0无关!
❖平抛运动的水平位移x由 高度h和v0 共同决定。
人教版高中物理必修2 5.2平抛运动(共24张PPT)【PPT优 秀课件 】-精美 版
人教版高中物理必修2 5.2平抛运动(共24张PPT)【PPT优 秀课件 】-精美 版
vx v 0
x P ( x,y)
θ vx
vy v
v vx2 vy2
tan y gt
y
x 2v0
v02 (gt)2 tan2tan
人教版高中物理必修2 5.2平抛运动(共24张PPT)【PPT优 秀课件 】-精美 版
人教版高中物理必修2 5.2平抛运动(共24张PPT)【PPT优 秀课件 】-精美 版
2、分类
v0
v0 v0
竖直上抛运动
平抛运动
斜抛运动
二、平抛运动
初速度沿水平方向的抛体运动叫平抛运动。
思考:
❖如果你是研究者,对并不了解的平 抛运动,你应当如何着手去研究?
❖你准备研究关于平抛运动的哪几个 方面的问题?
科学研究的一般过程:
观察与 猜想与 实验探 总结与 …… 思考 假设 究与验 理论提
二、平抛运动
理论探究二:平抛运动物体在竖直方向 做什么运动?
条件:竖直方向的初速度为0 受力分析:只受重力
竖直方向加速度为g
结论:竖直方向做自由落体运动
二、平抛运动
实验验证: 做平抛运动的物体
在水平方向做匀速直线运动 在竖直方向做自由落体运动
比较法、频闪照相法等
二、平抛运动
其它验证实验:
落球实验——比较法
人教版高中物理必修2 5.2平抛运动(共24张PPT)【PPT优 秀课件 】-精美 版
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
_______白__色__沉__淀_。不在溶A解lCl3溶液中滴加少量NaOH溶
液,现象为____________产_,生继白续色加沉入淀过量的NaOH
溶液,现象为___________.
白色沉淀溶解
2.下列金属化合物,不能与氢氧化钠溶液反应的是: A. FeCl3 B. Fe2O3 特点: ①水平方向不为零的初速度; ②只受重力作用,有恒定的竖直向下的重力加速度; ③任一相同的时间间隔内的速度的变化量都相同; ④属于匀变速曲线运动。
研究平抛运动的思想方法 运动的分解 将平抛运动分解为竖直方向和水平方向上两个简 单的为我们所熟悉的直线运动——变复杂为简单
(3)抛出点距地面的高度。
(4)水平射程。
(5)第二秒内的速度变化。
例、如图为一小球作平抛运动的频闪照片的一部分。图中 背景方格的边长均为5cm。如果g取10m/s2,
求:(1)则闪光的时间间隔是多少? A
(2)平抛初速度是多少?
B
(3)求B点的竖直分速度
(4)求出抛出点O的坐标
C
图2
例、如图所示在倾角为α=30°的斜坡顶端A处,沿水平方 向以初速度v0=10m/s抛出一小球,恰好落在斜坡脚的B点, 求: (1)小球在空中飞行的时间。
(3)Na2CO3和NaHCO3盐酸的反应
Na2CO3
NaHCO3
现
反应较剧烈,有 反应很剧烈,有
象
气泡产生
气泡产生
化 学
Na2CO3+2HCl=2
方
NaCl+H2O+CO2
NaHCO3+HCl= NaCl+H2O+CO2
程 式
CO32-+2H+=H2O+CO2 HCO3-+H+=H2O+CO2
总结
分析:为什么铝能与碱溶液反应?
2Al + 6H2O == 2Al(OH)3 + 3H2
+ 2Al(OH)3+2NaOH==2NaAlO2+4H2O
2Al+2H2O+2NaOH==2NaAlO2+3H2
练习
1.在MgCl2溶液中滴加少量的NaOH溶液,现象为
____产_生__白__色__沉__淀,继续加入过量的NaOH溶液,现象为
CaO+H2O==Ca(OH)2
③过氧化钠溶于水,反应生成氢氧化钠和氧气 2Na2O2+2H2O==4NaOH+O2
(2)多数不溶于水的金属氧化物可与酸反应, 实验3-5 MgO、Fe2O3 、CuO分别与盐酸反应
金属氧化物的性质
氧化物 固体颜色 水溶性
与盐酸反应
Na2O 白色
溶
MgO 白色 微溶
产生红褐色的沉淀
先有灰白色的沉淀,迅速变 成灰绿色,最后变成红褐色
化学方程式
FeCl3+3NaOH= Fe(OH)3+3NaCl
FeSO4+2NaOH =Fe(OH)2+Na2SO4
4Fe(OH)2+O2+2H2O =4Fe(OH)3
(1)氢氧化铁的性质 氢氧化铁是一种难溶于水的红褐色固体
①与酸反应 ②受热可分解
3.可用做医用胃酸用和剂的是:
A. NaOH B. Cu(OH)2 C. Al(OH)3 D. NaHCO3
三.盐 1.碳酸钠和碳酸氢钠 (1)Na2CO3和NaHCO3在水中的溶解性
步骤
Na2CO3
NaHCO3
①
白色粉未,加水结块 白色粉未,加水部分溶
成晶体,放热
解,感受不到热量变化
②
振荡长时间可溶解
O v0
v1 v2 yA
x O v0
x
v1
v2
y B
O v0 v1 v2
y C
x O v0
x
v1
v2
y
D
回
例.飞机在离地面高度为H的空中,以速度在水平方向上匀 速飞行,每隔相等时间间隔从飞机上放下一只球,不计空 气阻力,下列说法中正确的是( )
A.小球在空中排成竖直线,它们的落地点是等间距的 B.小球在空中排成竖直线,它们的落地点是不等间距的 C.小球在空中排成抛物线,它们的落地点是等间距的 D.小球在空中排成抛物线,它们的落地点是不等间距的
(还原剂)(氧化剂)
2.氢氧化铝
(1)氢氧化铝的制备 实验:向0.5mol\L的Al2(SO4)3溶液滴加氨水 现象:产生白色胶状沉淀 Al2(SO4)3+6NH3•H2O=2Al(OH)3 +3(NH4)2SO4
白色胶状的氢氧化铝难溶 于水,能凝聚水中的悬浮物, 并能吸附色素
(2)氢氧化铝的性质 实验1:向氢氧化铝沉淀中加入盐酸 现象: 白色沉淀溶解成无色溶液
②能与酸反应生成盐和水 NaOH+HCl=NaCl+H2O (H++OH-= H2O)
Cu(OH)2+H2SO4=CuSO4+2H2O [Cu(OH)2+2H+=Cu2++2H2O]
1.铁的氢氧化物
实验3-6:在FeCl3、FeSO4分别加入NaOH溶液
FeCl3
FeSO4
加入NaOH溶
液产生的现象
(1)Fe3+离子的检验
向FeCl3和FeCl2溶液中分别加入KSCN溶液
FeCl3溶液 FeCl2溶液
滴入KSCN溶液
溶液呈血红色
溶液颜色无变化
交流和讨论:有哪些方法可 以签别FeCl3溶液和FeCl2溶液
(2)Fe3+离子的氧化性
实验1:在FeCl3溶液中加入Fe粉,振荡。 再滴入几滴KSCN溶液
例:甲乙两球位于同一竖直线上的不同位置,甲比乙高h,
如图,将甲乙分别以速度v1和v2水平抛出,不计空气阻力
,下列条件中有可能使乙球击中甲球的是( D)
A、同时抛出,且v1<v2 C、甲早抛出,且v1>v2
B、甲迟抛出,且v1>v2 D、甲早抛出,且v1<v2
剖析:从抛出到相遇;h甲>h乙,所以t甲>t乙,即甲 早抛出才有可能相遇.
水平方向:匀速直线运动(V0) 竖直方向:自由落体运动(V0’=0,G,a=g)
平抛运动的规律:
位移规律:
分位移: x v0t y 1 gt2 2
合位移: S x2 y2
O’
位移偏转角:tan y gt
x 2v0
平抛运动的轨迹方程: y g x 2 2v0 2
平抛运动的规律:
速度规律:
Fe(OH)3+3HCl=FeCl3+3H2O 2Fe(OH)3===Fe2O3+3H2O
(2)氢氧化亚铁的性质 讨论:通过以上实验,你认为氢氧化亚铁 的化学性质与一般的氢氧化物有什么异同?
①与酸反应 Fe(OH)2+2HCl=FeCl2+2H2O ② 不稳定,易被空气中的氧气氧化 4Fe(OH)2+O2+2H2O=4Fe(OH)3
俗名
水溶性
溶液碱性
Na2CO3
纯碱 苏打 易溶
较强
NaHCO3
小苏打
可溶
较弱
与酸作用 反应较剧烈
反应很剧烈
Na2CO3+2HCl=2NaCl+H2O+CO2 NaHCO3+HCl=NaCl+H2O+CO2
热稳定性 稳定加热难分解
不稳定,加热可分解
2NaHCO3==Na2CO3+H2O+CO2
2.三价铁的氧化性
Ⅱ.氧化铁(Fe2O3)是一种红棕色 的粉未(俗称铁红),常用于 制造红色油漆和涂料
Ⅲ.氧化铝(Al2O3)是一种白色难熔的物质,是一种 较好的耐火材料
Ⅳ.氧化亚铜(Cu2O)呈红色,可以制 造玻璃、搪瓷的红色颜料
二.氢氧化物 思考和交流
氢氧化物具有哪些物理化学性质? (以NaOH、Mg(OH)2、 Cu(OH)2 为例,从颜色状态、水溶性和化学性 质进行讨论)
碱性氧化物
(3)氧化铝性质的特殊性
Al2O3+6HCl==2AlCl3+3H2O Al2O3+2NaOH==2NaAlO2+H2O
(偏铝酸钠)
因此氧化铝既能与酸反应生成盐和水,也能 与强碱溶液反应生成盐和水这类氧化物叫做
两性氧化物
2. 金属氧化物的用途
Ⅰ.作为冶炼金属的原料 Fe2O3+3CO===2Fe+3CO2
(2)AB间的距离。
(3)从抛出经多长时间小球与斜面间的距离最大。
例、如图所示AB为斜面,BC为水平面,AB与BC的夹角
为θ,从A点以水平初速度v0向右抛出一小球,其落点与A
的水平距离为S1,若初速度为2v0,则落点与A的水平距离
为S2,不计空气阻力,则S1:S2可能为 ( )
A.1:2 B.1:3 C.1:4
总结:Fe2
+
+氧化剂(Cl2) +还原剂(Fe)
还原剂
Fe3
氧+ 化剂
3.焰色反应
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,
火焰呈
黄色
②钠燃烧时,火焰呈 黄色
很多金属或它们的化合物在灼烧时都会使火焰呈现 特殊的颜色,这在化学上叫做焰色反应
实验:用铂丝分别蘸取碳酸钠溶液和碳酸钾溶 液,在火焰上灼烧
t
0
2h 0t
v v 3、影响落地速度的因数:
2 2gh
t
0
4、任意两个相等时间间隔内的速度变化量相等
v g t
思考:猎人的枪口和动物考拉处于同一水平位置,动物考 拉为了逃命在发射的同时沿子弹前进方向水平向前跳,动 物能否逃脱厄运?怎样跳才能逃脱厄运?
