第二章电极与电极过程概述
02-电极过程简介
物质的传递速度可以用流量来表示, 物质的传递速度可以用流量来表示,即单位时间 流量来表示 内通过单位截面积的物质的量。 内通过单位截面积的物质的量。
若只考虑一维方向, 方向, 的传质流量为: 若只考虑一维方向,即x方向, 粒子 的传质流量为: 方向 粒子i的传质流量为
J i ( x) = J id ( x) + J ic ( x) + jim ( x) ∂Ci Zi F ∂E = − Di + Ci v( x) − Ci D ∂x RT ∂x
O +e- →R
如果电子交换速率较快(可逆过程) 如果电子交换速率较快(可逆过程),而传质速 度慢,则电流受传质速度控制。 度慢,则电流受传质速度控制。 如果溶液中加入大量的支持电解质(如KCl), 如果溶液中加入大量的支持电解质( ), 可以消除迁移电流, 可以消除迁移电流,在紧靠近电极表面的溶液内 对流作用也可忽略不计。 部,对流作用也可忽略不计。 因此,仅由扩散控制,称为扩散过程, 因此,仅由扩散控制,称为扩散过程,相应的电 扩散过程 流为扩散电流。实际上,许多电化学也如此。 流为扩散电流。实际上,许多电化学也如此。
暂态阶段:流过电极的电流(总电流) 暂态阶段:流过电极的电流(总电流)包括的范 围比稳态时大。 围比稳态时大。
法拉弟电流
由电极表面的氧化或者还原反应所产生的。 由电极表面的氧化或者还原反应所产生的。
非法拉弟电流
如双电层的充电电流,不符合法拉弟定律。 如双电层的充电电流,不符合法拉弟定律。
双电层充电电流(非法拉弟电流)可表示为: 双电层充电电流(非法拉弟电流)可表示为:
∂C i ( x, t ) J i ( x ) = − Di ∂x
Fick第一定律。 第一定律。 第一定律
燃料电池技术 第二章 燃料电池基础理论与研究方法(1)

15
真实燃料电池的效率要低于上述的极限效率, 主要是由于电压损失和燃料的利用率导致。 要使电压损失为0,电化学反应在完全可逆 的情况发生,需输出电流无穷小。实际是不可 能的。 电压效率=开路电压V/理论电动势E 燃料 利 用 率 : 实 际使 用过程中,燃料 不 能 完全 转 化 为 电能,部 分 燃料 直 接 随废气 被 排除 燃料电池 系统,导致燃料利用率小于100%。
1
第二章
燃料电池基础理论 与研究方法
燃料电池技术 第2章 燃料电池基础理论与研究方法
2
阳极: 燃料被氧化,产生
电子和质子,电子通过外 回路到达阴极,质子穿过 膜到达阴极。
阴极: 氧化剂被还原,接
受电子,并与阳极来的质 子发生反应。
燃料电池技术
第2章 燃料电池基础理论与研究方法
3
2.1 燃料电池热力学
19
2.2.1 法拉第定律
当FC工作时, 输出电能而对外做功,FC的燃料和氧化剂 的消耗量与输出电量之间的定量关系服从法拉第定律。 法拉第第一定律:燃料和氧化剂在FC内的消耗量∆m与电池 输出的电量Q成正比,即:
∆m = ke ⋅ Q = ke ⋅ I ⋅ t
其中, ∆m和Q分别是反应物的消耗量和产生的电量(单位 库仑),I是电流强度,t是时间。 ke 比例 系 数 :是产生 单 位 电量所 需 的反应 物 的量, 称 为 电 化当量。
23
FC 都 是 采 用 多孔 气 体 扩散 电极, 电极 , 反应是在 整 个电极的立 体空间 内的三 相( 相( 气、液 、固 ) 界面上进行的。 的。 对任何形式的多孔气体扩散电极,由于电极 反应界面 的真 实面积是很难计算 的,通 常是 以 电极的几何面 积计算 电流密 度的,所得 到的电 流密度称为表观电流密度。 显然,表观电流密度可以用来表示电化学反 应速度。
电极过程的基本历程和特点

电极过程的基本历程和特点电极过程是指在电化学反应中,电子从电极中流出或流入溶液的过程。
电极过程是电化学反应的关键步骤,它决定了整个电化学反应的进行方式和速率。
本文将从基本历程和特点两个方面进行解释。
一、基本历程:电极过程包括氧化过程和还原过程两个方面。
在氧化过程中,电极上的物质失去电子,形成正离子;在还原过程中,电极上的物质获得电子,形成负离子或中性物质。
氧化过程的基本历程如下:1. 电子从电极中流出:电极上的物质失去电子,形成正离子,并将电子传递给电解质溶液中的其他物质。
2. 离子在溶液中扩散:正离子在电解质溶液中自由扩散,并与其他物质发生反应。
3. 反应生成产物:正离子与电解质溶液中的其他物质发生反应,生成新的物质。
还原过程的基本历程如下:1. 电子进入电极:电解质溶液中的物质失去电子,形成负离子或中性物质,并将电子传递给电极。
2. 离子在溶液中扩散:负离子或中性物质在电解质溶液中自由扩散,并与其他物质发生反应。
3. 反应生成产物:负离子或中性物质与电解质溶液中的其他物质发生反应,生成新的物质。
二、特点:1. 电极过程是电化学反应的关键步骤:电极过程决定了电化学反应的进行方式和速率。
通过控制电极上的物质的氧化和还原过程,可以控制电化学反应的方向和速率。
2. 电极过程与电极材料的性质相关:电极过程的进行受到电极材料的性质影响。
不同的电极材料对电极过程的催化作用不同,可以加速或减缓电极过程的进行。
3. 电极过程与电解质溶液的浓度相关:电极过程的进行受到电解质溶液中物质浓度的影响。
电解质溶液中物质浓度越高,电极过程的进行越容易。
4. 电极过程与温度的变化相关:电极过程的进行受到温度的影响。
温度升高可以加快电极过程的进行速率,而温度降低则会减慢电极过程的进行速率。
5. 电极过程与电流的大小相关:电极过程的进行速率与电流的大小呈正相关关系。
电流越大,电极过程进行得越快,反之亦然。
电极过程是电化学反应中的关键步骤,它决定了反应的进行方式和速率。
电极过程动力学

Grahame 开创了用滴汞电极研究 “电极/溶液” 界面的系统工作。
4.
20世纪50年代是电化学学科的重要成熟期
经典电化学方法蓬勃发展和电化学队伍迅速扩大
各种快速暂态方法,旋转圆盘电极系统,研究许多电化学
测量方法在这一阶段建立。这些方法在当代电化学实验室 中仍然是基本测试手段。
§1.1 电极过程动力学的发展
§1.1 电极过程动力学的发展
电化学科学的发展大致可以分为三个阶段:电化学热 力学、电化学动力和现代电化学。 电化学热力学研究的是处在平衡状态的电化学体系, 涉及的主要问题是电能和化学能之间的转换的规律。 从19世纪末到20世纪初,在热力学基本原理被牢固地 确立后,用热力学方法研究电化学现象成了电化学研 究的主流,取得了重大的进展,使“电化学热力学” 这部分内容趋于成熟,成为物理化学课程的经典组成 部分。
§1.1 电极过程动力学的发展
电化学是在科学研究和生产实践中发展起来的,反过 来它又促进了生产力的发展。在化工、冶金、化学电 源、金属腐蚀和保护、电化学加工和电化学分析等工 业部门占有及其重要的地位。 近30年来,它在高新技术领域,如新能源、新材料、 微电子技术、生物化学等等方面也扮演重要角色。与 此同时,由于电化学理论与方法的发展,在与其他学 科边缘地域形成了融盐电化学、半导体电化学、催化 电化学、腐蚀电化学、金属电化学、生物电化学等新 兴学科。电化学应用已远远超出了化学领域,在国民 经济许多部门发挥了巨大作用。
第六章 交流阻抗方法
§6.1 电解池的等效阻抗 §6.2 表面浓度波动和电极反应完全可逆 时的电解阻抗 §6.3 电化学步骤和表面转化步骤对电解 阻抗的影响 §6.4 电极交流阻抗的复数阻抗图 §6.5 交流阻抗的测量方法 §6.6 电化学阻抗谱数据处理的若干问题
电极过程动力学导论

计时电流法
通过测量电流随时间的变化, 推算电极反应的动力学参数。
电极过程动力学实验结果分析
动力学参数的确定
通过实验数据拟合,确定电极反应的 动力学参数,如反应速率常数、活化 能等。
电极过程的机理分析
根据实验结果,推断电极反应的机理 和中间产物。
THANKS FOR WATCHING
感谢您的观看
电极过程
在电化学反应中,电极与电解质溶液界面上的电子转移和相关化学反应的动态 过程。
涉及内容
电极电位、电流密度、反应速率等。
电极过程分类
可逆电极过程
电极反应速率相对较慢,电极电位与平衡电位相差较小,电极表面附近无显著的物质积累或减少。
不可逆电极过程
电极反应速率相对较快,电极电位与平衡电位相差较大,电极表面附近有显著的物质积累或减少。
电极过程动力学导论
contents
目录
• 引言 • 电极过程动力学基础 • 电极反应速率理论 • 电极过程动力学模型 • 电极过程动力学实验研究 • 电极过程动力学研究展望
01 引言
主题简介
电极过程动力学是研究电化学反应在 电极表面进行的速率和机理的学科, 涉及到电子转移、传质、化学反应等 多个方面。
随着实验技术的不断发展和理论模型的完善,电极过程动力学研究已经取得了许 多重要的成果,为电化学工业、能源存储和转化等领域的发展提供了重要的理论 支撑。
电极过程动力学研究发展趋势
随着新能源和环保技术的需求日益增 长,电极过程动力学研究将更加注重 高效、环保和可持续性,研究领域将 进一步拓展到新型电极材料、电化学 反应新机制和高效能量转化与存储等 方面。
电极过程简明教程

电极过程简明教程电极过程是化学反应中重要的一环,它使反应物受到电子的作用,从而产生电子的行为。
它是一种能够交换电子的过程,广泛应用于日常的实验,也广泛应用于医学、农业和其他行业。
本文将简要介绍电极过程的基本原理和过程。
一、电极反应的定义电极反应是指当反应物受到电子的作用时,发生的电子行为。
这种电子行为可以使反应物产生电子流动,从而使反应物之间产生联系,从而实现反应。
电极反应可分为催化电极反应、氧化还原电极反应和电极分离反应等。
二、电极反应的基本原理电极反应是电子在反应物之间传输的过程,表面上可以看到电子从一种物质到另一种物质的迁移。
这一过程是以反应物之间的能量差值为基础的,比如物质A含有低能量电子,物质B含有高能量电子,当两者之间存在能量差时,电子就会从物质A向物质B迁移,从而实现反应。
三、电极反应的基本过程电极反应的过程主要包括以下几步:1.反应物和电极连接起来,使其具有电流流过反应物的能力。
2. 使用电源提供电压,以产生电流,从而使反应物之间形成电子反应,从而进行反应。
3.过监测反应物及其产物的活性变化,确定反应是否发生,及其反应的方向和程度。
4.后断开电极连接,停止反应过程。
四、电极反应的实验步骤1.备所需设备:电源、电极、容器、反应物等。
2.电极放置在容器中,将反应物放入容器中,充分混合;3.接电极与电源,调节电压,使电极反应开始;4.测反应物及其产物的活性变化;5.整电压,使反应接近平衡;6.开连接,停止反应过程,完成实验。
五、总结电极反应是指当反应物受到电子的作用时,发生的电子行为,是一种能够交换电子的过程。
本文介绍了电极反应的基本原理、基本过程及实验步骤,希望能够给相关人员搭建一座桥梁,扩大电极反应的应用范围,促进电极反应实验的顺利进行。
光电化学课件-电化学研究方法第二讲-电极过程动力学的唯像处理
j(电流密度)
j(电流密度)
电极电势
原电池中的极化曲线
电解制备和纯化金属如铝 NaCl
H2O
electrolysis
NaOH
1 2
Cl2
除了电压型的传感器(pH计, ISE)外, 大部分电化学装置在 工作时, 往往是偏离平衡的条件的
如何评价(偏离平衡条件下工作)电化学装置的性能
指导设计、优化的电化学装置?
以一定电流密度电解水时电解池中的电压分布
2H 2e H2
处理复杂电极过程问题的基本思路
简化的电极反应过程
电子转移面
把握总过程中占主导地 位的过程,或者创造条件
使所研究的基本过程在
电极
电荷转移
Os
传质过程 电极过程中占主导地位 Ob 电极过程动力学研究
ne
注重电荷传递过程
控制实验条件,可使
Rs 传质过程 Rb 电荷传递过程成为速
OHP面
控步骤.
• 传荷过程 k0 - 电荷传递速率 k0 》m 传质过程为速控步骤
浓差、电化学、电阻极化及混合作用下的极化曲线
j 浓差
jl
=电化学+ 浓差
电化学
电阻
=电化学+ 浓差+ 电阻
0
首先必须深刻地从理论上了解构成电极过程的各个基本 过程,了解它们影响这些过程的各影响因素以及每个过程 本身的主要矛盾,以及它们之间的相互联系
电极过程动力学
潘牧 Panmu@
目
录
第一章 绪论 第二章 “电极/溶液”界面的基本性质 第三章 “电极/溶液”界面附近液相中的传质过程 第四章 电化学步骤的动力学 第五章 复杂电极反应与反应机理研究 第六章 交流阻抗方法 第七章 若干重要电极过程的反应机理与电化学催
I nFv nF dm
(1-1)
sdt
电极的极化
电极过程就是“极化”的过程 电极过程动力学就是 “极化”的过程动力学
电极过程动力学
“极化”产生的原因 “极化”程度 影响“极化”的因素
§2.1 研究“ 电极/溶液”界面性质的意 义
电极反应作为一种界面反应,是直接在“电极/溶液”界面上实现的。
(4)电化学应用。
§1.1 电极过程动力学的发展
电化学是在科学研究和生产实践中发展起来的,反过 来它又促进了生产力的发展。在化工、冶金、化学电 源、金属腐蚀和保护、电化学加工和电化学分析等工 业部门占有及其重要的地位。
近30年来,它在高新技术领域,如新能源、新材料、 微电子技术、生物化学等等方面也扮演重要角色。与 此同时,由于电化学理论与方法的发展,在与其他学 科边缘地域形成了融盐电化学、半导体电化学、催化 电化学、腐蚀电化学、金属电化学、生物电化学等新 兴学科。电化学应用已远远超出了化学领域,在国民 经济许多部门发挥了巨大作用。
§1.2 电池反应与电极过程
不论是电解池中的电化学反应,还是原电池中的电化学反应,习 惯上都称为电池反应。
电解池将外部电源供给的电能转变为电池反应的化学能,原电池 将电池反应产生的化学能转化为电能。
在“ 电极/溶液”界面上传递电子时,必然发生某一或某些组分 的氧化或还原。
不管是电极池还是原电池反应,至少包括两种电极过程—阳极过 程和阴极过程,以及液相中的传质过程。
电化学原理
第 一 章 绪论
§1.1电化学科学的研究对象 §1.2电化学科学的发展简史 §1.3电化学科学涉及的领域 §1.4电化学科学的应用
§1.1 电化学科学的研究对象
• 研究对象: 电子导电回路 电解池回路 原电池回路
1、电子导电回路
• 自由电子跨越相界面 定向运动,不发生化 学变化。
• 第一类导体: 依靠自由电子导电 金属、合金、石墨
阴极上因为还原反应使电子贫乏,电位高,是 正极。
电流从正极流向负极。
电化学中:
发生氧化反应的电极称阳极
负极
正极
发生还原反应的电极称阴极
电极电位较高的电极是正极
电极电位较低的电极是负极
4、电化学科学的研究对象
电子导电相(物理学研究范畴) 离子导电相(经典电化学研究的领域) 界面效应(现代电化学研究内容)
二、电化学发展缓慢(20世纪上半叶) 电化学家企图用热力学方法解决一切电化学
问题,遭到失败。
三、电化学动力学发展( 20世纪40年代)
弗鲁姆金等 析氢过程动力学
和双电层结构研究取得进展
格来亨
用滴汞电极研究两类导体界面
电化学动力学:研究电极反应速度及其影响因素
四、理论和实验技术突破性进展( 20世纪60年代) 理论方面:非稳态传质过程动力学 表面转化步骤 复杂电极过程 实验技术方面:界面交流阻抗法 暂态测试方法 线性电位扫描法 旋转圆盘电极系统
对于溶液中的离子,其电化当量即该离子的摩尔质量 与其电荷数的比值,如1电化当量的Ag+=108g;1电化 当量的Al3+=27/3g。
§1.2 电化学科学的发展简史
一、电化学热力学发展(1799~1905)
1799 物理学家伏打发明第一个化学电源 1800 尼克松发明电解水 1833 法拉第定律发现 1870 亥姆荷茨提出双电层概念 1889 能斯特提出电极电位公式 1905 塔菲尔提出塔菲尔公式
电化学原理知识点
电化学原理第一章 绪论两类导体:第一类导体:凡是依靠物体内部自由电子的定向运动而导电的物体,即载流子为自由电子(或空穴)的导体,叫做电子导体,也称第一类导体。
第二类导体:凡是依靠物体内的离子运动而导电的导体叫做离子导体,也称第二类导体。
三个电化学体系:原电池:由外电源提供电能,使电流通过电极,在电极上发生电极反应的装置。
电解池:将电能转化为化学能的电化学体系叫电解电池或电解池。
腐蚀电池:只能导致金属材料破坏而不能对外界做有用功的短路原电池。
阳极:发生氧化反应的电极 原电池(-)电解池(+) 阴极:发生还原反应的电极 原电池(+)电解池(-) 电解质分类:定义:溶于溶剂或熔化时形成离子,从而具有导电能力的物质。
分类:1.弱电解质与强电解质—根据电离程度2.缔合式与非缔合式—根据离子在溶液中存在的形态3.可能电解质与真实电解质—根据键合类型 水化数:水化膜中包含的水分子数。
水化膜:离子与水分子相互作用改变了定向取向的水分子性质,受这种相互作用的水分子层称为水化膜。
可分为原水化膜与二级水化膜。
活度与活度系数: 活度:即“有效浓度”。
活度系数:活度与浓度的比值,反映了粒子间相互作用所引起的真实溶液与理想溶液的偏差。
规定:活度等于1的状态为标准态。
对于固态、液态物质和溶剂,这一标准态就是它们的纯物质状态,即规定纯物质的活度等于1。
离子强度I :离子强度定律:在稀溶液范围内,电解质活度与离子强度之间的关系为: 注:上式当溶液浓度小于0.01mol ·dm-3 时才有效。
电导:量度导体导电能力大小的物理量,其值为电阻的倒数。
符号为G ,单位为S ( 1S =1/Ω)。
影响溶液电导的主要因素:(1)离子数量;(2)离子运动速度。
当量电导(率):在两个相距为单位长度的平行板电极之间,放置含有1 克当量电解质的溶液时,溶液所具有的电导称为当量电导,单位为Ω-1 ·cm2·eq-1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.2.3 电极反应的表达
阳极反应(氧化反应),Cu电极为阳极 Cu (M) Cu2+ + 2e- (M)
阴极反应(还原反应),Cu电极为阴极
2.3 电极过程
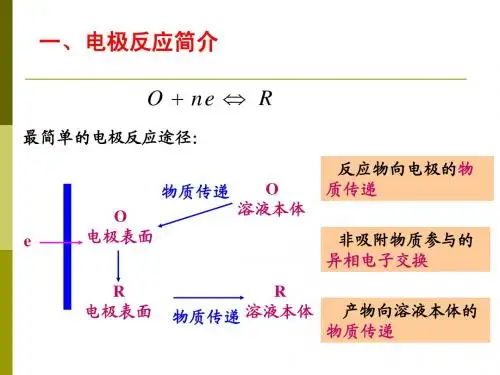
2.3.1 电极过程的基本历程
2.3.2 电极过程的主要特征
2.3.1向电极表面传递。这一步骤称 为液相传递步骤。 (2)反应物粒子在电极表面或电极表面附近的液层中进行 某种转化,例如在表面上吸附或发生化学变化(前置转化步 骤)。
(3)“电极/溶液”界面上的电子传递,生成反应产物。这
一步骤称为电化学步骤。
2.3.1 电极过程的基本历程
(4)反应产物在电极表面或电极表面附近的液层中进行某 种转化,例如从表面上脱附或发生化学变化(后置转化步 骤)。 (5)A: 反应产物生成新相,例如结晶或生成气体; B:反应产物从电极表面向溶液中或液体电极内传递,
电极系统一般由金属与电解质溶液构成。
2.1.2 电极系统及其特点
电极系统的主要特点
伴随者电荷在两个不同的导电相之间的转移,不可避免 地同时会在两相的界面上发生物质的变化由一种物质变为
另一种物质,即化学变化。
在电荷从一个相穿越界面转移到另一相中时,这个过程 必然要依靠两种不同的荷电粒子(电子和离子)之间相互转 移电荷的过程来实现。这个过程也就是物质得到或释放外层 电子的过程,而这正是化学变化的基本特征。
(3)气体电极
如一块Pt片浸在H2气氛下的HCl溶液中: 1/2 H2 (g) H+ (sol) + e- (M)
(4)氧化还原电极
如一块Pt片浸在含有铁离子(Fe3+)和亚铁离子( Fe2+ )的水溶液 中: Fe2+(sol) Fe3+(sol) + e- (M)
2.1.4 电极的含义
系统
被划定的研究对象称为系统,亦称为体系。
环境 与系统通过物理界面或假想的界面相隔开,与体系密切 相关、有相互作用或影响所能及的部分称为环境。 相
由化学性质和物理性质一致的物质组成的、与系统的其
它部分之间有界面隔开的均匀部分叫做相。
2.1.2 电极系统及其特点
电极系统的定义 如果系统有两个相组成,一个相是电子导体, 叫做电子导体相,另一个是离子导体,叫做离子导 体相,且有电荷通过它们相互接触的界面,即有电 荷在两个相之间转移,这个系统就叫做电极系统。
(1)指构成电极系统的电子导电相或电子导体材料:
例如:铂电极、汞电极和石墨电极。通常把电极系统中电子 导体相与同它接触的离子导体相之间的界面称为“电极界面”。
(2)指的是整个电极反应或整个电极系统而不只是指电子
导体材料:
例如:氢电极、参比电极。
2.2 电极反应
2.2.1 电极反应的定义
2.2.2 电极反应的特点
Q = nZe0
2.2.3 电极反应的表达
在电极反应中处于氧化状态的物质叫做氧化体,用O表 示;处于还原状态的物质叫做还原体,用R表示;在电极反 应中氧化或还原状态没有发生变化的物质用S表示。
还原体 氧化体
RR + 1S1 + 2S2 + … OO + LSL + mSm +… + ne反应物 生成物
2.1.3 常见的几类电极系统
(1)第一类金属电极
如一块Cu浸泡在清除了氧的CuSO4水溶液中: Cu (M) Cu2+ + 2e- (M)
(2)第二类金属电极
如一块表面上附有AgCl晶体层的Ag片浸在NaCl的水溶液中: Ag (M) + Cl- (sol) AgCl (M) + e- (M)
2.2.3 电极反应的表达
A. 阳极反应
当电极反应进行的方向是从还原体的体系向氧化体的体系转化时, 称这个反应是按阳极反应的方向进行,或称这个电极反应是阳极反应。
即阳极反应是氧化反应,发生阳极反应的电极为阳极。
B. 阴极反应
反之,当电极反应进行的方向是从氧化体的体系向还原体的体系 转化时,称这个反应是按阴极反应的方向进行,或称这个电极反应是阴 极反应。即阴极反应是还原反应,发生阴极反应的电极为阴极。
(3)反应“分区进行”,即氧化、还原反应分别在阳极和 阴极进行,反应中涉及的电子通过电极和外电路传递。 (4) “电极/溶液”界面附近的电场对电极反应有活化作 用,在“电极/溶液”界面上有可能在一定范围内随意地控
制反应表面的“催化活性”与反应条件。所以,电极过程是
一种特殊的异相催化反应。
2.2.2 电极反应的特点
(4)电极反应毫无例外都是氧化还原反应,但只是一个电 极反应只有整个氧化还原反应的一半:或是氧化反应,或是 还原反应。故氧化剂或还原剂的概念不能应用于单个电极反
应。
2H+(sol) + e-(M) H2(g) 2H2O(sol) 2H2(g) + O2(g) (阴极反应) 4OH-(sol) - 4e- (M) O2(g) + 2H2O(sol) (阳极反应) (整个反应) (5)电极反应遵循法拉第定律:
第二章 电极与电极过程概述
2.1 电极系统
2.2 电极反应
2.3 电极过程
2.1.1 两类导体
A. 电子导体(第一类导体)
荷电粒子是电子或电子空穴,它既包括普通
的金属导体也包括半导体。
B. 离子导体(第二类导体)
荷电粒子是离子,例如电解质溶液、熔融的
金属盐、离子液体。
2.1.1 两类导体
A. 电子导体的特点
(1)电极反应是化学反应,它遵守化学反应的基本原理, 如当量定律、质量作用定律等。 (2)在电极反应进行时,电极材料必须放出电子或吸收电
子。因此,电极反应还受到两个导体相之间的界面层的电学
状态的影响。 (3)电极反应必须发生在电极表面上,因此具有表面反应 的特点。电极的表面状况对电极反应的进行有很大的影响。
2.2.3 电极反应的表达
2.2.1 电极反应的定义
何谓电极反应? 在反应系统中伴随者两个非同类导体相之间的 电荷转移而在两相界面上发生的化学反应,称为电 极反应。 Cu (M) Cu2+ + 2e- (M) Ag (M) + Cl- (sol) AgCl (M) + e- (M)
2.2.2 电极反应的特点
自由电子或电子空穴作定向移动而导电; 导电过程中导体本身不发生变化; 温度升高,电阻也升高; 导电总量全部由电子承担。
2.1.1 两类导体
B. 离子导体的特点
正、负离子作反向移动而导电; 导电过程中有化学反应发生; 温度升高,电阻下降; 导电总量分别由正、负离子分担。
2.1.2 电极系统及其特点
这一步骤也称为液体传递步骤。
任何电极反应都包括第一、三、五步骤。
2.3.1 电极过程的基本历程
2.3.2 电极过程的主要特征
(1)一般电极过程的基本步骤串联进行,当整个电极过程 到达稳态时,各个基本步骤的净反应速度相等。 (2)整个电极过程的速度受速度最慢(活化能最大)的基
本步骤控制,该步骤称为“速控步骤”。
