反应工程李绍芬
反应工程公式总结

反应速率为:
������������
=
−
1 ������
������������������ ������������
;������������
=
−1
������
������������������ ������������
;������������
=
1 ������
������������������ ������������
因此 tafel方程只适用于强极化范围。
《反应工程》学习总结
参考资料: 《反应工程》第二版 李绍芬
主要学习:
1.反应动力学基础 2.吸附与脱附
1.反应动力学基础
化学反应速率:以反应
������������������ + ������������������ → ������������������ 为例:
又因为
������������
=
������������������,所以对于恒容过程,������������
= − ������������������
������������
该式以浓度对时间的变化率表
示化
学反应速率
2.动力学方程
基元反应的速率方程(幂函数型速率方程):
������:反应速率常数,是温度的函数
总之不论是可逆还是不可逆反应。反应速率 都是随着转化率增大而降低的。
4.反应速率与转化率的关系
单一反应:������������������ + ������������������ → ������������������
������������ = ������0[exp
化学反应工程教案
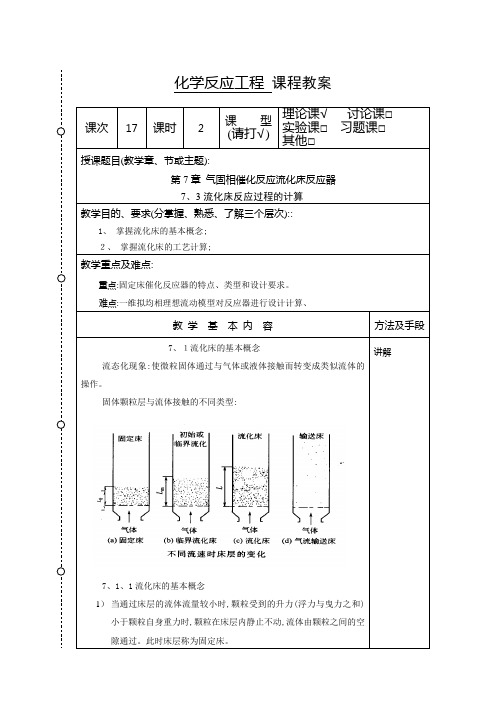
化学反应工程课程教案课次17课时 2 课型(请打√)理论课√讨论课□实验课□习题课□其他□授课题目(教学章、节或主题):第7章气固相催化反应流化床反应器7、3流化床反应过程的计算教学目的、要求(分掌握、熟悉、了解三个层次)::1、掌握流化床的基本概念;2、掌握流化床的工艺计算;教学重点及难点:重点:固定床催化反应器的特点、类型和设计要求。
难点:一维拟均相理想流动模型对反应器进行设计计算、教学基本内容方法及手段7、1流化床的基本概念流态化现象:使微粒固体通过与气体或液体接触而转变成类似流体的操作。
固体颗粒层与流体接触的不同类型:7、1、1流化床的基本概念1)当通过床层的流体流量较小时,颗粒受到的升力(浮力与曳力之和)小于颗粒自身重力时,颗粒在床层内静止不动,流体由颗粒之间的空隙通过。
此时床层称为固定床。
讲解2)随着流体流量增加,颗粒受到的曳力也随着增大、若颗粒受到的升力恰好等于自身重量时,颗粒受力处于平衡状态,故颗粒将在床层内作上下、左右、前后的激烈运动,这种现象被称为固体的流态化,整个床层称为流化床、曳力(表面曳力、形体曳力)曳力是流体对固体的作用力,而阻力是固体壁对流体的作用力,两者是作用力与反作用力的关系。
表面曳力由作用在颗粒表面上的剪切力引起,形体曳力由作用在颗粒表面上的压强力扣除浮力部分引起、3)。
流化床类似液体的性状(a) 轻的固体浮起;(b)表面保持水平;(c)固体颗粒从孔中喷出;(d)床面拉平;(e)床层重量除以截面积等于压强流化床的优点(1) 颗粒流动类似液体,易于处理、控制;(2) 固体颗粒迅速混合,整个床层等温;(3) 颗粒能够在两个流化床之间流动、循环,使大量热、质有估计在床层之间传递;(4) 宜于大规模操作;(5) 气体和固体之间的热质传递较其它方式高;(6) 流化床与床内构件的给热系数大、浓相段和稀相段(P185-186)1)、当流体通过固体床层的空塔速度值高于初始流化速度但低于逸出速度(p188),颗粒在气流作用下悬浮于床层中,所形成的流固混合物称为浓相段。
反应工程李绍芬

(2)得率:生成目的产物P与着眼反应物A起始的物质的量之比。
XP
nP np0 nA0
(3)选择性:生成目的产物P与副产物S的物质的量之比。
瞬时选择性
sP
dcP dcS
rP rS
总选择性
SP
nP nS
np0 nS0
(4)
XP PxA
能源与动力工程学院化工系
1平行反应
一种反应物按不同途径反应,生成不同的反应物。根据 反应种类可分为若干种组合。
研究对象:反应速率及其影响因素 微观动力学 准确描述反应机理的理论模型基础上的 反应动力学 宏观动力学 包含了传递过程影响在内的反应动力学 本征动力学 排除了传递过程影响的反应动力学
能源与动力工程学院化工系
2.1 反应速率
vAA vBB vRR
以单位时间,单位反应体积内反应物系中某一反应组分 的变化量来定义速率。
A
dt
AA B
k
C
1
A
CB
• dCA dt
[k ] [t C 1 1 ]
1级反应: [k]=[t-1] 1级反应: [k]=[t-1c-1]
能源与动力工程学院化工系
2.2.3可逆反应
A S 1级,CS0=0,恒容
(rA )
dCA dt
k
CA
kCS
k
CA
k(CA0
)
( k k )CA kCA0
能源与动力工程学院化工系
2.2.2单一反应动力学方程的建立
对于不可逆反应(把它看做恒容反应)
aA+bB产物
假定其动力学方程为:
( r
)
dC A
k
c c
A
反应工程的前沿之一

反应工程的前沿之一反应工程的前沿之一——对新材料合成的综述学院:化学与化工学院专业:化学工程与工艺班级:化工091过程,创造出能满足各种需要的新型材料的技术。
新材料按材料的属性划分,有金属材料、无机非多属材料(如陶瓷、砷化镓半导体等)、有机高分子材料、先进复合材料四大类。
按材料的使用性能性能分,有结构材料和功能材料。
结构材料主要是利用材料的力学和理化性能,以满足高强度、高刚度、高硬度、耐高温、耐磨、耐蚀、抗辐照等性能要求;功能材料主要是利用材料具有的电、磁、声、光热等效应,以实现某种功能,如半导体材料、磁性材料、光敏材料、热敏材料、隐身材料和制造原子弹、氢弹的核材料等。
新材料在国防建设上作用重大。
例如,超纯硅、砷化镓研制成功,导致大规模和超大规模集成电路的诞生,使计算机运算速度从每秒几十万次提高到现在的每秒百亿次以上;航空发动机材料的工作温度每提高100℃,推力可增大24%;隐身材料能吸收电磁波或降低武器装备的红外辐射,使敌方探测系统难以发现,等等。
新材料技术被称为“发明之母”和“产业粮食”。
新材料作为高新技术的基础和先导,应用范围极其广泛,它同信息技术、生物技术一起成为二十一世纪最重要和最具发展潜力的领域。
同传统材料一样,新材料可以从结构组成、功能和应用领域等多种不同角度对其进行分类,不同的分类之间相互交叉和嵌套,目前,一般按应用领域和当今的研究热点把新材料分为以下的主要领域:电子信息材料、新能源材料、纳米材料、先进复合材料、先进陶瓷材料、生态环境材料、新型功能材料(含高温超导材料、磁性材料、金刚石薄膜、功能高分子材料等)、生物医用材料、高性能结构材料、智能材料、新型建筑及化工新材料等。
下面对几种新材料作简介。
一、纳米材料纳米粒子即非微观粒子又非宏观物体,一种介观粒子有一系列不同于宏观块体的特性:(1)、表面效应是指纳米粒子表面原子数与总原子数之比随粒径的变小而急剧增大后引起的性质上的变化。
随着颗粒尺寸的减小,比表面大大增加,当粒径为5nm时,表面将占50%;(2)、小尺寸效应当纳米粒子尺寸与德布罗意波以及超导态的相干长度或透射深度等物理特征尺寸相当或更小时,对于晶体其周期性的边界条件将被破坏,对于非晶态纳米粒子其表面层附近原子密度减小,这些都会导致电、磁、光、声、热力学等性质的变化,这称为小尺寸效应;(3)、量子尺寸效应当粒子尺寸降低到某一值时,金属费米能级附近的电子能级由准连续变为分立能级和纳米半导体微粒的能隙变宽的现象均称为量子尺寸效应。
化学反应工程教案5(化工13)

化学反应工程课程教案
从本质上说,物理过程不改变反应过程的动力学规律。
也就是说,反应的动力学方程并不因为物理过程的存在而发生变化。
但是,流体的流动、传质、传热过程会影响实际反应场所的浓度和温度在时间、空间上的分布,从而影响实际反应场的浓度和温度在时间、空间上的分布,从而影响反应的最终结果。
对某个具体反应,选择反应器、操作条件和操作方式主要考虑化学反应本身的特征与反应器特征,最终选择的依据将取决于所有过程:一是反应器的大小,二是产物分布济性。
过程的经济性主要受两个因素影响;而对于复合反应,首先要考虑产物分布。
2.1单一不可逆反应过程与反应器
2.1.1单一不可逆反应过程平推流反应器与全混流反应器的比较
在反应器设计评比中,只考虑如何有利于反应速率的提高。
当然,其中一个重要因素是,考察反应器的大小.
一、理想流动反应器的体积比较
基本条件:
和反应温度均相同;等容过程。
V R ,V RP ,V RM 分别表示间歇反应器体积、平推流反应器
体积和全混流反应器体积,则:
当转化率越大,则两者的差距
较大,所以可采用低转化率操作。
1、对同一单一的正级
数反应,在相同工艺
00,,A Af V C x Af A 0A00A x R dx V V C r =⎰Af A 0A00A x Rp
dx V V C r =⎰00()A Af RM A f
V C x V
r =0000[]
[]
Rp A RM A V V C OABD V V C OCBD ==1
<RM RP
V V。
李绍芬《反应工程》课后习题答案

李绍芬《反应工程》课后习题答案1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分 摩尔分率y i0 摩尔数n i0(mol) CH 3OH 2/(2+4+1.3)=0.2740 27.40 空气 4/(2+4+1.3)=0.5479 54.79 水 1.3/(2+4+1.3)=0.1781 17.81 总计 1.000 100.0A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol组分 摩尔数(mol ) 摩尔分率% CH 3OH 7.672 6.983 HCHO 18.96 17.26 H 2O 38.3 34.87 CO 2 0.7672 0.6983 O 2 0.8788 0.7999 N 2 43.28 39.391. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+ 242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩原料气 Bkg/h 粗甲醇 Akmol/h100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
反应工程第三版答案李绍芬
反应工程第三版答案李绍芬【篇一:李绍芬版反应工程(第二版)完整答案】在银催化剂上进行甲醇氧化为甲醛的反应:2ch3oh?o2?2hcho?2h2o 2ch3oh?3o2?2co2?4h2o进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:s0.9611?96.11%(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol时,则反应器的进料组成为设甲醇的转化率为xa,甲醛的收率为ypna、np和nc分别为:na=na0(1-xa)=7.672 mol np=na0yp=18.96 molnc=na0(xa-yp)=0.7672 mol结合上述反应的化学计量式,水(nw)、氧气(no)和氮气(nn)的摩尔数分别为:nw=nw0+np+2nc=38.30 mol no=no0-1/2np-3/2nc=0.8788 molnn=nn0=43.28 mol所以,反应器出口气体组成为:1. 1.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:co?2h2?ch3oh2co?4h2?(ch3)2o?h2o co?3h2?ch4?h2o4co?8h2?c4h9oh?3h2oco?h2o?co2?h2由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图原料气 bkg/h 粗甲醇 akmol/h100kmol放空气体原料气和冷凝分离后的气体组成如下:(mol)组分原料气冷凝分离后的气体 co 26.82 15.49 h2 68.25 69.78 co2 1.46 0.82 ch4 0.55 3.62 n2 2.92 10.29粗甲醇的组成为ch3oh 89.15%,(ch3)2o 3.55%,c3h9oh 1.10%,h2o 6.20%,均为重量百分率。
第三章 釜式反应器
������������
1
= − ln 1 − ������
1 − ������
������
化学反应工程——釜式反应器
7
t与CA0有关 t与CA0无关
2. 间歇反应器的反应体积:
������ = ������ ������ + ������
式中: Q0— 单位时间内处理的反应物料的体积(由生产任务决定) t— 反应时间 t0— 辅助时间
1 − ������
������������
������������
1 反应时间:������ =
������������
������������ 1 − ������
若 ������ ≠ 1
t = 1 − ������
−1
������ − 1 ������������
若 ������ = 1
1 ������ = ������
������ = = ������ ������
(5)
������������
初 始 条 件 : t=0时,CA=CA0 ; CP=0; CQ=0
对 ( 4 ) 积 分 得 : ∴ ������ =
ln =
ln
(6)
由此式可求得为达到一定的XA所需要的反应时间,式(6)也可写成:
������ = ������ exp − ������ + ������ ������
1 − exp − ������ + ������ ������
������ + ������
两种产物的浓度之比,在任何反应时间下均等于两个反应的速率常数之比。
化学反应工程——釜式反应器
16
李绍芬版本 反应工程 课后习题全解 管式反应器
4 管式反应器4.1在常压及800℃等温下在活塞流反应器中进行下列气相均相反应: 6532664+→+C H CH H C H CH在反应条件下该反应的速率方程为:0.51.5,/.=T H r C C mol l s式中C T 及C H 分别为甲苯及氢的浓度,mol/l ,原料处理量为2kmol/h ,其中甲苯与氢的摩尔比等于1。
若反应器的直径为50mm ,试计算甲苯最终转化率为95%时的反应器长度。
解:根据题意可知甲苯加氢反应为恒容过程,原料甲苯与氢的摩尔比等于1,即:00=T H C C ,则有:0(1)==-T H T T C C C X示中下标T 和H 分别代表甲苯与氢,其中:53300330000.5 1.01310 5.6810/8.3141010732/21/0.27810/--⨯⨯===⨯⨯⨯====⨯T T T T p C kmol mRT F Q C kmol h kmol s所以,所需反应器体积为:00000.5 1.500 2.50.95333 1.5 1.501.5 1.5(10.95)10.278100.4329 3.0061.5(5.6810)(1) 1.51---==--=⨯=⨯=⨯--⎰⎰⎰TT X X T Tr T T T H T T T dX dX V Q C Q C C C C dX mX 所以,反应器的长度为:23.0061531.10.05 3.14/4=⨯m4.2根据习题3.2所规定的条件和给定数据,改用活塞流反应器生产乙二醇,试计算所需的反应体积,并与间歇釜式反应器进行比较。
解:题给条件说明该反应为液相反应,可视为恒容过程,在习题3.2中已算出:0275.8/=Q l h 0 1.231/=A C mol l所以,所需反应器体积:00000000(1)()275.80.95818.61 5.2 1.23110.95=--===-⨯-⎰AX Ar A A A B A A A A A dX V Q C kC X C C X Q X lkC X由计算结果可知,活塞流反应器的反应体积小,间歇釜式反应器的反应体积大,这是由于间歇式反应器有辅助时间造成的。
化学反应工程李绍芬第三版课后答案
化学反应工程李绍芬第三版课后答案1、苯丙素类的基本母核是具有一个或数个()单元的天然化合物()[单选题] * AC6-C3基团(正确答案)BC6-C6基团CC5-C3基团DC8-C8基团2、在结晶溶剂的选择过程中首先要遵循的是()[单选题] *A成分的纯度(正确答案)B相似相容原理C冷却热饱和原理D以上都不对3、阿托品的结构类型是()[单选题] *A喹啉类B异喹啉类C莨菪烷类(正确答案)D苄基异喹啉类4、E连续回流提取法(正确答案)能用乙醇作溶剂提取的方法有(多选)()* A浸渍法(正确答案)B渗漉法(正确答案)C煎煮法D回流提取法(正确答案)5、下列应用最广的经典提取方法是()[单选题] *A水蒸气蒸馏法B溶剂提取法(正确答案)C超临界流体萃取法D超声提取法6、下列化合物中β位有-COOH取代的是()[单选题] *A大黄素B大黄酸(正确答案)C大黄素甲醚D芦荟大黄素7、属于挥发油特殊提取方法的是()[单选题] *A酸提碱沉B水蒸气蒸馏(正确答案)C煎煮法D浸渍法8、南五味子保肝的主要效药效成分是()[单选题] *A蒽醌B香豆素C黄酮D木脂素(正确答案)9、处方中厚朴主要化学成分厚朴酚,其结构类型是()[单选题] * A黄酮B香豆素C木脂素(正确答案)D三萜皂苷10、具有升华性的生物碱是()[单选题] *A烟碱B咖啡因(正确答案)C槟榔碱D苦参碱11、游离生物碱和生物碱盐都易溶解的溶剂是()[单选题] *A三氯甲烷B正丁醇C乙醇(正确答案)D水12、从香豆素类的结构与分类看,下列属于简单香豆素类的是()[单选题] * A龙脑B七叶内酯(正确答案)C薄荷醇D西瑞香素13、木脂素母核结构中的C6-C3单体数目为()[单选题] *A1个B2个(正确答案)C3个D4个14、下列不能作为极性吸附剂的是()[单选题] *A活性炭(正确答案)B氧化铝C硅胶D氧化镁15、碱水提取芦丁时,若PH过高会使()[单选题] * A产品质量降低B产品收率降低(正确答案)C苷键水解断裂D内酯环开环16、下列含有蒽醌类成分的中药是()*A丹参B决明子(正确答案)C芦荟(正确答案)D紫草17、分馏法分离挥发油的主要依据是()[单选题] * A密度的差异B沸点的差异(正确答案)C溶解性的差异D旋光性的差异18、可沉淀具有羧基或邻二酚羟基成分的沉淀法是()[单选题] *A溶剂沉淀法B醋酸铅沉淀法(正确答案)C酸碱沉淀法D水提醇沉法19、以下哪种方法是利用成分可以直接由固态加热变为气态的原理()A [单选题] * A升华法(正确答案)B分馏法C沉淀法D透析法20、四氢硼钠反应变红的是()[单选题] *A山柰酚B橙皮素(正确答案)C大豆素D红花苷21、结晶法一般是在分离纯化物质的哪个阶段常常使用的()[单选题] * A开始B中期C最后(正确答案)D以上均可22、连续回流提取法与回流提取法比较,其优越性是()[单选题] *A节省时间且效率高B节省溶剂且效率高(正确答案)C受热时间短D提取量较大23、具有挥发性的生物碱是()[单选题] *A苦参碱B莨菪碱C麻黄碱(正确答案)D小檗碱24、具有挥发性的生物碱是()[单选题] *A吗啡碱B麻黄碱(正确答案)C苦参碱D小檗碱25、极性最大的溶剂是()[单选题] *A酸乙酯(正确答案)B苯C乙醚D氯仿26、二氢黄酮类专属性的颜色反应是()[单选题] * A盐酸-镁粉反应B四氢硼钠反应(正确答案)C硼酸显色反应D锆盐-枸橼酸反应27、水蛭的主要化学成分是()[单选题] *A有机酸B蛋白质(正确答案)C多糖D生物碱28、下列化合物中,酸性最强的是()[单选题] *A芦荟大黄素B大黄酚C大黄素甲醚D大黄酸(正确答案)29、与明胶反应生成沉淀的成分是()[单选题] *A强心苷B皂苷C有机酸D鞣质(正确答案)30、E连续回流提取法(正确答案)用乙醇作溶剂提取时,下列说法正确的是()* A对植物细胞壁穿透力强(正确答案)B溶解范围广,提取较全面(正确答案)C提取液中蛋白质、多糖等水溶性杂质少(正确答案)D有防腐作用,提取液不易发霉变质(正确答案)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
速率常数
k k0eE / RT
式中 k0――频率因子或指前因子 E――活化能,J或J/mol R――通用气体常数,(国际单位)8.314J/mol·K T――绝对温度K,呈指数变化
两边取对数
ln
k
E R
1 T
ln
k0
得到以-E/R为斜率以lnk0为截距的一条直线。
能源与动力工程学院化工系
图2-1
能源与动力工程学院化工系
2.2 反应速率方程
什么是速率方程(动力学方程)?
r = f(C,T)
影响因素:温度、浓度、压力、溶剂及催化 剂,此外还有传质、传热等
• 速率方程形式:
幂函数型
( r ) k CC
A
AA B
,
(
mol m3 s
)
双曲型
rHBr
k1H 2 Br2 1/ 2 k2 HBr/ Br2
复合称为复合反应。
平行反应
k1 P
A k2 S
串联反应
A k1 P k2 S
能源与动力工程学院化工系
术语
(1)收率:生成目的产物P与消耗掉的着眼反应物A的物质的量之比。
瞬时收率
P
dcP dcA
rP rA
总收率
P
nP np0 nA0 nA
A B R
V dt
能源与动力工程学院化工系
对于物料体积变化较小的反应,液相反应即使不是等摩尔反应 体积变化也都很小都可以看做是恒容反应,即可视为恒容反应, V可视作恒定值,则n/V=CA
(rA
)
dCA dt
变容反应
rA
1 V
dnA dt
1 V
d (VCA ) dt
dCA dt
CA V
dV dt
{1
exp[
(k1
k2 )t]}
(cS
cS0 )
k2cA0 k1 k2
{1 exp[ (k1
k2 )t]}
(5) (6)
能源与动力工程学院化工系
得率 收率
总选择性 瞬时选择性
XP
(cP cp0 ) cA0
k1 k1 k2
xA
XS
(cS cS0 ) cA0
k2 k1 k2
xA
P
(cP cP0 ) cA0 cA
k )t
C
K
A0
ln
C A
-
C Ae
( k
k )t
C -C
A0
Ae
来表示
式中CA0、CA、CAe都是可测的已知数
能源与动力工程学院化工系
ln CA - CAe -(k k)t
CA0 - CAe
C -C
ln A
Ae
C -C
A0
Ae
斜率:-( k k )
t
能源与动力工程学院化工系
复杂可逆反应
dCA dt
对速率方 程两边取 对数进而 求出n和k
能源与动力工程学院化工系
1、CA对t作图 2、斜率即为反应速率 3、对速率方程 (rA) k CAn 两边取对数得
ln(-rA)=nlnCA+lnk 作图,斜率为n,截距为k
通过实验取得t对应CA的数据计算出
t
t1
t2
t3
t4
CA
-dCA/dt
(2)得率:生成目的产物P与着眼反应物A起始的物质的量之比。
XP
nP np0 nA0
(3)选择性:生成目的产物P与副产物S的物质的量之比。
瞬时选择性
sP
dcP dcS
rP rS
总选择性
SP
nP nS
np0 nS0
(4)
XP PxA
能源与动力工程学院化工系
1平行反应
一种反应物按不同途径反应,生成不同的反应物。根据 反应种类可分为若干种组合。
研究对象:反应速率及其影响因素 微观动力学 准确描述反应机理的理论模型基础上的 反应动力学 宏观动力学 包含了传递过程影响在内的反应动力学 本征动力学 排除了传递过程影响的反应动力学
能源与动力工程学院化工系
2.1 反应速率
vAA vBB vRR
以单位时间,单位反应体积内反应物系中某一反应组分 的变化量来定义速率。
微分法:直接利用动力学方程标绘,得到的实验数据是 否与此动力学方程相拟合。
对于不可逆反应(把它看做恒容反应)
aA rR
(rA
)
dCA dt
(rA) k CAn
能源与动力工程学院化工系
微分法 求解反应动力学方程的程序
假定机理 列出动力 学方程
实验数 据 CA - t 作图
求对应时 间点的斜 率:
CP CP0 k1 CS CS0 k2
(rA )
dcA dt
rP
rS
(k1
k2 )cA
初始条件:t=0,cA=cA0,cP=cP0,cS=cS0
对式(3)积分得
cA cA0 exp[ (k1 k2 )t]
(3) (4)
式(4)分别代入式 (1)和(2)积分得
(cP
cP0 )
k1cA0 k1 k2
反应工程
伊春海 能动学院化工系
复习
1. 转化率是指某一反应物转化的百分率或分率 其定义式:
某一反应物的转化量 某一反应组分反应掉的 摩尔数
x 该反应物的起始量
该组分起始摩尔数
2. ξ-反应进度 , 恒为正值
n A n B n R n S A B R S
能源与动力工程学院化工系
2.反应动力学基础
1
k2
ln
k1cA0
cA0 1 k2
k1cA0 k2 cA
k1cA0 cA0
(9)
能源与动力工程学院化工系
2. 串联反应
A k1
P
k2 S
(主反应) (副反应)
一级不可逆串联反应
初始条件:t=0,cA=cA0,cP0=cS0=0
对式(1)积分得
式(4)代入式(2)得 一阶微分方程, 解此方程得
c A,m ax
cM 0 2
rA,max
k 4
cM2 0
如何求解最大反应速率
cM0/2
cA
能源与动力工程学院化工系
复习
1. 反应速率 2. 反应速率方程 3. 速率常数k 4. 温度对k的影响 5.反应速率方程的建立
不可逆反应 可逆反应 6. 催化反应
能源与动力工程学院化工系
2.2.4 复合反应
积分得
:
k CC
t
ln
C A0 CA
1 ln
1 xA
能源与动力工程学院化工系
2.2.5自催化反应:
A+C2C+R
◆特点:反应产物中某一产物对反应有催化作用,同时,为了使反应进行,
常事先加入一定浓度的催化剂C,设浓度为CC0。……
设对各组分均为一级,则:
rA
dCA dt
kCCCA
t=0, CA=CA0 CC=CC0 CR=CR0=0
一、 1级不可逆平行反应
k1 A
k2
P (主反应)
rP
dcP dt
k1cA
S (副反应)
rS
dcS dt
k2cA
(rA )
dcA dt
rP
rS
(k1 k2 )cA
(1) (2) (3)
能源与动力工程学院化工系
rP
dcP dt
k1cA
rS
dcS dt
k2cA
rP dCP k1 rS dCS k2
k1 k1 k2
S
(cS cS0 ) cA0 cA
k2 k1 k2
SP
XP XS
k1 k2
sP
dcP dcS
k1 k2
能源与动力工程学院化工系
一级不可逆平行反应中各组分的浓度分布
与简单的一级不可逆反应变化趋势相同。 反应物浓度随反应时间单调减小; 产物浓度随反应时间单调增大。
能源与动力工程学院化工系
能源与动力工程学院化工系
2.2.2单一反应动力学方程的建立
对于不可逆反应(把它看做恒容反应)
aA+bB产物
假定其动力学方程为:
( r
)
dC A
k
c c
A
dt
AA B
整理并积分得
CA
CA0
dCA
C
A
CB
kt
常在已知的浓度CA随时间t的数据的基础上,采用微分
法和积分法。
能源与动力工程学院化工系
微分法
能源与动力工程学院化工系
lnk与1/T是直线关系 -E/R为斜率 lnk0为截距
通过实验测出不同温度下的 速率常数k,作图根据截距 就可以求出指前因子k0,再 根据直线的斜率求出活化能 E
对给定的反应,反应速率与 温度的关系在低温时比高温 时更加敏感
温度对反应速率的影响
反应速率与E、T的函数关系
反应温度/℃
lnCA
ln(-rA)
重复实验可以得到一系列的速率常数值
能源与动力工程学院化工系
积分法
aArR
(rA )
dCA dt
k
C
A
2级反应
ln(
C A
)
ln(
C A0
)kt
C
C
A0
A
ln( 1 ) kt 1 x
A
能源与动力工程学院化工系
k的因此分析
k的含义? 因此分析
( r ) dCA k cc
反应开始时总mol数(单位体积):CM0= CA0+ CC0
