认证产品或服务执行标准清单
铜业适用的产品或服务质量标准清单

铜业适用的产品或服务质量标准清单(1)铜治炼企业应建立、实施并保持满足GB/T19001要求的质量管理体系,并鼓励通过质量管理体系第三方认证。
阳极铜符合行业标准(YS/T1083),阴极铜符合国家标准(GB/T467),其他产品质量符合国家或行业相应标准。
(2)利用铜精矿的铜治炼企业,应采用生产效率高、工艺先进、能耗低、环保达标、资源综合利用效果好、安全可靠的闪速熔炼和富氨强化熔池熔炼等先进工艺(如旋浮铜熔炼、合成炉熔炼、富氧底吹、富氧侧吹、富氧顶吹、白银炉熔炼等工艺),不得采用国家明令禁止或淘汰的设备、工艺。
鼓励有条件的企业对现有传统转炉吹炼工艺进行升级改造,提升无组织烟气排放管控水平。
须配置烟气制酸、资源综合利用、节能等设施。
烟气制酸须采用稀酸洗涤净化、双转双吸等先进工艺,烟气净化严禁采用水洗或热浓酸洗涤工艺,硫酸尾气需设治理设施。
配备的治炼尾气余热回收、收尘工艺及设备须满足国家《节约能源法》《清洁生产促进法》《环境保护法》等要求。
(3)利用含铜二次资源的铜冶炼企业,须采用先进的节能环保、清洁生产工艺和设备。
企业应强化含铜二次资源的预处理,最大限度进行除杂、分类。
禁止采用化学法以及无烟气治理设施的焚烧工艺和装备。
冶炼工艺须采用NGL炉、旋转顶吹炉、倾动式精炼炉、富氢顶吹炉、富氨底吹炉、100吨以上改进型阳极炉(反射炉)等生产效率高、能耗低、资源综合利用效果好、环保达标、安全可靠的先进生产工艺及装备。
同时,应根据原料状况配套二英排放控制设施或净化设施,须使用预热空气和余热锅炉等设备。
禁止使用直接燃煤的反射炉熔炼含铜二次资源。
禁止使用无烟气治理措施的治炼工艺及设备。
(4)鼓励有条件的企业开展智能工厂建设。
建立铜治炼大数据平台,广泛应用自动化智能装备,逐步建立企业资源计划系统(ERP)、数据采集与监视控制系统(SCADA)、制造执行系统(MES)、产品数据管理系统(PDM)、试验数据管理系统(TDM),实现智能化管理、智能化调度、数字化点检和设备在线智能诊断,最终实现智能分析决策。
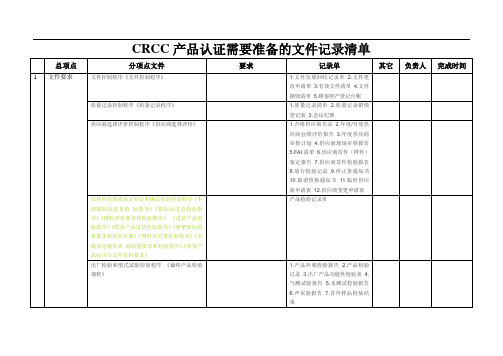
CRCC产品认证需要准备的文件记录清单(编)
18
测量,分析和改进
内部审核《内部审核控制程序》
1.年度内审计划2.内审实施计划3.内审检查表4.不符合报告5.内部质量体系审核报告6.不合格项分布表7.首,末次会议签到表8.内审会议记录
过程检验《生产过程控制程序》
▲出厂检验《最终产品检验规程》《淋雨实验规程》《气密性实验规范》《隔声实验规范》
1.合格供应商名录2.年度/月度供应商业绩评价报告3.年度供应商审核计划4.供应商现场审核报告5.FAI清单6.供应商首件(样件)鉴定报告7.供应商首件检验报告8.放行检验记录9.停止货通知书10.取消资格通知书11.临时供应商申请表12.供应商变更申请表
原材料检验或验证和定期确认检验控制程序《不锈钢制品进货检验指导》《铝制品进货检验指导》《橡胶密封条进货检验指导》《进货产品检验指导》《焊接产品进货检验指导》《喷塑表面质量要求和检验步骤》《塑料件进货检验指导》《金属及电镀件表面质量要求和检验程序》《到货产品标识与文件资料要求》
3
技术文件控制
技术标准文件
工厂制定产品企业标准,并具备和贯彻执行有关国家法律,法规和认证检验依据,企业标准严于和符合相应国家法律,法规和认证检验依据要求
设计文件
完整图纸和技术资料,自行开发的产品因有全套设计文件和设计验证,设计确认资料,且具有型式实验报
1.型式实验报告
工艺文件
工厂应具备生产所需的各种工艺文件,能够正确指导生产。(其中应规定工装,量具,工艺,材料定额,工位器具等项,并有工装设计和验证资料。)
1.往来信息记录2.售后服务信息记录
15
特殊过程
补《特殊过程制度》
对产品质量不易或不能经济地进行验证的特殊过程,应事先进行设备认可和人员鉴定,按规定的方法和要求进行操作,并对适宜的过程参数和产品特性进行监视
ISO13485医疗器械质量管理体系认证清单

ISO13485医疗器械质量管理体系认证清单认证流程认证注册条件1申请组织应持有法人营业执照或证明其法律地位的文件。
2已取得生产许可证或其它资质证明(国家或部门法规有要求时)。
3申请认证的质量管理体系覆盖的产品应符合有关国家标准、行业标准或注册产品标准(企业标准),产品定型且成批生产。
4申请组织应建立符合拟申请认证标准的管理体系、对医疗器械生产、经营企业还应符合YY/T 0287标准的要求,生产三类医疗器械的企业,质量管理体系运行时间不少于6个月,生产和经营其它产品的企业,质量管理体系运行时间不少于3个月。
并至少进行过一次全面内部审核及一次管理评审。
5在提出认证申请前的一年内,申请组织的产品无重大顾客投诉及质量事故。
认证注册需要的主要文件1法律地位证明文件(如企业法人营业执照、事业单位法人代码证书、社团法人登记证等)。
2有效的资质证明(如:医疗器械产品注册证、医疗器械生产许可证、卫生许可证等涉及法律法规规定的行政许可的须提交相应的行政许可证件复印件)。
3组织简介(内容包括企业介绍、产品用途、主要顾客、其他认证及证书情况等)人员情况、管理体系范围涉及的产品的生产/加工/服务流程图(标明关键过程、特殊过程和外包过程)。
4管理体系成文信息:方针、目标、范围、组织为过程运行及沟通而保持的信息,必须提供:车间布局图(洁净车间)、工艺流程图、灭菌过程等及其有关的过程文件。
5管理体系覆盖分支机构(包括多场所或临时场所)情况登记表。
6质量管理体系覆盖的产品和服务的接收准则清单或说明(产品检验规范)。
7最新国家、行业产品/服务监督抽查报告(如发生)。
8产品说明书(适用时,如:最终产品需提供)。
9适用的法律法规清单,包括产品标准清单(适用时,如:最终产品需提供)。
类别如何划分医疗器械之分类原则主要依据其特性,如非侵入式器材、侵入式器材、主动式器材,以及其他特殊原则。
而分类别的界定,则可根据MDD的guidelines、93/42/EEC Annex IX 中之叙述、或使用英国卫生署的disk来判断,并由厂商自行决定。
3C认证审核资料清单及相关文件

3C认证审核资料清单及相关文件证其可追溯性和完整性?2.2 是否符合国家标准要求或者更高标准?开发三部负责制定产品设计标准或规范,确保其符合国家标准要求或更高标准。
2.3 是否建立并保持文件化的文件和资料的控制程序?XXX负责建立并保持文件化的文件和资料的控制程序,以确保文件在发布前和更改时由授权人员审批其适宜性,并且文件的更改和修订状态得到识别,防止作废文件非预期使用。
同时,在使用处可获得相应文件的有效版本。
质量记录是否规定了适当的保存期限并保证其可追溯性和完整性?XXX负责建立并保持文件化的质量记录的标识、储存、保管和处理程序,同时规定适当的保存期限并保证其可追溯性和完整性。
是否规定了与质量活动有关的各类人员职责及相互关系?公司程序文件中规定了与质量活动有关的各类人员职责及相互关系。
是否已指定质量负责人并赋予了相应的职责和权限?公司程序文件中已指定质量负责人并赋予了相应的职责和权限,并且该质量负责人已履行了相应的职责。
是否在所有班次的生产操作中规定了负责产品质量的人员?现场人员安排中规定了在所有班次的生产操作中负责产品质量的人员。
是否赋予了负责产品质量的人员为了纠正质量问题,停止生产的权限?负责产品质量的人员是否履行了职责?公司程序文件中赋予了负责产品质量的人员为了纠正质量问题,停止生产的权限,并且该负责产品质量的人员已履行了职责。
是否配备了必须的生产设备、检验设备;具备必要能力的人员;必备的生产、检验、储存的环境?现场人员配置中配备了必须的生产设备、检验设备,具备必要能力的人员,并且提供了必备的生产、检验、储存的环境。
公司是否已建立、保持了文件化的质量计划/类似文件,以及确保产品质量相关过程有效运作和控制的文件?公司已建立、保持了文件化的质量计划/类似文件,并确保产品质量相关过程有效运作和控制的文件。
1.是否有记录保存期限的要求?2.是否有关键元器件和材料供应商的选择、评定和日常管理程序?3.是否有材料检验记录、质量检验记录和成品检验记录等程序文件?4.是否有记录清单规定各记录的保存年限?5.是否已完成新供方管理办法和采购管理办法的程序文件?6.是否有供方评定记录和日常管理文件?7.是否有关键零部件清单和供应商审核记录?8.是否有例行检验和确认检验的项目及要求?9.是否包括对关键零部件或材料供应商实行产品和制造过程批准的要求?10.是否按照文件要求对供应商进行选择、评定和日常管理,并保存对供应商选择和日常管理记录?11.是否建立了进货的关键元器件和材料检验/验证程序及定期确认检验的程序?12.是否明确了检验项目、方法、频次和判定准则?13.是否按照文件要求对供应商提供的产品进行检验和验证?记录是否完整有效?14.当关键元器件和材料检验由供应商检验时,是否提出明确的检验要求?15.是否保存关键零部件检验或验证记录、确认检验记录及供应商提供的合格证明及有关检验报告等?16.是否对其关键生产工序进行识别并确认?17.关键工序操作人员是否具备相应的能力?18.是否制定了工艺作业指导书,以保证质量?以便于追溯和管理?在生产过程中,需要对关键的生产过程进行研究,以验证过程能力并为过程提供输入。
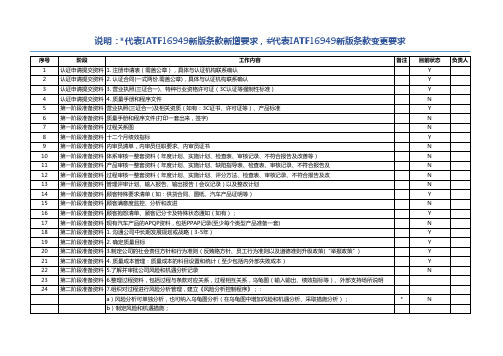
IATF16949认证需准备的清单
Y
108 第二阶段准备资料 6二方审核:第二方审核计划和记录; 109 第二阶段准备资料 7.收集供方通过认证证明(ISO9001/TS),制定供方质量体系开发计划 (按新标准8423要求); 110 第二阶段准备资料 8.供应商开发计划,针对风险高的供应商,制定供应商开发计划 111 第二阶段准备资料 1.与主要材料供应商签订供货协议(合同、质量保证协议等等),如果涉及法规方面要求,则保留符合性证明 112 第二阶段准备资料 2.整理采购订单,统计供应商交期,作为供应商考核依据 113 第二阶段准备资料 1.检验人员上岗资格认可 114 第二阶段准备资料 2. 进货检验试验指导书(C=O)和每批进料检验记录报告 115 第二阶段准备资料 3. 检验现场和仓库状态标识(区域标示、“合格/不合格/待判”标示) 116 第二阶段准备资料 4. 供应商进货检验和试验数据传递给采购部门进行供货业绩评价的输入 117 第二阶段准备资料 1.检验人员上岗资格认可 118 第二阶段准备资料 2. 过程检验试验指导书(C=O)和按照检验指导书保留的检验记录(首件、巡检等) 119 第二阶段准备资料 3. 检验和试验状态标识 120 第二阶段准备资料 4. 检验出现的不合格品控制(标识、隔离) 以及保留相关记录,具体见“不合格品控制” 121 第二阶段准备资料 5. 对特殊特性SPC控制,张贴于现场(依据控制计划要求进行) 122 第二阶段准备资料 1.检验人员上岗资格认可 123 第二阶段准备资料 2. 检验试验规范(C=O)和按照检验指导书保留的检验记录(每批检验报告),注意要和作业指导书保持一致 124 第二阶段准备资料 3. 检验和试验状态标识 125 第二阶段准备资料 4.最终检验一定控制好,包括检验项目、要求、记录以及检验工具,否则,将构成严重不符 126 第二阶段准备资料 1. 不合格品的判定权限的规定(程序文件规定谁有资格判定不合格) 127 第二阶段准备资料 2. 现场、仓库等所有不合格品的可视标识和隔离:区域、标签等 128 第二阶段准备资料 3. 保留针对现场、各种报表出现的不合格品的处置记录(评审、判定、报废) 129 第二阶段准备资料 4. 特采,必须走审批流程,必要时需要客户签字认可 130 第二阶段准备资料 5. 不合格品的定期统计分析(包括进料、制程、成品、退货产品),可在周报、月报内统计分析,top3改进 131 第二阶段准备资料 6.返工控制:风险分析、顾客批准(如客户有要求)、返工作业指导书、返工记录、返工验证 132 第二阶段准备资料 7.返修控制:风险分析、顾客批准(必须)、返修作业指导书、返修记录、返修验证记录 133 第二阶段准备资料 8.不合格品报废处理记录(不得用于其他用途) 134 第二阶段准备资料 1. 计量管理人员的资格认可记录 135 第二阶段准备资料 2. 委托外部检验和试验机构的资质证明(如有) 136 第二阶段准备资料 3. 检验测量和试验设施台账管理(包含检具) 137 第二阶段准备资料 4.年度校验计划(可合并到台账内)
CE认证标准清单
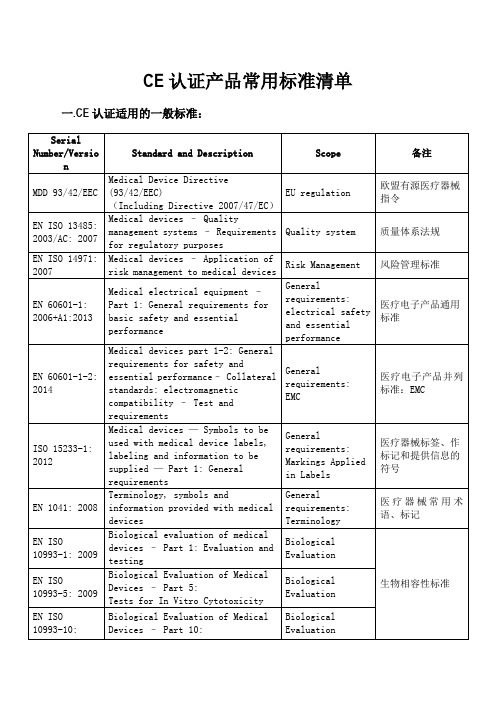
CE认证产品常用标准清单一.CE认证适用的一般标准:
二. 监护仪系列产品适用标准:
三. 生理参数检测仪适用标准:
注:生理参数检测含有的心电、血糖、无线传输功能并没有随产品做CE认证。
四. 血氧系列产品(含血氧探头)适用标准:
注:血氧探头没有IEC 60601-1-11: 2010标准。
五. 多普勒胎心仪适用标准:
六. 快速心电检测仪适用标准:
备注:第一部分属于常用标准,适用于公司做过CE认证的所有医疗产品,后面是根据产品的功能、特性附加的标准。
所以一般情况下,可用第一部分加上其他部分即可组成具体产品的适用标准。
产品认证填表指南

初次产品认证时需要提交的材料及填写指南一、企业在申请产品认证时需要提交的材料清单申请产品认证时,需要提交以下申请材料:注:如申请企业没有获得IS09000质量管理体系认证证书或证书范围不包含申请产品认证的产品时,可同时向泰尔认证中心提出质量管理体系认证申请,我中心将把ISO9000认证的现场检查和产品认证的工厂检查合并进行,做到一次审核, 多张证书。
二、对申请材料准备的总要求1、企业在准备申请材料时使用A4纸、单面打印,不要装订。
2、需要填写或签字的部分应用钢笔、签字笔。
除签字部分外可以采用打印的方式。
3、所有申请材料应认真准备、一律不得涂改,应保证真实有效。
4、申请材料中凡需加盖公章的,均应提供加盖公章后的原件。
5、申请材料中需要法人签字的,应由营业执照中注明的法定代表人签字,或由法定代表人的授权人签字,但应出具法人代表授权书原件或在授权书复印件上加盖申请单位公章,被授权人才可以签字。
6、当申请单位的通信地址、联系人、联系电话及传真发生变化时应书面形式通知我中心。
三、对申请表中各项内容的填写要求(与材料代号相对应)A、申请表1、申请表一律用钢笔或签字笔填写或采用打印方式,不得用圆珠笔、铅笔填写、不得涂改。
对申请表中的每项内容(包括表中“□”处需要划“V”加以确认的内容)均应填写完整并保证真实有效。
2.申请表首页需加盖申请单位公章。
申请表第二页右下角应加盖申请单位公章,第二页“法定代表人(签字)”应是申请单位营业执照上的法定代表人签字(如不是法定代表人签字的,要出具法人代表授权书原件或在授权书复印件上加盖申请单位公章,被授权人才可以签字)并加盖申请单位公章。
3、申请表中各栏目的填写要求3. 1 “申请单位名称”即申请单位必须是境内的企业或境外企业驻境内的办事处。
境外企业不能作为申请单位。
3.2“企业性质”:填写的企业类型对于境内企业应按法人营业执照填写,对于境外企业直接选勾“境外企业” 。
3.3“产地”:应填写申请产品认证产品的最终产地并注明省市。
CE认证准则清单

CE认证准则清单CE认证是指产品符合欧洲联盟(EU)相关法规和指令的要求,可以在欧洲市场销售和使用。
CE认证准则是指CE认证过程中需要遵守的一系列规定和标准。
1.完整性:CE认证申请文件必须包含产品完整的技术文件,包括设计、制造、性能和安全等方面的信息。
2.产品分类:根据CE认证的产品种类,确定适用的欧洲法规和指令。
根据产品的特性,例如医疗器械、电器和机械等,可以选择不同的CE认证模块。
3.技术规格:根据适用的欧洲法规和指令,制定产品的技术规格。
这些规格包括产品的设计、材料、制造工艺、性能和安全等要求。
4.产品测试:在CE认证过程中,需要进行产品测试以验证其符合欧洲法规和指令的要求。
这些测试包括性能测试、安全测试和电磁兼容性测试等。
6.CE标志:凡符合CE认证要求的产品,可以在产品上标记CE标志。
CE标志是证明产品符合欧洲法规和指令要求的标志。
7.追溯性:产品在整个生命周期中需要保持追溯性。
即产品应当有完整的文档和记录,可以追踪到供应链、制造过程和销售渠道等。
8.法规要求:CE认证要求产品符合一系列的欧洲法规和指令,如低压指令(LVD)、机械指令(MD)、EMC指令等。
申请人需要了解并遵守这些法规的要求。
9.委托评估:在CE认证申请过程中,申请人可以委托第三方机构进行产品评估和测试。
这些机构需要得到合适的认可,并出具相关的评估报告。
10.文件保存:申请人需要保存完整的CE认证文件,包括申请材料、技术文件、测试报告和厂商声明等。
这些文件需要在相关部门的要求下提交或提供。
11.更新认证:CE认证具有有效期限,根据产品的特性和规定,需要定期进行更新认证,以确保产品持续符合相关法规和指令的要求。
12.合规监督:CE认证机构会对已获得认证的产品进行合规监督,包括市场抽查、产品抽查和工厂检查等。
申请人需要配合合规监督,并保持产品的合规性。
13.限制条件:根据欧洲法规和指令的要求,一些特定产品可能有限制性条件,如医疗器械和化妆品等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
煤炭工业污染物排放标准
矿井工程质量标准
生产矿井质量标准化实施细则案有效日期。
认证产品或服务执行标准清单
企业名称(公章):
序号
产品或服务名称
执行标准
备注
生活用水自备井使用地下水
中华人民共和国国家地下水质量标准
生活用水处理
生活饮用水卫生标准
厂界噪声测量
工业企业厂界噪声标准
扬尘测量
环境空气质量标准
矿井水和生活污水排放
中华人民共和国标准污水综合排放标准
矿井水和生活污水排放
山东省南水北调沿线水污染物综合排放标准(山东省地方标准DB37/ 599-2006)
