自噬监测——LC3双标腺病毒(完整版)
其他细胞器的自噬研究和自噬流荧光数据的处理
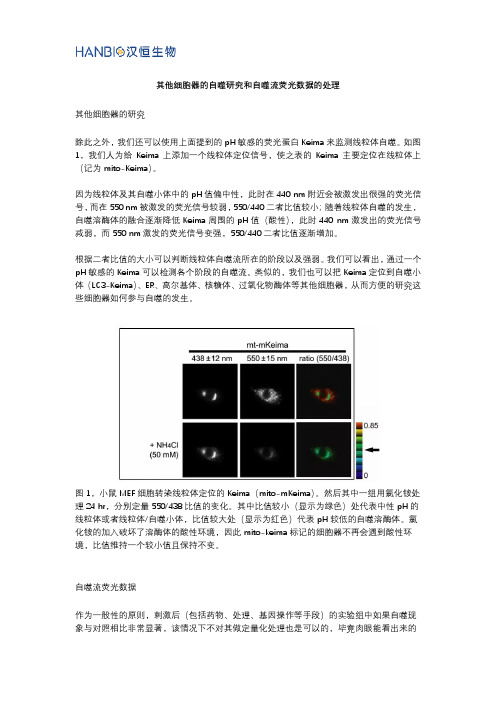
其他细胞器的自噬研究和自噬流荧光数据的处理其他细胞器的研究除此之外,我们还可以使用上面提到的pH敏感的荧光蛋白Keima来监测线粒体自噬。
如图1,我们人为给Keima上添加一个线粒体定位信号,使之表的Keima主要定位在线粒体上(记为mito-Keima)。
因为线粒体及其自噬小体中的pH值偏中性,此时在440 nm附近会被激发出很强的荧光信号,而在550 nm被激发的荧光信号较弱,550/440二者比值较小;随着线粒体自噬的发生,自噬溶酶体的融合逐渐降低Keima周围的pH值(酸性),此时440 nm激发出的荧光信号减弱,而550 nm激发的荧光信号变强,550/440二者比值逐渐增加。
根据二者比值的大小可以判断线粒体自噬流所在的阶段以及强弱。
我们可以看出,通过一个pH敏感的Keima可以检测各个阶段的自噬流。
类似的,我们也可以把Keima定位到自噬小体(LC3-Keima)、ER、高尔基体、核糖体、过氧化物酶体等其他细胞器,从而方便的研究这些细胞器如何参与自噬的发生。
图1,小鼠MEF细胞转染线粒体定位的Keima(mito-mKeima)。
然后其中一组用氯化铵处理24 hr,分别定量550/438比值的变化。
其中比值较小(显示为绿色)处代表中性pH的线粒体或者线粒体/自噬小体,比值较大处(显示为红色)代表pH较低的自噬溶酶体。
氯化铵的加入破坏了溶酶体的酸性环境,因此mito-keima标记的细胞器不再会遇到酸性环境,比值维持一个较小值且保持不变。
自噬流荧光数据作为一般性的原则,刺激后(包括药物、处理、基因操作等手段)的实验组中如果自噬现象与对照相比非常显著,该情况下不对其做定量化处理也是可以的,毕竟肉眼能看出来的差别才是最大的差别。
即使如此,如果一定要对其进行定量化处理,我们在此推荐一个应用最广、操作也相对简单的定量方法-计算细胞内的自噬相关点(红点、绿点,甚至黄点)的平均数目,然后做柱状图即可。
细胞自噬检测的具体步骤及方法

细胞自噬检测的具体步骤及方法一、自噬体介绍自噬(Autophagy),或称自体吞噬,是一个涉及到细胞自身结构通过溶酶体机制而被分解的过程,该过程是一个受到紧密调控的步骤,帮助细胞产物在合成、降解以及接下来的循环中保持一个平衡状态。
细胞接受自噬诱导信号后,在胞浆的某处形成一个扁平的类似“脂质体”样的膜结构,称为Phagophore。
随着Phagophore不断延伸,将胞浆中的细胞器等成分,全部包裹住成为密闭的结构,称为“自噬体(autophagosome)”。
自噬体形成后,可与溶酶体融合,自噬体中的内容物随即被降解,产物(氨基酸、脂肪酸等)被输送到胞浆中,供细胞重新利用,而残渣或被排出细胞外或滞留在胞浆中。
自噬信号通路:二、自噬研究策略和方法正常细胞基础水平自噬活性比较低,对自噬研究通常需要进行人工调节和干预,常用药物有:1、自噬诱导剂a) Bredeldin A / Thapsigargin / Tunicamycin :模拟内质网应激;b) Carbamazepine/ L-690,330/ Lithium Chloride(氯化锂):IMPase 抑制剂(即Inositol monophosphatase,肌醇单磷酸酶);c) Earle's平衡盐溶液:制造饥饿;d) N-Acetyl-D-sphingosine(C2-ceramide):Class I PI3K Pathway抑制剂;e) Rapamycin:mTOR抑制剂;f) Xestospongin B/C:IP3R阻滞剂。
2、自噬抑制剂a) 自噬抑制剂3-Methyladenine(3-MA):(Class III PI3K) hVps34 抑制剂;b) Bafilomycin A1:质子泵抑制剂;c) 溶酶体抑制剂Hydroxychloroquine(羟氯喹)。
3、自噬检测1) 透射电镜;电镜作为自噬检测的金指标。
由于自噬体属于亚细胞结构,普通光镜下观察不到自噬体的形成,因此,直接观察自噬体需在透射电镜下。
自噬双标腺病毒(mRFP-GFP-LC3)使用指南

自噬双标腺病毒(mRFP-GFP-LC3)使用指南背景:自噬是细胞内的一种“自食(Self-eating)”的现象,凋亡是“自杀(Self-killing)”的现象,二者共用相同的刺激因素和调节蛋白,但是诱发阈值和门槛不同,如何转换和协调目前还不清楚. 自噬是指膜(目前来源还有争议,大部分表现为双层膜,有时多层或单层)包裹部分胞质和细胞内需降解的细胞器、蛋白质等形成自噬体,最后与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞稳态和细胞器的更新。
目前文献对自噬过程进行观察和检测常用的策略和手段有:通过western blot检测LC3的剪切;通过电镜观测自噬体的形成;在荧光显微镜下采用GFP(-RFP)-LC3等融合蛋白来示踪自噬体形成以及降解。
近几年对自噬流的研究日趋增多,针对于此我们汉恒生物科技(上海)有限公司自主研发了用于实时监测自噬(流)的mRFP-GFP-LC3腺病毒,mRFP 用于标记及追踪LC3,GFP的减弱可指示溶酶体与自噬小体的融合形成自噬溶酶体,即由于GFP荧光蛋白对酸性敏感,当自噬体与溶酶体融合后GFP 荧光发生淬灭,此时只能检测到红色荧光。
这种串联的荧光蛋白表达载体系统直观清晰的指示了细胞自噬流的水平,是我们自噬研究尤其是自噬流研究不可或缺的利器。
mRFP-GFP-LC3腺病毒的操作收到病毒后的处理(一)、腺病毒的储存1、腺病毒采用冰袋运输。
(1)、收到病毒液后如未融化请置于-80℃冰箱,下次使用时再进行分装;(2)、如客户收到时腺病毒已融化,请直接分装后置于-80℃冰箱保存;若短期内用于实验,可分装部分于4℃保存(尽量一周内用完)。
2、尽量避免反复冻融,否则会降低病毒滴度(每次冻融会降低病毒滴度10%)。
建议不要在-20℃下长期保存。
如果病毒储存时间超过6个月,应该重新测定病毒滴度。
3、建议收到病毒产品后根据实验需求自行分装或购买经过分装的小包装病毒产品(购买时请提出)。
(完整word版)自噬检测

自噬体的检测① 电子显微镜检测:电子显微镜检测形态学超微结构被认为是检测自噬体的金指标。
在透射电镜下可见未消化的胞浆成分或损伤的细胞器(如线粒体、内质网片段等)周围出现空泡状双层膜样结构,随后双层膜环绕并封闭形成自噬体,然后与溶酶体融合,变成单层膜结构,其中含有降解不同阶段的胞浆成分。
一般来说,降解物的电子密度会增加,形成黑色颗粒状或不定形的聚集,因此也能够辨认。
② 吖啶橙(AO)、丹酰戊二胺(MDC)染色法:吖啶橙(AO)染色法是利用对pH敏感的原理标记酸性囊泡细胞器结构。
AO是一种具有细胞渗透性的荧光染色方法,可以染色DNA和胞质为亮绿色。
AO也可以渗透进入酸性细胞器,例如自噬溶酶体,当pH 值较低的时候,AO发出红色荧光,且强度与酸性程度相关。
所以在AO标记的细胞中,酸性囊泡细胞器结构可以通过流式细胞仪或者在荧光显微镜下观察到。
丹酰戊二胺(MDC)染色法也是一种常用的酸性细胞器标记技术,但有研究发现MDC荧光信号主要集中于核周,而自噬体结构一般散在分布于细胞质。
说明其并不是一种好的自噬体标记物。
③ 自噬体膜标志性蛋白质的检测:自噬体膜上标志性蛋白质有ATGl2-ATG5结合体和微管相关蛋白1的轻链3(LC3)。
ATGl2和A TG5在翻译后就像单个分子一样共价结合在一起,它定位在自噬体双层隔离膜的整个延长阶段。
LC3是酵母A TG8的哺乳动物同源蛋白微管相关轻链蛋白3,LC3是目前最明确贯穿整个自噬过程并能出现在晚期自噬溶酶体中的自噬相关蛋白,细胞内合成LC3后,新生LC3的C末端即被ATG4加工生成LC3-Ⅰ,自噬激活时,LC3-Ⅰ在泛素样反应酶的作用下与磷脂酰乙醇胺偶联生成LC3-Ⅱ。
LC3-Ⅰ定位于胞质内,LC3-Ⅱ定位于自噬体的内外膜。
通过与绿色荧光蛋白(GFP)结合成ATGl2-ATG5-GFP、LC3-GFP,即可实现对自噬体的检测。
也可以通过免疫印迹法检测其表达水平,以反映自噬体的数量。
自噬双标腺病毒(mrfpgfplc3)使用指南1404知识讲解

自噬双标腺病毒( mRFP-GFP-LC3 )使用指南背景:自噬是细胞内的一种“自食(Self-eating )”的现象,凋亡是“自杀( Self-killing )”的现象,二者共用相同的刺激因素和调节蛋白,但是诱发阈值和门槛不同,如何转换和协调目前还不清楚. 自噬是指膜(目前来源还有争议,大部分表现为双层膜,有时多层或单层)包裹部分胞质和细胞内需降解的细胞器、蛋白质等形成自噬体,最后与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞稳态和细胞器的更新。
目前文献对自噬过程进行观察和检测常用的策略和手段有:通过western blot检测LC3勺剪切;通过电镜观测自噬体的形成;在荧光显微镜下采用GFP(-RFP) -LC3等融合蛋白来示踪自噬体形成以及降解。
近几年对自噬流的研究日趋增多,针对于此我们汉恒生物科技(上海)有限公司自主研发了用于实时监测自噬( 流)的mRFP-GFP-LC腺病毒,mRFP用于标记及追踪LC3, GF啲减弱可指示溶酶体与自噬小体的融合形成自噬溶酶体,即由于GF荧光蛋白对酸性敏感,当自噬体与溶酶体融合后GFP 荧光发生淬灭, 此时只能检测到红色荧光。
这种串联的荧光蛋白表达载体系统直观清晰的指示了细胞自噬流的水平,是我们自噬研究尤其是自噬流研究不可或缺的利器。
mRFP-GFP-LC3 腺病毒的操作收到病毒后的处理(一)、腺病毒的储存1、腺病毒采用冰袋运输。
(1)、收到病毒液后如未融化请置于-80 C冰箱,下次使用时再进行分装;(2)、如客户收到时腺病毒已融化,请直接分装后置于-80 C冰箱保存;若短期内用于实验,可分装部分于4C保存(尽量一周内用完)。
2、尽量避免反复冻融,否则会降低病毒滴度(每次冻融会降低病毒滴度10%)。
建议不要在-20 C下长期保存。
如果病毒储存时间超过6个月,应该重新测定病毒滴度。
3、建议收到病毒产品后根据实验需求自行分装或购买经过分装的小包装病毒产品(购买时请提出)。
lc3-β检测主要原理

lc3-β检测主要原理
LC3-β (Microtubule-associated protein 1 light chain 3 beta) 检测是一种用于检测细胞自噬活动的方法。
LC3 是一个与细胞
自噬相关的蛋白,包括 LC3-I 和 LC3-II 两种形式。
LC3-I 是未修饰
的形式,在细胞质中广泛存在,LC3-II 是修饰后的形式,主要定位在
自噬液泡膜上。
LC3-β 检测的主要原理是通过免疫荧光染色或免疫印迹技术检
测 LC3 的表达和定位。
免疫荧光染色可以直接观察到细胞内的 LC3
分布情况,而免疫印迹则可以通过检测 LC3 的蛋白表达水平来判断细
胞中自噬的活性。
在免疫荧光染色中,首先需要使用特异性的抗体标记 LC3,通常
使用抗 LC3 的抗体结合荧光染料标记抗体。
然后将该混合物加入待检
测的细胞样品中进行孵育,使抗体与特定的抗原结合。
最后用荧光显
微镜观察细胞内的荧光强度和分布,可以判断细胞中 LC3 的定位情况。
在免疫印迹中,首先需要提取细胞蛋白,并使用聚丙烯酰胺凝胶
电泳(SDS-PAGE)将蛋白分离。
然后将蛋白转移到膜上,并使用特异
性的抗体与膜上的 LC3 结合。
最后通过荧光或化学发光技术检测抗体
与 LC3 的结合情况,从而确定 LC3 的表达水平。
通过以上原理和技术,可以判断细胞中 LC3 的表达及其定位情况,从而间接反映细胞自噬的活性。
检测细胞自噬的方法

检测细胞自噬的方法
检测细胞自噬的方法主要包括以下三种:
1. 透射电镜法:自噬体属于亚细胞结构,普通光镜下看不到,直接在透射电镜下观察自噬不同阶段的形态变化是一种非常直接的方法。
2. 荧光显微镜观察法:LC3全称MAP1LC3,贯穿整个自噬过程,是目前公认的自噬标记物。
其中,LC3B应用广泛。
自噬体和溶酶体融合后,外膜上的LC3-II被Atg4切割,产生LC3-I循环利用;内膜上的LC3-II被溶酶体酶降解,导致自噬溶酶体中LC3含量很低。
因此,可以通过荧光显微镜观察内源性LC3或GFP-LC3,实现对自噬发生的检测。
3. Western Blot检测LC3和p62蛋白的表达量:利用Western Blot检测LC3-II/I比值的变化评价自噬形成。
自噬形成时,胞浆型LC3-I会酶解掉一小段多肽,随后跟PE结合转变为膜型的LC3-II。
因此可以通过LC3-II/I比值的大小估计自噬水平的高低。
请注意,以上方法可能受到多种因素的影响,例如样本的来源、处理方法、检测条件等。
在进行自噬检测时,建议按照操作规程仔细操作,以保证结果的准确性和可靠性。
同时,建议在进行自噬检测时参考相关文献,以获得更全面的信息。
自噬研究-自噬双标腺病毒登Cell主刊

自噬研究—汉恒自噬腺病毒登Cell主刊---附:汉恒专家教你如何发Cell小编非常欣慰的告知大家,汉恒荧光自噬双标病毒产品再次荣登世界级权威杂志---不过这次换成了Cell主刊,2016年的影响因子:30.41!2017年7月27日,来自上海交通大学医学院附属仁济医院消化科的房静远教授、陈萦晅副教授、洪洁和陈豪燕副研究员与美国密西根大学邹伟平教授合作在Cell 正刊发表了题为“Fusobacterium nucleatum Promotes Chemoresistance to Colorectal Cancer by Modulating Autophagy”的研究论文,该研究表明核梭杆菌(Fusobacterium nucleatum)通过激活结直肠癌(CRC)细胞自噬诱导CRC对化疗药物耐受。
“该研究为临床上评估结直肠癌治疗后的复发风险和进一步加强联合治疗提供了非常广阔和重要的应用前景。
(Bioart)”在这篇论文中,研究者使用汉恒生物荧光自噬双标病毒产品mRFP-GFP-LC3有力地证明了F. nucleatum激活了CRC细胞自噬(Figure 1和2),而使用的方法恰是汉恒生物一直倡导的“自噬研究的金指标”-①LC3的Western blot、②自噬双标工具检测自噬流变化、③电镜直接观测自噬小体和自噬溶酶体的产生(Figure 3).换言之,做自噬,必须要用荧光自噬双标病毒mRFP-GFP-LC3做自噬流检测。
【广告】汉恒生物荧光自噬双标病毒产品mRFP-GFP-LC3属于病毒现货产品,囊括了三大主流病毒-慢病毒、腺病毒和在体研究专用的腺相关病毒(AAV)。
同时还包括一系列线粒体自噬研究的现货工具。
详情请点击下方“阅读原文”获取资料。
Figure 1. F. nucleatum激活HCT116和HT29细胞的自噬(该图源于原文Fig2).Figure 2. F. nucleatum激活HCT116细胞自噬是通过miR-18*和miR-4802介导的(该图源于原文Fig 4).Figure 3. 汉恒生物自噬研究三大金指标(该图来源于汉恒讲坛系列PPT。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
自噬双标腺病毒(mRFP-GFP-LC3)使用指南1自噬双标腺病毒(mRFP-GFP-LC3)使用指南背景:自噬是细胞内的一种“自食(Self-eating )”的现象,凋亡是“自 杀(Self-killing )”的现象,二者共用相同的刺激因素和调节蛋白, 但是诱发阈值和门槛不同,如何转换和协调目前还不清楚. 自噬是指 膜(目前来源还有争议,大部分表现为双层膜,有时多层或单层)包 裹部分胞质和细胞内需降解的细胞器、蛋白质等形成自噬体,最后与 溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞稳 态和细胞器的更新。
目前文献对自噬过程进行观察和检测常用的策略 和手段有:通过western blot 检测LC3的剪切;通过电镜观测自噬体 的形成;在荧光显微镜下采用GFP (-RFP )-LC3等融合蛋白来示踪自 噬体形成以及降解。
近几年对自噬流的研究日趋增多,针对于此我们 汉恒生物科技(上海)有限公司自主研发了用于实时监测自噬(流) 的mRFP-GFP-LC3腺病毒,mRFP 用于标记及追踪LC3,GFP 的减弱可指 示溶酶体与自噬小体的融合形成自噬溶酶体,即由于GFP 荧光蛋白对 酸性敏感,当自噬体与溶酶体融合后GFP 荧光发生淬灭,此时只能检 测到红色荧光。
这种串联的荧光蛋白表达载体系统直观清晰的指示了 细胞自噬流的水平,是我们自噬研究尤其是自噬流研究不可或缺的利 器。
mRFP-GFP-LC3腺病毒的操作收到病毒后的处理(一)、腺病毒的储存1、腺病毒采用冰袋运输。
(1)、收到病毒液后如未融化请置于-80℃冰箱,下次使用时再进行分装;(2)、如客户收到时腺病毒已融化,请直接分装后置于-80℃冰箱保存;若短期内用于实验,可分装部分于4℃保存(尽量一周内用完)。
2、尽量避免反复冻融,否则会降低病毒滴度(每次冻融会降低病毒滴度10%)。
建议不要在-20℃下长期保存。
如果病毒储存时间超过6个月,应该重新测定病毒滴度。
3、建议收到病毒产品后根据实验需求自行分装或购买经过分装的小包装病毒产品(购买时请提出)。
(二)、腺病毒的稀释需要稀释病毒时,将病毒取出后置于冰上融解,使用培养目的细胞用PBS 或培养基稀释到所需浓度后混匀分装后4℃保存,并尽快用于实验(尽量一周内用完),动物实验建议使用注射用平衡液来稀释,并尽快用完。
感染目的细胞2由于腺病毒是自主复制性基因载体,不能插入基因组稳定遗传,因此实验中细胞感染腺病毒的实验需要具体情况具体对待。
一般根据外界刺激处理的时间来选择感染腺病毒的时间,短时程处理(一周之内)建议先感染腺病毒之后再进行处理,长时程刺激的建议在刺激结束前2~3 天进行腺病毒感染。
另外不同细胞的M OI 不同,所以在将病毒感染正式感染目的细胞前,需要做一个预实验以确定目的细胞中加入的病毒数。
(一)细胞准备将状态良好的目的细胞接种到24孔板,使细胞浓度为1×105/ml 细胞,接种细胞数量因细胞的生长速度而略有不同,一般是保证第二天进行病毒感染的时候细胞汇合率介于50%至70%直接。
(二)病毒感染I、贴壁细胞由于该病毒感染后续拍照需要进行自噬小点的计算,因此需要在高倍镜下拍照,条件允许最好使用共聚焦显微镜拍照,此时需要把细胞铺被在玻片上面(部分细胞铁壁能力不是很强,此时需要预先在玻片上包被g aletin 甚至l aminin)。
感染实验在1/2 体积培养液感染(详见下表格)。
加入的病毒量范围在M OI=20~50 内(具体感染的操作量参见附录表格),每个M OI 值加两个孔 2 小时后换液。
3自噬双标腺病毒(mRFP-GFP-LC3)使用指南4II 、悬浮细胞 上面介绍的是针对贴壁细胞的感染方法,若是悬浮或半悬浮细胞,则需要通过平角离心转染法,即将适量的病毒液加入细胞培养皿 后,封好口,放入平角离心机后,低速离心 1h ,然后放入培养箱中 正常培养即可。
若由于实验条件有限,没有平角离心机,可用离心管 代替,将细胞吹打吸入离心管中,进行低速离心,去掉大部分上清, 然后加入适量的病毒液,室温放置 10min (不能超过半小时),然后 将细胞和病毒液同时吸出转入培养皿中继续病毒感染至 2 小时后换 液即可。
(三)观察感染情况 感染24小时后,可以开始观察到GFP 以及RFP 表达,36-48小时可以进行细胞固定、封片(需要使用防淬灭的固定剂)、拍照分析。
(四)结果分析mRFP-GFP-LC3 串联荧光蛋白腺病毒中表达的G FP 和m RFP 用于标记及追踪LC3,GFP 的减弱可指示溶酶体与自噬小体的融合形成自噬溶酶体(由 GFP 荧光蛋白对酸性敏感,当自噬体与溶酶体融合后G FP 荧光发生淬灭,此时只能检测到红色荧光,原理如下图所示)。
统计方法我们在显微镜成像后红绿荧光m erge 后通过m erge 后出现的黄色斑点即只是自噬体.红色的斑点指示自噬溶酶体,通过不同颜色斑点的计数可以清晰的看出自噬流的强弱:一般统计采用人为计数的方56法,也就是统计叠加(overlay )之后黄色斑点和红色斑点的数目, 然后做出 b ar 图。
如下图:细胞转染 mRFP-GFP-LC3 病毒后给予氨基酸剥夺处理 2 小 时后出现明显增强的自噬以及自噬流(通过 merge 后的红色小点明显 增多可以判定自噬流水平升高)。
实验操作注意事项Antioxid Redox Signal 14(11): 2179-2190.1、操作病毒时请尽量使用生物安全柜;2、操作时需戴上帽子,佩戴双层手套,双层口罩;3、病毒操作中绝对禁止在安全柜内有任何皮肤直接暴露的情况;4、剩余的病毒和接种用的注射器等耗材需高压灭菌后才能扔弃;5、操作完毕要及时用肥皂和水洗手消毒;6、未尽事宜请咨询汉恒生物技术人员了解详情,汉恒生物全国免费热线400-092-0065;7、您可登录汉恒生物官网w 观看腺病毒实验操作视频,并与我们的客服人员互动交流。
参考文献:Hariharan, N., et al. (2011). "Oxidative stress stimulates autophagic flux during ischemia/reperfusion." Antioxid Redox Signal 14(11): 2179-2190.Ma, X., et al. (2012). "Impaired autophagosome clearance contributes to cardiomyocyte death in ischemia/reperfusion injury." Circulation 125(25): 3170-3181.Choi, A. M., S. W. Ryter and B. Levine (2013). "Autophagy in human health and disease." N Engl J Med 368(7): 651-662.Gannage, M., D. Dormann, R. Albrecht, J. Dengjel, T. Torossi, P. C. Ramer, M. Lee, T. Strowig, F. Arrey, G. Conenello, M. Pypaert, J. Andersen, A. Garcia-Sastre and C. Munz (2009). "Matrix protein 2 of influenza A virus blocks autophagosome fusion with lysosomes." Cell Host Microbe 6(4): 367-380.Hariharan, N., Y. Maejima, J. Nakae, J. Paik, R. A. Depinho and J. Sadoshima (2010). "Deacetylation of FoxO by Sirt1 Plays an Essential Role in Mediating Starvation-Induced Autophagy in Cardiac Myocytes." Circ Res 107(12): 1470-1482.7Levine, B. and G. Kroemer (2008). "Autophagy in the pathogenesis of disease." Cell 132(1): 27-42.Mizushima, N., T. Yoshimori and B. Levine (2010). "Methods in mammalian autophagy research." Cell 140(3): 313-326.Ravikumar, B., K. Moreau, L. Jahreiss, C. Puri and D. C. Rubinsztein (2010). "Plasma membrane contributes to the formation of pre-autophagosomal structures." Nat Cell Biol 12(8): 747-757.Ravikumar, B., S. Sarkar, J. E. Davies, M. Futter, M. Garcia-Arencibia, Z. W. Green-Thompson, M. Jimenez-Sanchez, V. I. Korolchuk, M. Lichtenberg, S. Luo, D. C. Massey, F. M. Menzies, K. Moreau, U. Narayanan, M. Renna, F. H. Siddiqi, B. R. Underwood, A. R. Winslow and D. C. Rubinsztein (2010). "Regulation of mammalian autophagy in physiology and pathophysiology." Physiol Rev 90(4): 1383-1435.Wei, Y., Z. Zou, N. Becker, M. Anderson, R. Sumpter, G. Xiao, L. Kinch, P. Koduru, C. S. Christudass, R. W. Veltri, N. V. Grishin, M. Peyton, J. Minna, G. Bhagat and B. Levine (2013). "EGFR-Mediated Beclin 1 Phosphorylation in Autophagy Suppression, Tumor Progression, and Tumor Chemoresistance." Cell 154(6): 1269-1284.8自噬双标腺病毒(mRFP-GFP-LC3)使用指南9附录注:1)24板长满了细胞大约有3×105个细胞。
