化学人教版九年级下册附录1 部分酸碱盐溶解性表(常温)
人教版初中化学2011课标版九年级下册附录1部分酸、碱和盐的溶解性表(室温)优秀教学案例

3.讲解酸、碱和盐的溶解性规律,通过实验和观察,引导学生发现并总结这些规律。
(三)学生小组讨论
1.将学生分成若干小组,每组学生共同进行实验、讨论和探究,培养学生的团队合作意识和沟通能力。
2.教师要引导学生明确小组合作的目标和任务,确保每个学生都能积极参与到小组活动中。
三、教学策略
(一)情景创设
1.利用多媒体展示与酸、碱和盐相关的日常生活中的现象,如厨房里的烹饪、清洁剂的使用等,激发学生的学习兴趣,引导学生关注化学知识在生活中的应用。
2.创设实验情境,让学生亲自动手进行实验,观察实验现象,引发学生对酸、碱和盐溶解性规律的好奇心。
3.通过设ห้องสมุดไป่ตู้问题,引导学生思考生活中的化学现象,如“为什么厨房里的清洁剂能去除油污?”、“为什么用醋可以洗掉水垢?”等,激发学生的探究欲望。
1.培养学生对化学学科的兴趣和爱好,激发学生学习化学的内在动力。
2.使学生认识到化学知识在生活和社会中的重要性,增强学生的社会责任感。
3.培养学生严谨的科学态度,教育学生诚实守信,勇于面对困难和挑战。
4.引导学生学会关爱环境,关注可持续发展,提高学生的环保意识。
在教学过程中,我将以酸、碱和盐的溶解性表为载体,深度融合学科知识与学生的生活实际,关注学生的个体差异,充分调动学生的学习积极性。通过创设生动有趣的教学情境,引导学生主动探究,发现并总结酸、碱和盐的溶解性规律。同时,我还将继续关注学生的情感态度与价值观的培养,使他们在学习的过程中,既能掌握知识,又能提高自身的综合素质。
2.实验与观察的结合:在教学过程中,教师设计了多个实验,让学生亲自动手进行实验操作,观察实验现象。这种实践性的教学方式使学生能够更加直观地理解和掌握酸、碱和盐的溶解性规律,提高了学生的实践操作能力。
人教版初中化学九年级下册附录Ⅰ 部分酸、碱和盐的溶解性表(室温)课件

不
不
溶
溶
溶
不
不
溶
溶
溶
不
不
溶
溶
溶
——
不
溶
溶
溶
——
——
溶
不
微
不
碱
硝酸盐
盐酸盐
硫酸盐
碳酸盐
学法启示
酸
铵盐 钾盐 钠盐 钡盐 钙盐 镁盐 铝盐 锰盐 锌盐 亚铁盐 铁盐 铜盐 银盐
网络资源 自主学习
水解·不存在:碳酸
铁铝镁碱银(碳酸
铁·旅美·捡银)
学法启发
H+
NH4+ K+ Na+ Ba2+ Ca2+
Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
自主预习·小组协作 成果梳理·筹备展示
展示课 预‥‥进习行课‥‥
展示交流·拓展释疑
重庆市江北中学校 王建伟
感谢你的关注与聆听!
附录 Ⅰ部分酸、碱和盐的溶解性表(室温)
OH-
NO3-
Cl-
SO42-
CO32-
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶 挥发性:溶硝酸、 溶
溶 微 不
溶 溶 溶
溶 溶
盐酸、碳不微酸、氨
溶 水(挥发溶性:硝
不 不 微
不
溶
溶 盐碳三酸溶·碱氨) ——
不
溶
溶
溶
不
不
溶
人教版九年级下册初中化学《附录Ⅰ 部分酸、碱和盐的溶解性表(室温)》_0

人教版九年级化学下册附录I 部分酸、碱和盐的溶解性一、教材分析:本课题是人教版九年级化学下册第114页附录I的图表素材,内容为部分酸、碱和盐的溶解性表,这其中蕴藏着丰富的化学知识和教育价值。
若充分挖掘、合理利用“酸碱盐溶解性表”能很好地攻克“酸碱盐”涉及的四大基本化学用语:离子符号、化学式、化学方程式、物质组成及分类等问题,也能有效突破“酸碱盐”之间发生复分解反应条件的判定,从而进一步深化课堂教学知识范畴,提升教学质量。
所以本课题对于学生的学习十分重要。
(二)教学目标1.知识与技能目标:⑴通过实验探究,知道一些常用酸、碱、盐的溶解性规律;⑵通过研究溶解性规律,明确常见的沉淀及常见盐溶液中离子的颜色;⑶通过物质的溶解性,学会判断复分解反应能否发生。
2.过程与方法目标:⑴通过实验探究,明确溶解性规律,常见的沉淀及常见盐溶液中离子的颜色;⑵通过小组讨论,学会交流有用信息,自主归纳整理溶解性表中的知识。
3.情感态度价值观目标:通过小组实验探究,交流讨论完成学习任务,独自完成课堂练习,独立与合作之间相互转换,可逐步提升学生综合素质。
(三)教学重、难点教学重点:部分酸、碱、盐的溶解性规律;教学难点:部分酸、碱、盐的溶解性规律的灵活使用。
二、学情分析首先,学生学习上册知识对于常见元素符号、化合价、离子符号、化学式名称的记忆有一定的局限性,交叉法准确书写化学式的方法掌握的不熟练,加之下册教学中酸碱盐的学习不够系统与完善,不明确哪些物质是沉淀,哪些物质有颜色,所以本节课的学习能够将两册的化学知识系统的串联起来,完善学生的知识结构。
三、学法指导:在教师引导和协助下,学生通过实验探究、交流讨论难点、展示小组成果、独立测验等活动,逐步形成自主学习和合作学习的科学学习方法。
四、教学流程:根据酸、碱、盐类知识的特点和学生理解过程中易出现的问题,具体教学分以下几个阶段:环节一:视频欣赏、明确目标明确:探究酸碱盐的溶解性规律环节二:实验探究、交流展示根据实验探究、讨论交流了解酸碱盐的溶解性规律,以及在练习中的使用。
人教版酸碱盐溶解性表(常温)解读与应用(20张PPT)

Cu(OH)2
N H 4C l
BaCO3
酸碱盐溶解性规律记忆
钾、钠、铵、硝酸均可溶; 氯不溶银、硫酸不溶钡; 碳酸只溶钾、钠、铵;
可溶碱有5个铵、钾、钙、钠、钡。
应用1 分析复分解反应能否发生
水
生成物 条件 反应物 气 沉淀 无酸要溶
Na2CO3+2HCl==2NaCl+H2O+CO2
部 分 酸 碱 盐 溶 解 性 表 ( 室 温 )
分 析 物 质 溶 解 性 规 律
酸碱盐溶解性规律
钾、钠、铵、硝酸均可溶; 氯不溶银、硫酸不溶钡; 碳酸只溶钾、钠、铵;
可溶碱有5个铵、钾、钙、钠、钡。
物质溶解性快速判定
AgCl
BaCl2 CuSO4
KOH
BaS版九年级化学下册附录Ⅰ
酸碱盐溶解性表 应用
部 分 酸 碱 盐 溶 解 性 表 ( 室 温 )
部 分 酸 碱 盐 溶 解 性 表 ( 室 温 )
部 分 酸 碱 盐 溶 解 性 表 ( 室 温 )
分 析 物 质 溶 解 性 情 况
部 分 酸 碱 盐 溶 解 性 表 ( 室 温 )
实 验 验 证 物 质 溶 解 性
• • • • • • • • • • • • • • • • • • • •
1、想要体面生活,又觉得打拼辛苦;想要健康身体,又无法坚持运动。人最失败的,莫过于对自己不负责任,连答应自己的事都办不到,又何必抱怨这个世界都和你作对?人生的道理很简单,你想要什么,就去付出足够的努力。 2、时间是最公平的,活一天就拥有24小时,差别只是珍惜。你若不相信努力和时光,时光一定第一个辜负你。有梦想就立刻行动,因为现在过的每一天,都是余生中最年轻的一天。 3、无论正在经历什么,都请不要轻言放弃,因为从来没有一种坚持会被辜负。谁的人生不是荆棘前行,生活从来不会一蹴而就,也不会永远安稳,只要努力,就能做独一无二平凡可贵的自己。 4、努力本就是年轻人应有的状态,是件充实且美好的事,可一旦有了表演的成分,就会显得廉价,努力,不该是为了朋友圈多获得几个赞,不该是每次长篇赘述后的自我感动,它是一件平凡而自然而然的事,最佳的努力不过是:但行好事,莫问前程。愿努力,成就更好的你! 5、付出努力却没能实现的梦想,爱了很久却没能在一起的人,活得用力却平淡寂寞的青春,遗憾是每一次小的挫折,它磨去最初柔软的心智、让我们懂得累积时间的力量;那些孤独沉寂的时光,让我们学会守候内心的平和与坚定。那些脆弱的不完美,都会在努力和坚持下,改变模样。 6、人生中总会有一段艰难的路,需要自己独自走完,没人帮助,没人陪伴,不必畏惧,昂头走过去就是了,经历所有的挫折与磨难,你会发现,自己远比想象中要强大得多。多走弯路,才会找到捷径,经历也是人生,修炼一颗强大的内心,做更好的自己! 7、“一定要成功”这种内在的推动力是我们生命中最神奇最有趣的东西。一个人要做成大事,绝不能缺少这种力量,因为这种力量能够驱动人不停地提高自己的能力。一个人只有先在心里肯定自己,相信自己,才能成就自己! 8、人生的旅途中,最清晰的脚印,往往印在最泥泞的路上,所以,别畏惧暂时的困顿,即使无人鼓掌,也要全情投入,优雅坚持。真正改变命运的,并不是等来的机遇,而是我们的态度。 9、这世上没有所谓的天才,也没有不劳而获的回报,你所看到的每个光鲜人物,其背后都付出了令人震惊的努力。请相信,你的潜力还远远没有爆发出来,不要给自己的人生设限,你自以为的极限,只是别人的起点。写给渴望突破瓶颈、实现快速跨越的你。 10、生活中,有人给予帮助,那是幸运,没人给予帮助,那是命运。我们要学会在幸运青睐自己的时候学会感恩,在命运磨练自己的时候学会坚韧。这既是对自己的尊重,也是对自己的负责。 11、失败不可怕,可怕的是从来没有努力过,还怡然自得地安慰自己,连一点点的懊悔都被麻木所掩盖下去。不能怕,没什么比自己背叛自己更可怕。 12、跌倒了,一定要爬起来。不爬起来,别人会看不起你,你自己也会失去机会。在人前微笑,在人后落泪,可这是每个人都要学会的成长。 13、要相信,这个世界上永远能够依靠的只有你自己。所以,管别人怎么看,坚持自己的坚持,直到坚持不下去为止。 14、也许你想要的未来在别人眼里不值一提,也许你已经很努力了可还是有人不满意,也许你的理想离你的距离从来没有拉近过......但请你继续向前走,因为别人看不到你的努力,你却始终看得见自己。 15、所有的辉煌和伟大,一定伴随着挫折和跌倒;所有的风光背后,一定都是一串串揉和着泪水和汗水的脚印。 16、成功的反义词不是失败,而是从未行动。有一天你总会明白,遗憾比失败更让你难以面对。 17、没有一件事情可以一下子把你打垮,也不会有一件事情可以让你一步登天,慢慢走,慢慢看,生命是一个慢慢累积的过程。 18、努力也许不等于成功,可是那段追逐梦想的努力,会让你找到一个更好的自己,一个沉默努力充实安静的自己。 19、你相信梦想,梦想才会相信你。有一种落差是,你配不上自己的野心,也辜负了所受的苦难。 20、生活不会按你想要的方式进行,它会给你一段时间,让你孤独、迷茫又沉默忧郁。但如果靠这段时间跟自己独处,多看一本书,去做可以做的事,放下过去的人,等你度过低潮,那些独处的时光必定能照亮你的路,也是这些不堪陪你成熟。所以,现在没那么糟,看似生活对你的亏欠,其 实都是祝愿。
人教版初中化学九年级下册附录1 部分酸、碱和盐的溶解性表的应用 课件
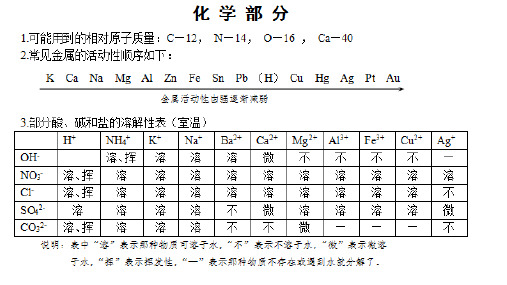
酸、碱、盐的溶解性(室温)
H+ NH4+
K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+
Fe3+ Cu2+ Ag+
OH-
溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不 ——
NO3-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
溶 溶 溶
Cl-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
酸、碱、盐的溶解性(室温)
H+ NH4+
K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+
Fe3+ Cu2+ Ag+
OH-
溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不 ——
NO3-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
溶 溶 溶
Cl-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
(5)一般情况下,不能跟其他物质发生复分解反应的可溶性盐是 NaNO3
。
酸、碱、盐的溶解性(室温)
H+ NH4+
K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+
Fe3+ Cu2+ Ag+
OH-
溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不 ——
NO3-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
人教版九年级下册初中化学《附录Ⅰ 部分酸、碱和盐的溶解性表(室温)》_0
附录一部分酸、碱和盐的溶解性表(室温)教学设计一、教学目标1、通过对表格各离子不同组合,进一步加深对酸、碱、盐的组成理解,强化了酸碱盐化学式的书写。
2、从表中找出酸碱盐的溶解性特点,找出有效的记忆方法或口诀,快速判断出有沉淀生成的复分解反应能否实行。
3、利用表中常见的酸碱盐的溶解性,巩固酸碱盐的鉴别、转化、制取等实验技能,熟悉中考常考的特征离子的检验。
二、教学重难点1、教学重点:酸碱盐的溶解性规律及记忆方法。
2、教学难点:微溶物的处理。
三、课前准备:事先印一张表格,要求学生课前先完成化学式的书写。
附:酸碱盐化学式四、教学流程2、提问:酸碱盐之间发生复分解反应的条件是什么?注意学生往往没说到反应物应是溶液(可溶,酸例外)特别是“盐+碱”、“盐+盐”反应物一定要全溶。
3、引入问题:复分解反应要具备生成物有水、气体、沉淀三个条件之一才能实行,生成水或气体通过方程式很容易判断出来,最难是如何判断是否生成沉淀,所以今天我们来学习酸碱盐的溶解性表。
附练习:3、下列实验能观察到明显现象的()A、硫酸钠溶液滴入氯化铜溶液B、氯化钡溶液滴入氧化铜中C、氢氧化钾溶液滴入硝酸钠溶液中D、硝酸银溶液滴入氯化钠溶液4、只有一种试剂来鉴别NaOH、Ca(OH)2、稀H2SO4三种溶液,这种试剂是()A、氯化钡溶液B、石蕊溶液C、碳酸钠溶液D、酚酞溶液5、下列各种物质,相互不能发生反应的是()A、Ca(OH)2溶液和硫酸B、氧化铁和盐酸C、三氧化硫和氢氧化化钠溶液D、盐酸和二氧化碳6、下面是某同学实行碱的化学性质实验时记录的现象,其中与事实不符的是( )A、Ca(OH)2溶液中加入稀盐酸,无明显变化B、NaOH溶液中通入CO2气体,有白色沉淀生成C、Ca(OH)2溶液中加入石蕊溶液,溶液呈蓝色D、NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成7、将下列各组物质放入水中,有化学反应发生,但无沉淀生成,也无气体生成,且溶液为无色的一组是( )A、K2CO3、BaCl2、NaClB、CaSO4、HNO3、NaClC、CaCl2、KOH、Na2CO3D、K2SO4、H2SO4、NaOH8.(2019广安市)酸、碱、盐的溶解性表为我们确定常见物质的溶解性提供了方便,下表是溶解性表中的一部分,结合表格和溶解度知识判断,下列说法不准确的是()常见酸、碱、盐的溶解性表(20℃)A.绘制表格的依据是物质的溶解度B.常见物质一般可分为:溶、微溶和不溶C.Ca(OH)2、CaSO4和CaCO3的溶解度都大于1gD.Ca2+、NO3-、Cl-三种离子在溶液中能大量共存9、完成发生的下列反应的化学方程式。
人教版初中化学九年级下册《附录Ⅰ部分酸、碱和盐的溶解性表(室温)》优秀教学案例
3.教师提出问题:“为什么有的物质能溶解在水中,有的物质不能?”引发学生的思考,激发他们的学习兴趣。
(二)讲授新知
1.教师以讲解为主,结合实验现象,为学生阐述酸、碱和盐的溶解性规律。
2.教师通过举例,让学生了解溶解性规律在实际生活中的应用,如:“如何选用合适的洗涤剂?”
3.教师引导学生关注溶解性规律的形成原因,如:温度、压力等因素对溶解性的影响。
人教版初中化学九年级下册《附录Ⅰ部分酸、碱和盐的溶解性表(室温)》优秀教学案例
一、案例背景
在我国教育体系中,初中化学是一门重要的基础学科,旨在培养学生的科学素养和实际操作能力。在人教版初中化学九年级下册的教材中,附录Ⅰ部分酸、碱和盐的溶解性表(室温)是一个重要的教学内容。这部分内容主要介绍了酸、碱和盐在不同温度下的溶解性规律,对于学生理解和掌握化学基础知识具有重要意义。
三、教学策略
(一)情景创设
1.教师可以通过展示生活中常见的化学现象,如烹饪、洗涤等,引导学生关注化学知识在实际生活中的应用。
2.利用多媒体课件,为学生展示酸、碱和盐的溶解性实验现象,让学生在视觉上产生直观感受。
3.创设问题情境,如:“为什么有的物质能溶解在水中,有的物质不能?”激发学生的好奇心,引发思考。
二、教学目标
(一)知识与技能
1.让学生掌握酸、碱和盐的溶解性规律,能够熟练运用溶解性表解决实际问题。
化学人教版九年级下册附录1 部分酸、碱和盐的溶解性表(室温)
附录1部分酸、碱和盐的溶解性表大城县北魏乡北魏中学刁凤英教学目标:知识与技能:认识复分解反应发生的条件。
理解酸碱盐的溶解性;判断两物质能否发生反应。
过程与方法:通过分类归纳复分解反应的条件,促进分类学习和归纳学习能力的提升。
通过观察分析,学会独立思考,促进学生思维能力的提升。
情感态度与价值观:通过教师与学生的交互,体验化学学习的乐趣以及化学的奥秘,增强化学学习的内在动力,培养自身的科学素养;通过应用复分解反应发生的条件判断物质间是否发生反应,让学生领会学以致用的思想。
教学重点与难点:重点:复分解反应发生的条件和复分解反应发生的判断难点:1、复分解反应的发生的判断2、理解酸碱盐的溶解性教学用品:ppt课件、投影等教学过程:一、复习引入新课(学生自然的进入学习状态,形象的动态课件、电子白板教学吸引学生,激发学习兴趣)展台展示:通过前面的学习,请同学们判断下面反应属于何种反应类型?1.2KmnO4==K2MnO4+MnO2+O2↑2.Fe+CuSO4=FeSO4+Cu3.Na2CO3+2HCl=2NaCl+ H2O +CO2↑4.Na2CO3+Ca(OH)2=CaCO3↓+2NaOH学生回答:1是分解反应,2是置换反应,3、4是复分解反应教师根据学生回答在白板上批注教师提问:那么什么是复分解反应?其特点是什么?表达式是什么?学生回答教师根据学生回答进行归纳总结,并用ppt展示定义:在溶液中,由两种化合物互相交换成分,生成另外两种化合物的反应。
特点:化合物双交换,里应外合价不变。
提问:下面请大家看看这两个反应是否属于复分解反应?课件展示NaOH+HCl=NaCl+H2OCa(OH)2+H2SO4=CaSO4+2H2O学生讨论:根据复分解反应的特征分析中和反应是否属于复分解反应呢?分析总结:根据中和反应特点,反应物酸和碱是化合物,交换成分后生成另外两种化合物盐和水,因此,中和反应是复分解反应。
过渡:通过以上讨论可知,酸、碱和盐之间可以发生复分解反应,那是不是所有的酸、碱、盐之间均能发生复分解反应呢?ppt展示二、学习新课(通过教师与学生的交互,体验化学学习的乐趣以及化学的奥秘,增强化学学习的内在动力,培养自身的科学素养)(一)复分解反应发生的条件板书:复分解反应发生的条件请大家完成白板上的化学方程式1. Na2CO3 + Ca(OH)2=CuSO4 + 2NaOH=2. NaHCO3 + HCl=CaCO3 + 2HCl=3. H2SO4 + 2NaOH=2HCl + Ca(OH)2=4.CuSO4+NaOH=学生练习书写化学方程式,将结果展台展示,集体订正,并指名交流每组反应的共同点。
最新人教版九年级化学下册《录1部分酸、碱和盐的溶解性表(室温)》精品课教案_21.doc
常见酸碱盐溶解性及其应用教学设计一、教学目标1、认识常见酸碱盐溶解性表2、通过观察常见酸碱盐溶解性表掌握常见酸碱盐溶解规律3、利用常见酸碱盐溶解性表解决相关问题二、教学重点和难点重点:通过观察常见酸碱盐溶解性表掌握常见酸碱盐溶解规律难点:利用常见酸碱盐溶解性表解决相关问题三、教学过程(一)、复习引入结合导学案自主复习酸碱盐的概念,为常见酸碱盐的溶解性做准备。
复习引入:酸碱盐的概念、酸:溶于水时解离(电离)出的阳离子只有1........的化合物,如:、、碱:溶于水时解离(电离)出的阴离子只有2........的化合物,如:、、盐:溶于水时解离(电离)出3......离子(或铵根离子)和离子(或氯离子)的化合物,如:、(二)、新授1、初步认识常见酸碱盐的溶解性表2、根据表格掌握常见阴阳离子结合后形成的化合物的化学式。
完成导学案相关内容。
写出对应阴阳离子结合形成的化合物的化学式OH -NO 3-Cl -SO42-CO 32-H +NH 4+K +Na+Ba2+Ca2+Mg 2+Al 3+Mn 2+Zn 2+Fe2+Fe3+Cu 2+Ag +3、根据常见盐的化学式将盐分类,为下面总结常见酸碱盐溶解规律做准备。
完成导学案相关内容。
常见盐的分类(1)、观察溶解性表,第二纵行除HNO 3外,其余化合物的阴离子都是,这样的盐可归类为硝酸盐,如:、。
(2)、观察溶解性表,第三纵行除HCl 外,其余化合物的阴离子都是(又叫做盐酸根),这样的盐可归类为盐酸盐,...如:、。
(3)、观察溶解性表,第二横行除 KOH 外,其余盐的金属离子都是,这样的盐可以归类为钾盐,如:、。
4、具体认识酸碱盐溶解性表,找出常见的具有挥发性的物质和不溶于水的物质。
完成导学案相关内容。
(1)、“溶” :表示方框对应的阳离子和阴离子形成的化合物可溶于...水,如:.、(2)、“不溶”:表示方框对应的阳离子和阴离子形成的化合物不溶于...水,如:.、(3)、“微溶”:表示方框对应的阳离子和阴离子形成的化合物微溶于...水,如:.、(4)、“挥发”:表示方框对应的阳离子和阴离子形成的化合物具有挥...发性,如:、..(5)、“——”:表示方框对应的阳离子和阴离子形成的化合物不存在...或遇水分解。
部分酸、碱盐的溶解性归纳表(室温)(适用人教版九年级化学下册酸碱盐)
1 / 2部分酸、碱和盐的溶解性表(室温)注意:1、亚铁离子(Fe 2+)为浅绿色,形成的可溶性盐类物质形成的溶液为浅绿色,即Fe(NO 3)2溶液、FeCl 2溶液、FeSO 4溶液均为浅绿色;铁离子(Fe 3+)为黄色,形成的可溶性盐类物质形成的溶液为黄色,即Fe(NO 3)3溶液、FeCl 3溶液、Fe 2(SO 4)3均为黄色;Cu(NO 3)2溶液、CuCl 2溶液、CuSO 4溶液均为蓝色。
2、Fe(OH)3为红褐色、Cu(OH)2为蓝色不溶于水物质,AgCl 、BaSO 4均为不溶于盐酸和硫酸的白色物质。
读作:氢氧化某读作:硝酸某读作:氯化某读作:硫酸某读作:碳酸某氢氧根硝酸根盐酸根硫酸根碳酸根OH -NO 3-Cl -SO 42-CO 32-H +H 2O 溶、挥HNO 3溶、挥HCl 溶H 2SO 4溶、挥H 2CO 3酸K +溶KOH 溶KNO 3溶KCl 溶K 2SO 4溶K 2CO 3钾盐Na +溶NaOH 溶NaNO 3溶NaCl 溶Na 2SO 4溶Na 2CO 3钠盐NH 4+溶、挥NH 3·H 2O 溶NH 4NO 3溶NH 4Cl 溶(NH 4)2SO 4溶(NH 4)2CO 3铵盐Ba 2+溶Ba(OH)2溶Ba(NO 3)2溶BaCl 2不BaSO 4不BaCO 3钡盐Ca 2+微Ca(OH)2溶Ca(NO 3)2溶CaCl 2微CaSO 4不CaCO 3钙盐Mg 2+不Mg(OH)2溶Mg(NO 3)2溶MgCl 2溶MgSO 4微MgCO 3镁盐Al 3+不Al(OH)3溶Al(NO 3)3溶AlCl 3溶Al 2(SO 4)3---铝盐Mn 2+不Mn(OH)2溶Mn(NO 3)2溶MnCl 2溶MnSO 4不MnCO 3锰盐Zn 2+不Zn(OH)2溶Zn(NO 3)2溶ZnCl 2溶ZnSO 4不ZnCO 3锌盐Fe 2+不Fe(OH)2溶Fe(NO 3)2溶FeCl 2溶FeSO 4不FeCO 3亚铁盐Fe 3+不Fe(OH)3溶Fe(NO 3)3溶FeCl 3溶Fe 2(SO 4)3---铁盐Cu 2+不Cu(OH)2溶Cu(NO 3)2溶CuCl 2溶CuSO 4---铜盐Ag +---溶AgNO 3不AgCl微Ag 2SO 4不Ag 2CO 3银盐盐碱硝酸盐盐酸盐硫酸盐碳酸盐阳离子阴离子3、注意含Fe2+和Fe3+离子的碱和盐的读法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸碱盐溶解性表 应用
张欣梅
部 分 酸 碱 盐 溶 解 性 表 ( 室 温 )
部 分 酸 碱 盐 溶 解 性 表 ( 室 温 )
部
分
酸分
碱 盐 溶 解 性 表析 物ຫໍສະໝຸດ 质 溶 解(性室情
温 )
况
部
分
酸实
碱 盐 溶 解 性 表
验 验 证 物 质
(溶
室解
温 )
性
部
分
酸分
碱析
酸碱盐溶解性规律记忆
钾、钠、铵、硝酸均可溶; 氯不溶银、硫酸不溶钡; 碳酸只溶钾、钠、铵; 可溶碱有5个铵、钾、钙、钠、钡。
应用1 分析复分解反应能否发生
Na2CO3+2HCl==2NaCl+H2O+CO2 CuSO4+ 2NaOH== Na2SO4+Cu(OH)2
狭 路 相 逢
H2O
CO2
狭
NH3
路
相
逢
勇
者
胜
总结离子对
应用2 根据离子对判断是否共存
分析下列哪组能够共存: A、Ba2+、K+、NO3-、H+ B、Fe3+、SO42-、OH-、Na+、Cu2+ C、Ag+、Ba2+、Cl-、NO3D、K+、Cl-、Mg2+、NO3-、H+
在PH=1的溶液中能大量共存的一组离子是( ) A、Na+、Ba2+、Cl-、OHB、SO42-、K+、Ca2+、CO32C、Ag+、Na+、NO3-、ClD、NO3-、Cl- 、Mg2+、Cu2+
盐物
溶 解 性 表 (
质 溶 解 性
室规
温律
)
酸碱盐溶解性规律
钾、钠、铵、硝酸均可溶; 氯不溶银、硫酸不溶钡; 碳酸只溶钾、钠、铵; 可溶碱有5个铵、钾、钙、钠、钡。
物质溶解性快速判定
AgCl KOH Na2CO3 BaCl2 BaSO4 Ca(OH)2 CuSO4 NaNO3 Al2(SO4)3 Cu(OH)2 NH4Cl BaCO3
给 某化工厂甲乙两个车间排出的废液 的中含有以下8种离子:H+ 、Ag+、
离 K+、Cu2+、Cl-、OH- 、NO3-、 子 CO32,按照一定比例混合后,过滤,
溶液中只有一种溶质。已知,取少
找 量甲车间的溶液加入无色酚酞,酚 家 酞变成红色。请分析两个车间中的 人 离子分别是什么?
