工程热力学第13讲-第7章-2理想溶液、相平衡基础
工程热力学课件完整版

第三章 理想气体的性质
基本要求: 1、熟练掌握并正确应用理想气体状态方程式; 2、正确理解理想气体比热容的概念,熟练应用比热容计算理想 气体热力学能、焓、熵及过程热量; 3、掌握有关理想气体的术语及其意义; 4、掌握理想气体发生过程; 5、了解理想气体热力性质图表的结构,并能熟练应用它们获得 理想气体的相关状态参数。
T
不可逆过程的熵增(过程角度)
q
T
0
克劳休斯积分不等式(循环角度)
dsiso 0
孤立系统角度
ds sf sg 非孤立系统角度
熵、热力学第二定律的数学表达式
1. 熵的定义
ds qre
T
2. 循环过程的熵
3. 可逆过程的熵变
qre Tds
ds 0,则 q 0 可逆过程中ds 0,则 q 0
dv
q cndT Tds
T s
n
T cn
T ,定容过程 cV
T ,定压过程 cp
4个基本过程中的热量和功的计算
2
2
1、定容过程
w pdv 0 1
wt 1 vdp v( p2 p1)
2、定压过程
qv u cv (T2 T1)
2
w 1 pdv p(v2 v1)
热力学上统一规定:外界向系统传热为正,系统向外界传热为负。
可逆过程的热量
T
1
B
qre = Tds
T
A
2
q
ds qrev
T
S1
S dS S2
q “+”
q “-”
热力循环
功:工质从某一初态出发,经历一系列热力状态后,又回到原来 初态的热力过程称为热力循环,即封闭的热力过程,简称循环。
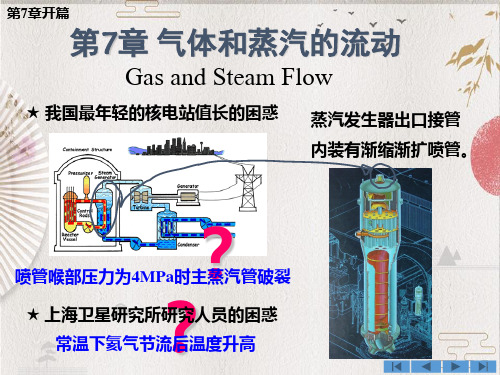
工程热力学第七章讲解

第七章 气体流动
当p2=0时,出口速度达最大,即:
c f 2,max
2k k 1
p0v0
2
k
k
1
RgT0
此速度实际上是达不到的,因为压力趋于零时比体积 趋于无穷大。
第七章 气体流动
三、临界压比
在临界截面上:
Ma 1
c f c f ,cr c
c f ,cr
2(h1
c2f 1 2
2
vdp c f dc f
0
vdp
第七章 气体流动
结论:要使工质的流速改变,必须有压力差
压力下降,速度增加 喷 管 速度下降,压力增加 扩压管
c f dc f vdp
1 cf 2
cf
dc f
1 cf 2
vdp
第七章 气体流动
1 cf 2
cf
dc f
1 cf 2
vdp
定义:流体速度为零的截面称为滞止截面; 此时流体的状态称为滞止状态。相应的参数称为滞止参
数。如滞止压力, 滞止温度,滞止焓(总焓)。
所有截面上的滞止焓均相同
=定值
第七章 气体流动
理想气体:
cpT0 ห้องสมุดไป่ตู้ cpT1
c2f 1 2
cpT2
c2f 2 2
cpT
c2f 2
0
T0
c
2 f
2
滞止温度
对于不可压流体(dv = 0),如液体等,流体速度的改变取决 于截面的改变,截面积A与流速cf成反比; 对于气体等可压缩流体,流速的变化取决于截面和比体积的综 合变化
高等工程热力学 童钧耕 第章溶液和相平衡

高等工程热力学童钧耕第章溶液和相平衡第一节:溶液的基本概念1.1 溶液的定义溶液是指由两个或两个以上的物质在一定温度和压力下混合形成的均相体系。
1.2 溶解度溶解度是指在某一温度和压力下,单位体积溶剂中最多溶解的物质的量,通常用摩尔溶解度表示。
在给定的温度和压力下,溶液中溶质的摩尔浓度等于溶解度,此时称为饱和溶液。
1.3 等温线等温线是指在恒定温度下,溶质在溶剂中溶解度随压力变化的曲线。
当某一压强下,溶质的摩尔浓度等于溶解度时,称为等温线上的点,该点就是该压强下的平衡点。
第二节:相平衡2.1 相平衡的定义相平衡是指在一定温度和压力下,两个或两个以上的不同相处于平衡状态时所对应的状态,即两个或两个以上的相间存在相互转化的正逆反应,并且反应速率相等,达到动态平衡。
2.2 平衡常数平衡常数是指在一定温度下,反应物与生成物之间的摩尔浓度比值,即为反应的平衡常数。
反应的正逆反应之间的平衡常数满足比例关系。
2.3 相图相图是描述物质(纯物质或混合物)在不同条件下相平衡关系的图形记录。
它通常是以温度和压力为轴,画出不同相的出现范围,用以研究物质在不同条件下的相变规律。
第三节:二元液体体系3.1 物质在不同条件下的相变物质在不同条件下的相变表现为液态、固态、气态之间的相互转化。
同一物质在不同条件下的相变规律与其在相图上的相变曲线有关。
3.2 系统的有序性和无序性在研究液体体系时,通常采用统计力学的方法。
在这种方法中,系统的有序程度通常用熵来描述。
对于二元液体体系,其混合熵对于温度和组成都是函数,因此可以得到相互作用参数。
3.3 凝聚度模型凝聚度模型用于描述液-液混合,其核心是假设体系可以分为两类分子,一类是聚集分子(偏好型分子),一类是单体分子(排斥型分子)。
据此可以得到混合自由能,用于计算热力学性质。
第四节:非理想溶液4.1 溶液中混合气体的非理想性在高压条件下,气体分子之间的相互作用不能忽略,导致混合气体的非理想性。
【工程热力学精品讲义】第7章
喷管 cf p 扩压管 p cf
2) cf dcf vdp
cf
1 2
cf2
的能量来源
是压降,是焓㶲(即技术功)转换成机械能。
14
二、几何条件
dcf cf
~
dA
A
力学条件 过程方程
dp Ma2 dcf
p
cf
dp dv
pv
Ma2 dcf dv cf v
连续性方程 dA dcf dv A cf v
.
9
滞止参数的求取 ★理想气体:
▲定比热容
▲变比热容
T0
T1
cf21 2cp
p0
p1
T0 T1
1
v0
RgT0 p0
h0 T0 pr0 T1 pr1
p0
p1
pr 0 pr1
★水蒸气: h0
h1
1 2
cf21
s0 s1
其他状态参数
p0 t0
h0 h1
10 s1
4.声速方程
? 声音的速度330m/s
速度达Ma = 7,若飞机在–20℃ 的高空飞行,其 t0 = 334 ℃。
加上与空气的摩擦温度将极高,如美国航天飞机设计承受最
高温1650℃,实际经受温度1350~1400℃
12
7–2 促使流速改变的条件
一、力学条件
dcf cf
~
dp
p
流动可逆绝热 δq dh vdp 0
气流焓㶲 dex,H dh T0ds dh vdp
c
p
s
v2 p v s
等熵过程中
dp dv 0
pv
p
v
s
p v
102 二元理想溶液的气液相平衡PPT课件

5.露点方程的应用
露点方程
(1)已知体系压力、气相露点可由上式计算气相组成; (2)已知体系压力、气相组成计算气相的露点,需试差; (3)已知气相组成、气相露点计算体系压力,需试差。
第二节 二元理想溶液的气、液相平衡
四、恒压相平衡图 1.温度-组成(T-x-y)相 图
温度-组成(T-x-y)相 图代
6.相平衡方程(Gas Liquid Equபைடு நூலகம்librium )
当汽、液两相达到平衡时:
yA
p0 A
p
xA
yB
pB 0 p
xB
ppB 0 (1xA)
表示成更一般的形式:
yA KAxA
A组分的相平衡 常数
KA
p
0 A
p
yB K B xB K B (1 xA )
KB
p
0 B
p
第二节 二元理想溶液的气、液相平衡
第二节 二元理想溶液的气、液相平衡
2.泡点方程 (bubble-point equation) 当汽、液两相达到平衡时:
p p A p B p A 0 x A p B 0 1 x A
xA
P pB0 pA0 pB0
泡点方程 p-t-x关
系
上式表示了低压下二元物系的p-t-x关系,即在一定
pA pAoxA
p Bp B oxBp B o(1xA )
第二节 二元理想溶液的气、液相平衡
二、低压下的汽、液相平衡关系
真正的二元理想物系在自然界是不存在的,但当 形成液相混合物的组分分子具有相似的结构,且分 子量很相近时,可以认为是理想溶液。当压力较低 (如300以下)而温度又不很低时,汽相可认为是理想 气体,此时拉乌尔及道尔顿定律均可适用。
理想溶液的气液平衡关系遵循

理想溶液的气液平衡关系遵循1. 引言嘿,大家好!今天咱们聊聊一个看似很高大上的话题——理想溶液的气液平衡关系。
听起来有点复杂,但别担心,我会尽量把它讲得简单易懂,毕竟,科学也是可以很有趣的嘛。
想象一下,如果你的朋友是个化学家,他和你聊起化学的时候,怎么才能让你觉得不那么无聊呢?这就是我今天的目标!2. 理想溶液是什么2.1 理想溶液的定义那么,啥是理想溶液呢?简单来说,理想溶液就是当两种或多种液体混合在一起时,它们的行为就像个一体的大家庭,彼此之间没有太多的摩擦和排斥。
比如,想象你和朋友一起做蛋糕,大家各自拿出自己的拿手好戏,然后把这些美味的食材混在一起,结果出来的蛋糕那叫一个美味可口,绝对的和谐。
这个过程就像是理想溶液的形成。
2.2 理想溶液的特性不过,理想溶液可不是随便就能凑合起来的哦。
它有几个特性,比如说它的组成成分在不同浓度下的蒸气压变化都是线性的。
就像你在超市看到的那些促销活动,买一送一,随着数量增加,价格的变化也不会太离谱。
而在理想溶液里,各种成分的挥发性也差不多,大家都在这个“气泡派对”上平起平坐,不分你我。
3. 气液平衡3.1 气液平衡的概念接下来,咱们得聊聊气液平衡。
想象一下,你在一个阳光明媚的日子里,喝着冰凉的饮料,饮料的水分不断蒸发,形成了小小的水珠在杯子表面上,乍一看还挺好看的!这就是气液平衡的一个小缩影。
气液平衡实际上就是液体和气体之间的一种状态,在这个状态下,蒸发和凝结的速度是一样的,听起来是不是很高深?但实际上就是一场小型的化学舞会,大家跳得不亦乐乎!3.2 理想溶液的气液平衡关系而在理想溶液中,这种气液平衡的关系可就特别“讲究”了。
根据拉乌尔定律,液体的蒸气压与它的摩尔分数成正比。
这就是说,如果你在混合液体中加入了更多的某种成分,它的蒸气压就会随之增加。
就像朋友聚会,如果你请了更多的朋友来,大家的热情自然会高涨,不是吗?这种动态平衡就像一场精心编排的舞蹈,互相配合得恰到好处。
化工热力学第七章 相平衡

P-yb •恒沸点
Raoult定律计算值
§7.3 活度系数与组成关系式
§7.3.0 引言 §7.3.1 正规溶液和无热溶液 §7.3.2 Wohl型方程(经典模型)
• Margules方程 • Van Laar方程
§7.3.3基于局部组成概念的方程式
• Wilson方程 • NRTL方程 • UNIQUAC方程
•恒沸点 P-xb P-yb
Raoult定律计算值
•恒沸点
4)负偏差,最小压力恒沸物(最高恒沸点)
•负偏差较大,溶液的总压在P-x曲线上出现最低点 •最低点压力小于两纯组分的蒸汽压。 •在T-x曲线上出现最高点,该点y=x,称为恒沸点。 •如氯化氢-水体系、氯仿-丙酮体系 。对于这种体系,用一 般精馏法是不能将此分离开的,必须要采用特殊分离法。
第四章已学过逸度用EOS计算的方法:
ˆ ln i
P
0
Zi 1 1 dP P RT
P
0
RT (Vi )dP P
状态方程法(逸度系数法)
ˆ ˆ iV iL 的求取: 采用状态方程法的重点在于
,,
ˆ V f iV 1 Vm RT p V ˆ ln ln )T ,V ,n j [ i ] ]dVm ln Z V 0 [ V ( pyi RT Vm ni
S
i ?
对于活度系数法,
RT 0 (Vi P )dP nG E RT ln i ni T , P , n n
j i
PiS
i 模型是关键
与T,P,x有关,来自理论、半理论、经验
§7.3.1正规溶液和无热溶液
化工热力学第七章-相平衡PPT课件

.
22
.
23
7 相平衡
7.1 平衡的判据与相律
7.2 互溶体系VLE相图
7.3 VLE的计算
7.4 汽液平衡数据的热力学一致性检验
.
24
7.3 VLE的计算
在前边的章节中,我们已经讨论了相平衡计算
中所应用到的一些基本热力学关联式,在这一部分
.
17
7.2 互溶体系VLE相图
2) 低压下互溶体系的汽液平衡相图
在化工生产中,经常遇到低压下的蒸馏分 离,低压下的汽相一般接近于理想气体的性 质,而液相则由于分子大小的差异及个组分 间作用力的不同确定了液相与理想溶液的偏 差,对理想溶液(或拉乌尔定律)产生偏差 的情况有四种:
.
18
7.2 互溶体系VLE相图
.
4
7 相平衡
目的:学习汽液相平衡基本规律与计算 要求:
1、了解相平衡的基本概念和规律 2、掌握低压下汽液相平衡的计算 3、了解中压、高压下汽液相平衡的计算 4、学习汽液平衡数据的热力学一致性检验
.
5
7 相平衡
7.1 平衡的判据与相律 7.2 互溶体系VLE相图
7.3 VLE的计算 7.4 汽液平衡数据的热力学一致性检验
.
2
7 相平衡
汽液平衡 精馏
气液平衡 吸收
液液平衡 萃取
液固平衡 结晶、湿法冶金
固固平衡 晶型转变
汽固平衡 升华、气相沉积
.
3
7 相平衡
如何得到平衡数据,一般通过实验来测取 所研究体系的平衡数据,但同样存在需要实 验设备和时间的问题,因此计算方法的研究 同样具有重要意义。如今计算机的发展使计 算相平衡,特别是汽液相平衡成为可能。本 章着重与讨论汽液相平衡的问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
若溶液中有A, B 同时存在,平衡时,
pB (T ) RT ln p
l B g B
B
在上两式中消去
B
则得
pB (T , p ) RT ln * pB
过程装备与控制工程专业
工程热力学
第十三讲
山东大学机械工程学院 过程装备与控制工程研究所
本讲内容
7-2 溶液热力学
1 理想溶液 2 逸度和活度
7-3 相平衡基础
3 汽液相平衡 4 汽液平衡相图 5 汽液相平衡关系
6 汽液相平衡关系的应用
学习要求
1 掌握逸度、逸度系数、活度、活度系数、理想溶液、非 理想溶液、汽液相平衡等基本概念。 2 3 掌握理想溶液有关定律和相图的应用。 掌握低压汽液相平衡的计算。
V B ,m V m ( B )
(2)
mixV n BV B , m n BV m ( B ) 0
B B
mix S 0 定温定组成条件下:
* B (T , p ) B * B (T , p ) RT ln x B R ln x B T p ,n T p , n T p ,n
4
了解中、高压汽液相平衡的计算。
1.理想溶液
理想溶液的引入
理想溶液,顾名思义,就是理想化的溶液,是实际不存在的 溶液。 科学研究的前提往往是要首先建立一个理想化的模型,这个 模型是从各种实际现象中抽出来的,求其共性,舍其差异。 这就大大简化了科研中的困难,从而建立一套思想体系,在 具体应用中加以修正,就可以用于实际体系。
(4)由 ln i A12 , A21
x2 ln 2 2 A12 (1 ) ln 1 x1 ln 1 A21 (1 x1 ln 1 2 ) ln 2 x2 ln 2
(5) 式中ln不能换成lg (6) 范拉尔方程式没有考虑T,P的影响。
双组分系统活度系数关联式
mix H mix G T mix S 0
2.逸度和活度
逸度和逸度系数
逸度 f 是由美国物理化学家Gibbs Nenton Lews 提出的,用 其代替压力,以修正非理想气体与理想气体的偏差。 dG=-SdT+Vmdp 对理想气体 恒T:dG=Vmdp
RmT dG dp RmTdlnp p
ln 2 A21 x12 Ax12
双组分系统活度系数关联式
(3)当 A
12
12
A21 0
时,
当A
0, A21 0 时,
i 1 为理想体系; i 1 为负偏差非理想体系;
当A 12
0, A21 0 时, i 1 为正偏差非理想体系。
A可用来判别实际溶液与理想溶液的偏离度
Lim
p 0
fi 1 p
对真实气体
ZRmT dG dp RmTdlnp p
dG RmTdlnf
Zdlnp dlnf
逸度的定义
三种不同的逸度
dG i RT dlnfi
纯组分i
Lim
p 0
fi 1 p
^
混合物中 组分i
d G i RTdln f i
_
Lim
p 0
* * B (T , p ) B (T , p ) B (T )
一般来说不致引起很大的误差。所以可以使用上式来表示理想溶
液中任一组分的化学势的表示式。
理想溶液的性质
V i Vmi
_
由于没有体积效应 由于没有热效应 由于相互作用力相同
H i H mi
_
U i U mi
理想溶液中各组分的化学位(势)
由于 故积分得
B p
* B
V B ,m T ,n
B
p p
(T , p ) (T ) V B , m dp
由于在通常情况下,p与标准压力pӨ的偏差不会太大,且溶液体积受压力
的影响很小,故若忽略积分项,而认为
混合物
f p
f p
逸度的物理意义与注意事项
逸度的物理意义主要表现在: (1)逸度是有效的压力; (2)逸度是自由焓与可测的物理量之间的辅助函数。 注意以下几点: ① 逸度和逸度系数都是强度性质的热力学函数。 ② 逸度的单位与压力相同,逸度系数无因次。 ③ 理想气体的逸度等于p,逸度系数等于1。
V i Vi
引入了一个新的概念—活度 用活度修正浓度来表示非理想体系。
_
活度
活度的定义:溶液中组分i的逸度与在溶液T,P下组分i的 标准态逸度的比值,称为组分i在溶液中的活度。
fi ai 0 fi
实质:相对逸度
物理意义:有效浓度
活度系数
对于液态理想溶液
i i0 RT lnxi
i RT lna i
0 i
( A)
对于液态非理想溶液
( B)
比较(A)、(B)二式,可以看出实际溶液对理想溶液的偏差,而 这种偏差程度常用活度系数来衡量,即:
ai fi fi γi id o xi xi f i fi
注意点
(1)纯组分液体的活度系数为1; (2)理想溶液的活度等于摩尔浓度。
a i xi
或
γi
ai 1 xi
(3)用活度系数来描述实际溶液的非理想行为
a i xi
或
ai γi 1 xi
非理想溶液大致有两大类
i 1
i 1
正偏差
负偏差
活度系数与组成的关系
活度定义为:
ai i xi
欲求出活度,需要知道活度系数γi; 活度系数γi一般是要据关系式求得;
G i Gmi RmTlnxi
_
_
S i S mi Rmlnxi
_
Sid 0
理想溶液的性质
(1)
mixV 0 定温定组成条件下:
B p
* B * (T , p ) p B (T , p ) RT ln x B p T ,n T ,n T ,n
物质逸度的计算
dG RmTdlnf
lnfi Vi p RT T
dp ln i Z i - 1 p 0 p 1 R ln i V dp RT 0
p
利用H,S值
利用实验数据
利用普遍化方法 利用EOS法
非理想溶液
不符合理想溶液其中任一个热力学性质的溶液,就称 为非理想溶液。
同位素分子混合物( H2O—D2O) 立体异构体混合物(HOOC-CH= CH- COOH 顺式、反式 ) 光学异构体混合物( d-樟脑 — l -樟脑) 紧邻同系物混合物(苯 — 甲苯)
1. 2. 3. 4.
理想溶液中各组分的化学位(势)
首先讨论纯液体的化学势: 设温度T 时,纯液体B与其蒸气平衡 ,根据化学势判据,B 在气相和 液相中的化学势必相等:即
G
式中
12和 21叫威尔逊参数,其定义为: Vm, 2 12 11
12 exp Vm,1 RT Vm,1 21 22 21 exp Vm, 2 RT
双组分系统活度系数关联式
x1 21 x2 ln 1 1 lnx1 12 x2 讨论: x1 12 x2 x2 21 x1
( x1 0, x2 0)
A12
A21
lim
x1 0
ln 1 ln 1 A12
ln 2 ln 2 A21
lim
x2 0
12 21 时, (2)当 此二元系统称对称系统, 变为单参数的对称方程:
A A A
2 2 ln 1 A12 x2 Ax2
讨论:(1) 其他的活度系数按1 2方式变换得到 3 (2) 当x3 =0时,为双组分马格勒斯方程 (3) C=0时为对称系统(表征三组分系统性质的常数,
由三组分系统平衡数据确定)
(4) T, P没考虑
双组分系统活度系数关联式
※3 威尔逊(Wilson)方程:
E m
Q
x1 ln(x1 12 x2 ) x2 ln(x2 21 x1 ) RT x1 21 x2 ln 1 1 lnx1 12 x2 x1 12 x2 x2 21 x1
S B , m S m ( B ) R ln x B
mix S n B S B , m n B S m ( B ) Rn B ln x B 0
B B B
理想溶液的性质
(3)
mixG 0
设混合前和混合后的自由焓分别为G1和G2,则
* G1 n B G m ( B ) n B B (T , p ) B B
l B * B
理想溶液中各组分的化学位(势)
若溶液服从拉乌尔定律 代入得
* pB pB xB
l * B B (T , p ) RT ln x B
* B (T , p )
是温度T 和压力P 时(即溶液上面的总压)纯B 的化
学势,这个态不是标准态,我们通常选用标准态的压力为pӨ(
101.325kPa),当外压改变时,化学势有所改变。
fi 1 xip
^
混合物
dG RTdlnf
Lim
p 0
f 1 p
