茳芒决明子质量标准起草说明
决明子中药材详细说明书

决明子药材名称:决明子拼音名称:JUEMINGZI别名:决明、马蹄决明、假绿豆、草决明,羊明、羊角、马蹄决明、还瞳子、狗屎豆、假绿豆、马蹄子、千里光、芹决、羊角豆、野青豆、猪骨明、猪屎蓝豆、细叶猪屎豆、夜拉子、羊尾豆。
科属:为豆科一年生草本植物决明或小决明的干燥成熟种子。
产地:布于长江以南各省区。
全世界热带地方均有。
安徽、广西、四川、浙江、广东等省,南北各地均有栽培。
性味:[性味、归经]甘、苦、咸、微寒。
归肝、大肠经。
功效:清热明目,润肠通便。
中成药:共有131种中成药使用决明子:杞明胶囊清热明目茶醒脑再造胶囊牛黄降压丸十味乳香胶囊养心丸元胡胃舒胶囊活络通口服液明目滋肾片降压袋泡茶等。
应用:1、目赤肿痛,羞明多泪,目暗不明。
本品入肝经,功善清肝明目而治疗肝热目赤肿痛,羞明多泪,常配伍黄芩、赤芍、木贼用;若治风热上攻头痛目赤,可配伍菊花、青箱子、茺蔚子;本品有益肝阴之功,配伍山茱萸、生地黄等,可治疗肝肾阴亏、视物昏花、目暗不明。
2、头晕头痛。
本品苦寒入肝,既能清泄肝火,又兼能平抑肝阳,可用治肝阳上亢之头痛、眩晕,常配伍菊花、钩藤、夏枯草等。
3、肠燥便秘。
本品性味甘咸寒,兼入大肠经而能清热润肠通便,用于内热肠燥,大便秘结,可与火麻仁、瓜蒌仁用。
用法用量:煎服,10~15G;用于润肠通便,不宜久煎。
注意事项:气虚便溏者不宜服用。
采收加工:秋季采收成熟果实,晒干,打下种子,除去杂质,生用或炒用。
炮制工艺:1、决明子:取原药材,除去杂质,洗净,干燥。
用时捣碎。
2、炒决明子:取净决明子,置预热炒制容器内,用文火加热,炒至微有爆裂声,微鼓起,内部黄色,并逸出香气时,取出晾凉。
用时捣碎。
现代研究:1、化学成分:本品含大黄酸、大黄素、芦荟大黄素、决明子素、橙黄决明子素,决明素等蒽醌类物质,以及决明苷、决明酮、决明内酯等萘并吡咯酮类物质;此外,尚含甾醇、脂肪酸、蛋白质。
2、药理作用:本品水浸出液,醇水浸出液及乙醇浸出液都有低血压作用;本品又降低血浆总胆固醇和甘油三酯的作用;其注射液可使小鼠胸腺萎缩,对吞噬细胞吞噬功能有增强作用;其所含蒽脂类物质有缓和的泻下作用;其醇浸出液除去醇厚,对金黄葡萄球菌、白色葡萄球菌、橘色葡萄球菌、白喉杆菌、巨大芽孢杆菌、伤寒杆菌、副伤寒杆菌、乙型副伤寒杆菌及大肠杆菌有抑制作用。
决明子质量标准

XXXXXXXXX有限公司
一、目的:建立决明子药材、饮片的质量标准,确保投用药材、饮片的质量。
二、范围:本规定适用于决明子药材、饮片的质量控制。
三、责任:
四、内容:
1.标准来源
2015年版《中国药典》一部
2.技术要求
2.1决明子药材:
2.2决明子饮片:
3.贮存条件:置干燥处。
4.相关标准操作规程:决明子检验操作规程(SOP-ZL-JG(YL)-024)、物料取样标准操作规程(SOP-ZL-QA-001)。
5.企业统一指定的物料名称:与2015年版《中国药典》一部一致。
6.内部使用的物料代码:1101092。
7.经批准的供应商:见合格供应商目录。
8.印刷包装材料的实样或样稿:无此项内容。
9.注意事项:无此项内容。
10.复验期:执行“物料有效期及复验期管理规程(SMP-WL-008)”相关规定。
11.文件附件:共0份。
12.修订及变更历史:。
决明子质量标准及检验操作规程
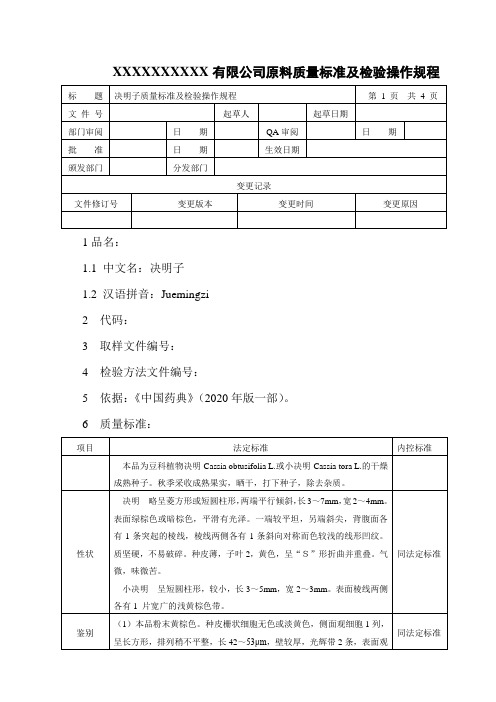
XXXXXXXXXX有限公司原料质量标准及检验操作规程1品名:1.1 中文名:决明子1.2 汉语拼音:Juemingzi2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7 检验操作规程:7.1 试药试剂:甲醇、盐酸、乙醚、三氯甲烷、橙黄决明素对照品、大黄酚对照品、无水乙醇、乙酸乙酯、石油醚(30~60℃)、丙酮、氨试液、乙腈、磷酸。
7.2 仪器设备:显微镜、电子天平、回流装置、水浴锅、硅胶H薄层板、紫外光灯、马福炉、高效液相色谱仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1取本品横切面制片显微镜(10×10)观察组织结构特征。
7.4.2取本品粉末1g,加甲醇10ml,浸渍1小时,滤过,滤液蒸干,残渣加水10ml使溶解,再加盐酸1ml,置水浴上加热30分钟,立即冷却,用乙醚提取2次,每次20ml,合并乙醚液,蒸干,残渣加三氯甲烷1ml使溶解,作为供试品溶液。
另取橙黄决明素对照品、大黄酚对照品,加无水乙醇-乙酸乙酯(2:1)制成每1ml各含1mg的混合溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述两种溶液各2μl,分别点于同一硅胶H薄层板上,以石油醚(30~60℃)-丙酮(2:1)为展开剂,展开,取出,晾干。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点;置氨蒸气中熏后,斑点变为亮黄色(橙黄决明素)和粉红色(大黄酚)。
7.5 检查:7.5.1水分:不得过15.0%(附录15第二法)。
7.5.2总灰分:不得过7.0%(附录17)。
7.5.3黄曲霉毒素照黄曲霉毒素测定法(附录50)测定。
取本品粉末约5g,紧密称定,加氯化钠3 g,照黄曲霉毒素测定法项下的供试品的制备方法,测定,计算,即得。
本品每1000 g含黄曲霉毒素B1不得过5μg,含黄曲霉毒素G2、黄曲霉毒素G1、黄曲霉毒素B2和黄曲霉毒素B1的总量不得过10μg。
决明子炮制方法与标准

决明子炮制方法与标准决明子炮制方法与标准【药材来源】决明子为豆科植物决明或小决明的干燥成熟种子。
秋季采收成熟果实,晒干,打下种子,除去杂质。
【古代炮制方法】梁代开始有火炙和煮制(《集注》)。
唐代有醋渍(《千金翼)的方法。
宋代用微炒(《圣惠方》)和火炙(《证类》)等法。
元代和明代均用炒法(《活幼》、《通玄》)。
清代有酒煮法(《握灵》),并记述了酒煮目的。
【现代炮制方法】1.决明子:取原药材,除去杂质,洗净,干燥。
用时捣碎。
2.炒决明子:取净决明子,置炒制容器内,用文火加热,炒至微有爆裂声,并逸出香气时,取出晾凉。
用时捣碎。
【饮片性状】决明子略呈菱方形或短圆柱形,两端平行倾斜,长3~7毫米,宽2~4毫米;表面绿棕色或黯棕色,平滑有光泽;一端较平坦,另端斜尖,背腹面各有一条突起的棱线,棱线两侧各有1条斜线对称而色较浅的线形凹纹;质坚硬,不易破碎;种皮薄,子叶2,黄色,呈“S”形折曲并重叠;气微,味微苦。
小决明呈短圆柱形,较小,长3~5毫米,宽2~3毫米;表面棱线两侧各有1片宽广的浅黄棕色。
炒决明子微鼓起,种皮破裂,颜色加深,偶有焦斑,质稍脆,微有香气。
【质量标准】决明子水分不得过15.0%,总灰分不得过5.0%,按干燥品计算含大黄酚不得少于0.20%,含橙黄决明素不得少于0.080%。
炒决明子水分不得过12.0%,总灰分不得过6.0%,含大黄酚不得少于0.12%,含橙黄决明素不得少于0.080%。
【炮制目的】决明子味苦、甘、咸,性微寒。
归肝经、大肠经。
具有清肝明目,润肠通便的功能。
生决明子长于清肝热,润肠燥。
常用于目赤肿痛,大便秘结。
炒决明子寒泻之性减弱,并能提高煎出效果,有平肝养肾之功。
可用于头痛、头晕,青盲内障。
【应用选择】1.生用(1)风热目赤:常与菊花、蔓荆子、黄芩、羌活等配伍,用于风热上扰,目赤肿痛,或兼头晕头痛,具有疏风散热,明目的作用,如决明子散(《济生方》)。
(2)肝火目赤:常与柴胡、黄连、菊花等同用,能泻肝明目,用于肝胆郁火上冲,目赤涩痛,羞明多泪,如决明子汤(《总录》)。
中药材商品规格等级—决明子

感谢观看
2016年2月22日,中国国务院《中医药发展战略规划纲要(2016-2030年)》要求“推动实施中药标准化行动 计划,构建中药产业全链条的优质产品标准体系”;7月,由中国国家中医药管理局组织的中药标准化项目正式启 动,该中药标准化项目规划提出建立制定中药材等级标准,制定不同质量等级中药饮片产品辨识、检测技术和方 法,建立中药饮片等级标准。
起草单位:河南中医药大学、中国中医科学院中药资源中心、无限极(中国)有限公司、中药材商品规格等级 标准研究技术中心、北京中研百草检测认证有限公司。
主要起草人:陈随清、张飞、黄璐琦、郭兰萍、詹志来、杨国静、康利平、余意、马方励。
标准目次
参考资料:
内容范围
团体标准《中药材商品规格等级—决明子》(T/CACM 1021.149-2018)规定了决明子(Cassia sophera Linn.)的商品规格等级。该标准适用于决明子药材生产、流通以及使用过程中的商品规格等级评价。
团体标准《中药材商品规格等级—决明子》(T/CACM 1021.149-2018)规定了决明子(Cassia sophera Linn.)的商品规格等级。该标准适用于决明子药材生产、流通以及使用过程中的商品规格等级评价。
制定过程
修订背景 编制进程
修订依据 起草工作
新中国成立后,中国先后3次颁布中药材商品规格等级标准,分别为《36种药材商品规格标准》(1959年), 《54种药材商品规格标准》(1964年),《七十六种药材商品规格标准》(1984年)。随着20世纪90年代药材经 营管理的放开,药材市场采纳的标准已发生较大变化,常用大宗药材也由野生品转向以栽培品为主,加之各地无 序的引种,重量轻质,照搬农作物的栽培生产方式,以及化肥、农药、植物生长调节剂等农业投入品的滥用,导 致栽培药材的形态特征、质量等均发生较大的改变。《七十六种药材商品规格标准》仅以性状为分级指标,在数 量和质量评价方法上,与现代水平相差甚远,而市场形成的“标准”随意性较大,无法统一,导致药材市场中部 分药材商品品别、规格、等级的混乱。此外,随着人民群众对中药材质量及其他不同要求的增加,也迫切需要制 订适合中药材规格等级划分的标准。为此,制(修)订药材商品规格标准受到中国国家相关部门及行业的高度重 视,2012年8月中国国家发展与改革委员会办公厅下发《国家发展改革委办公厅关于落实中药材价格综合整治政 策措施部门分工方案的通知》(发改办价监[2012]2308号),文件第四项第2条明确指出“加强中药材质量监 管,完善中药材商品规格等级标准”,明确要求“选取常用大宗家种道地的中药材品种,依托《中华人民共和国 药典》标准和药企商业流通标准,制订出一套科学合理的商品规格等级标准,使中药材商业流通质量有据可循。 文件明确提出制(修)订中药材商品规格等级标准。鉴于此,制定了团体标准《中药材商品规格等级—决明子》 (T/CACM 1021.149-2018)。
决明子茶(食品安全企业标准)

决明子茶1范围本标准规定了决明子茶的技术要求、试验方法、检验规则、标志、包装、运输及贮存。
本标准适用于以决明子为原料,经净选、焙炒、破碎、过筛、包装等工序制成的决明子茶。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本标准。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191 包装储运图示标志GB 2760 食品安全国家标准食品添加剂使用标准GB 2761 食品安全国家标准食品中真菌毒素限量GB 2762 食品安全国家标准食品中污染物限量GB 2763 食品安全国家标准食品中农药最大残留限量GB 4789.2 食品安全国家标准食品微生物学检验菌落总数测定GB 4789.3 食品安全国家标准食品微生物学检验大肠菌群计数GB 4789.4 食品安全国家标准食品微生物学检验沙门氏菌检验GB 4789.10 食品安全国家标准食品微生物学检验金黄色葡萄球菌检验GB 4789.15 食品安全国家标准食品微生物学检验霉菌和酵母计数GB 5009.3 食品安全国家标准食品中水分的测定GB 5009.4 食品安全国家标准食品中灰分的测定GB 5009.11 食品安全国家标准食品中总砷及无机砷的测定GB 5009.12 食品安全国家标准食品中铅的测定GB 7718 食品安全国家标准预包装食品标签通则GB 9683 复合食品包装袋卫生标准GB 14881 食品安全国家标准食品生产通用卫生规范GB/T 25436 热封型茶叶滤纸GB 28050 食品安全国家标准预包装食品营养标签通则JJF 1070 定量包装商品净含量计量检验规则《中华人民共和国药典》2015年版一部国家质量监督检验检疫总局令第75号《定量包装商品计量监督管理办法》国家质量监督检验检疫总局令第123号《食品标识管理规定》3技术要求3.1原料要求决明子:应符合《中华人民共和国药典》2015年版一部及GB 2762、GB 2763的规定。
不同商品规格决明子的质量分析

tora and imported Cassia, imported Cassia tora is the lowest.Most of imported Cassia tora and imported Cassia are not up to the standards of pharmacopoeia.Conclusion: Among the different specif ications of Cassia. the quality of Cassia is better than Cas— sia imported. which provides a basis for market regulation and comprehensive quality evaluation.
Quality Evaluation of Cassia with Different Specif icat ions YANG Guoding,ZHANG Luo—qi,CHEN Sui—qing ,WANG Li—li (Pharmacy school,Henan Unwemity of Traditional Chinese Med&ine,Zhengzhou 450046,China)
[Keywords] Cassia;specif ication;aurantio—obtusin;ehrysophanol;rubrofusarin gentiobioside;casside doi:10.13313/j.issn.1673-4890.20171l15004
-DB34T 481-2004 决明种

[地方标准]-DB34T 481-2004决明种子—2004决明种子于2004年10月29日发布实施安徽省质量技术监督局发布的—2004一此前,决明是安徽省主要中药材品种之一,为规范决明种子生产、为管理和保护用户利益,特制定本标准。
本标准由xx质量技术监督局提出。
本标准由安徽省国家农业标准化监测中心起草。
本标准主要起草人:蒋君书、沈青、姚汝嫣、吴启禄、邵梁冬、张和茂。
本标准于2004年10月29日首次发布。
标准股w w w .bzf x w .co本标准规定了决明种子的术语、要求、试验方法、检验规则、标签、包装、储存。
本标准适用于决明子。
2规范性参考文件下列文件中的条款通过引用本标准而成为本标准的条款。
对于注明日期的参考文件,其所有后续修订(不包括勘误)或修订版均不适用于本标准。
但是,鼓励根据本标准达成协议的各方研究是否可以使用这些文件的最新版本。
对于未注明日期的参考文件,最新版本适用于本标准。
GB/T 3543.1-1995农作物种子检验规则通用规定GB/T 3543.2-1995农作物种子检验规则抽样GB/T 3543.3-1995农作物种子检验规则纯度分析GB/T 3543.4-1995农作物种子检验规则发芽试验GB/T 3543.5-1995农作物种子检验规则真实性和品种纯度鉴定GB/T 3543.6-1995农作物种子检验规则水分测定GB/T 3543.7-1995农作物种子检验规则其他项目检验GB 7414-1987主要农作物种子包装GB 7415-1987主要农作物种子储存农作物种子标签3术语3.11000粒重:指1000粒天然干燥决明种子的重量,单位为克(g)。
3.2水分:指干燥种子样品所损失的重量,表示为损失重量与待测样品原始重量的百分比。
3.3种子透明度:指决明子总重量占试样总重量的百分比。
3.4种子活力:指种子的活力或种子胚的活力。
3.5发芽率:指在规定的条件和时间内,正常发芽的种子总数占待测样品总数的百分比。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
起草说明1. 【名称】1.1药材的收集与鉴定取得七组样本:编号1-7。
1-3产地山东、4和7产地江苏、5产地云南、6产地广西。
依据《中药大辞典》(南京中医药大学编著第二版)及《山东省中药材标准》除样本7不符合外其他均鉴定为豆科植物茳芒决明Cassia Sophera L.的干燥成熟种子。
1.2建议名称据《中药大辞典》(南京中医药大学编著第二版)其来源植物为豆科植物茳芒决明Cassia Sophera L.,药用部位为干燥成熟的种子且经常和望江南子混淆混用,望江南子该品种有毒。
定名应准确到种到用药部位,以防混淆,故建议药材名称如下:●药材正名:Cassia Sophera Semen●中文名:茳芒决明子●汉语拼音名:Jiangmangjuemingzi1.3 参考文献[1] 《中药大辞典》(南京中医药大学编著第二版)2168页茳芒、3134页望江南子[2] 《山东省中药材标准》2012年版望江南2. 【来源】2.1原植物简介豆科决明属植物茳芒决明为灌木或半灌木,高1~2m。
分枝多,通常被毛。
偶数羽状复叶,互生,叶柄近基部有1个腺体;托叶卵状披针形,早落;小叶5~10对,叶片卵形、长卵形至椭圆状披针形,长1.7~4.2cm,宽0.7~2cm,先端急尖或短渐尖,基部近圆形,边缘有刺毛,上面绿色,下面被白粉,有臭气。
伞房状总状花序,有少数花,顶生或腋生;花萼筒短,花托状,萼片5,倒卵形或近于圆形;花黄色,花瓣5,直径约2cm,倒卵形;雄蕊10,7枚发育,3枚退化;雌蕊1,子房柄密被白色硬毛,花柱先端弯曲。
荚果近圆筒形,膨胀,边缘棕黄色,中间棕色,长7~9cm,疏生毛。
花期7~9月,果期10~11月【1.2】。
2.2 药用部位茳芒决明的干燥成熟种子【1】。
2.3 采收季节10~11月果实成熟时采收【1.2】。
2.4 资源分布主产于山东、河南、河北、浙江等地【1】。
2.5 产地加工剪下荚果,晒干,取出种子晒干既得【1.2】。
2.6 参考文献[1] 《中药大辞典》(南京中医药大学编著第二版)2168页茳芒[2] 《全国中草药汇编》(卷三)第3版主编王国强408页茳芒决明图2-1 茳芒决明3.【性状】3.1 药材性状鉴定结果检查7组中6组样本,并参考《中药大辞典》(南京中医药大学编著第二版)[1]、《全国中草药汇编》(卷三)第3版[2]、文献报告[3]及材料的描绘做出叙述。
3.2 建议内容本品呈广卵形而扁,直径3~5mm。
表面黄绿色或绿褐色,两表面中央有椭圆形凹斑,偏斜,一端略尖,旁有种脐。
横断面子叶2,桔黄色,近平直。
质坚硬,气微,味微苦。
3.3 参考文献[1] 《中药大辞典》(南京中医药大学编著第二版)2168页茳芒[2] 《全国中草药汇编》(卷三)第3版主编王国强408页茳芒决明[3] 《中草药》第34卷4期2003年4月决明子与混淆品茳芒决明的比较鉴别朱山寅,徐洪杰,徐木根图3-1茳芒决明子外观图4. 【鉴别】4.1 显微鉴别4.1.1 粉末本品粉末黄棕色。
种皮栅状细胞无色或淡黄色,多成片,侧面观细胞1列,呈长方形,长30~50µm,宽约10µm;表面观呈类多角形,壁稍皱缩。
种皮支持细胞无色,表面观呈类圆形,可见环状增厚壁,直径10~35(55)µm;侧面观呈哑铃状。
角质层碎片厚15~20µm,表面观可见网格样纹理。
内胚乳细胞壁黏液化,胞腔内含淡黄色物。
子叶碎片灰色,断面观可见子叶两面均有栅栏组织。
4.1.2 参考文献[1] 《中药大辞典》(南京中医药大学编著第二版)2168页茳芒[2] 《全国中草药汇编》(卷三)第3版主编王国强408页茳芒决明[3] 《中草药》第34卷4期2003年4月决明子与混淆品茳芒决明的比较鉴别朱山寅,徐洪杰,徐木根4.2 薄层色谱鉴别4.2.1 试验方法取供试品粉末0.2g[1],用10%的盐酸甲醇溶液适量湿润,加三氯甲烷10ml,超声30分钟,过滤,滤液作为供试品溶液。
另取望江南子对照药材0.2g,同法制成对照药材溶液。
再取大黄素甲醚对照品,加甲醇制成每1ml含1mg的溶液作为对照品溶液。
经试验不同厂家薄层及不同温度、湿度条件,分离度均符合要求。
对照品:大黄素甲醚(中检院提供,批号:110758-200611含量以97.2%计)温度:25℃相对湿度:45%1 2 3 4 5 6 7 8图 4-1茳芒决明薄层鉴别标准色谱图薄层板:青岛海洋化工厂硅胶G(1-6分别为1-6号检品、7为大黄素甲醚、8为阴性对照)温度:25℃相对湿度:45%1 2 3 4 5 6 7 8图4-2茳芒决明薄层鉴别标准色谱图薄层板:上海东方药品科技实业有限公司硅胶G(1-6分别为1-6号检品、7为大黄素甲醚、8为阴性对照)温度:10℃相对湿度:65%1 2 3 4 5 6 7 8薄层板:青岛海洋化工厂硅胶G(1-6分别为1-6号检品、7为大黄素甲醚、8为阴性对照)温度:40℃相对湿度:65%1 2 3 4 5 6 7 8图4-3不同温度、湿度色谱图薄层板:青岛海洋化工厂硅胶G(1-6分别为1-6号检品、7为大黄素甲醚、8为阴性对照)4.2.2 参考文献[1]《光明中医》2010年3月第25卷第3期河北习用望江南子炮制规范研究付秀英田新刚王永新王立岭沧州市药品检验所5. 【检查】5.1 水分按《中华人民共和国药典》2010年版一部附录 IX H 进行测定,结果见下表:根据测定结果暂定水分限度为:不得过15.0%。
编号 1 2 3 4 5 6 7 8 9 10水分9.59 8.70 9.73 8.27 9.94 9.36 8.64 9.01 8.33 9.27(% W/W)平均8.90相对标准偏差(%)7.05.2 总灰分按《中华人民共和国药典》2010年版一部附录 IX K 进行测定,结果见下表:根据测定结果暂定总灰分限度为:不得过6.0%。
编号 1 2 3 4 5 6 7 8 9 10总灰分 3.614.34(% W/W)平均9.50相对标准偏差(%)17.2编号 1 2 3 4 5 6 7 8 9 10总灰分(%W/W) 3.61 4.34 3.58 4.88 3.28 3.33 4.21 3.77 3.24 3.56异常值无平均值 3.72相对标准偏差(%)16.7最小值 3.28最大值 4.885.3 酸不溶性灰分按《中华人民共和国药典》2010年版一部附录 IX K 进行测定,结果见下表:酸不溶性灰分数值很小故未列此项编号 1 2 3 4 5 6 7 8 9 10酸不溶性灰分(% W/W)0.18 0.23 0.20 0.52 0.18 0.41 0.33 0.25 0.47 0.19异常值无平均值0.30相对标准偏差(%)51.3最小值0.18最大值0.526.【浸出物】按《中华人民共和国药典》2010年版一部附录 X A 项下的冷浸法测定,用乙醇作溶剂行测定,结果见下表:根据测定结果暂定浸出物限度为:不得少于6.0%。
编号 1 2 3 4 5 6 7 8 9 10浸出物10.30 10.10 9.59 12.45 9.50 7.19 7.8911.36 10.31 8.01(% W/W)平均9.50相对标准偏差(%)17.27. 【含量测定】茳芒决明子中含多种蒽醌类化合物,但以大黄素甲醚及其苷为主,因此制定了HPLC 测定大黄素甲醚含量的方法,并做了方法学考察。
样品信息见表7-1。
大黄素甲醚7.1 仪器与试剂高效液相色谱仪:Agilent 1100,Shimadzu LC-2010A色谱柱:Thermo ODS-2 HYPERSIL (5μm 4.6×250mm)Agilent ZORBAX SB-C18 (5μm 4.6×250mm)Shimadzu VP-ODS (5μm 4.6×250mm)Phenomenex Luna 5u C18(2)(5μm 4.6×250mm)电子天平:METTLER TOLEDO XS 105对照品:大黄素甲醚(中检所提供,批号110758-200610 含量以98.6%计、批号110758-200611 含量以97.2%计)试剂:甲醇(色谱纯)、水(去离子水)、磷酸(分析纯)、三氯甲烷(分析纯)、无水乙醇(分析纯)、乙酸乙酯(分析纯)7.2 色谱条件的选定7.2.1 检测波长的选择用流动相配制成适宜浓度的对照品溶液,在220nm~500nm进行扫描。
结果表明在438nm处有最大吸收。
并参照文献[1]确定波长为440nm。
经试验,在440nm波长处目标峰与杂质峰分离良好。
序号峰/谷波长(nm) Abs 注释1 峰438.00 0.2547.2.2 流动相、柱长、柱温的选择流动相据参考文献[1]调整为甲醇-0.1%磷酸溶液(76:24)。
柱长选用我室常用的4.6×250mm。
柱温为30℃。
7.3 供试品溶液制备条件的选择参考中国药典2010年版一部第135页,决明子含量项下提取方法。
7.4含量测定方法按《中华人民共和国药典》2010年版一部(附录ⅥD)测定[2]。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇为流动相A,以0.1%磷酸溶液为流动相B,按下表中的规定进行梯度洗脱;检测波长为440nm。
理论板数按大黄素甲醚峰计算应不低于3000。
时间(分钟) 流动相A(%) 流动相B(%)0~30 76 2430~60 100 060~75 76 24对照品溶液的制备取大黄素甲醚对照品适量,精密称定,加无水乙醇-乙酸乙酯(2:1)混合溶液制成每1ml含大黄素甲醚10μg的混合溶液,即得。
供试品溶液的制备取本品粉末(过三号筛)约0.1g,精密称定,置具塞锥形瓶中,精密加入甲醇50ml,称定重量,加热回流2小时,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液25ml,蒸干,加稀盐酸30ml,置水浴中加热水解1小时,立即冷却,用三氯甲烷振摇提取4次,每次30ml,合并三氯甲烷液,回收溶剂至干,残渣用无水乙醇-乙酸乙酯(2:1)混合溶液使溶解,转移至20ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
测定法 分别精密吸取对照品溶液与供试品镕液各10μl ,注入液相色谱仪,测定,即得。
7.5 方法学考察7.5.1 专属性考察 取对照品溶液、供试品溶液,按上述色谱条件测定,并用二极管阵列检测器对峰纯度进行测试,图谱见第 页,表明其他成分不干扰被测成分的测定。
7.5.2 线性关系考察对照品溶液的制备方法:取大黄素甲醚对照品(中检所提供,批号110758-200610 含量以98.6%计),精密称取0.01080g 置100ml 量瓶中,加无水乙醇-乙酸乙酯(2:1)混合溶液使溶解,加无水乙醇-乙酸乙酯(2:1)混合溶液至刻度,摇匀,精密量取2ml 置20ml 量瓶中,加无水乙醇-乙酸乙酯(2:1)混合溶液至刻度,摇匀。
