【高中化学】烃和卤代烃知识点总结(二)
高三烃卤代烃知识点

高三烃卤代烃知识点烃类化合物是由碳和氢构成的有机化合物,是有机化学的基础。
而在高三化学中,烃与卤化烃是重要的研究内容。
本文将围绕高三烃卤代烃的知识点进行论述,包括基本概念、命名化合物、性质及应用等方面。
1. 烃的基本概念及分类烃是由碳和氢原子构成的有机化合物。
根据碳原子之间的连接方式,烃可以分为饱和烃和不饱和烃两类。
饱和烃含有碳—碳单键,不饱和烃则包含碳—碳双键或者三键。
2. 卤代烃的基本概念及命名方法卤代烃是烃类化合物中,由卤素取代了一个或多个氢原子的化合物。
根据卤素的取代位置和数量,卤代烃可分为氯代烃、溴代烃和碘代烃。
命名卤代烃时,需要根据取代位置和数量进行命名,同时需遵循一定的规则,如按字母顺序排序、标注卤素取代位置等。
3. 高三烃卤代烃的性质(1)燃烧性质:烃和卤代烃都是易燃物质,燃烧产生二氧化碳和水。
(2)溶解性质:烃和卤代烃具有不同的溶解度,烃通常不溶于水,而卤代烃可以在水中溶解,但不稳定。
(3)反应性质:烃与卤化烃具有不同的反应性质,如烃可以发生烷基化反应,而卤化烃则容易发生亲核取代反应等。
4. 高三烃卤代烃的合成方法(1)烃的合成方法:烃可以通过裂解、脱水、加氢等方法合成。
(2)卤代烃的合成方法:卤代烃可以通过烃与卤化试剂反应得到,反应条件一般要求在紫外光或者加热条件下进行。
5. 高三烃卤代烃的应用(1)燃料:烃是重要的燃料来源,如石油中的烃类化合物可用于石油化工及能源生产。
(2)化工原料:卤代烃广泛应用于有机合成中,如溴代烷可用于制备溴代物、溴化物等化合物。
(3)医药领域:烃类及卤代烃在医药领域有广泛应用,如乙烷可作为麻醉剂,氟代烃可用于制备抗生素等。
本文主要针对高三烃卤代烃的知识点进行了介绍,包括基本概念、命名方法、性质、合成方法及应用等方面。
通过对烃卤代烃的深入学习,有助于提升高三化学的基础理论知识水平,为学生更好地理解和应用有机化学提供有力支持。
高中化学 第二章 烃和卤代烃 重难点一 饱和烃和不饱和
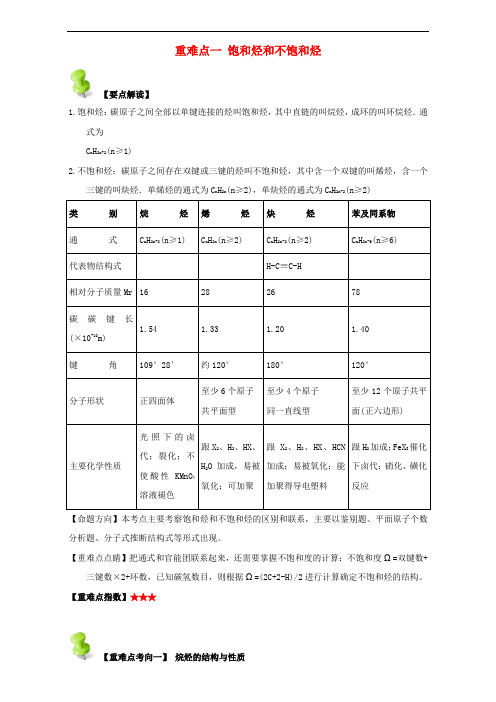
重难点一 饱和烃和不饱和烃【要点解读】1.饱和烃:碳原子之间全部以单键连接的烃叫饱和烃,其中直链的叫烷烃,成环的叫环烷烃.通式为 C n H 2n+2(n≥1)2.不饱和烃:碳原子之间存在双键或三键的烃叫不饱和烃,其中含一个双键的叫烯烃,含一个三键的叫炔烃.单烯烃的通式为C n H 2n (n≥2),单炔烃的通式为C n H 2n-2(n≥2)【命题方向】本考点主要考察饱和烃和不饱和烃的区别和联系,主要以鉴别题、平面原子个数分析题、分子式推断结构式等形式出现。
【重难点点睛】把通式和官能团联系起来,还需要掌握不饱和度的计算:不饱和度Ω=双键数+三键数×2+环数,已知碳氢数目,则根据Ω=(2C+2-H)/2进行计算确定不饱和烃的结构。
【重难点指数】★★★【重难点考向一】 烷烃的结构与性质【例1】下列关于戊烷的说法正确的是( )A.分子中的碳原子在一条直线上B.其一氯代物共有8种C.能与溴水发生取代反应D.同分异构体有2种【答案】B【重难点点睛】考查戊烷的有关知识,侧重考查戊烷的结构、同分异构体的判断,题目难度不大,根据等效氢原子,最后根据氢原子的种类确定一氯代物的种类,确定烃的同分异构体是解本题的关键;烷烃同分异构体书写方法:先写最长链,然后从最长链减少一个碳原子作为取代基,在剩余的碳链上连接,即主链由长到短,支链由整到散,位置由中心排向两边,戊烷的同分异构体有3种。
【重难点考向二】不饱和烃的结构与性质【例2】能说明某烃分子里含有碳碳不饱和键的叙述中正确的是( )A.分子组成中含碳氢原子数比为1:2B.完成燃烧生产等物质的量的CO2和H2OC.能与溴加成反应而使溴水褪色,还能使KMnO4酸性溶液褪色D.空气中燃烧能产生黑烟【答案】C【解析】A.环烷烃中含碳氢原子数比为1:2,但不含有不饱和键,故A错误;B.完成燃烧生产等物质的量的CO2和H2O,只能说明该烃中C、H原子比为1:2,该烃可能是环烷烃、烯烃,故B错误;C.不饱和键既能与溴发生加成反应,又能被酸性高锰酸钾溶液氧化,故C正确;D.燃烧产生黑烟只能说明没有充分燃烧或含碳量高,不能说明含有碳碳不饱和键,故D错误;故选C。
高中化学选修5第二章_烃和卤代烃(复习课)

催化剂
+ 3H2
Δ
H2 C H2 C C H2
CH2 CH2
3、消去反应:有机物在一定条件下,从一个分子 中脱去一个小分子(如:H2O、HX、NH3等)生 成不饱和化合物的反应(消去小分子)。
C2H5Br + NaOH
CH2=CH2 + NaBr +H2O
2012-9-11 34
反应:
NaOH CH3CH2Br + HOH △ CH3CH2OH + HBr
NaOH+HBr=NaBr+H2O
CH3CH2Br + NaOH CH3CH2OH + NaBr 水解反应 AgNO3+NaBr=AgBr↓+NaNO3 取代反应
△
C2H5Br与NaOH的醇溶液共热实验的注意事项: 1.反应物: 溴乙烷+氢氧化钠的醇溶液; 2.反应条件:共热 3.反应方程式
2.各类烃及卤代烃的结构特点和化学性质
分类 烷烃 烯烃(环烷烃) 通式 官能团 特点: C—C 一个C=C 化学性质
CnH2n+2 CnH2n (n≥2)
稳定,取代、氧化、 裂化
加成、加聚、氧化
炔烃(二烯烃)
苯及其同系物
CnH2n-2
(n≥2) CnH2n-6 (n≥6)
CnH2n+1X
一个C≡C
1、烃的物理性质: ①密度:所有烃的密度都比水小 ②状态:常温下,碳原子数小于等于4的气态 ③熔沸点:碳原子数越多,熔、沸点越高 ; 碳原子数相同,支链越多,熔沸点越低; ④含碳量规律: 烷烃<烯烃<炔烃<苯的同系物 烷烃(CnH2n+2):随n值增大,含碳量增大 烯烃(CnH2n) :n值增大,碳的含量为定值; 炔烃(CnH2n-2) :随n值增大,含碳量减小 苯及其同系物:(CnH2n-6):随n值增大含碳量减小
高二化学选修五第二章2.3卤代烃知识点总结大全

1、卤代烃(属于烃的衍生物)(1)定义:烃分子中的氢原子被卤素原子取代后所生成的化合物,通式为R-X,官能团是-X。
饱和一卤代烃通式:C n H2n+1X(2)分类:按分子中所含卤素原子种类的不同,分为氟代烃、氯代烃、溴代烃、碘代烃。
(3)物理性质:①状态:常温下,大多数卤代烃为液体或固体。
(CH3Cl为气体)②溶解性:卤代烃都不溶于水,能溶于大多数有机溶剂,某些卤代烃自身就是很好的有机溶剂。
③熔沸点:随碳原子数的增加而升高。
④密度:随碳原子数的增加而降低,除一氟代烃和一氯代烃比水轻外,其余卤代烃都比水重。
注:卤代烃分子中不一定含有H原子。
如CCl4、F2C=CF2等2、溴乙烷A. 分子组成和结构名称分子式结构式结构简式官能团球棍模型比例模型溴乙烷C2H5Br CH3CH2Br—BrB. 物理性质颜色状态沸点密度溶解性无色液体38O CρC2H5Br>ρH2O不溶于水,易溶于有机溶剂C. 化学性质溴乙烷化学性质稳定,一般不会被酸性高锰酸钾、溴水等强氧化剂氧化。
但能与NaOH水溶液、NaOH醇溶液发生反应。
(1)水解反应(取代反应)溴乙烷与NaOH水溶液的反应:(2)消去反应:有机物在一定条件下,从一个分子中相邻的两个碳原子上脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键化合物的反应。
溴乙烷与NaOH的乙醇溶液反应:3、卤代烃的水解反应与消去反应A. 取代(水解)反应(1)反应条件:强碱的水溶液、加热。
(2)反应本质:卤代烃分子中的—X被水分子中的—OH 所取代:RCH 2X+NaOHRCH 2OH+NaX (X 表示卤素原子)2H O △(3)反应规律:所有的卤代烃在强碱(如NaOH )的水溶液中加热均能发生取代(水解)反应。
B. 消去反应(1)反应条件:强碱的醇溶液、加热。
(2)反应本质:相邻的两个碳原子间脱去小分子HX :CH 3CH 2X+NaOHCH 2=CH 2↑+NaX+H 2O (X 表示卤素原子)乙醇△(3)反应规律:①没有邻位碳原子的卤代烃不能发生消去反应,如CH 3Cl 。
高考化学第11章(有机化学基础)第2节烃和卤代烃考点(2)芳香烃的结构与性质讲与练(含解析)

第十一章有机化学基础李仕才第二节烃和卤代烃考点二芳香烃的结构与性质1.苯和苯的同系物的结构比较2.苯和苯的同系物的主要化学性质苯的化学性质:易取代,能加成,难氧化;苯的同系物的化学性质:易取代,能加成,能氧化。
(1)取代反应。
①硝化反应。
a.苯的硝化反应:b.甲苯的硝化反应:上述反应中浓硫酸的作用是催化剂和吸水剂,硝基苯是一种具有苦杏仁气味、密度比水大、不溶于水的油状液体,2,4,6三硝基甲苯俗称为TNT。
②卤代反应。
a.苯与液溴的取代反应:b.对二甲苯与液溴(FeBr3作催化剂)的取代反应,写出生成一溴代物的化学方程式:c.对二甲苯与氯气(光照条件)的取代反应,写出生成一氯代物的化学方程式:苯的同系物与卤素单质发生取代反应时,反应条件不同,取代的位置不同,在光照条件下,苯环的侧链发生取代反应,在三卤化铁催化下,发生苯环上的取代反应。
③加成反应。
a.苯与氢气的加成反应:b.甲苯与氢气的加成反应:④氧化反应。
苯和苯的同系物均可燃烧,苯不能使酸性KMnO4溶液褪色,但苯的同系物能使酸性KMnO4溶液褪色。
甲苯被酸性KMnO4溶液氧化的反应表示为3.芳香烃(1)芳香烃:分子里含有一个或多个苯环的烃。
(2)芳香烃在生产、生活中的作用:苯、甲苯、二甲苯、乙苯等芳香烃都是重要的有机化工原料,苯还是一种重要的有机溶剂。
(3)芳香烃对环境、健康产生影响:油漆、涂料、复合地板等装饰材料会挥发出苯等有毒有机物,秸秆、树叶等物质不完全燃烧形成的烟雾和香烟的烟雾中含有较多的芳香烃,对环境、健康产生不利影响。
4.苯的同系物的同分异构体(1)C8H10。
(2)C9H12。
①丙苯类:、;②甲乙苯类:、、;③三甲苯类:、、。
判断正误(正确的打“√”,错误的打“×”)1.苯不具有典型的双键所具有的加成反应的性质,故不可能发生加成反应。
( ×)2.C2H2和的最简式相同。
( ×)3.乙烯和苯都能使溴水褪色,褪色的原因相同。
高三卤代烃知识点总结

高三卤代烃知识点总结高三化学课程中,烃类化合物是一个重要的内容。
其中,卤代烃作为一类特殊的有机化合物,具有独特的性质和应用。
下面将对高三卤代烃的相关知识点进行总结。
一、卤代烃的定义和特点卤代烃是由氢原子被卤素取代的烃类化合物,通式为C_nH_(2n+1)X,其中X代表卤素。
卤代烃的物理性质与烃类相似,但化学性质却有很大差异。
它们含有高电负性的卤素原子,因此具有一系列特殊的化学反应。
二、卤代烃的命名方法卤代烃的命名主要分为两个方面。
一是命名其碳链的长度,二是命名卤素的种类和数量。
例如,对于氯代烷烃,我们通常采用“氯+烷烃碳数+烷”的方式进行命名。
如氯代丙烷为1-氯丙烷,二氯代丙烷为1,2-二氯丙烷。
同时,在命名中还需要注意立体异构体和官能团的存在。
三、卤代烃的制备方法卤代烃的制备方法有多种,常见的包括:1. 单质卤素与烃反应,如氯化亚甲与甲烷反应得到氯代甲烷。
2. 醇与卤化酰反应,如醇与氯化亚磷反应得到氯代醇。
3. 卤化酰与酸反应,如酸与溴化亚砷反应得到酰溴。
4. 生成物与卤素反应,如氯代乙烷与银盐反应得到氯代银。
四、卤代烃的性质和反应卤代烃具有许多特殊的性质和反应,包括:1. 氢卤酸的生成:卤代烃与水反应生成相应的氢卤酸。
例如,氯代甲烷与水反应生成盐酸。
2. 亲核取代反应:由于卤素的电负性,卤代烃容易发生亲核取代反应。
如氯代甲烷与氢氧根离子反应生成甲醇。
3. 消除反应:卤代烃在碱性条件下会发生消除反应,生成烯烃。
如氯代乙烷在浓氢氧化钠溶液中生成乙烯。
4. 光解反应:卤代烃在紫外光的作用下发生断裂反应,生成卤素和烯烃。
如氯代甲烷在紫外光作用下生成氯气和甲烯。
五、卤代烃的应用卤代烃在生产和科学研究中具有广泛的应用。
它们可以用于有机合成、溶剂、药物制造等方面。
同时,由于卤代烃具有较高的毒性和环境污染性,也需要注意正确使用和处理。
总结:在高三化学课程中,学习卤代烃的相关知识是非常重要的。
需要掌握卤代烃的定义、命名方法、制备方法、性质和反应以及应用等内容。
烃和卤代烃高考知识点
烃和卤代烃高考知识点在高考化学中,烃和卤代烃是两个重要的知识点。
烃是由碳氢化合物组成的有机化合物,而卤代烃则是在烃的基础上,通过取代反应将氢原子替代成卤素原子的化合物。
烃的分类主要有饱和烃和不饱和烃两种。
饱和烃分子中碳原子之间是通过单键连接的,而不饱和烃分子中则存在双键或三键。
最简单的烃是甲烷,它是一种饱和烃,由一个碳原子和四个氢原子组成。
烷烃是一类饱和烃,它的分子由碳原子链构成,两端都有氢原子。
乙烷、丙烷和正戊烷都是烷烃的例子。
烷烃的特点是它们比较稳定,难以与其他物质发生反应。
不饱和烃分为烯烃和炔烃两大类。
烯烃的分子中有一个或多个双键,而炔烃的分子中则有一个或多个三键。
乙烯和丙烯是烯烃的例子,而乙炔是一个炔烃。
卤代烃是在烃的基础上,通过取代反应将氢原子替代成卤素原子的化合物。
最常见的卤代烃是氯代烷,如氯甲烷和氯乙烷。
卤代烃的命名方法是根据取代的卤素原子的原子量来命名的。
如氯乙烷的命名,其中氯代表取代的卤素是氯,乙代表所取代的碳原子数目为2。
在进行化学实验中,我们经常会遇到燃烧实验,用来判断化合物的燃烧性质。
烃在通氧气时,会发生燃烧反应,生成二氧化碳和水。
燃烧反应是一种氧化反应,在此过程中,烃中的碳原子与氧气结合形成二氧化碳,氢原子与氧气结合形成水。
此外,烃还可以通过加氢反应和脱氢反应来进行化学转化。
在加氢反应中,烯烃或炔烃可以被氢气还原为对应的烷烃。
而在脱氢反应中,烷烃可以通过去除氢原子的方式转化为烯烃或炔烃。
卤代烃的化学反应也是高考化学的重要内容之一。
卤代烃与氢氧根离子(OH-)反应可以生成醇。
这个反应叫做亲核取代反应,在此反应中,氢氧根离子取代了卤素原子。
此外,这些化合物还可以通过取代反应来合成其他化合物。
例如,酯是由醇和羧酸反应生成的,而醇可以由卤代烃和氢氧根离子反应得到。
这些化合物的反应是有机合成中常见的反应,为有机化学的研究和应用提供了基础。
在考试中,对于烃和卤代烃的理解和运用是十分重要的。
高中化学【卤代烃]
芳香烃和卤代烃
知识点二 卤代烃的结构 与性质
考必备•清单
1.卤代烃的概念 (1)卤代烃是烃分子里的氢原子被__卤__素__原__子__取代后生成的化
合物。通式可表示为 R—X(其中 R—表示烃基)。 (2)官能团是__—__X__。
2.卤代烃的物理性质
高
难
易溶
小
大
3.卤代烃的化学性质 (1)消去反应的规律 ①官能团(-OH或-X)②β-H
①两类卤代烃不能发生消去反应
结构特点
实例
与卤素原子相连的碳没有邻位 碳原子
CH3Cl
与卤素原子相连的碳有邻位碳 原子,但邻位碳原子上无氢原子
②有两种或三种邻位碳原子,且碳原子上均带有氢原子时,发 生消去反应可生成不同的产物。例如:
(或 CH3—CH===CH—CH3)+NaCl+H2O
(2)卤代烃水解反应和消去反应比较
有卤代烃都能发生消去反应,如 CH3Cl、 生消去反应。
不能发
②并不是所有卤代烃发生水解反应后都生成醇,如
水解后生成
水解后生成
③有些二元卤代烃发生消去反应后能引入碳碳三键,如:
④结构不对称的卤代烃发生消去反应时,一般先消去含氢较少 的邻位碳上的氢,可生成不同的不饱和烃。 ⑤一氯代苯不能发生消去反应。
6.卤代烃在有机合成中的应用 (1)连接烃和烃的衍生物
(2)改变官能团的个数 如 CH3CH2Br醇―Na,―O→△H CH2===CH2―B―r2→CH2BrCH2Br (3)改变官能团的位置
(4)进行官能团的保护 如在氧化 CH2===CHCH2OH 的羟基时,碳碳双键易被氧化, 常采用下列方法保护:
可以通过烷烃、芳香烃、醇与卤素单质或卤化氢发生取代反 应制得。
高二化学第二章知识点总结
第2章烃和卤代烃一.各类烃的结构特点及物理性质含有键CH===CH1甲烷(烷烃通式:C n H2n+2)(1)氧化反应甲烷的燃烧:CH4+2O2点燃CO2+2H2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH4+Cl光照3Cl(一氯甲烷)+HClCH3Cl+Cl光照2Cl2(二氯甲烷)+HClCH2Cl2+Cl光照3(三氯甲烷)+HCl(CHCl3又叫氯仿)CHCl3+Cl光照4(四氯化碳)+HCl取代1 mol氢原子,消耗1 mol氯分子。
(3)分解反应图乙烯的制取甲烷分解:CH高温22. 乙烯(烯烃通式:C n H2n)=CH2↑+H2O(消去反应)乙烯的制取:CH3CH2浓硫酸170℃2(1)氧化反应乙烯的燃烧:CH2=CH2+3O点燃2+2H2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH2=CH2+Br2Br—CH2Br与氢气加成:CH2=CH2+H2催化剂CH3CH3与氯化氢加成:CH2=CH2+HCl催化剂CH3CH2Cl与水加成:CH2=CH2+H2O催化剂CH3CH2OH马氏规则:当不对称烯烃与卤化氢加成时,通常氢加到含氢最多的不饱和碳原子一侧。
(3)聚合反应乙烯加聚,生成聚乙烯:n CH2=CH2催化剂[CH2—CH2 ] n(4)1,3-丁二烯与溴完全加成:CH2=CH-CH=CH2+2Br CH2Br-CHBr-CHBr-CH2Br 与溴1,2-加成:CH2=CH-CH=CH2+Br CH2Br-CHBr-CH=CH2与溴1,4-加成:CH2=CH-CH=CH2+Br CH2Br-CH=CH-CH2Br(5)烯烃的顺反异构(a)并不是所有的烯烃都存在顺反异构,只有当双键两端的同一碳原子上连接不同的原子或原子团时烯烃才存在顺反异构。
(b)判断烯烃是否存在顺反异构的方法:①分子中有碳碳双键;②双键两端的同一碳原子上不能连接相同的基团。
高中卤代烃基础知识点总结
高中卤代烃基础知识点总结一、卤代烃的基本概念1.1 卤代烃的定义卤代烃是一类有机化合物,其分子中含有卤素原子(如氟、氯、溴、碘等)取代了碳氢化合物中的氢原子。
卤代烃通常可分为有机氟化合物、有机氯化合物、有机溴化合物和有机碘化合物等。
1.2 卤代烃的命名卤代烃的命名采用通用的IUPAC命名法。
以氯代烷为例,其命名规则为先按分子中碳原子数确定烷烃的根,然后在根后加上前缀代表卤素的名称,并在根名前用数字表示卤素取代位置。
例如,1-氯丙烷表示在丙烷分子中的第一个碳原子上有一个氯原子。
1.3 卤代烃的结构卤代烃分子结构中包含碳、氢和卤素元素,卤素原子通常取代碳链中的氢原子。
卤代烃的结构可以是直链烷基、支链烷基、环烷基或者芳香烃基等。
二、卤代烃的性质2.1 物理性质卤代烃大部分为无色液体,有些卤代烃也为无色固体。
它们的密度大多大于水,且有较大的折射率。
在室温下,氯仿和四氯化碳属于该类。
一般情况下,卤代烃的沸点较高,而蒸气密度较大。
2.2 化学性质(1)亲电取代反应卤代烃中的卤素对碳原子的取代性能是亲电性的。
当卤代烃与亲电试剂(如氢氧根离子、醇、醚、酮、胺等)接触时,卤素会被亲电试剂取代,产生相应的化合物。
(2)消除反应卤代烃受热时会发生β-消除反应,生成烯烃。
在碱性条件下,卤代烃也能发生消除反应,生成烯烃和相应的卤化银。
(3)还原反应卤代烃的卤素可以被金属直接还原,生成相应的卤化金属和亚硫酸盐。
氢气可以还原卤代烃生成烃。
(4)重排反应卤代烃分子中的卤素原子在环境条件变化下,有时会发生重排反应,产生不同结构的同分异构体化合物。
2.3 化学稳定性卤代烃的碳-卤键是比较稳定的,一般情况下,不会被强酸、强碱和氧化剂等化学试剂破坏。
但在高温、紫外辐射的条件下会发生碳-卤键裂解,生成卤素自由基或释放卤素原子。
三、卤代烃的制备3.1 卤代烃的适用范围卤代烃在有机合成中具有广泛的应用,可用于合成医药品、染料、香料、润滑剂等。
