2019届高考化学二轮复习(浙江专用)元素与物质推断专题卷
浙江省金丽衢十二校2019届高三第二次联考化学试题及答案

浙江省金丽衢十二校2019届高三第二次联考化学试题及答案一、方案一:可用KMn04溶液进行氧化还原滴定。
在配制100mL 1.00 x 10 - 2 mol·L-1的 KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___________(填仪器名称)。
在配制过程中,下列说法正确的是____________(填序号字母)。
A. KMnO4溶于水不放热,可以直接在容量瓶中溶解B.容量瓶洗涤后不需干燥即可直接用于实验C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平D.如果定容时加水超过刻度线必须毓配制、II.方案二:将FeS04· 7H20最终转化为Fe2 03,测定质量变化,操作流程如下:①步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量。
②假设实验过程中Fe无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示)。
③若步骤③加人X溶液的量不足,则最后测出每片补血剂含铁元素的质量将______(填“偏大,’.“偏小”或“不变”)。
29.(14分)芳香烃X是一种重要的有机化工原料,其摩尔质量为92g·mol一1,某课题小组以它为原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。
已知A是一氯代物,H是一种功能高分子,链节组成为C7 H5 NO。
已知:回答下列问题:(1)对于阿司匹林,下列说法正确的是_______A.是乙酸的同系物B.能发生醋化反应C.1 mol阿司匹林最多能消耗2mmol Na0HD.不能发生加成反应(2)H的结构简式是,F→G的反应类型是_______(3)写出C→D的化学方程式_______(4)写出符合下列条件的的同分异构体的结构简式_______。
(写出2种)①属于芳香族化合物,且能发生银镜反应;②核磁共振氢谱图中峰面积之比为1 :2:2:1③分子中有2个羟基(5)以A为原料可合成,请设计合成路线,要求不超过4步(无机试剂任选)。
浙江省学选考化学2019届高三二轮复习27题对题复习课件(15张)

2、特征反应现象 【讲义4】为探究无机盐X(仅含三种短周期元素) 的组成和性质,设计并完成如下实验:请回答:
n(SiO2)=0.03mol
n(Mg(OH)2)=0.06mol (3)高温条件下白色粉末与焦炭发生置换反应, 写出该反应的化学方程式______
高温
SiO2+2C==Si+2CO
注意几个特殊的置换反应: 1.金属 盐 金属 盐
【例3】(2018年4月)某同学用含结晶水的正盐X(四种短 周期元素组成的纯净物)进行了如下实验:
n(H2O)=0.05mol
n(HCl)=0.02mol n(MgO)=0.01mol
实验中观测到:混合气甲呈无色并被蒸馏水全部吸收; 固体乙为纯净物;在步骤③中,取1/10溶液丙,恰好中 和需消耗0.00200 mol NaOH;另取一定量的溶液丙,
n(SO3)=0.1mol
第2题和讲义第五题
n(Cu2O)=0.2mo
取一定量的浅绿色盐X进行上述实验,充分反应后得到 23.3 g白色沉淀E、28.8 g红色固体G和12.8 g红色固体H。
①浅绿色盐X在570 ℃、隔绝空气条件下受热分解为 非氧化还原反应;
②常温下B呈液态且1个B分子含有10个电子。
4KI+O2+2H2O
2I2+4KOH
。
(2)在通气良好的土壤中,土壤中NH4+的氧化途径
之一是在硝酸细菌作用下完成,写出反应的离子方程
式
NH4++2O2
硝酸细菌
NO3-+H2O+2H+。
(3)工业上一般采用电解(惰性电极)K2MnO4溶
液制KMnO4,写出电解总反应方程式
2019高考全国Ⅱ卷化学试题(解析版)

2019年高考全国卷II化学试题解析7.“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是()A.蚕丝的主要成分是蛋白质B.蚕丝属于天然高分子材料C.“蜡炬成灰”过程中发生了氧化反应D.古代的蜡是高级脂肪酸酯,属于高分子聚合物【答案】D【解析】蚕丝的主要成分为蛋白质,而蛋白质是高分子,蚕丝属于天然纤维,因此A、B正确。
蜡烛的主要成分是烃,在燃烧过程中发生了氧化反应,因此C正确。
蜡是烃(碳氢化合物),不属于高级脂肪酸酯,也不是高分子聚合物,因此D错误。
此题精选古代诗句的有关情景,与前几年高考题相映成辉,体现了传承精神,考查了油脂,蛋白质,石油分馏产物的概念和性质,属于较容易题目。
8.已知N A是阿伏伽德罗常数的值,下列说法错误的是()A.3g3He含有的中子数为1N AB.1 L 0.1mol·L-1磷酸钠溶液含有的PO43-数目为0.1N AC.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N AD.48g正丁烷和10g异丁烷的混合物中共价键数目为13N A【答案】B【解析】3g3He为1 mol质量数为3,质子数为2,中子数为1,因此1mol3He的中子数为1N A,因此A正确。
磷酸钠溶液中PO43-要水解,因此PO43-数目应小于0.1N A,根据物料守恒知N(PO43-)+N(HPO42-)+N(H2PO4-)=0.1N A,因此B错误。
K2Cr2O7中Cr元素为+6价,因此1 mol K2Cr2O7被还原为Cr3+转移的电子数为3×2N A=6N A,因此C正确。
48g正丁烷为48/58mol,10g异丁烷为10/58mol,无论正丁烷还是异丁烷共价键数均为13,因此该混合物共价键数目为13N A,因此D正确。
阿伏伽德罗常数作为化学中常用的基本物理常数,是高考永恒不变的话题,本题综合考查原子结构,盐类水解,氧化还原,化学键的知识,涵盖了高中化学部分核心知识,属于容易题目。
(浙江选考)2019高考化学二轮增分策略27题专练金属及其化合物的框图推断课件

H2SO3+H2O2===H2SO4+H2O。
解析 答案
(3)化合物X与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶
+=== Fe S + 6H 3 4 物和一种臭鸡蛋气味气体,请写出该反应的离子方程式:________________
3Fe2++S↓+3H2S↑ 。 ____________________
解析 化合物Fe3S4与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不
溶物和一种臭鸡蛋气味气体,说明反应产物为Fe2+、S和H2S,根据得失电子守恒
和原子守恒,该反应的离子方程式为Fe3S4+6H+===3Fe2++S↓+3H2S↑。
解析 答案
以通过如下反应和相应的数据推知它的化学式。其中A~J是中学化学中的常
见物质,G是一种红褐色固体,D是一种难溶于水的含氧酸,J是一种主要的温
室气体,A为强碱,其焰色反应呈黄色,E和B分别与酸化的硝酸银溶液反应时
的实验现象相同,均有白色沉淀产生,流程中的部分生成物已略去。
回答下列问题:
(1)A的电子式:_______________。
解析 H→G的化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。
解析
答案
3.(2018· 温州市高三选考适应性测试)为探究液体X[仅含两种元素,100 g· mol-1 <M(X)<200 g· mol-1]的组成和性质,设计并完成如下实验:
请回答:
S2Cl2 。 (1)化合物X的化学式为______
解析
答案
Fe2SiO4(或2FeO· SiO2) 。 (2)铁橄榄石的化学式:_____________________
解析 铁橄榄石的化学式为2FeO· SiO2。
2019届高考化学二轮复习浙江选考化学真题专项训练题组(第27题)
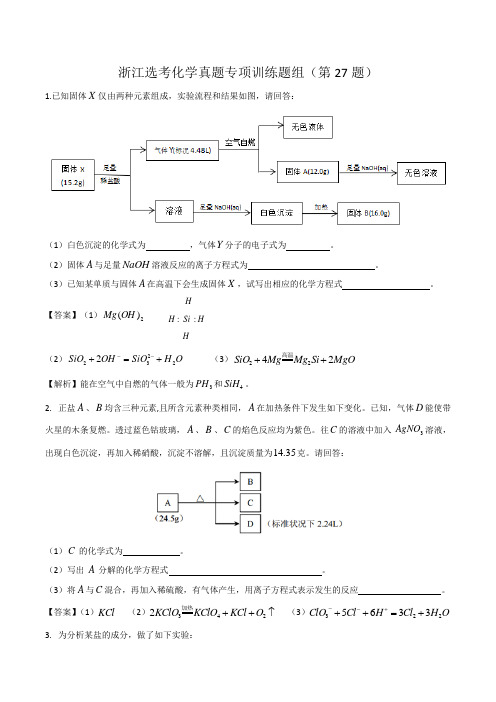
浙江选考化学真题专项训练题组(第27题)1.已知固体X 仅由两种元素组成,实验流程和结果如图,请回答:(1)白色沉淀的化学式为 ,气体Y 分子的电子式为 。
(2)固体A 与足量NaOH 溶液反应的离子方程式为 。
(3)已知某单质与固体A 在高温下会生成固体X ,试写出相应的化学方程式 。
【答案】(1)2)(OH Mg HH Si H H::....(2)O H SiO OH SiO 22322+=+-- (3)MgO Si Mg Mg SiO 2422++高温【解析】能在空气中自燃的气体一般为3PH 和4SiH 。
2. 正盐A 、B 均含三种元素,且所含元素种类相同,A 在加热条件下发生如下变化。
已知,气体D 能使带火星的木条复燃。
透过蓝色钴玻璃,A 、B 、C 的焰色反应均为紫色。
往C 的溶液中加入 3AgNO 溶液,出现白色沉淀,再加入稀硝酸,沉淀不溶解,且沉淀质量为35.14克。
请回答:(1)C 的化学式为 。
(2)写出 A 分解的化学方程式 。
(3)将A 与C 混合,再加入稀硫酸,有气体产生,用离子方程式表示发生的反应 。
【答案】(1)KCl (2)↑++2432O KCl KClO KClO 加热 (3)O H Cl H Cl ClO 2233365+=+++--3. 为分析某盐的成分,做了如下实验:请回答:(1)盐 M 的化学式是 ;(2)被NaOH 吸收的气体的电子式 ;(3)向溶液A 中通入S H 2气体,有淡黄色沉淀产生,写出反应的离子方程式 (不考虑空气的影响)。
【答案】(1)34)(ClO Fe (2)⋅⋅⋅⋅⋅⋅⋅⋅:::Cl Cl (3)↓++=++++S H Fe S H Fe 2222234. 为探究矿石样品A (仅含两种元素)的组成和性质,设计并完成如下实验:已知:溶液D 中只含一种金属阳离子,与铁粉充分反应后固体质量减少g 14。
请回答:(1)样品A 的化学式为 。
(浙江选考)2019版高考化学-考前提升训练26-元素与物质推断(第27题)

提升训练26元素与物质推断(第27题)1. (2018 •学军中学模拟)探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验请回答:(1) X 的化学式是____________________ 。
(2) 白色粉末溶于氢氧化钠溶液的离子方程式是 ______________________________________________ 。
(3) 白色沉淀用途广泛,请列举一例: _______________ 。
2. 某新型无机材料 AM 由两种非金属元素组成,元素M 位于第二周期第VA 族。
D E 、H 均为难溶于 水的白色固体,化合物C E 均含A 元素。
其余物质均为中学化学中的常见物质。
单康A「口务詐些壘蚯化回■S 1扁娜野廉•回1呱回—»*i请回答:(1) 写出H 的化学式: _________________ 。
(2) 化合物AM 中含有的化学键类型为 _______________________ 。
(3) 写出反应②的离子方程式 : ____________________________________________ 。
3.为了探究不溶性盐 X (仅含5种元素)的组成和性质,设计并完成如下实验(所加试剂均过量,气体体积均在标准状况下测定)。
请回答:(1) X 的组成元素为 H 0和 _______________ (用元素符号表示),气体C 的电子式 为 _______________ 。
(2) 写出反应①的离子方程式 : _______________________________________________ 。
4.为探究含结晶水的化合物 X(含四种元素,摩尔质量为180 g • mol -1)的组成和性质,某兴趣小组设 计并完成如下实验:白啊粧充鲫毎白也怜底些墮1无色X 帆 20 £)iJ^NaOH丸色辭薩一*请回答:(1) 黑色固体Y的化学式为_________ ,气体C的电子式为________________ 。
2019浙江宁波市二月高三联考理综化学试卷

2019浙江宁波市二月高三联考理综化学试卷可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Cu 64 Zn 65第Ⅰ卷一、选择题:本题共7个小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7、化学与生产、生活密切相关,下列有关叙述正确的是()A.在生产、生活中要尽量利用释放能量的反应,避免吸收能量的反应发生B.PM2.5、二氧化碳都属于空气质量日报的内容C.用天然气逐步取代民用燃煤是“绿色化学”理念的体现D.对“地沟油”进行分流可以获得汽油8、用N A表示阿伏加德罗常数的数值,下列说法正确的是A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5N AB.4.2 g丙烯中所含的共价键数目为0.6N AC.1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 N AD.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为0.2 N A9、有关有机物的说法正确的是A.石油分馏可以获得重要的有机化工原料乙烯B.乙醇、乙酸、乙酸乙酯可用饱和氢氧化钠溶液鉴别C.乙烷和苯所含的碳碳键不同,但都能发生氧化反应和取代反应D.糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同10、有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16。
三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子。
有关判断不正确的是A.X元素位于ⅥA族B.A不能溶解于B中C.B的沸点高于C的沸点D.A和C不可能发生氧化还原反应11、从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是12、粗铜中一般含有锌、铁、银、金等杂质。
在下图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH==2K2CO3+6H2O 接通电路一段时间后,纯Cu电极质量增加了3.2 g。
2019届高考化学二轮复习浙江选考化学真题专项训练题组(第6题)

浙江选考专项训练题组(第6题)1.下列说法不正确的是( ).A 氯化钠可用于制备纯碱.B 硅是制太阳能电池的常用材料.C 大力发展新能源汽车能减少酸雨危害.D 电解2MgCl 溶液制金属Mg【解析】A 项,侯氏制碱法就是用NaCl 、2CO 、O H 2和3NH 作反应物制备纯碱,正确;B 项,硅是半导体,可作为制备太阳能电池的材料,正确;C 项,发展新能源汽车可减少石油的使用,减少x NO 的排放及酸雨的危害,正确;D 项,制备金属Mg 要通过电解熔融的2MgCl ,错误。
故选D 。
2.下列说法不正确的是( ).A 二氧化氯可用于自来水的消毒.B 二氧化碳可用于工业制镁.C 二氧化硅可用于制作光学镜片.D 二氧化硫可用于漂白纸浆【解析】A 项,2ClO 具有强氧化性,可用于自来水消毒,正确;B 项,2CO 与Mg 反应方程式为C MgO CO Mg ++222点燃,不能用于工业制Mg ,错误;C 项,2SiO 熔沸点高,硬度大,可用于制作光学镜片,正确;D 项,2SO 具有漂白性,能漂白纸浆,正确。
故选B 。
3.下列说法不正确的是( ).A 3NaHCO 能与碱反应,所以可用作焙制糕点的蓬松剂.B 还原铁粉可用作食品袋内的抗氧化剂.C 水玻璃可用于生产黏合剂和防火剂.D 盐析可提纯蛋白质并保持其生理活性【解析】A 项3NaHCO 受热分解产生气体,可用作焙制糕点的蓬松剂,与能和碱反应无关。
4.下列说法正确的是().A二氧化硅是太阳能电池的常用材料.B氯化铁、硫酸铁都可用于净水.C碳酸钡是医院常用的钡餐.D氧化镁、金刚石熔点很高,都是优质的耐高温材料【解析】A项,太阳能电池的常用材料是Si,错误;B项,氯化铁和硫酸铁都能水解生成氢氧化铁胶体,二者都可用于净水,正确;C项,医院常用的钡餐只要成分是硫酸钡,错误;D项,金刚石高温条件下在空气中易燃烧,不能用作耐高温材料,错误。
故选B。
5.下列说法不正确的是().A氧化镁可以用于制造飞机、火箭.B钠可以用于冶炼钛、锆、铌等金属.C溴化银是胶卷中必不可少的成分.D游泳场馆常用硫酸铜作池水消毒剂【解析】氧化镁熔点高,可以作耐高温的材料,如耐火砖、耐火管等,A错误;钠的化学性质很活泼,能够从钛、锆、铌等金属的熔融氯化物中置换出钛、锆、铌等金属,B正确;溴化银见光分解,是重要的感光材料,是胶卷中必不可少的成分,C正确;硫酸铜为重金属盐,能够使蛋白质变性,能够起到杀毒消菌的作用,D正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
提升训练26 元素与物质推断(第27题)1.(2018·学军中学模拟)探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:请回答:(1)X的化学式是。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是。
(3)白色沉淀用途广泛,请列举一例:。
2.某新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期第ⅤA族。
D、E、H均为难溶于水的白色固体,化合物C、E均含A元素。
其余物质均为中学化学中的常见物质。
请回答:(1)写出H的化学式:。
(2)化合物A3M4中含有的化学键类型为。
(3)写出反应②的离子方程式:。
3.为了探究不溶性盐X(仅含5种元素)的组成和性质,设计并完成如下实验(所加试剂均过量,气体体积均在标准状况下测定)。
请回答:(1)X的组成元素为H、O和(用元素符号表示),气体C的电子式为。
(2)写出反应①的离子方程式:。
4.为探究含结晶水的化合物X(含四种元素,摩尔质量为180 g·mol-1)的组成和性质,某兴趣小组设计并完成如下实验:请回答:(1)黑色固体Y的化学式为,气体C的电子式为。
(2)晶体X隔绝空气受热分解的化学方程式为。
5.某盐A是由三种元素组成的化合物,某研究小组按如图流程探究其组成:请回答:(1)写出红棕色固体C的化学式:。
(2)写出A受热分解反应的化学方程式:。
(3)写出检验A中阳离子的实验方案:。
6.为探究某矿物X(仅含三种元素)的组成,设计并完成了如下实验:已知:气体A能使品红溶液褪色,固体B中仅含CuO、Fe2O3。
请回答:(1)X的化学式为。
(2)溶液C中存在的阳离子有。
参考答案提升训练26元素与物质推断(第27题)1.答案: (1)Mg2SiO4或2MgO·SiO2(2)SiO2+2OH-Si O32-+H2O(3)优良的阻燃剂(答案合理即可)解析: 无机盐X(仅含三种短周期元素),加入过量盐酸溶解,离心分离得到白色胶状沉淀和无色溶液,白色胶状沉淀为硅酸,硅酸充分灼烧得到白色粉末1.80g为SiO2,其物质的量=1.80g60g·mol-1=0.03mol,溶于氢氧化钠溶液得到无色溶液为硅酸钠溶液,说明无机盐X 中含Si O32-或Si O44-,且物质的量为0.03mol,若为Si O32-,则其质量=0.03mol×76g·mol-1=2.28g,金属质量=4.20g-2.28g=1.92g,无色溶液中加入过量氢氧化钠溶液生成白色沉淀,则沉淀为Mg(OH)2,则无机盐X中含镁元素的物质的量=3.48g58g·mol-1=0.06mol,质量为0.06mol×24g·mol-1=1.44g,不符合要求,则无机盐X中含Si O44-,其物质的量为0.03mol,质量=0.03mol×92g·mol-1=2.76g,金属质量为4.20g-2.76g=1.44g,其物质的量=1.44g÷24g·mol-1=0.06mol,得到X为Mg2SiO4,则(1)X的化学式为Mg2SiO4或2MgO·SiO 2;(2)白色粉末溶于氢氧化钠溶液的离子方程式是SiO 2+2OH -Si O 32-+H 2O;(3)氢氧化镁是优良的阻燃剂。
2.答案: (1)AgCl(2)共价键 (3)SiO 2+2OH -Si O 32-+H 2O解析: 根据题中各物质转化关系,D 受热得E,E 能与氢氧化钠溶液反应生成F,F 与过量的二氧化碳反应生成D,说明D 为弱酸且能受热分解;新型无机材料A 3M 4由两种非金属元素组成,元素M 位于第2周期ⅤA 族,应为氮元素,A 元素在A 3M 4中显+4价,化合物C 、E 均含A 元素,D 、E 、H 均为难溶于水的白色固体,可知A 3M 4应为Si 3N 4,可以确定A 为Si,E 为SiO 2,F 为Na 2SiO 3,则D 为H 2SiO 3,G 与硝酸银溶液反应生成不溶于稀硝酸的沉淀H,则可知G 中有Cl -,H 为AgCl,故C 为SiCl 4,B 为Cl 2;由SiCl 4+3H 2O4HCl ↑+H 2SiO 3↓,生成G(HCl)。
(1)H 的化学式为AgCl;(2)化合物Si 3N 4中含有的化学键类型为共价键;(3)SiO 2溶解于NaOH 溶液发生反应的离子方程式为SiO 2+2OH -Si O 32-+H 2O 。
3.答案: (1)N 、S 、Cu H ··N ····H ··H (2)2NH 4CuSO 3+4H +Cu+Cu 2++2SO 2↑+2H 2O+2N H 4+解析: A 气体能使品红溶液褪色,应是SO 2,物质的量是0.1mol,说明X 中含有亚硫酸根或亚硫酸氢根离子。
B 是红色固体,应该是铜,物质的量是0.05mol;蓝色溶液和氢氧化钠反应生成能使湿润的红色石蕊试纸变蓝的气体C 和蓝色沉淀,说明C 是氨气,物质的量是0.1mol,即X 中含有铵根;蓝色沉淀灼烧生成黑色固体D,D 是氧化铜,物质的量是0.05mol 。
则X 中铜离子、铵根和亚硫酸根(或亚硫酸氢根)的物质的量之比是1∶1∶1且均为0.1mol,而0.1molNH 4CuSO 3的质量恰好是16.2g 。
(1)根据以上分析可知X 的组成元素为H 、O 、N 、S 、Cu,氨气的电子式为H ··N ····H ··H 。
(2)根据以上分析可知反应①的离子方程式为2NH 4CuSO 3+4H +Cu+Cu 2++2SO 2↑+2H 2O+2N H 4+。
4.答案: (1)FeO ··O ······C ····O ···· (2)FeC 2O 4·2H 2O FeO+CO ↑+CO 2↑+2H 2O解析: 黑色固体Y 与盐酸反应的产物遇KSCN 溶液无明显现象,通入氯气后,溶液变为血红色,可知Y 为FeO,则FeO 的物质的量n (FeO)=m (FeO )M (FeO )=10.8g72g ·mol -1=0.15mol;混合气体与足量澄清石灰水反应生成15.0g 白色沉淀和气体B,B 与足量的CuO 反应生成气体C,C 能与足量澄清石灰水反应生成15.0g 白色沉淀,根据原子守恒,可知混合气体中含有等物质的量的CO 2和CO,即:n (CO)=n (CO 2)=n (CaCO 3)=m (CaCO 3)M (CaCO 3)=15.0g 100g ·mol -1=0.15mol 。
结合X 的物质的量n (X)=m (X )M (X )=27.0g 180g ·mol -1=0.15mol,X 中含有H 2O 物质的量:n (H 2O)=m (X )-m (CO )-m (CO 2)-m (FeO )M (H 2O )= 27.0g -0.15mol ×28g ·mol -1-0.15mol ×44g ·mol -1-10.8g18g ·mol -1=0.3mol,则n (X)∶n (FeO)∶n (CO)∶n (CO 2)∶n (H 2O)=0.15mol ∶0.15mol ∶0.15mol ∶0.15mol ∶0.3mol=1∶1∶1∶1∶2,推出:X 的分子式为FeC 2O 4·2H 2O 。
(1)黑色固体Y 的化学式为FeO,气体C(CO 2)的电子式为··O ······C ····O ····;(2)晶体X(FeC 2O 4·2H 2O)隔绝空气受热分解的化学方程式为FeC 2O 4·2H 2OFeO+CO ↑+CO 2↑+2H 2O 。
5.答案: (1)Fe 2O 3(2)2FeSO 4Fe 2O 3+SO 3↑+SO 2↑(3)取少量试样配成溶液,滴入KSCN 溶液,若不变色,再滴加少量氯水,出现血红色,证明有亚铁离子解析: 标准状况下448mL 气体B 能与足量BaCl 2溶液反应,产生2.33g 白色沉淀,则该气体中有SO 3,2.33g 白色沉淀是BaSO 4,物质的量为0.01mol,SO 3的物质的量为0.01mol,448mL 气体B 的物质的量为0.02mol,则气体B 中还有0.01molSO 2,红棕色固体C 与盐酸反应生成黄色溶液,则红棕色固体C 为Fe 2O 3,物质的量为1.6g ÷160g·mol -1=0.01mol,氧化铁与盐酸反应生成氯化铁和水,氯化铁溶液呈黄色,化合物A 中铁原子与硫原子的物质的量之比为1∶1,铁元素、硫元素质量和为(56+32)g·mol -1×0.02mol=1.76g,则盐A 是由三种元素组成的化合物,另一种元素应为氧,质量为3.04g-1.76g=1.28g,物质的量为0.08mol,所以化合物中Fe 、S 、O 的物质的量之比为1∶1∶4,A 是FeSO 4。
(1)根据上述分析,红棕色固体C 为氧化铁,化学式为Fe 2O 3。
(2)根据上述分析,A 为FeSO 4,受热分解生成氧化铁、SO 2和SO 3,反应的化学方程式为2FeSO 4Fe 2O 3+SO 3↑+SO 2↑。
(3)A 为FeSO 4,根据Fe 2+的检验方法,检验FeSO 4中Fe 2+的实验方案是取少量试样配成溶液,滴入KSCN 溶液,若不变色,再滴加少量氯水,溶液变为血红色,证明有亚铁离子。
6.答案: (1)Cu 5FeS 4 (2)Fe 3+、Cu 2+、H +解析: (1)气体A 能使品红溶液褪色,气体A 应为SO 2,固体B 中仅含CuO 、Fe 2O 3,并结合X 中含有三种元素,可知X 为S 、Fe 、Cu 组成的化合物;固体B 溶于足量稀盐酸生成FeCl 3和CuCl 2,往溶液C 中加入5.0gCu,剩余1.8gCu,则溶解3.2gCu,其物质的量为0.05mol,根据Cu+2Fe 3+Cu 2++2Fe 2+,可知固体B 中含有Fe 3+的物质的量为0.1mol,Fe 2O 3的物质的量为0.05mol,质量为0.05mol×160g·mol -1=8g,则固体B 中CuO 的质量为40g,其物质的量为0.5mol,原固体X中S的物质的量为50.4g-56g·mol-1×0.1mol-64g·mol-1×0.5mol=0.4mol,则化合物X中n(Fe)∶n(Cu)∶n(S)=0.1mol∶32g·mol-10.5mol∶0.4mol=1∶5∶4,X的化学式为Cu5FeS4;(2)CuO、Fe2O3溶于足量稀盐酸生成FeCl3和CuCl2溶液,则所得溶液C中存在的阳离子有Fe3+、Cu2+、H+。
