生活中常见的盐
生活中常见的盐

鉴别Na2CO3 和 NaHCO3
方法一:加热 2NaHCO3
∆
Na2CO3 + H2O + CO2↑ CaCO3↓ + 2NaOH
方法二:滴加Ca(OH)2溶液
Na2CO3 + Ca(OH)2
除杂:Na2CO3 (NaHCO3)
方法:加热
第十一单元 盐 化肥
11.1
生活中常见的盐
第1课时 生活中常见的盐
1
课堂讲解 几种常见的盐
碳酸钠、碳酸氢钠、碳酸钙的化学性质
2
课时流程
逐点 导讲练 课堂 小结 课后 作业
除食盐(NaCl)外,生活中常见的盐还有:
1、碳酸钠(Na2CO3 , 俗称纯碱、苏打) 为什么Na2CO3 俗称纯碱? 答:因为 Na2CO3 的水溶液呈碱性 2、碳酸氢钠(NaHCO3 , 俗称小苏打) 3、碳酸钙(CaCO3 , 俗称石灰石、大理石)
名称 碳酸钠Na2CO3 俗名 物理 性质 苏打、纯碱 白色粉末 易溶于水 碳酸氢钠NaHCO3 碳酸钙CaCO3 大理石、石灰石 白色固体 难溶于水 可作 补钙 剂 作建筑材料
小苏打
白色粉末 易溶于水 发酵粉的主要成分、 治疗胃酸过多的药剂
主要 生产玻璃、造 用途 纸、纺织、洗 涤剂
CaCO3 + 2HCl = CaCl2 + CO2 ↑ + H2O
Na2CO3 + 2HCl = 2NaCl + CO2 ↑ + H2O
NaHCO3 + HCl = NaCl + CO2 ↑ + H2O
现象:溶液中有气泡产生,澄清石灰水变浑浊
澄清石灰水
CO32- 和 HCO3- 的检验:
考点生活中常见的盐(完整版)实用资料

考点生活中常见的盐(完整版)实用资料(可以直接使用,可编辑完整版实用资料,欢迎下载)考点:生活中常见的盐一、基本考点考点1.生活中常见的盐(1)氯化钠(NaCl):①俗名:食盐。
②存在:在自然界中分布很广,存在于海水、盐湖、盐井、盐矿中。
③用途:a. 调味品,b. 配制生理盐水,c. 工业原料,d. 工业上用来做原料制取碳酸钠、氢氧化钠、氯气、盐酸等,e. 农业上用氯化钠溶液来选种等。
(2)碳酸钠(Na 2CO 2):俗名:纯碱、苏打;用途:用于生产玻璃、造纸、纺织、洗涤剂。
(3)碳酸氢钠(NaHCO 3):俗名:小苏打;用途:在食品工业上用作食品添加剂,在医疗上是治疗胃酸过多的一种药剂。
(4)碳酸钙(CaCO 3):它是大理石或石灰石的主要成分;用途:用作建筑材料及补钙剂。
考点2.盐的化学性质和复分解反应(1)盐的化学性质:①盐与金属反应生成另一种金属和另一种盐;如Zn+CuSO 4==ZnSO 4+Cu 。
②盐和酸反应生成另一种盐和另一种酸;如:BaCl 2+H 2SO 4==BaSO 4↓+2HCl 。
③盐和碱反应生成另一种盐和另一种碱;如:CuSO 4+2NaOH==Cu(OH)2↓+Na 2SO 4。
④盐和盐反应生成两种新盐;如:NaCl+AgNO 3==AgCl ↓+NaNO 3。
(3)复分解反应:①定义:两种化合物相互交换成分生成另外两种化合物的反应叫复分解反应。
如NaOH+HCl==NaCl+H 2O 。
②发生的条件:酸、碱、盐之间并不是都能发生反应,只有当两种化合物相互交换成分,有沉淀、水或气体生成时,复分解反应才能发生。
考点3.粗盐提纯粗盐中含有较多的可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等),可以通过过滤的方法把不溶于液体的固体物质跟液体分离。
过滤时,液体穿过滤纸上的小孔,而固态物质留在滤纸上,从而使固体和液体分离。
粗盐提纯时,把粗盐溶解在水里,经过过滤,把泥沙等杂质从食盐水中除去,然后再通过蒸发结晶,得到食盐晶体。
初中九年级化学下册《生活中常见的盐》(基础) 知识讲解
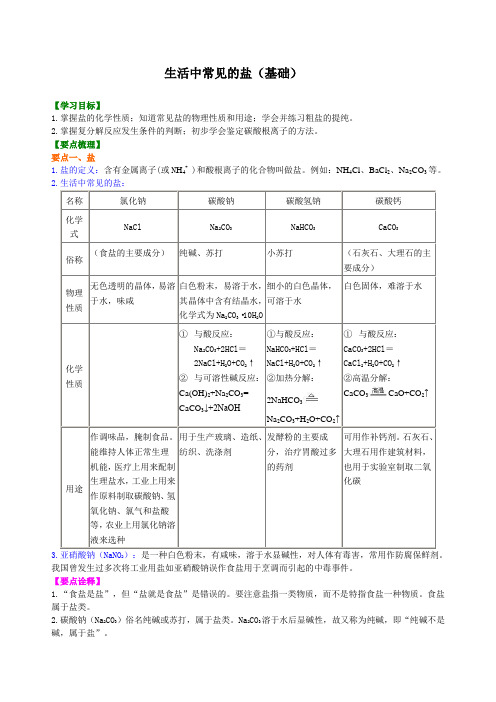
生活中常见的盐(基础)【学习目标】1.掌握盐的化学性质;知道常见盐的物理性质和用途;学会并练习粗盐的提纯。
2.掌握复分解反应发生条件的判断;初步学会鉴定碳酸根离子的方法。
【要点梳理】要点一、盐1.盐的定义:含有金属离子(或N H4+ )和酸根离子的化合物叫做盐。
例如:NH4Cl、BaCl2、Na2CO3等。
2.生活中常见的盐:名称氯化钠碳酸钠碳酸氢钠碳酸钙化学式NaCl Na2CO3NaHCO3CaCO3俗称(食盐的主要成分)纯碱、苏打小苏打(石灰石、大理石的主要成分)物理性质无色透明的晶体,易溶于水,味咸白色粉末,易溶于水,其晶体中含有结晶水,化学式为Na2CO3·10H2O细小的白色晶体,可溶于水白色固体,难溶于水化学性质①与酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑②与可溶性碱反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH①与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑②加热分解:2NaHCO3Na2CO3+H2O+CO2↑①与酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑②高温分解:CaCO3CaO+CO2↑用途作调味品,腌制食品。
能维持人体正常生理机能,医疗上用来配制生理盐水,工业上用来作原料制取碳酸钠、氢氧化钠、氯气和盐酸等,农业上用氯化钠溶液来选种用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分,治疗胃酸过多的药剂可用作补钙剂。
石灰石、大理石用作建筑材料,也用于实验室制取二氧化碳3.亚硝酸钠(NaNO2):是一种白色粉末,有咸味,溶于水显碱性,对人体有毒害,常用作防腐保鲜剂。
我国曾发生过多次将工业用盐如亚硝酸钠误作食盐用于烹调而引起的中毒事件。
【要点诠释】1.“食盐是盐”,但“盐就是食盐”是错误的。
要注意盐指一类物质,而不是特指食盐一种物质。
食盐属于盐类。
2.碳酸钠(Na2CO3)俗名纯碱或苏打,属于盐类。
Na2CO3溶于水后显碱性,故又称为纯碱,即“纯碱不是碱,属于盐”。
生活中常见的盐。

五、石灰石和石灰岩地区 的溶洞
奇妙的石笋和钟乳石
溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到 溶有二氧化碳的水时,会慢慢变成可溶于水的 碳酸氢钙Ca(HCO3)2 CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙 会分解,重新变成碳酸钙沉积下来。 Ca(HCO3)2=CaCO3↓+CO2↑+H2O 在自然界里不断发生上述反应,石灰岩逐 渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢 钙不断分解,生成的碳酸钙逐渐沉积,形成千 姿百态的钟乳石、石笋和石柱。
生活 调味品、腌制蔬菜、鱼、肉、蛋等;
交通 公路上的积雪用氯化钠来消除。
有关食品与药品
融雪机洒盐融雪
3.氯化钠的分布
海盐
岩盐
湖盐Biblioteka 井盐世界上最大的盐矿储地是柴达木盆地
4.氯化钠的提纯
氯化钠的溶解度受温度变化影响_____ 不大 , 所 以一般采用蒸发溶剂 ________方法得到晶体,粗盐经 沉淀 _____、 _____、_____ 蒸发 、结晶可以得到初 溶解 、 过滤 氯化钙 步提纯。粗盐因含有______ ______等杂质易发 氯化镁、
碳酸钠与氢氧化钙的反应
现象
无色碳酸钠溶液中出现浑浊 (沉淀)
碳酸钠与氢氧化钙反应生 成碳酸钙,碳酸钙难溶于 水,故出现浑浊
分析
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
3.复分解反应 1.概念
由两种化合物互相交换成分,生成另外两 种化合物的反应。
AB + CD AD + CB
盐酸腐蚀含碳酸钙的建材
碳酸钠、碳酸氢钠和盐酸反应
生活中常见的盐

3.某盐在人体的新陈代谢中十
分重要。它可维持血液中适当 的酸碱度,并通过人体复杂的 作用产生消化液,帮助消化。 该盐是 B A.氯化钙 B.氯化钠 C.硝酸钾 D.碳酸钠
下列是关于“粗盐提纯”实验的几种 说法,其中正确的是 BD A.为加快过滤速度,应用玻璃棒不断 搅拌过滤器内的液体 B.如果经两次过滤滤液仍浑浊,则应 检查实验装置并分析原因 C.蒸发滤液时要用玻璃棒不断搅拌, 用酒精灯持续加热直到蒸干为止 D.倒入蒸发皿里的溶液不应超过蒸发 皿容积的2/3
4、氯化钠的物理性质:
白色晶体,易溶于水
5、氯化钠的化学性质: 酸根离子(Cl-)检验
NaCl + AgNO3
AgCl ↓ + NaNO3
巩固练习: 1.下列物质的俗称与化学式一致的是 (
A.纯碱(NaHCO3)
C.食盐(NaCl)
Na2CO3
B.小苏打(Na2CO3)
D.大理石[Ca(OH)2]
CaCO3
NaHCO3
C
)
2.在我国某地曾经发生把白色的工业用盐误做食 盐的中毒事件,这种工业用盐可能含有 ( C ) A.KMnO4 B.Na2CO3 C.NaNO2 D.MgSO4
3.玻璃棒不可以用来
A.蘸取溶液测定其pH B.过滤时引流液体注入漏斗内
(
C
)
C.搅拌漏斗中的悬浊液,加快过滤速度 滤纸破损 ×
搅拌滤液,以防液滴 飞溅。
粗盐的提纯
实验步骤 ①溶解
注意事项 玻璃棒起搅 拌作用,加速 食盐的溶解
①滤纸低于漏斗边 约0.5厘米; ②液体 要低于滤纸; ③要用玻璃棒引流 ;④漏斗管下端要 靠紧烧杯壁
实验现象 食盐溶解,泥 沙不溶
实验结论 两种固体,一 种溶于水,一 种不溶于水 才用过滤法 食盐水和泥 沙分开
初三化学:生活中常见的盐

初三化学:生活中常见的盐一、氯化钠(NaCl )↓性质氯化钠的熔点、沸点较高。
纯净的氯化钠不潮解,粗盐因含有少量的氯化镁、氯化钙等杂质,能吸收空气中的水分而潮解。
↓制法由于氯化钠的溶解度随温度的影响不大,故可以使用蒸发结晶法将氯化钠析出。
工业上用海水或盐井水晒盐,盐湖水煮盐等方法,使氯化钠成晶体析出。
↓分类氯化钠属于盐,但是盐类中大多数是有毒的,如亚硝酸钠、硫酸铜等。
氯化钠是少数可以食用的盐。
↓用途氯化钠在生活中可作为调味品。
医疗上使用的生理盐水是0.9%的氯化钠溶液。
农业上用10%—16%的氯化钠溶液来选种。
交通上,将氯化钠撒在积雪的路面上,可使路面上的积雪消融,减少事故的发生。
工业上用氯化钠作为原料制取碳酸钠、氢氧化钠、氯气、盐酸等化工产品。
↓粗盐的提纯步骤:溶解、过滤、蒸发、计算产率。
注意的问题:1.过滤时应遵循“一贴、二低、三靠”的基本原则。
2.过滤之前的溶液应静置一会儿,以免不溶物堵住滤纸的小孔,影响过滤的速度及效果。
3.过滤后的溶液如果仍浑浊,应查找原因,在过滤一次。
4.蒸发时应不断搅拌,以免溶液受热不均匀造成液滴飞溅。
5.当蒸发皿中出现较多固体时,应停止加热,利用蒸发皿的余热使滤液蒸干。
6.粗盐提纯的每一步操作中,玻璃棒的作用为:加速溶解、使液体均匀受热、转移固体。
过滤食盐水 蒸发食盐水二、碳酸钙、碳酸钠、碳酸氢钠↓碳酸钙(CaCO 3)碳酸钙大量应用于建筑业。
天然存在的石灰石、大理石的主要成分是碳酸钙。
碳酸钙也可以作为补钙剂等。
氯化钠晶体↓碳酸钠(Na2CO3)碳酸钠俗称纯碱、苏打。
为白色粉末,易溶于水。
虽然碳酸钠的溶液呈碱性,但碳酸钠属于盐。
碳酸钠广泛用于制玻璃、纺织、造纸和洗涤剂等工业生产中。
在蒸馒头前加入一些碳酸钠,可以中和发酵过程中产生的酸性物质。
↓碳酸氢钠(NaHCO3)碳酸氢钠俗称小苏打,是白色粉末,易溶于水,水溶液呈碱性。
碳酸氢钠是发酵粉的主要成分,也可以制治疗胃酸过多的药品。
生活中常见盐
海盐的制备方法
晒盐:在有阳光和风的条件下,将 海水蒸发成盐粒或盐晶
添加标题
添加标题
添加标题
添加标题
盐田结晶:通过在盐田中蒸发海水, 使海水中的盐分结晶
煮盐:通过加热海水使盐分分离出 来
海盐的储存和使用注意事项
储存:存放在阴凉干燥处,避免阳光直射和潮湿环境 使用:按照个人需求适量使用,避免浪费和过量摄入 注意事项:不要与食品混合存放,避免污染食物 应急处理:如果不慎误食,应立即漱口并咨询医生
海盐
海盐的种类和用途
种类:分为粗盐、 细盐和片盐等
用途:烹饪调味、 腌制食品、制作 冰块等
特点:具有独特 咸味和矿物质含 量
历史:自古以来 就是人类饮食中 重要的调味品之 一
海盐的营养价值
含有丰富的微 量元素
含有大量的矿 物质
含有一定量的 维生素
含有多种酶类 物质
海水蒸发:将海水经过日晒蒸发后 留下的盐结晶
加工食品:制作 腌制品、烹饪料 理等
医疗用途:补充 钠、氯等矿物质, 治疗呕吐、腹泻 等症状
食盐的摄入量
每天适宜摄入量:6g 高盐食品:腌制食品、加工肉类、高盐零食等 摄入过多的危害:高血压、心血管疾病等 减少摄入的方法:控制烹饪用盐、选择低盐食品等
食盐的选购与保存
选购:选择正规品牌,注意成分表和保质期 保存:存放在阴凉干燥处,避免阳光直射和潮湿环境
小苏打
小苏打的性质
化学式:NaHCO3 外观:白色结晶性粉末 易溶于水:易溶于冷水中 稳定性:不稳定,易分解
小苏打的用途
烘焙:在烘焙过程中作为膨松剂,增加食物的口感和蓬松度。 清洁:可以用来清洁厨房用具、洗衣机等,去除污渍和异味。 家庭医疗:可以用于缓解胃酸、消化不良等症状,以及口腔溃疡的辅助治疗。 美容护肤:可以去除皮肤表面的污垢和油脂,使皮肤更加光滑细腻。
生活中常见的盐
请回答:(1)步骤①和②的操作名称是 ________________________
(2)步骤③判断加入盐酸“适量”的方法是 ____________________________________ 步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止 ____________________________________,当蒸发皿中有较多 量固体出现时,应________________________,用余热使水份 蒸干。
(3)在步骤②中玻璃棒的作用是 ________________________。
答案:
(1)①溶解;②过滤;③蒸发
(2)漏斗、烧杯、酒精灯
(3)引流
2、如图所示试剂瓶中分别盛有四种常见的化学药品。
(1)C瓶中药品的化学式为____________。D瓶中药品的名 称是____________
二、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、 碳酸钙(CaCO3)
我们可以通过列表归纳氯化钠、碳酸钠、碳酸氢钠和碳酸钙的组 成及其主要用途。
那么Na2CO3、NaHCO3、CaCO3的化学性质怎样?
首先,
我们回顾一下:实验室制取CO2的化学方程式:
CaCO3+2HCl=CaCl2+H2O+CO2↑
)
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品
答案:C
12、53g Na2CO3和42g NaHCO3分别与过量的盐酸完全反应,则 ( )
A.Na2CO3放出的CO2多
几种常见的盐
化学性质:
跟某些金属的反应
跟酸的反应 跟碱的反应 跟另一种盐的反应 盐跟酸反应,一般生成另一 种盐和另一种酸。 AgNO3 + HCl = AgCl↓+ HNO3
(右上录像)
BaCl2 + H2SO4 = BaSO4 + HCl
化学性质:
跟某些金属的反应
跟酸的反应 跟碱的反应 跟另一种盐的反应
盐跟碱反应,一般生成另一种盐和另一种碱。 Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
工业上,精炼铜、镀铜和组成里含有CO32-的盐跟盐酸反应都能生成CO2, 利用这种反应可鉴别CO32-。
二、盐的性质
物理性质: 在常温下盐大都是晶体。不同种类的盐在水中 的溶解性不同。钾盐、钠盐、铵盐和硝酸盐都溶, 盐酸盐除氯化银,硫酸盐除硫酸钡外其他都溶,碳 酸盐、磷酸盐除钾盐、钠盐、铵盐溶,其他不溶。
常见的盐
一、几种常见的盐
1、氯化钠
用途很广。日常生活中用于调味和腌制食物, 医疗上用与配制生理盐水,也是重要的化工原料。
2、碳酸钠 碳酸钠是重要的化工产品,用途广泛。 我国著名化学家侯德榜在改进纯碱的生产方面, 曾做出杰出的贡献。 3、硫酸铜 硫酸铜有毒,在农业上用作杀菌剂,由它和石 灰配制的波尔多液杀菌效率高,药害较小。
H Cu(OH)2 + 2HCl = CuCl2 + 2H2O
HCl + AgNO3 = AgCl ↓ + HNO3
CaCO3+2HCl=CaCl2+H2O+CO2↑
复分解反应发生的条件
有难溶的物质(如BaSO4、AgCl)或难电离的物质(如 H2O)或挥发性的物质(如CO2)生成,只要具备上述条件之一, 这类反应就能发生。
生活中常见的盐
生活中常见的盐
一:氯化钠
1:物理性质:白色晶体,有咸味,易溶于水。
2:制取方法:(1)通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐(粗盐中含有多种可溶性杂质氯化镁、氯化钙等)。
(2)粗盐通过溶解、沉淀、过滤、蒸发、结晶等处理,可以得到初步的提纯。
3:用途
(1)医疗上用氯化钠配制生理盐水(质量分数0.9%的氯化钠溶液);
(2)农业上用氯化钠溶液选种(质量分数16%的氯化钠溶液);
(3)工业上可以用氯化钠为原料来制取碳酸钠、氢氧化钠、氯气和盐酸等;
(4)氯化钠用作调味品、腌制食品;(5)用氯化钠消除公路上的积雪。
4:氯化钠对人的影响:
(1)钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。
(2)人们每天都要摄入一些食盐来补充由于出汗、排尿等而排出的氯化钠,以满足人体的正常需要(每人每天约需3~5g食盐)。
但长期食用过多食盐不利于人体健康。
二:碳酸钠、碳酸氢钠、碳酸钙的物理性质和用途。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
? 护路工人撒的什么
实用文档
盐=食盐?
实用文档
盐:一类金属离子或铵根离子(NH4+) 与酸根离子或非金属离子结合的化合
物。
实用文档
实用文档
氯化钠晶体
碳酸钠Na2CO3
实用文档
碳酸氢钠 NaHCO3
高锰酸钾 KMnO4
实用文档
大理石CaCO3
一些常见物质的化学式及俗称
俗称
食盐
纯碱\苏 打
盐酸
水
化学式 NaCI Na2CO3 HCl
H2O
分类 俗称
盐
盐
熟石灰 大理石
酸 生石灰
氧化物 小苏打
化学式 Ca(OH)2 CaCO3
分类
碱
盐
实用文档
CaO NaHCO3
氧化物
盐
导学提纲(一)
自学课本完成下列问题
1.盐是指一类组成里含有 金属离子 酸根离和子
的化合物。氯化钠是由氯离子 钠离子和
构成的氯。离其子中
实验
组成里含有CO32-(或HCO3-)离子的盐,都能 跟盐酸反应生成二氧化碳气体,利用此反应 可以检验盐的组成中是否含有CO32-(或HCO3-)
实用文档
如何鉴别碳酸钠和碳酸氢钠?
1.加热固体
产生2能N使aH澄CO清3 石△灰水变浑Na浊2C的O3气+H体2O的+C是O2NaHCO3
2.在溶液中加入相同溶液的盐酸 反应剧烈的是NaHCO3
(1)滤纸对折,呈半圆型(一折); (2)再对折,呈扇形,但不要压出折线(二折); (3)滤纸展开(一边为三层),放到漏斗中调整大 小后再拿出压折线,可撕掉外层中一角; (4)滤纸置于漏斗中,加水润湿; (5)轻压滤纸,赶出气泡,使其贴紧漏斗; (6)漏斗置于漏斗架,下端贴边放置烧杯。
实用文档
(1)步骤:①溶解 ②过滤 ③蒸发
有促生盐酸、帮助消
化和增进食欲的作用。
2.碳酸钠俗称纯碱 苏打、
;碳酸
氢钠小俗苏称打
。
3.氯化钠的用途:
①生活中作 调味剂 防腐、剂
;②医
疗上生用理来盐配水制
配制;盐③水农选业种上用
来
碳酸钠 氢;氧④化工钠业上可以用来
制取
实用、文档消除积雪
、氯气和
盐酸等;⑤公路上用来
。
食盐的生理用途
(1)维持细胞外液的渗透压 (2)参与体内酸碱平衡的调节 (3)氯离子在体内参与胃酸的生 成
(NaHCO 3)
碳酸钙
(CaCO3)
白色 白色
白色
实用文档
状态
粉末状,晶体中 含有结晶水
细小的单斜晶体
晶)
名称
碳酸氢钠(NaHCO3 )
主要用途
碳酸钙
碳酸钠 碳酸氢钠
碳酸钙
工业上:用于生产玻璃、造纸、 纺织、洗涤剂
生活上:用于蒸馒头,做洗涤剂
(2)注意事项: 一贴:滤纸紧贴漏斗内壁 二低:滤纸低于漏斗边缘0.5cm 滤液低于滤纸边缘
三靠:漏斗下端紧靠烧杯内壁 玻璃棒靠在三层滤纸处 烧杯靠在玻棒上倾倒液体
实用文档
实验操作
常压过滤:
(1)玻璃棒靠近三层滤纸一端; (2)玻璃棒引流导入溶液; (3)溶液转移完毕,烧杯口沿玻璃棒上提并逐渐竖 直,防止溶液沿烧杯外壁流下;
实用文档
实用文档
实验操作
蒸发浓缩:
(1)溶液转移至蒸发皿; (2)酒精灯加热蒸发; (3)开始出现结晶时,注意慢火加热并搅拌,防止 局部过热导致晶体迸溅; (4)溶液变稠时(表面出现晶膜),停止加热,冷 却过滤。 演示如下:
实用文档
实用文档
实用文档
实用文档
颜色
碳酸钠
(Na2CO3) 碳酸氢钠
先在溶液中加入CaCl2溶液,没有沉 淀 (证明不是CO32-,SO32-)再加入盐酸, 产生无色无味的气体, 可使澄清石灰水变浑
浊, (从气味证明不是HSO3-) HCO3-+H+=CO2+H2O
CO2+Ca(OH)2 =CaCO3 +H2O
实用文档
实验【11-2】 演示如下: 分析:
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
海水是盐的“故乡”, 海水中含有各种盐类,其中百 分之90左右是氯化钠,也就是
食盐。
实用文档
食盐的分布
实用文档
海 原 县 盐 湖 带
实用文档
青 海 盐 湖 带
实用文档
内 蒙 古 盐 湖 带
实用文档
班 戈 错 盐 湖 带
实用文档
新 疆 盐 湖 带
实用文档
实用文档
实用文档
实验操作
常压过滤装置的安装:
实用文档
复分解反应:由两种化合物互相交换成分, 生成另外两种化合物
的反应。 实质:发生复分解反应的两种物质在水溶液
中相互交换离子,结合成难电离的物 质----沉淀、气体、水,使溶液中离 浓度降低,化学反应即向着离子浓度 降低的方向进行。可简记为
AB+CD=AD+CB。
实用文档
例:Na2CO3 +HCl
实用文档
食盐的用途
医疗上:1)配制生理盐水 2)预防感冒 3)用盐水漱口防治口腔炎症
农业上:用10%——16%的食盐溶液来选种 食品上: 用食盐腌制蔬菜、鱼、肉、蛋等 工业上:重要的化工原料 交通上: 化雪
实用文档
食盐的实用价值 (1)清晨喝一杯盐开水,可以治大便不通。喝盐开水可 以治喉咙痛牙痛。 (2)误食有毒物,喝一些盐开水,有解毒作用。 (3)豆腐易变质,如将食盐化在开水中,冷却后将豆腐 浸入,即使在夏天,也可保存数月。 (4)鲜花插入稀盐水里,可数日不谢。 (5)新买的玻璃器皿,用盐煮一煮,不易破裂。 (6)洗有颜色的衣服,先用5%盐水浸泡10分钟,然后再 洗,则不易掉色。 (7)洗有汗渍的白衣服,先在5%的盐水中揉一揉,再用 肥皂洗净,就不会出现黄色汗斑。 (8)将胡萝卜砸碎拌上盐,可擦去衣服上的血迹。 (9)铜器生锈或出现实用黑文档点,用盐可以擦掉。
3.溶解,加入氯化钙. 产生沉淀的是Na2CO3
Na2CO3+CaCI2=CaCO3 +2NaCl
实用文档
阴离子的检验
CO32-的检验
加入盐酸,生成的气体通 过澄清石灰水,生成乳白色浑浊。
如果可能有亚硫酸根, 通入品红溶液,溶液不褪色 就是碳酸根,褪色是亚硫酸
根
实用文档
阴离子的检验
HCO3-的检验
发酵粉的主要成分、治疗胃酸过 多的药剂
泡沫灭火剂的重要原料
可作作补钙剂。石灰石、大理石 作作建筑材料、也用于实验室制 取二氧化碳
实用文档
实用文档
碳酸钙与盐酸反应 CaCO3+2HCl=CaCl2+H2O+CO2↑
请书写出碳酸钠、碳酸氢钠与盐酸反应的化学方程式
Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑
