蛋白质专题——受体.pdf
高三生物《蛋白质专题》

第7讲蛋白质专题知识网络知识点睛一、蛋白质的结构(一)元素组成:均含C、H、O、N,少数含S,一些蛋白被磷酸化修饰后具有P元素。
追踪蛋白质合成运输过程时常用3H标记的氨基酸(噬菌体的外壳蛋白用35S标记)。
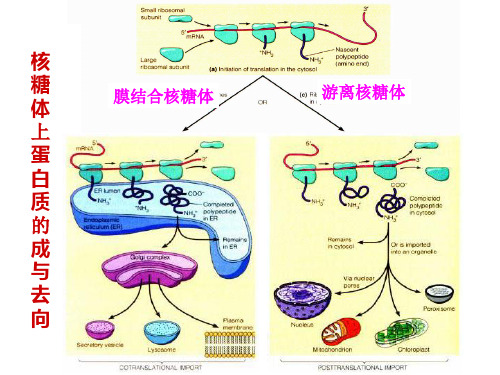
(二)氨基酸的脱水缩合1.核糖体是氨基酸脱水缩合的场所。
2.细胞内的蛋白质按合成后的功能和去向分成两类:一类是胞内蛋白,由游离核糖体合成,另一类蛋白为分泌蛋白和膜蛋白,由附着于内质网上的核糖体合成。
3.核糖体合成的直接产物是多肽,需要运输到内质网、高尔基体,加工成具有特定空间结构的蛋白质,从而实现其功能。
4.相关计算(1)脱水数=肽键数=氨基酸数-肽链数116肽链数氨基酸数肽键数脱水数氨基酸平均分子量蛋白质相对分子质量氨基数羧基数m n n-m n-m a na-(n-m)×18 至少m个至少m个(2)多肽种类的计算如:有5种氨基酸,组成的三肽有53=125种,如果氨基酸种类不重复则有5×4×3=60种(3)氨基酸数、mRNA的碱基数和DNA的碱基数比较内容数量基因中能编码蛋白质的碱基数6mmRNA上的碱基数3m蛋白质中的氨基酸数m①基因中部分序列不转录,准确的说,基因上碱基数目比对应的mRNA上碱基数目的2倍还要多一些;②真核基因编码区中的内含子只转录成前体mRNA,但不翻译;③翻译时,mRNA上的终止密码子不决定氨基酸,准确的说,mRNA上的碱基数目比对应的蛋白质中氨基酸数目的3倍还要多一些。
基因上的碱基数目比对应的蛋白质中氨基酸数目的6倍还要多一些。
因此,在回答问题时,应加上“最多”或“至少”。
如:mRNA上有n个碱基,转录产生它的基因中至少有2n个碱基;该mRNA指导合成的蛋白质中最多有n/3个氨基酸。
(三)多肽的加工修饰1.肽段的切除:由专一性的蛋白酶催化,将部分肽段切除,使蛋白质能够正确盘曲折叠,形成有功能的蛋白质。
(1)胰岛素的合成(2)血液中的凝血酶原2.甲硫氨酸的切除:当起始密码子AUG对应的氨基酸是甲硫氨酸,使得多肽链合成时第一个氨基酸是甲硫氨酸。
专题1 细胞的组成、结构和功能

结 构 蛋 白
根本原因
物种水平 生态系统水平
宏观 水平
场所 条件 过程 产物 意义
生物多样性
蛋白质
蛋白质代谢
功能 动的承担者
一切生命活 某些 激素 功 能 蛋 白
生物合成
应用
酶
消 化
吸 收
运 输
利 用
排 泄
一、生命中的蛋白质
蛋白质是细胞和生物体中最重要的物质,它对生命 的重要性体现在两个字上:质与量上。 质: 蛋白质是一切生命活动的体现者,有什么样的蛋白质 就能表达出什么样的生物性状。 量: 1、无机盐 1—1.5% 2、糖类和核酸 1—1.5% 无机盐 糖类和核酸 3、脂类 1—2% 脂类 蛋白质 4、蛋白质 7—10% 水 5、水 80—90%
五、蛋白质代谢
二、蛋白质专题
知 识 网 络
性质
直接原因 分子 水平 基 本 组 成 元 素 基 本 组 成 单 位 化 学 结 构 空 间 结 构
双缩脲试剂
血红蛋白 肌肉蛋白 染色体蛋白 核糖体蛋白 载体蛋白 …… 胰岛素 生长激素 …… 各种消化酶 光合作用酶 呼吸作用酶 解旋酶 ……
分子结构
鉴定
细胞膜内质网膜核膜高尔基体膜线粒体膜直接转化直接转化通过小泡间接转化紧密相依返回目录靶细胞胰岛b细胞肝细胞血液受体过敏原释放组织胺抗体信号被传递到大脑的高级中枢信号在球囊中被转换嗅觉受体细胞被激活并传送电信号嗅觉受僧帽体细胞细胞气味物质结合到受体上含有气味分子的空气传入神经纤维纤毛上有受体嗅神经嗅觉系统组织示意图例1细胞中的rna分子从产生部位到作用场所需要穿过多少层磷脂双分子层a0b4c5d6例2人体组织细胞如骨骼肌细胞有氧呼吸时需要的c从外界进入该细胞参与反应各自至少需要通过多少层生物膜返回目录小肠黏膜上皮细胞毛细血管壁细胞葡萄糖红细胞组织液组织细胞线粒体肺泡壁二细胞器与物质代谢叶绿体
蛋白质结构与功能——受体

• α亚基具有GTP酶活性,能催化所结合的GTP水解, 恢复无活性的三聚体状态
G蛋白偶联系统的组成:膜结合机器
效应物 蛋 白 分 子 开 关
G
G蛋白循环(G protein cycle)
磷脂酶C-β催化PIP2水解生成DAG和IP3
处于静息状态的磷脂肌醇信号转导系统
IP3和DG的作用
用于PIP2再合成
胞质溶胶中IP3的命运
Ca2+信号的消除
蛋白激酶C激活特定基因转录的两种途径
肝细胞中两个第二信使 的协同作用,促进糖原 分解并抑制糖原合成
某些激活磷脂酶C的信号分子
信号分子 肾上腺素 加压素 PDGF 乙酰胆碱 凝血酶
phosphodiesterase)。
cAMP途径的信号解除方式
• 通过cAMP磷酸二酯酶(cAMP phosphodiesterase,PDE)将cAMP的环破坏,形成 5’-AMP。
• 通过抑制型的信号作用于Ri,然后通过Gi起作用。
• 在某些细胞中,G蛋白不仅可激活其效应物酶的 活性,也可抑制其活性。因此,G蛋白偶联系统
• 离子通道偶联型受体又可分为阳离子通道,如乙酰胆碱、谷氨酸和五羟色胺 的受体以及阴离子通道,如甘氨酸和γ-氨基丁酸的受体
乙酰胆碱受体结构模型
乙酰胆碱受体的三种构象
神经肌肉接点处的离子通道型受体
γ- 氨基丁酸(GABA)受体结构
离
①动作电位到达突触末 端,引起暂时性的去极
子 化;②去极化作用打开
G蛋白偶联受体信号转导系统的特点
• 系统由三个部分组成:7次跨膜的受体、G蛋白和 效应物(酶)
G蛋白偶联受体的结构与功能_20_省略_2年诺贝尔化学奖相关研究成果简介_王珑珑

第24卷 第12期2012年12月V ol. 24, No. 12Dec., 2012生命科学Chinese Bulletin of Life Sciences文章编号:1004-0374(2012)12-1373-07G 蛋白偶联受体的结构与功能——2012年诺贝尔化学奖相关研究成果简介王珑珑,黄 旲*(中国科学院上海生命科学研究院生物化学与细胞生物学研究所,上海 200031)摘 要: 2012年的诺贝尔化学奖授予了美国科学家Robert J. Lefkowitz 以及Brian K. Kobilka ,以表彰他们在“G 蛋白偶联受体”研究中作出的突出贡献。
G 蛋白偶联受体是人体中分布最广、地位最重要的膜蛋白受体,其著名的7次跨膜结构使得人人了解了其复杂性,同时,它所介导的各种信号通路也使得其有着重大的研究和临床价值。
通过简单介绍G 蛋白偶联受体的结构和功能方面的一些概况,来对其进行一些讨论。
关键词:G 蛋白偶联受体;G 蛋白;7次穿膜结构受体中图分类号:Q51 文献标志码:AStructure and function of g-protein coupled receptorWang Long-Long, Huang Ying*(Shanghai Institute of Biochemistry and Cell Biology, Shanghai Institutes of Biological Sciences, Chinese Academy ofSciences, Shanghai 200031, China)Abstract: The 2012 Nobel Prize in Chemistry has been awarded to American scientists Robert J. Lefkowitz and Brian K. Kobilka “groundbreaking discoveries that reveal the inner workings of an important family of such receptors: G-protein-coupled receptors (GPCR)”. The structure of GPCRs contains a seven-transmembrane domain, which pass through the cell membrane seven times. GPCRs are involved in a variety of physiological processes by sensing the ligand outside the cell and activating the downstream signal transduction pathway inside the cell. This review will summarize the structure and function of GPCRs and discuss their application in the treatment of human diseases and clinical medicine.Key words: G protein-coupled receptor; G protein; seven-transmembrane domain receptor; 7TM receptor收稿日期:2012-11-29基金项目:国家重大科学研究计划(“973项目”)(2011-CB966304;2012CB910502);上海浦江人才计划(11PJ1410600)*通信作者:E-mail: huangy@2012年的诺贝尔化学奖授予了美国科学家Robert J. Lefkowitz 以及Brian K. Kobilka ,以表彰他们在“G 蛋白偶联受体”研究中作出的突出贡献。
专题1.3 生命活动的承担者——蛋白质(必刷试题)-2021年高考生物大一轮复习紧跟教材(解析版)

2021年生物高考一轮复习专题1.3 生命活动的承担者——蛋白质A组基础巩固练1.(2020年高考预测)下列关于肽和蛋白质的叙述,正确的是()A.α-鹅膏蕈碱是一种环状八肽,含有8个肽键B.蛋白质是由2条或2条以上多肽链构成的C.蛋白质变性是由于肽键的断裂造成的D.变性蛋白质或多肽不能与双缩脲试剂发生反应1【答案】A【解析】肽链盘曲折叠形成具有一定空间结构的蛋白质,蛋白质也可仅含有一条肽链,B错误;蛋白质变性是空间结构被破坏,氨基酸之间形成的肽键并没有断裂,C错误;变性蛋白质只是空间结构发生改变,仍能与双缩脲试剂产生紫色反应,D错误。
2.如图表示一个由200个氨基酸构成的蛋白质分子。
下列叙述正确的是()A.该分子中含有198个肽键B.这200个氨基酸中至少有200个氨基C.合成该蛋白质时分子量减少了3 582D.该蛋白质中至少含有3个—NH22【答案】C【解析】由题图看出该蛋白质有两条肽链并且2条肽链由1个肽键连接,链内肽键198个,链间肽键1个,共199个肽键,A错误;因链间的肽键是R基上的氨基和羧基形成的,所以200个氨基酸中至少有201个氨基,B错误;缩合成该蛋白质时脱去水分子199个,相对分子质量减少了199×18=3 582,C正确;该蛋白质有两条肽链,至少含有2个—NH2,D错误。
3.(2020年高考预测)植物A被害虫咬伤后,受伤部位分泌的多肽S能激活相邻细胞内蛋白酶抑制剂基因,增加蛋白酶抑制剂的合成,从而抑制害虫消化道中蛋白酶的活性。
据此分析正确的是() A.多肽S和双缩脲试剂可发生反应,产生砖红色沉淀B.多肽S在植物A细胞间的信息交流中发挥作用C.多肽S基因是在害虫的攻击、诱导下植物A突变产生的D.多肽S作为化学信息调节植物A与害虫的种间关系3【答案】B【解析】多肽S含有肽键,能与双缩脲试剂发生紫色反应,A错误;根据题干信息“受伤部位分泌的多肽S 能激活相邻细胞内蛋白酶抑制剂基因”,说明多肽S是植物A细胞释放的、能使相邻细胞代谢改变的信号分子,在植物A细胞间的信息交流中发挥作用,B正确;植物A细胞本身具有多肽S基因,多肽S是在害虫的攻击、诱导下,植物A细胞的多肽S基因选择性表达产生的,C错误;多肽S是植物体内细胞间信息交流的信号分子,不是生态系统中的化学信息,因此不能作为化学信息调节植物A与害虫的种间关系,D 错误。
细胞内蛋白质分选和运输-细胞生物学-讲义1-10
信号识别颗粒(SRP):细胞质基质中的核蛋白复合体,
内质网与蛋白合成
识别信号肽、核糖体。
2.跨膜蛋白到内质网膜的运输 内质网与蛋白合成
信号肽
SRP SRP受体
跨膜蛋白
跨膜蛋白有多种插入内质网膜的方式,决定了转移到 细胞器膜上以及质膜上后膜蛋白分布的不对称性。
蛋白质在 游离核糖体 上合成 还是在 附着核糖体
进出细胞核的蛋白质分别含有核定位信号和核输出信号, 可为信号肽,也可为信号斑;不被切除,可反复使用。 核输入受体识别核定位信号,核输出受体识别核输出信号。
第三节 细胞内蛋白质的穿膜运输
蛋白质穿过细胞器的膜从细胞质基质进入细胞器内 的运输方式称为穿膜运输(transport àtravers la membrane ),靶细胞器膜上存在蛋白质转运子,识别 分选信号。
"for the discovery that proteins have intrinsic signals that govern their transport and localization in the cell"
USA Rockefeller University New York, NY, USA; Howard Hughes Medical Institute
细胞质基质
线粒体
பைடு நூலகம்
过氧化物酶体
合成中 蛋白质
细胞外 蛋白质
细胞核
2.共翻译转运的蛋白质运输途径
内体
溶酶体
内质网
高尔基体
细胞表面
3.蛋白质的胞吞途径 分泌颗粒
生物合成 -分泌途径
细胞外
内体
溶酶体
三、细胞内蛋白质的运输方式
蛋白质与蛋白质作用
与G蛋白偶联的受体作用机理:
G-蛋白 的两种 构象 配体 + 受体 (-GDP) 非活化型
配体-受体复合物
(-GTP) + 活化型
GDP
配体-受体
(复合物)
GDP Pi
GTP
G蛋 白 循 环 示 意 图
效应分子:
腺苷酸环化酶
(adenylate cyclase, AC) 磷脂酰肌醇磷脂酶C (phosphatedyl inositol phospholipase, PI-PLC)
一、受体的分类、一般结构及功能
膜受体 —— 位于细胞质膜
胞内受体 —— 位于细胞浆和细胞核中
(一)膜受体
1、环状受体
配体依赖性离子通道(配体门控离子通道),
主要受神经递质的信息物质直接调节。
在神经冲动的快速传递中起作用。
2、七个跨膜 -螺旋受体( 蛇型受体,serpentine
receptor) —— G-蛋白偶联受体 (1)结构:
1、维持染色质的结构稳定 2、对特定基因起阻遏作用——关闭基因 一、DNA与支架蛋白(原核) 支架蛋白与DNA结合后使染色体保持紧密状态。 二、DNA与蛋白质(真核) 染色体中DNA与蛋白质结合构成核小体 核小体中的蛋白质 组蛋白(Histone):N端富含碱性氨基酸,C端富含酸性氨 基酸,共5种。 非组蛋白(Nohistone):不均一,有种属和器官特异性
FGF——成纤维细胞生长因子
(2)非催化型受体 该类受体缺乏内在酶活性,但与配体
结合后可引起其同源二聚体形成,与酪氨酸
蛋白激酶偶联而表现激酶的活性。
(二)、胞内受体
由400-1000个残基组成的单体蛋白,多为反式作用因子。
蛋白质相互作用的结构与功能机制
蛋白质相互作用的结构与功能机制蛋白质是生命体中最基本的有机物质之一,广泛参与生物体内的各种生理过程。
蛋白质相互作用是生物体内最基本的生化反应之一,对于维持生物体的正常功能至关重要。
本文将从蛋白质相互作用的结构与功能机制入手,探讨蛋白质相互作用的研究现状,及其在药物研发、生物信息学等领域的应用。
一、蛋白质相互作用的结构蛋白质分子需要与其他分子相互作用才能发挥生物学功能。
蛋白质相互作用的结构与功能机制一直是生命科学研究的重点。
目前已经发现了多种蛋白质相互作用的结构形式,其中,静电相互作用、氢键相互作用和范德华力相互作用是重要的相互作用类型。
(1)静电相互作用静电相互作用是指电荷相同的孪生离子之间产生互斥作用,而电荷相反的离子之间则会产生吸引力。
在蛋白质分子中,由于其化学性质的不同,蛋白质分子的不同区域会带有正电荷或负电荷。
当这些蛋白质区域之间产生相互作用时,便会产生静电相互作用。
静电相互作用在蛋白质稳定性的维持中起着重要作用。
例如,在激素受体内,蛋白质分子上的氨基酸残基会与相应的激素分子产生静电相互作用,从而诱导激素受体发生构象改变,转运激素分子。
(2)氢键相互作用氢键是一种通过水分子中的氢与一个电负性较强的原子结合起来的化学键。
在蛋白质相互作用中,氢键是一种相对较弱的相互作用,但氢键又是在蛋白质相互作用中最重要的氢键类型之一。
氢键通过带有氢原子的蛋白质氨基酸残基与带有氧或氮化物基团的氨基酸残基之间的相互作用实现。
氢键相互作用的重要作用之一是维持蛋白质的三维构象,也在酶反应、DNA结构等方面起着重要作用。
(3)范德华力相互作用范德华力是蛋白质分子相互作用的另一种形式,属于分子与分子之间的非共价相互作用。
范德华力是由于蛋白质分子中的带电粒子与偶极子相互作用引起的。
范德华力相互作用在蛋白质的可折叠性、类型、配位反应等方面起着重要作用,也在蛋白质的折叠、聚合体的形成等领域里扮演重要的角色。
二、蛋白质相互作用的功能机制蛋白质相互作用的功能机制主要包括识别、结合和促进受体功能。
蛋白质
3. GSH分子中含有一SH基,故能参与体内一些氧化还原反应。
4.血红蛋白与肌红蛋白均为氧的载体,前者是变构蛋白,而后者不是。
5.从某些微生物中分离得到的多肽抗菌素往往为环状肽链,并含有D—型氨基酸。
6.双缩脲反应是肽和蛋白质特有的反应,所以二肽也有双缩脲反应。
7.免疫球蛋白由两条轻链和两条重链所组成,抗体与抗原的结合只涉及轻链,因为它有可变区域,重链的序列基本上都是恒定的,只起维持结构稳定的作用。
错误
15
错误
1.一个化合物如能和茚三酮反应生成紫色,说明这化合物是氨基酸、肽或蛋白质。
2.一个蛋白质样品经酸水解后,能用氨基酸自动分析仪准确测定它的所有氨基酸。3.多肽类激素,作为信使分子,须便于运转,所以都是小分子。由于分子小,较易通过靶细胞膜,可以深入内部,启动生化作用
4.球状蛋白分子含有极性基团的氨基酸残基在其内部,所以能溶于水。片层结构仅能出现在纤维状蛋白中,如丝心蛋白,所以不溶于水
4.脯氨酸不能参与α螺旋,它使α螺旋弯曲(bend),在肌红蛋白和血红蛋白的多肽链中,每一个弯曲处并不一定有脯氨酸,但是每个脯氨酸却产生一个弯曲。
5.胰岛素原是翻译后的原始产物
6.细菌细胞壁中的肽聚糖是一类线性多聚糖链通过小肽的广泛交联而成的巨大分子,其中氨基酸组成既有L型也有D型
7.L—氨基酸之间的肽键是单键,所以能自由旋转。
13.用纸电泳法分离氨基酸主要是根据氨基酸的极性不同。
14.“必需氨基酸”的含义是指:合成蛋白质必不可少的一式存在。
16.当溶液的pH值大于某一可解离基团的pKa值时,该基团有一半以上被解离。
17.细胞核内的组蛋白对阻遏基因的表达起着重要作用,所以需要种类繁多的组蛋白与这些基因结合,或在某些氨基酸残基上进行修饰子以调节18.胶原蛋白中有重复的疏水性氨基酸顺序出现,所以形成大面积的疏水区,相互作用使三股肽链稳定及整齐排列
高中生物课件-第3讲 蛋白质-高三一轮复习
核心知识一遍过高考一轮复习——必修一《分子与细胞》——第三讲 蛋白质v1.阐明蛋白质通常由21种氨基酸分子组成,它的功能取决于氨基酸序列及其形成的空间结构,细胞的功能主要由蛋白质完成。
必备知识考点一 蛋白质的结构、功能考点二 蛋白质的相关计算考点一蛋白质的结构、功能1.蛋白质的功能肌肉头发构成细胞和生物体结构的重要物质,称之为结构蛋白胃蛋白酶等消化酶血红蛋白运输氧气抗原抗体图中黄色区域的部分细胞分泌胰岛素,调节血糖平衡消化道蛋白质、脂肪、糖类维生素、水、无机盐氨基酸、甘油脂肪酸、葡萄糖残渣排遗(粪便)消化吸收血液机体组织细胞利用蛋白质必须经过消化成为各种氨基酸,才能被人体吸收和利用。
吸收判断:糖尿病病人既能注射,也能口服胰岛素因为胰岛素是一种蛋白质,口服会在消化道里以蛋白质的形式被消化成氨基酸,而失去胰岛素的功能。
CH 2N COOH HH 甘氨酸CH 3CH 2N COOH H 丙氨酸亮氨酸缬氨酸C H 2N COOH CH H CH 3CH 3CH 2C H 2N COOHH CH CH 3CH 3氨基酸结构通式:C HCOOH H 2N R每种氨基酸分子至少都含有一个氨基(-NH 2)和一个羧基(-COOH),并且都有一个氨基和一个羧基连接在同一个碳原子上,这个碳原子还连接一个氢原子和一个侧链基团。
2.蛋白质的结构(1)组成蛋白质的氨基酸哪些是组成蛋白质的氨基酸?写出它们的R基。
C H NH2COOHCH2SH C H NH2COOHCH2SHCH NH2COOHCH2OHC H NH2H CH2COOH√√××-CH 2-SH-CH 2-OH2.蛋白质的结构(1)组成蛋白质的氨基酸组成蛋白质的氨基酸约有21种。
必需氨基酸:有8种氨基酸是人体细胞不能合成的(婴儿有9种,多一种组氨酸),必须从外界环境中直接获取,这些氨基酸叫做必需氨基酸。
(携(缬氨酸)一(异亮氨酸)两(亮氨酸)本(苯丙氨酸)单(甲硫/蛋氨酸)色(色氨酸)书(苏氨酸)来(赖氨酸))非必需氨基酸:另外13种氨基酸是人体细胞能够合成的(氨基转换作用) , 叫做非必需氨基酸。
