泛素-蛋白酶体与蛋白酶体抑制剂
泛素_蛋白酶体及其抑制剂的分类与合成

·综述·泛素-蛋白酶体及其抑制剂的分类与合成李景, 张大永*, 吴晓明(中国药科大学药学院, 江苏南京 210009)摘要: 泛素-蛋白酶体是人体内降解蛋白质的主要途径, 通过该酶体来抑制蛋白质的降解是近年来治疗癌症的新策略, 同时还扩大了化学治疗药的靶标。
该蛋白酶体调控着人体内非必需或废弃细胞蛋白的降解, 这一过程在许多癌症细胞中往往调控紊乱。
基于这个靶标, 治疗多发性骨髓瘤的二肽硼酸类化合物Bortezomib, 在2003年得到了FDA的批准, 成为该靶点第一个成功上市的药物。
随后一系列具有蛋白酶20S抑制活性的合成小分子化合物或提取的天然化合物进入临床实验。
本文主要综述了蛋白酶体的结构、蛋白酶抑制剂的作用机制及其抑制剂的合成与分类。
关键词: 蛋白质的降解; 泛素-蛋白酶系统 (UPP); 抑制剂; 抗肿瘤活性中图分类号: R916 文献标识码:A 文章编号: 0513-4870 (2009) 12-1313-07Classification and synthesis of ubiquitin-proteasome inhibitorLI Jing, ZHANG Da-yong*, WU Xiao-ming(School of Pharmacy, China Pharmaceutical University, Nanjing 210009, China)Abstract: The inhibition of protein degradation through the ubiquitin-proteasome pathway is a recently developed approach to cancer treatment which extends the range of cellular target for chemotherapy. This therapeutic strategy is very interesting since the proteasomes carry out the regulated degradation of unnecessary or damaged cellular proteins, a process that is dysregulated in many cancer cells. Based on this hypothesis, the proteasome complex inhibitor Bortezomib was approved for use in multiple myeloma patients by FDA in 2003.Drug discovery programs in academy and the pharmaceutical industry have developed a range of synthetic and natural inhibitors of the 20S proteasome core particle that have entered human clinical trials as significant anti-cancer leads. The main results from the use of proteasome inhibition in cancer chemotherapy, the structure of several proteasome inhibitors and their synthesis is going to be reviewed in this paper.Key words: protein degradation; ubiquitin-proteasome pathway; inhibitor; anti-cancer activity1泛素-蛋白酶体的结构和功能人体内各种细胞的稳态以及功能的正常发挥有赖于机体内严格的分子调节机制, 其中一个重要的方面就是各种生理过程中蛋白质的及时降解, 如细胞分裂、生长发育、信号的转导及细胞的凋亡等过程[1]。
泛素-蛋白酶体途径的组成及其生物功能

泛素-蛋白酶体途径的组成及其生物功能董合玲;徐晓阳【摘要】泛素-蛋白酶体途径(UPP)是20世纪70年代末期新发现的一种细胞内蛋白降解途径,在多种蛋白质降解中发挥重要作用,具有高度特异性.UPP介导的细胞蛋白降解是一个复杂、缜密的调控过程.UPP可识别、标记、进而降解那些被泛素化的蛋白质.它在抗原提呈、细胞周期、NF-kB代谢等方面发挥重要调控作用,而且UPP的异常与许多疾病如肿瘤、脓毒症、骨骼肌损伤等的致病机制有关.就UPP的组成、作用机制及其功能进行综述.【期刊名称】《南京体育学院学报(自然科学版)》【年(卷),期】2011(010)003【总页数】3页(P35-37)【关键词】泛素-蛋白酶体途径;降解;作用机制;疾病【作者】董合玲;徐晓阳【作者单位】华南师范大学体育科学学院,广东广州510006;华南师范大学体育科学学院,广东广州510006【正文语种】中文【中图分类】G804.211 前言蛋白的合成和降解是一个同时发生的连续的过程,正常情况下,两者保持平衡。
正常成年人体内,每天的蛋白质合成和降解量可达3.5-4.5g/kg,相当于1.0-1.5kg肌肉[1]。
失活的蛋白质如需尽快被降解除去,这就需要一系列的蛋白质降解途径的参与。
机体细胞内蛋白质降解主要有三条途径,分别是溶酶体途径,非溶酶体、非能量依赖性的Ca2+依赖性蛋白酶途径和非溶酶体、能量依赖性的泛素-蛋白酶体途径(UPP)[2-3]。
UPP是20世纪70年代末期新发现的一种细胞内蛋白降解途径,且在多种蛋白质降解中发挥重要作用,而且具有高度特异性。
它在抗原提呈、细胞周期、NF-kB代谢、基因转录及表达等方面发挥重要调控作用,而且UPP的异常与许多疾病如肿瘤、脓毒症、骨骼肌损伤、炎症、心肌病等的致病机制有关。
2 泛素-蛋白酶体途径(UPP)的组成(The composition of UPP)UPP包括泛素(ubiquitin,Ub)、泛素活化酶(Ub-activating enzyme,E1)、泛素结合酶(Ub-conjugating enzyme,E2)、泛素连接酶(Ub-ligating enzyme,E3)、26S蛋白酶体(26S proteasomes)和去泛素化酶(DUBs)。
小分子靶向治疗药物简介
化学抗肿瘤药物经过半个多世纪的发展,已经进入靶向治疗药物时代。
小分子靶向药物在临床上的应用日益增多,在一些肿瘤类别中已经进入一线用药地位,比如肾癌、慢粒白、多发性骨髓瘤等。
本文对小分子靶向治疗药物做一综述。
小分子靶向治疗药物简介一、受体酪氨酸激酶抑制剂作为抗肿瘤药物靶点的酪氨酸激酶有两类,一类是受体酪氨酸激酶(RTKs),另一类是非受体酪氨酸激酶(nrRTKs)。
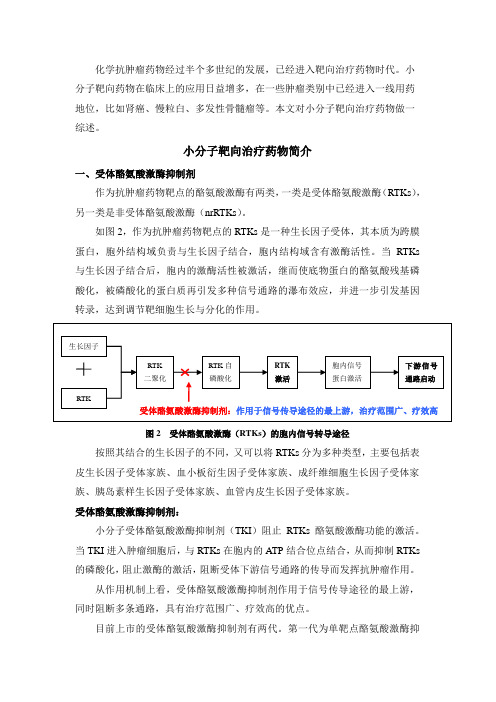
如图2,作为抗肿瘤药物靶点的RTKs是一种生长因子受体,其本质为跨膜蛋白,胞外结构域负责与生长因子结合,胞内结构域含有激酶活性。
当RTKs 与生长因子结合后,胞内的激酶活性被激活,继而使底物蛋白的酪氨酸残基磷酸化,被磷酸化的蛋白质再引发多种信号通路的瀑布效应,并进一步引发基因转录,达到调节靶细胞生长与分化的作用。
图2 受体酪氨酸激酶(RTKs)的胞内信号转导途径按照其结合的生长因子的不同,又可以将RTKs分为多种类型,主要包括表皮生长因子受体家族、血小板衍生因子受体家族、成纤维细胞生长因子受体家族、胰岛素样生长因子受体家族、血管内皮生长因子受体家族。
受体酪氨酸激酶抑制剂:小分子受体酪氨酸激酶抑制剂(TKI)阻止RTKs酪氨酸激酶功能的激活。
当TKI进入肿瘤细胞后,与RTKs在胞内的ATP结合位点结合,从而抑制RTKs 的磷酸化,阻止激酶的激活,阻断受体下游信号通路的传导而发挥抗肿瘤作用。
从作用机制上看,受体酪氨酸激酶抑制剂作用于信号传导途径的最上游,同时阻断多条通路,具有治疗范围广、疗效高的优点。
目前上市的受体酪氨酸激酶抑制剂有两代。
第一代为单靶点酪氨酸激酶抑制剂,如吉非替尼、厄洛替尼。
表已上市的酪氨酸激酶抑制剂注:EGFR:表皮生长因子受体,属HER家族;VEGFR:血管内皮生长因子;PDGFR:血小板衍生因子;HER2:HER家族的一种受体;Abl-Bcr:一种非受体酪氨酸激酶;Raf:酪氨酸激酶的下游信号通路中的一种蛋白;Flt-3:Src:一种非受体酪氨酸激酶;c-kit:Ret:胶质细胞源性神经营养因子的受体吉非替尼为EGFR酪氨酸激酶抑制剂,主要用于非小细胞肺癌,对酪氨酸激酶基因编码区突变型肿瘤的有效率高达80%以上。
去泛素化酶
泛素-蛋白酶体及其抑制剂一、内容介绍泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是真核细胞内蛋白质选择性降解的重要途径之一。
UPS广泛参与细胞凋亡、主要组织相容性复合物(MHC)-Ⅰ类抗原的递呈、细胞周期以及细胞内信号传导等多种生理过程。
蛋白酶体是UPS的核心组成部分,负责识别并降解带有K48泛素链标记的蛋白质底物,对于维持细胞功能至关重要。
泛素(ubiquitin,Ub)则是UPS的另一个重要组成部分,它是一个由76个氨基酸残基组成的高度保守的蛋白质,研究发现泛素在真核细胞内主要以多聚泛素链发挥作用。
其中以K48位连接的泛素链(K48泛素链)主要起到蛋白质降解标签的作用,当底物蛋白质与K48泛素链结合后,就会被蛋白酶体识别并降解。
研究发现,泛素链的长短决定了蛋白质底物同蛋白酶体的亲和性。
泛素链越长,蛋白质底物就越容易被蛋白酶体识别并降解。
泛素链的延长主要由泛素活化酶E1、泛素结合酶E2和泛素连接酶E3来完成;而泛素链的剪切则主要由去泛素化酶DUB完成。
由于E1-E2-E3及DUB的重要调控作用,它们已经成为药物设计的潜在靶点,其抑制剂能够通过干扰底物蛋白质的降解来抑制恶性疾病的发生,顾有可能成为治疗恶性疾病的治疗药物。
泛素链的另外一种形式——K63泛素链的作用被认为是参与许多重要的细胞信号通路,当底物蛋白质与K63泛素链结合后,就会被特异的调控因子识别,从而启动相应的信号通路。
泛素链去泛素化酶泛素链接酶1、产品质量有保障——产品均由专家研发生产,均可提供试用装2、性价比高——价格比国外同样的产品便宜30%左右,关税、国际运费等均省了3、订货周期短——备有大量现货4、技术健全——泛素相关产品齐全,技术成熟5、相信自己——中国自己的产品跟国外的一样好。
泛素-蛋白酶体

蛋白酶体蛋白酶体是在真核生物和古菌中普遍存在的,在一些原核生物中也存在的一种巨型蛋白质复合物。
在真核生物中,蛋白酶体位于细胞核和细胞质中。
蛋白酶体的主要作用是降解细胞不需要的或受到损伤的蛋白质,这一作用是通过打断肽键的化学反应来实现。
能够发挥这一作用的酶被称为蛋白酶。
蛋白酶体是细胞用来调控特定蛋白质和除去错误折叠蛋白质的主要机制。
经过蛋白酶体的降解,蛋白质被切割为约7-8个氨基酸长的肽段;这些肽段可以被进一步降解为单个氨基酸分子,然后被用于合成新的蛋白质。
需要被降解的蛋白质会先被一个称为泛素的小型蛋白质所标记(即连接上)。
这一标记反应是被泛素连接酶所催化。
一旦一个蛋白质被标记上一个泛素分子,就会引发其它连接酶加上更多的泛素分子;这就形成了可以与蛋白酶体结合的“多泛素链”,从而将蛋白酶体带到这一标记的蛋白质上,开始其降解过程。
从结构上看,蛋白酶体是一个桶状的复合物,包括一个由四个堆积在一起的环所组成的“核心”(右图中蓝色部分),核心中空,形成一个空腔。
其中,每一个环由七个蛋白质分子组成。
中间的两个环各由七个β亚基组成,并含有六个蛋白酶的活性位点。
这些位点位于环的内表面,所以蛋白质必须进入到蛋白酶体的“空腔”中才能够被降解。
外部的两个环各含有七个α亚基,可以发挥“门”的作用,是蛋白质进入“空腔”中的必由之路。
这些α亚基,或者说“门”,是由结合在它们上的“帽”状结构(即调节颗粒,右图中红色部分)进行控制;调节颗粒可以识别连接在蛋白质上的多泛素链标签,并启动降解过程。
包括泛素化和蛋白酶体降解的整个系统被称为“泛素-蛋白酶体系统”。
蛋白酶体降解途径对于许多细胞进程,包括细胞周期、基因表达的调控、氧化应激反应等,都是必不可少的。
2004年诺贝尔化学奖的获奖主题就是蛋白质酶解在细胞中的重要性和泛素在酶解途径的作用,而三位获奖者为阿龙〃切哈诺沃、阿夫拉姆〃赫什科和欧文〃罗斯。
发现在发现泛素-蛋白酶体系统之前,细胞中的蛋白质降解被认为主要依赖于溶酶体,一种膜包裹的囊状细胞器,内部为酸性环境且充满了蛋白酶,可以降解并回收外源蛋白质以及衰老或损伤的细胞器。
2 通过泛素蛋白酶体降解调节FOXO蛋白稳定性

通过泛素蛋白酶体降解调节FOXO蛋白稳定性摘要:叉头框O族(FOXO)蛋白是经历进化过程而保存的转录因子。
在人类中,它们属于由FOXO1,FOXO3a,FOXO4和FOXO6组成的蛋白家族。
越来越多的证据表明,FOXO蛋白通过在转录水平调控基因表达,起到抑制肿瘤的作用,如:抑制细胞周期、凋亡、DNA修复和抵抗氧化应激等。
在人类原代肿瘤和肿瘤细胞株中,包括Akt、IκB激酶(IKK)和ERK等在内的多种蛋白激酶的活化,导致FOXO蛋白磷酸化,并通过E3连接酶如SKP2、MDM2的介导而泛素化。
从而导致FOXO 蛋白被泛素蛋白酶体系统降解,从而失去或削弱了抗肿瘤功能,使细胞的转化、增值和生存更加便利。
因此,FOXO蛋白的泛素化和降解在肿瘤发生中起到关键的作用,并在癌症治疗方面表现出可利用的价值。
1.引文对于人类肿瘤谱中的大多数肿瘤而言,它们的“人第10号染色体缺失的磷酸酶及张力蛋白同源基因”(PTEN)常常是突变或缺失的。
PTEN通过对抗磷酸肌醇3-激酶(PI3K)的作用,其主要功能表现为脂质磷酸酶。
PTEN的缺失导致质膜中磷脂酰肌醇(3,4,5)三羟甲基氨基甲烷磷酸盐(PIP3)水平的增加,从而导致蛋白激酶B(PKB或Akt)的活化。
Akt通过对下游一系列效应蛋白(包括FOXO转录因子)的活化或去活化的作用,对细胞存活起核心作用。
越来越多证据表明,FOXO蛋白通过调节基因表达(包括凋亡、抑制细胞周期、抵抗氧化应激、DNA修复等)而表现抑制肿瘤功能。
人类肿瘤细胞中PTEN缺失导致的Akt活化或更本质上的PI3K活化,导致FOXO 蛋白的磷酸化和抑制。
Akt磷酸化还诱导细胞核通过核孔复合体输出FOXO蛋白,此过程依赖14-3-3伴侣蛋白和输出受体——染色体区域维持蛋白1(出核因子1,核输出受体1,CRM1)。
因此,由于Akt介导的磷酸化和核输出,依赖核及转录的FOXO蛋白的抑制肿瘤的功能被废除(图1)。
泛素-蛋白酶体系统(UPS)是什么
泛素-蛋⽩酶体系统(UPS)是什么
泛素-蛋⽩酶体系统(UPS)是什么?
泛素-蛋⽩酶体系统(ubiquitin-proteasomesystem,UPS)是细胞内蛋⽩质降解的主要途径,参与细胞内80%以上蛋⽩质的降解。
该系统包括泛素、泛素活化酶E1,泛素结合酶E2,泛素-蛋⽩连接酶E3,26S蛋⽩酶体和泛素解离酶DUBs。
1970年代末和1980年代初,泛素-蛋⽩酶体系统在以⾊列技术⼯程学院(Technion–IsraelInstituteofTechnology)阿夫拉姆·赫什科的实验室中发现,由于他在发现泛素-蛋⽩酶体系统上的贡献,阿夫拉姆·赫什科获得了2004年度的诺贝尔化学奖。
泛素-蛋⽩酶体系统(ubiquitin-proteasomesystem,UPS)是细胞内⼀系列⽣命进程的重要调节⽅式,与疾病的发⽣发展关系密切。
研究证实泛素-蛋⽩酶体系统在⼼⾎管疾病中具有重要的病理⽣理学意义,可调节动脉粥样硬化、缺⾎后再灌注损伤、家族性⼼肌病、⼼肌肥厚和⼼脏衰竭等重要疾病的发⽣和发展。
另外,最新的研究表明,UPS的重要作⽤还在于其被充分利⽤后,可以代谢诸如毒素、脂肪、癌细胞在内的⼈体垃圾,另外代谢产⽣的能量可刺激细胞进⾏⾃我复制以完成⼈体的⾃我代谢修复功能。
蛋白质降解的机制和调节
蛋白质降解的机制和调节蛋白质是生物体内最为重要的有机分子之一,参与了许多生命活动。
然而,在生物体内,蛋白质不是一成不变的,而是会经历一系列复杂的调节和代谢过程。
其中,蛋白质降解是一个重要的过程,本文将介绍蛋白质降解的机制和调节。
一、蛋白质降解的机制1.泛素-蛋白酶体途径泛素-蛋白酶体途径是蛋白质降解的主要途径之一。
它主要涉及到两种分子:泛素和蛋白酶体。
泛素是一种小分子蛋白,它可以与需要降解的蛋白质结合,形成一个泛素-蛋白质复合物。
然后,这个复合物会被运输到蛋白酶体中,其中被蛋白酶体导致的蛋白酶水解降解后,相应的泛素会从复合物上被解离,可以再循环使用。
2.赖氨酸体系除了泛素-蛋白酶体途径外,还有一个重要的降解途径:赖氨酸体系。
赖氨酸是蛋白质分子中的一种氨基酸,有时也被称为“降解性氨基酸”,因为它可以被一种特殊的酶——赖氨酸脱氨酶(AAD)降解。
赖氨酸体系的分解具有很高的特异性,能够只降解含有特定氨基酸序列的蛋白质。
因此,在一些情况下,赖氨酸体系被认为是比泛素-蛋白酶体途径更为适合的降解策略。
二、蛋白质降解的调节1.翻译后修饰翻译后修饰是影响蛋白质降解的一个重要因素。
在翻译过程中,多种修饰机制会发生。
一些翻译后修饰对降解有一定的保护作用,而另一些会促进降解。
例如,泛素化通常是蛋白质降解的标志,在这种情况下,泛素修饰通常会促进降解。
而且,磷酸化通常会抑制降解;而其他修饰如糖基化和乙酰化则对降解有不同程度的影响。
2.蛋白酶的活性和选择性蛋白酶的活性和选择性也对蛋白质降解起到重要的作用。
不同的蛋白酶具有不同的降解特性,它们能够识别不同的氨基酸序列和结构。
因此,在不同的细胞环境中,可能存在不同种类和数量的蛋白酶,这些蛋白酶能够协调地降解特定的蛋白质,从而帮助细胞维持正常的生理状态。
3.细胞信号途径最后,细胞信号途径也可以调节蛋白质降解。
在许多情况下,信号分子可以激发或抑制蛋白质降解的关键步骤,从而影响蛋白质的代谢和降解速率。
泛素化和蛋白酶体所介导的蛋白质降解途径
泛素化和蛋白酶体所介导的蛋白质降解途
径
泛素化和蛋白酶体是两种重要的蛋白质降解途径。
泛素化是一种通过连接泛素分子来标记蛋白质的过程,而蛋白酶体则是一种特殊的细胞器,能够将被泛素标记的蛋白质降解为小分子。
泛素化是一种非常重要的蛋白质降解途径。
在这个过程中,泛素分子会被连接到目标蛋白质的特定位置上。
这个过程需要多个酶的参与,包括泛素激活酶、泛素连接酶和泛素去除酶。
泛素化的主要作用是标记蛋白质,使其能够被蛋白酶体识别并降解。
此外,泛素化还能够调节蛋白质的功能和稳定性,对于细胞的正常生理过程具有重要的作用。
蛋白酶体是一种特殊的细胞器,能够将被泛素标记的蛋白质降解为小分子。
蛋白酶体由多种蛋白质组成,其中最重要的是蛋白酶体核心复合物。
这个复合物包括多种蛋白质,其中最重要的是ATP酶和泛素连接酶。
这些蛋白质能够协同作用,将被泛素标记的蛋白质降解为小分子。
泛素化和蛋白酶体是两种非常重要的蛋白质降解途径。
它们能够协同作用,对于细胞的正常生理过程具有重要的作用。
在细胞中,泛素化和蛋白酶体能够清除不需要的蛋白质,维持细胞内环境的稳定性。
此外,它们还能够调节蛋白质的功能和稳定性,对于细胞的正常生理过程具有重要的作用。
因此,泛素化和蛋白酶体的研究对于
理解细胞生物学和疾病发生机制具有重要的意义。
mg132作用原理
mg132作用原理MG132作用原理。
MG132是一种广泛应用于生物学研究的蛋白酶抑制剂,能够抑制细胞内的蛋白酶活性,从而影响细胞内蛋白质的降解和稳定性。
其作用原理主要涉及到细胞内的蛋白质降解途径以及蛋白酶的作用机制。
首先,我们来了解一下细胞内的蛋白质降解途径。
细胞内的蛋白质降解主要通过泛素-蛋白酶体系统和蛋白酶体系统来完成。
泛素-蛋白酶体系统是一种主要负责降解细胞内异常或老化蛋白质的途径,它通过将泛素分子连接到目标蛋白上,然后将其送入蛋白酶体进行降解。
而蛋白酶体系统则是一种涉及到多种蛋白酶参与的复杂降解途径,能够降解细胞内的多种蛋白质。
MG132的作用机制主要是通过抑制蛋白酶的活性来影响蛋白质的降解和稳定性。
具体来说,MG132能够与蛋白酶结合,形成稳定的复合物,从而阻碍蛋白酶与其底物的结合和降解。
这种抑制作用能够使得细胞内的蛋白质得以稳定,延长其在细胞内的寿命。
除了影响蛋白质的降解外,MG132还能够对细胞内的一些信号通路产生影响。
研究表明,MG132可以抑制NF-κB信号通路的活化,从而影响细胞的炎症反应和免疫应答。
此外,MG132还能够影响细胞周期的调控,对细胞增殖和凋亡产生影响。
在生物学研究中,科研人员常常利用MG132来研究蛋白质降解途径、蛋白酶的作用机制以及相关的细胞信号通路。
通过对MG132的使用,可以更好地理解细胞内蛋白质代谢的调控机制,为相关疾病的治疗和药物研发提供理论基础。
总的来说,MG132作为一种蛋白酶抑制剂,通过影响细胞内的蛋白质降解途径和蛋白酶的活性,对细胞内的蛋白质稳定性和细胞信号通路产生影响。
它在生物学研究中具有重要的应用价值,为人们深入了解细胞生物学提供了重要工具和理论基础。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
泛素-蛋白酶体及其抑制剂沈子珒许啸声李稻审校上海交通大学医学院病理生理学教研室摘要:蛋白酶体与泛素化信号系统一起构成的泛素—蛋白酶体(UPP)是哺乳动物细胞内主要的蛋白水解酶体系,参与和调控细胞的增殖、分化和凋亡。
蛋白酶体是一个由20S 催化颗粒、11S调控因子和2个19S调节颗粒组成的ATP依赖性蛋白水解酶复合体。
蛋白酶体的活性状态对细胞功能正常维持是非常重要的。
26S蛋白酶体对蛋白的降解依赖于靶蛋白的泛素化和泛素化蛋白识别。
蛋白酶体抑制剂能通过抑制蛋白酶体活性进而干扰和影响细胞原有的功能,尤其对肿瘤细胞生长有明显的抑制作用。
同时,利用蛋白酶体抑制剂改变蛋白酶体的酶切位点活性也成为免疫、炎症等研究的热点。
蛋白酶体的抑制剂可分为天然化合物和合成化合物两类,其中Bonezomib(Velcade,PS-341)是近年研究较多的一种蛋白酶体抑制剂。
关键词:肿瘤蛋白酶体泛素蛋白酶体抑制剂PS-341泛素—蛋白酶体通路(Ubiquitin–proteasome pathway,UPP)的蛋白酶体(proteasome)是一种具有多个亚单位组成的蛋白酶复合体,蛋白酶体沉降系数为26S,故又称26S蛋白酶体。
蛋白酶体水解蛋白的前提是靶蛋白的泛素化。
在UPP中,各种靶蛋白质泛素化后,先被26S蛋白酶体的19S亚单位识别,随后泛素化靶蛋白脱泛素链和变性,进入20S亚单位的筒状结构内被降解成3~22个多肽。
由于蛋白酶体具有精确降解细胞内各种目的靶蛋白,进而参与基因转录和细胞周期调节,以及受体胞吞、抗原呈递等各种细胞生理过程[1]。
因此,应用蛋白酶体抑制剂改变其酶切位点活性已成为抗肿瘤治疗的研究热点,蛋白酶体是影响和改变细胞功能重要的目的靶标。
1.蛋白酶体组成1979年,Goldberg等首先报道在大鼠肝脏和网织红细胞中存在一种分子质量为700 kD的受A TP激活的中性蛋白水解酶。
此后,一些在形态、功能及免疫学特征上与之相同的颗粒通过不同途径被分离出来,被统一命名为蛋白酶体[2]。
在真核生物进化中,蛋白酶体具有高度的保守性,其简单形式甚至存在于古细菌和真细菌中。
真核细胞内的蛋白酶体分布于胞质与胞核内,有的与内质网或细胞骨架相结合,约占细胞蛋白质总量的1%。
有功能的26S蛋白酶体是由20S催化颗粒(catalytic particle, CP)、11S调控因子(11S regulator)和2个19S调节颗粒(regulatory particle, RP)组成,其分子量为2.4MD,是ATP依赖性蛋白水解酶复合体。
1.120S催化颗粒(20S CP)人类蛋白酶体CP的沉降系数为20S,分子量700~750kD。
它由α环和β环组成,每个环各有7个相同的亚单位,分别以α1-7β1-7β1-7α1-7顺序排列成圆桶状结构,20S CP中间由两个β亚单位环组成。
几乎所有β亚单位都含有一个N 端前导序列,尽管此序列在20S CP装配过程中被切除,但在引导真核生物β亚单位的正确折叠以及β与α亚单位的组装中有重要作用[3]。
当β亚单位的N端前导序列被切除后,Thr残基被暴露出来,Thr是酶的活性位点,分别存在于β环的内表面,使β亚单位具有类似的丝氨酸蛋白酶的催化作用[4]。
例如,β亚单位N端的折叠方式允许Thr的-OH对底物发动亲核反应形成半缩醛,而Thr的α-NH3可代替丝氨酸蛋白酶中His的咪唑基作为质子受体。
此外,活性位点附近的一个Lys残基与特定的丝氨酸蛋白酶中一样,也起着催化剂的作用。
目前认为,在20S CP内起催化作用的亚单位主要是β1、β2、β5。
不同的β亚单位的催化活性尽管不同,但能互相协调使蛋白酶体具有多种蛋白酶活性,如类糜蛋白酶活性(chymotrypsin-like, ChTL)、类胰蛋白酶活性(trypsin-like,TL)、肽-谷氨酰肽水解酶活性(post-glutamyl-peptide hydrolyzing,PGPH)、支链氨基酸肽酶活性、中性氨基酸切割活性。
在20S CP圆桶状的两端由α亚单位环组形成,环口的中央被α亚单位(α、α2、α3、α6、α7)的N末端肽链所占据,使α环的外侧完全关闭,阻止胞内非目的靶蛋1白质进入20S CP内,而遭到降解破坏。
不论在种间或种内,α类亚单位遗传特征均比β类亚单位更为保守。
1.211S调控因子在哺乳动物细胞内存在参与调控蛋白酶体功能的复合物,11S调控因子(REG或PA28)是其中之一。
11S调控因子的亚单位分子量为28KD,其亚单位分为:ERGα、ERGβ、ERGγ(Ki抗原)三种。
亚单位的氨基酸序列大部分具有同源性,但17-34残基为易变区,这也赋予亚单位的特异性。
ERGα和ERGβ可优先形成一个七瓣形调控复合物—11S调控因子[5],并结合到20S CP末端,而ERGγ不能与ERGα和ERGβ结合形成11S调控因子。
11S调控因子本身不具有催化和降解大分子蛋白的功能,但可激活蛋白酶体的蛋白酶活性,以及在促进抗原肽产生中起到重要的作用[5]。
Wilk等人认为,ERGβ低聚合体对蛋白酶体的活性有激活作用,而单体时却是蛋白酶体的强有力抑制物[6]。
1.319S调节颗粒(19S RP)19S RP(19S调节复合物、19S帽或PA700)分别由20个亚单位组成,分子量为700KD,位于20S CP的两端。
从酵母到人类,19S RP的多数亚单位具有高度的保守性。
19S RP形成盖部(1id)和基底部(base) 两个亚复合体。
19S RP基底部含有三倍体ATP酶亚基(RP triple ATPase, Rpt)和非A TP酶亚基(RP non- ATPase, Rpn),分子量在30~110kD之间[7]。
6个Rpt 亚基和2个Rpn亚基(Rpnl和Rpn2)组成的基底部位于CP的两侧,6个Rpt亚基直接与20SCP 的7个α亚基结合在一起共同构成蛋白酶体。
另外,Rpt有两个有特殊作用:Rpt2 ATP酶参与打开α环孔道;Rpt5 ATP酶参与识别泛素标记的蛋白质,这有利于引导展开的泛素化蛋白进入20SCP的α环内。
Strous等人认为,19S RP基底部能单独降解小分子多肽和非泛素化蛋白,盖部对蛋白酶体水解泛素化蛋白提供了高度的特异性保证[8]。
另外,Romagnani等人研究发现,在Rpnl0或Rpn9基因缺失、突变的酵母株中,盖部与基底部易发生脱落。
这提示Rpn9和Rpnl0可能具有“合页”样的接纳体(acceptor)作用[8]。
所以,完整的26S蛋白酶体对ATP依赖的泛素化蛋白降解是必须的。
2.泛素化靶蛋白识别靶蛋白(断裂、氧化或衰老等引起的蛋白质损伤)的泛素化是26S蛋白酶体降解蛋白的前提。
但如何识别目的靶蛋白?目前为止,还知之甚少。
但有人认为,在靶蛋白的泛素化过程中,对蛋白质F-box序列的识别是识别已磷酸化靶蛋白的前提。
F-box是蛋白质间特异性相互作用的位点,具有F-box序列的蛋白质能够特异性结合磷酸化的蛋白,同时,也是泛素连接酶复合体的主要成分[ 9]。
2.1 靶蛋白泛素化90年代初,人们发现细胞表面受体和配体结合引起的受体磷酸化与受体的泛素化降解过程密切相关[10]。
许多细胞周期调节蛋白的泛素化受其自身磷酸化的调节,如细胞周期蛋白和细胞周期蛋白激酶的抑制蛋白、参与细胞信号传导过程的调控蛋白(表面受体、转运蛋白),以及一些转录调节因子(β-连环蛋白、P53、Jun、RNA聚合酶等)[11]。
靶蛋白的泛素化过程受遗传控制,许多蛋白都具有自身特定的泛素化所需的氨基酸序列。
Varshavsky等人首先发现重组p一半乳糖苷酶N一端存在降解决定序列,其泛素化的速度极大程度上依赖于N一端残基的同一性[12]。
此后,发现一些与泛素化降解相关序列具有亲水性特征。
但是,蛋白酶体对蛋白水解也有例外,如肿瘤抑制基因的RB蛋白能与人巨细胞病毒pp71蛋白结合在一起可通过非泛素化途径进行蛋白酶体的蛋白水解[13]。
2.2 靶蛋白脱泛素化泛素化也是一个可逆的过程。
已经发现真核细胞内存在多种脱泛素酶(DUB),能够水解泛素和蛋白质间的硫酯键。
DUB可分为两类:一类是泛素羧端水解酶,水解泛素C端的连接小肽,也参与由泛素前体产生泛素单体的过程;另一类是泛素特异性加工酶,参与去除泛素化蛋白上的多聚泛素链,从而防止泛素化蛋白蓄积[13]。
当蛋白酶体功能受抑制时,泛素化蛋白水解减少,蓄积的泛素化蛋白可出现脱泛素,如泛素化c-JNK激酶水解减少时,蓄积的泛素化c-JNK激酶可过脱泛素途径使c-JNK激酶复活,结果导致c-Jun的磷酸化增加,从而增加核转录因子AP-1的DNA结合活性,使Fas表达增加[13]。
3.蛋白酶体抑制剂由于蛋白酶体活性状态对细胞执行不同的功能是非常重要的,因此蛋白酶体将成为影响细胞功能的重要药物靶标,而其抑制剂有可能成为抗肿瘤的先导药物[14]。
实验也证实,恶性增殖细胞对蛋白酶体阻断的敏感性比非肿瘤细胞更为强烈,如乳胞素(Lactacystin)对正常的淋巴细胞无明显的作用。
Masdehors等人发现B- CLL细胞中,ChTL活性水平是正常淋巴细胞的三倍,其蛋白的泛素化水平也高于正常细胞[4]。
蛋白酶体的抑制剂可分为天然化合物和合成化合物两类。
3.1 天然化合物3.1.1 3,4-二氯异香豆素(DCI)DCI是丝氨酸蛋白酶的不可逆抑制剂。
近来发现,DCI也能抑制20S CP几种肽酶,如ChTL 活性。
由于DCI在抑制蛋白酶体的ChTL活性时,也能激活20S CP的酪蛋白酶活性和其他的肽酶活性,因此是一种选择性较差的抑制剂[15]。
3.1.2 乳胞素(Lactacystin)乳胞素是链霉菌属的天然代谢物,是一种选择性的20S CP抑制剂,具有抑制细胞周期和诱导神经母细胞分化的功能。
乳胞素的活性位点可能涉及其内酰胺环上的甲基和异丁基侧链上的第二个羟基[15]。
乳胞素及其活性中间体的β-内酯可选择性和不可逆地结合于蛋白酶体的β5亚单位,从而抑制蛋白酶体多种肽酶活性,其中ChTL活性最先被抑制,TL和PGPH的活性抑制较慢,丝氨酸和酪氨酸蛋白酶活性则不受抑制。
Qiao等人发现,乳胞素可以阻止动物和人类的结肠肿瘤形成,并通过脱氧胆酸抑制p53降解,导致核内p53积聚和相应的促凋亡基因的表达[16]。
3.1.3 AclacinomycinAclacinomycin是一种Aklavinone化学结构,抑制蛋白酶体的ChTL活性,对组织蛋白酶B 无抑制效应,能激活胰岛素,但对calpain作用范围较小[14]。
3.1.4EponemycinEponemycin能以共价键方式结合到20S CP的β5、β5i 和β1i亚单位,选择性抑制蛋白水解酶活性,进而抑制ChTL活性。
