从热平衡的建立过程来理解温度
热力学中的温度

热力学中的温度热力学是研究热、功与能的转化和互相关系的一门科学。
而在热力学中,温度是一个重要的概念。
本文将深入探讨热力学中的温度,并解释其在物体热平衡和能量传递中的作用。
一、温度的定义与单位温度是物体内部分子热运动强度的度量。
常用的温度单位有摄氏度(℃)、华氏度(℉)以及开尔文(K)。
摄氏度和华氏度是常见的常用温度刻度,而开尔文则是热力学中常用的绝对温度单位。
二、热平衡与温度的关系热平衡是热力学中一个重要的概念,它指的是物体之间不存在热量的净传递,或者是物体内部各处温度的均匀分布。
而在热平衡状态下,物体之间的温度是相等的。
温度在热平衡的判断中起着至关重要的作用。
通过测量不同物体间的温度,我们可以判断它们处于热平衡还是非热平衡状态。
如果两个物体的温度相等,则它们处于热平衡状态;而如果温度不相等,则说明它们之间存在能量转移,处于非热平衡状态。
三、温度的测量方法温度的测量方法有很多种,其中一种常用的方法是利用温度计进行测量。
温度计的原理基于物质在温度变化时的性质变化。
常见的温度计有水银温度计和电子温度计。
水银温度计是一种基于水银在温度变化时体积的变化来测量温度的仪器。
它利用了水银在受热后会膨胀、冷却后会收缩的特点,通过读取温度计上的刻度值来确定物体的温度。
电子温度计则利用了物质的电阻率随温度的变化而变化的特性。
通过对物质电阻率与温度之间的关系进行测量,可以得到物体的温度值。
四、温度与能量传递温度与能量传递之间存在密切的关系。
热力学中,热量的传递是由高温物体向低温物体传递的。
当两个物体的温度相差很大时,热传导就会快速进行,而当两个物体的温度接近时,热传导会逐渐减慢,直到达到热平衡。
根据热传导定律,温度梯度越大,热量传递速率就越快。
这是因为温度梯度表示了单位温度差距下的温度变化率,而热量传递的速率正比于温度梯度。
同时,温度也决定了物体内部分子平均动能的大小。
根据热力学的基本原理,温度越高,物体内部分子的平均动能就越大,从而能量传递速率也越快。
热力学第零定律、温度
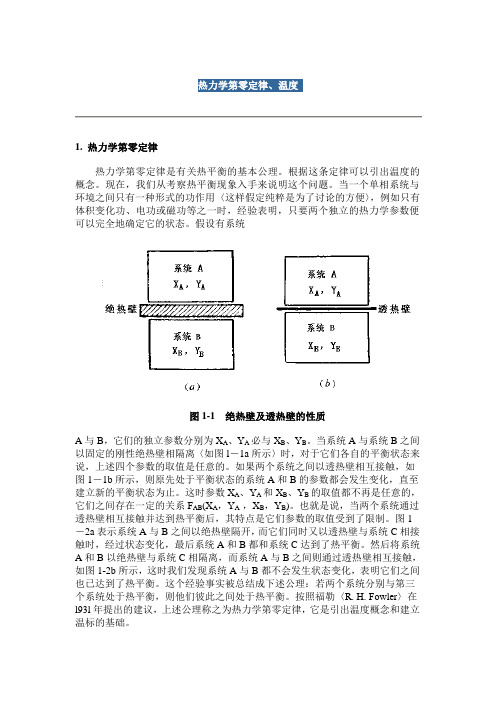
热力学第零定律、温度1. 热力学第零定律热力学第零定律是有关热平衡的基本公理。
根据这条定律可以引出温度的概念。
现在,我们从考察热平衡现象入手来说明这个问题。
当一个单相系统与环境之间只有一种形式的功作用〈这样假定纯粹是为了讨论的方便〉,例如只有体积变化功、电功或磁功等之一时,经验表明,只要两个独立的热力学参数便可以完全地确定它的状态。
假设有系统图1-1 绝热壁及透热壁的性质A与B,它们的独立参数分别为X A、Y A必与X B、Y B。
当系统A与系统B之间以固定的刚性绝热壁相隔离〈如图l-1a所示〉时,对于它们各自的平衡状态来说,上述四个参数的取值是任意的。
如果两个系统之间以透热壁相互接触,如图1-1b所示,则原先处于平衡状态的系统A和B的参数都会发生变化,直至建立新的平衡状态为止。
这时参数X A、Y A和X B、Y B的取值都不再是任意的,它们之间存在一定的关系F AB(X A,Y A ,X B,Y B)。
也就是说,当两个系统通过透热壁相互接触并达到热平衡后,其特点是它们参数的取值受到了限制。
图1-2a表示系统A与B之间以绝热壁隔开,而它们同时又以透热壁与系统C相接触时,经过状态变化,最后系统A和B都和系统C达到了热平衡。
然后将系统A和B以绝热壁与系统C相隔离,而系统A与B之间则通过透热壁相互接触,如图1-2b所示,这时我们发现系统A与B都不会发生状态变化,表明它们之间也已达到了热平衡。
这个经验事实被总结成下述公理:若两个系统分别与第三个系统处于热平衡,则他们彼此之间处于热平衡。
按照福勒〈R. H. Fowler〉在l93l年提出的建议,上述公理称之为热力学第零定律,它是引出温度概念和建立温标的基础。
图1-2 热力学第零定律示意图2. 温度当系统A与C处于热平衡时,它们参数间的限制关系为F AC(X A,Y A,X C,Y C)=0(1-1)同样,若系统B与系统C也处于热平衡,则有F BC(X B,Y B,X C,Y C)=0 (1-2)将这两个关系写成Y C的显式,可得Y C=f AC(X A,,X C) (1-3)及Y C=f BC(X B,X B,X C) (1-4)将式(1-3)与式(1-4)合并,消去变量Y C,得f AC(X A,X B,X C)= f BC(X B,Y B,X C)(1-5)根据热力学第零定律,当系统A和系统B分别与系统C处于热平衡时,它们之间也处于热平衡,因此有F AB(X A,Y A,X B,Y B)=0 (1-6)方程(1-5)与(l-6)描述的是同一个现象,因而应该是等同的,但后者没有包含参数只能取以下形式:X C。
热力学中的热力学平衡

热力学中的热力学平衡热力学平衡是热力学研究中一个重要的概念,它描述了在一个系统中,各个宏观性质保持稳定的状态。
热力学平衡是自然界中广泛存在的状态,对于理解物质间的相互作用及其行为具有重要意义。
本文将从热力学平衡的基本原理、条件以及应用等方面进行探讨。
一、热力学平衡的定义热力学平衡是指一个系统内部的各种宏观性质保持不变的状态。
在热力学平衡状态下,系统各部分之间不存在差异或变化,整体上呈现出一种稳定的状态。
这种状态可以通过一些物理量的测量来判断,比如温度、压力、物质的密度等。
二、热力学平衡的条件1. 热平衡:当系统内各部分之间没有温度差异时,系统达到了热平衡状态。
在热平衡状态下,热量不再从一个物体传递到另一个物体,整个系统的温度保持不变。
这是热力学平衡的重要条件之一。
2. 动力学平衡:动力学平衡是指系统内部的各个部分的物质流动速率不再发生变化。
换句话说,系统中各物质的输入和输出速率相等,达到了动力学平衡状态。
3. 化学平衡:化学平衡是指系统中不再发生物质的化学反应,或者反应速率相等,达到了化学平衡状态。
在化学平衡状态下,反应物和生成物的浓度不再发生变化。
三、热力学平衡的应用热力学平衡的应用非常广泛,涉及到许多领域和行业。
1. 工业生产:在工业生产中,热力学平衡的概念被广泛应用于各种物质的转化和传递过程。
比如在化工生产中,热力学平衡可以用来优化反应条件,提高反应的产率和选择性。
在能源生产中,热力学平衡可以用来优化能源转化过程,提高能源利用率。
2. 环境保护:热力学平衡的概念在环境保护中也有重要应用。
比如在大气污染控制中,可以利用热力学平衡的原理来优化工艺设计,减少二氧化硫等有害气体的排放。
在水处理中,热力学平衡可以用来优化水质的处理过程,提高水处理效率。
3. 生物系统:热力学平衡的概念也被广泛应用于生物系统的研究中。
生物系统中的各个组成部分之间的平衡是生物体正常运作的基础。
比如在生物代谢过程中,能量的平衡是保持生命活动正常进行的重要条件。
温度和k的关系-概念解析以及定义

温度和k的关系-概述说明以及解释1.引言1.1 概述概述部分:在自然界中,温度是一个非常重要的物理量,它是描述物质热状态的基本参数之一。
温度的概念源于人们对物体冷热的感知,通过温度的测量,我们可以了解物体内部分子的热运动情况。
同时,温度也是能量传递与转化的重要因素。
在科学研究和工程实践中,我们需要深入了解温度与其他物理量之间的关系,以便更好地理解和应用。
本文主要探讨温度与热力学性质、物质的相变以及热传导等方面之间的关系。
首先,我们将介绍温度的定义和测量方法,包括常用的温度计和热力学温度的概念。
随后,我们将深入理解温度与分子动能之间的关系,解释温度对物质的影响。
接着,我们将探讨热力学第一定律与温度之间的联系,解释能量转化与温度的关系。
在文章的结尾部分,我们将总结温度对物质性质的影响,讨论温度与热传导以及物质相变之间的关系。
通过对这些关系的研究,我们可以更好地理解物质的热力学性质,进而应用于实际生活和工程技术中。
文章的目的是通过深入分析温度与其他物理量之间的关系,帮助读者更好地理解温度的概念和作用,并应用于实际问题中。
通过这篇文章的阅读,读者将对温度与物质性质、能量转化以及热传导等方面有更全面的了解,从而为科学研究和工程技术提供有效的参考。
1.2 文章结构文章结构:本文主要探讨温度和k之间的关系。
文章分为引言、正文和结论三个部分。
引言部分将对整篇文章进行概述。
首先,我们将简要介绍本文的主题,即温度和k的关系。
接着,我们将阐述文章的结构,明确各个部分的目标和内容。
最后,我们将说明本文的目的,即希望通过对温度和k的关系的探讨,增进对温度和热力学规律的理解。
正文部分将从三个方面展开讨论。
首先,我们将探讨温度的定义和测量方法,介绍不同的温度标度以及温度计的原理和使用。
其次,我们将解释温度与分子动能之间的关系。
我们将深入探讨分子动能与温度的变化规律,以及温度对分子运动状态的影响。
最后,我们将研究热力学第一定律与温度之间的关系。
2020届人教版高中物理选修3-3教学案:第七章 第4节 温度和温标含答案

第4节温度和温标1.平衡态:如果容器与外界没有能量交换,经过一段时间后,容器内各点的压强和温度都不再变化。
2.热平衡:两个相互接触的系统,经过一段时间以后状态参量不再发生变化,这说明两个系统对传热来说已经达到了平衡。
3.热平衡定律:如果两个系统分别与第三个系统达到热平衡,那么这两个系统彼此之间也必定处于热平衡。
一切达到热平衡的系统都具有相同的温度。
4.摄氏温度t与热力学温度T的关系:T=t+273.15 K。
一、状态参量与平衡态1.热力学系统通常把由大量分子组成的研究对象称为热力学系统。
2.外界指系统之外与系统发生相互作用的其他物体的统称。
3.状态参量描述系统热学性质的物理量,常用的物理量有几何参量体积V、力学参量压强p、热学参量温度T。
4.平衡态系统在没有外界影响的情况下,经过足够长的时间,各部分的状态参量达到稳定的状态。
二、热平衡与温度1.热平衡:两个相互接触的热力学系统的状态参量不再变化。
2.热平衡定律:如果两个系统分别与第三个系统达到热平衡,那么这两个系统彼此之间也必定处于热平衡。
3.热平衡的性质:一切达到热平衡的系统都具有相同的温度。
4.温度:表征互为热平衡系统的共同热学性质的物理量。
三、温度计与温标1.常见温度计的测温原理名称测温原理水银温度计根据水银的热膨胀的性质来测量温度金属电阻温根据金属铂的电阻随温度的变化来测量温度度计气体温度计根据气体压强随温度的变化来测量温度热电偶温度根据不同导体,因温差产生电动势的大小不同来测量温度计2.温标(1)摄氏温标:一种常用的表示温度的方法,规定标准大气压下冰的熔点为0_℃,水的沸点为100_℃。
在0 ℃和100 ℃之间均匀分成100等份,每份算做1 ℃。
(2)热力学温标:现代科学中常用的表示温度的方法,规定摄氏温度的-273.15_℃为零值,它的一度等于摄氏温度的一度。
(3)摄氏温度与热力学温度:①摄氏温度:摄氏温标表示的温度,用符号t表示,单位摄氏度,符号为℃。
热平衡与温度

热平衡与温度热平衡是物体内部或不同物体之间热量传输达到均衡状态的过程。
在热平衡状态下,热量的净传输为零,即物体之间的热流相互抵消,使得温度保持稳定。
温度是衡量物体热平衡状态的物理量,表示物体内部分子运动的活跃程度。
一、热平衡热平衡是热力学中的基本概念之一,它指的是在相同或不同物体之间,热量的传递达到均衡状态。
在热平衡条件下,物体之间的热流相互抵消,没有净传输现象。
这意味着物体之间的温度不再发生变化,达到了稳定状态。
例如,当两个接触的物体之间温度差异很小时,它们之间的热传导将迅速抵消,达到热平衡。
这也是为什么我们在接触寒冷的物体时,会感到温暖,因为热量会从我们的皮肤传递到物体上,直到温度达到平衡。
热平衡是一个重要的概念,它在许多领域有着广泛的应用,例如工程热力学、热传导等。
了解物体达到热平衡的方式和条件,可以帮助我们更好地理解热力学和热传输过程。
二、温度温度是描述物体内部分子运动活跃程度的物理量。
它反映了物体的热平衡状态,是热力学和统计物理学中的基本概念。
温度的测量单位通常使用开尔文(Kelvin)或摄氏度(Celsius)。
开尔文温标使用绝对零度作为零点,绝对零度表示物体的分子运动停止。
摄氏度则以水的冰点和沸点作为温标的基准。
温度的变化导致了物体内部分子和原子的热运动的改变。
当温度升高时,物体内部分子的运动变得更加剧烈,速度增加,这意味着温度的升高与物体热量的增加有关。
温度还与物体的热容量有关。
热容量是物体吸收或释放热量的能力,它与物体的质量和物质性质有关。
当物体吸收一定量的热量时,其温度将发生变化,而热容量就是描述这种变化的物理量。
三、热平衡与温度的关系热平衡与温度之间有着密切的联系。
当物体达到热平衡状态时,物体的温度将趋于稳定,不再发生变化。
这是因为热平衡状态下,物体内部的热量传递达到零,热流互相抵消,使得物体之间的温度保持恒定。
热平衡与温度的关系可以通过热传导的例子来说明。
当我们将一个热物体和一个冷物体放在一起时,它们之间会发生热传导。
温度热力学论文
温度一、零定律与温度的定义温度是热力学中非常重要的一个物理量,人们最初是从直觉引入这个概念,即物体的冷热程度。
这主要依赖于人的主观感觉没有一个客观上的描述。
直到热力学第一与第二定律建立80年后的20世纪三十年代才由R.H Fowler正式提出了热力学第零定律,从而解决温度定义的难题。
根据热力学第零定律的描述:若A、B两物体同时与C物体达到热力学平衡,那么它们的温度必然相等,同时等于C物体的温度。
这就给出了温度可测的客观依据,从中定义了温度是互为热平衡的物体所具有的一个相等的态函数,或者说温度是物系达到平衡的一个标示。
但这个定义还过于抽象。
为了解释温度的本质,我们从微观以及统计的角度来考察温度这个概念、二、经典热力学中温度的意义在经典热力学中,温度的微观意义可以表述成物体内部分子热运动平均动能的量度,分子运动愈快,物体愈热,即温度愈高;分子运动愈慢,物体愈冷,即温度愈低。
这种分子运动表现为大量分子的一种统计状态,极个别的分子速度快慢并不影响整体温度的高低。
当物体温度较低时,分子、原子振动的速度很小,无法挣脱分子、原子也变小,分子之间距离就较大,此时物质为液态。
但随着温度的不断升高,分子运动十分激烈,分子间的距离也变大,此时物质为气体。
三、温标知道了温度的概念对温度的测量还需要一个标尺,即温标。
根据热力学第零定律,我们可以设计出各式各样的温度标尺,其均以物质的物理量变化为基础。
所以不同的温标对同一温度的测量可能会得到不同的数值。
为了结束温标上的混乱局面,开尔文创立了一种不依赖任何测温质(当然也就不依赖任何测温质的任何物理性质)的绝对真实的绝对温标,也叫开氏温标或热力学温标。
开氏温标是根据卡诺循环定出来的,以卡诺循环的热量作为测定温度的工具,即热量起着测温质的作用。
正因为如此,我们又把开氏温标叫做热力学温标。
四、温度的上下限在整个宇宙中,物质有冷有热,温度有高有低。
就让我们来考察一下温度的上下限问题。
热力学基础中的温度与热平衡
热力学基础中的温度与热平衡热力学是一门研究物质能量转化和传递规律的学科,而温度和热平衡是热力学基础中的两个重要概念。
本文将通过对温度和热平衡的定义和特性进行论述,帮助读者加深对热力学基础的理解并探索其相关应用。
一、温度的概念及意义温度是物质热状态的一种基本量度。
它反映了物质分子内部的热运动状态和能量分布情况。
通常情况下,我们所说的温度是指热平衡状态下的温度,即热系统与其周围环境没有能量的净输入输出,各部分之间达到了热平衡。
在热力学中,温度用符号T表示,其SI单位为开尔文(K)。
温度的测量通常依赖于物质的性质变化,常用的温度计有摄氏度计和华氏度计等。
温度的量纲为热力学温度单位。
温度的意义在于指示物质的热运动状态。
热力学第零定律指出,当两个物体与第三个物体分别达到热平衡时,它们之间的温度相等。
通过温度的比较和测量,我们可以判断物体的热运动状态,并进一步分析热平衡和能量转移的过程。
二、热平衡的定义及特性热平衡是指热力学系统中各部分之间达到了热力学均衡状态。
在热平衡状态下,热系统与其周围环境之间没有净能量的交换和传递,系统各部分之间的温度相等。
热平衡有以下几个特性:1. 热平衡状态下物体的各部分温度相等,不存在温度梯度。
如果在系统中存在温度差异,热量会自动从高温区域流向低温区域,直到各部分温度相等。
2. 热平衡状态下物体的宏观性质不随时间变化。
例如,热平衡状态下的理想气体压强和体积的乘积在不同时间段内保持不变。
3. 处于热平衡的物体之间不存在净热量的传递。
如果两个物体之间存在温度差异,热能会通过传导、辐射或对流等方式进行热传递,直到达到热平衡。
热平衡是热力学分析中的重要概念,它为我们理解物质能量转移和宏观状态提供了基础。
三、温度与热平衡的应用温度和热平衡的概念在热力学的理论和实践中有着广泛的应用。
1. 温度测量与控制:温度是热计量学的基本量,测温技术在工业、科学研究和生活中有着广泛的应用。
例如,在化工过程中,通过测量和控制温度可以确保反应过程的效率和产品质量。
热力学中温度的定义
(上接第 128 页)
参考文献:
[1] 孙祯祥. 论网络教育媒体与电视教育媒体的融合[ J ]. 电化教育研究,200(5 2):54- 62. [2] 徐正山. 现代教育技术中的电视教育与网络教育[ J ]. 科技情报开发与经济,2005,1(5 16):131- 132. [3] 付道明,张利桃. 中国教育电视的研究现状与发展趋势[ J ]. 电化教育研究,200(5 8):66- 69. [4] 胡为芹. 网络时代教育电视可持续发展的探究[ J ]. 现代远程教育研究,200(5 5):31- 34. [5] 张歌东. 影视非线性编辑[M]. 北京:中国广播电视出版社,2003:72- 76. [6] 朱强. 广播电视新技术[M]. 杭州:浙江大学出版社,2004:22- 28;401- 405.
3)统计物理学是目前物理理论体系中最完美的理论,爱因斯坦也给予了极高的评价. 它独立于热力 学理论,从微观角度研究了热运动问题. 我们在这里引入的描述热运动的量 σ,其意义就是统计物理中微 观状态数对应的熵 σ[3,6]. 这里的 σ与现有理论的熵 S 之间的关系为[6]S = κσ,其中 κ为玻尔兹曼常数. 这 样,我们定义的温度 T * 与现有理论的温度 T 有如下关系[6]:T * = κT. 因此,在现有理论中,也可定义温度 为能量 U 与熵 S 的比值.
1 ቤተ መጻሕፍቲ ባይዱ度的新定义
热力学研究的对象是由大量无规则运动的微观粒子组成的系统. 大量微观粒子的无规则运动称为热 运动,热力学就是研究热运动所表现出来的宏观规律的.
热力学中的热力学过程与平衡态
热力学中的热力学过程与平衡态热力学是研究能量转化和能量传递规律的科学,其中热力学过程与平衡态是热力学中的重要概念。
本文将介绍热力学过程和平衡态的概念及其在热力学中的重要性。
一、热力学过程热力学过程是指系统从一个状态变化到另一个状态的过程。
根据过程的性质不同,热力学过程可以分为准静态过程、绝热过程和等温过程等。
1. 准静态过程准静态过程是指系统的每个状态变化都接近于平衡态,变化过程十分缓慢。
在准静态过程中,系统内各部分之间的温度、压强、浓度等性质始终保持均匀和一致。
准静态过程可以视为一系列平衡态之间的连续转变。
2. 绝热过程绝热过程是指系统与外界没有热量交换的过程。
在绝热过程中,系统内部的能量只能通过做功或者吸收做功来改变。
绝热过程中,热力学第一定律可以表示为ΔU = Q - W = W,即系统内能的变化等于对外界做功的大小。
3. 等温过程等温过程是指系统与外界保持恒定温度的过程。
在等温过程中,系统从一个状态变化到另一个状态,温度保持不变。
根据理想气体状态方程,等温过程中,气体的压强和体积满足P1V1 = P2V2。
二、平衡态平衡态是指系统各个部分之间达到了动态平衡,没有宏观可观察到的变化。
平衡态分为热平衡、力学平衡、化学平衡等。
1. 热平衡热平衡是指系统内各部分之间达到了相同的温度,并且温度不随时间而变化。
在热平衡状态下,热能没有净传递。
当两个物体处于热平衡状态时,它们之间没有热传递。
2. 力学平衡力学平衡是指系统内各部分的受力之和为零,处于力学平衡的物体不会发生运动。
在力学平衡状态下,物体上的力相互抵消,物体保持静止或匀速直线运动。
3. 化学平衡化学平衡是指化学反应中产物和反应物浓度达到一定比例,反应速率相等,化学反应不再产生净反应。
在化学平衡状态下,反应物和产物之间的反应速率相等,化学反应不再向某一方向改变。
三、热力学过程与平衡态的关系及重要性热力学过程与平衡态密切相关,它们之间存在重要的关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
从热平衡的建立过程来理解温度
江苏省华罗庚中学物理组周月平213200
[摘要]:本文从热平衡的建立过程来分析和理解有关温度的两个知识点:即温度与冷热程度的关系和温度与分子平均动能的关系。
其中重点分析了分子平均动能与温度的关系,分析过程中采取了一般--特殊--一般的分析方法,分析过程和方法简单易懂,期望能帮助学生理解热学中的核心概念“温度”。
[关键词]:热平衡温度分子平均动能冷热程度
温度时什么?对于刚接触热学的高中生来说,就只有两点认识:(一)温度就是物体的冷热程度、(二)温度是分子热运动剧烈程度的标志。
对于高中学生来说根本无法理解温度这个概念的实质,从字面上很容易错误地理解为热的物体温度高,冷得物体温度低。
(比如相同温度的木头和铁块,用手去触摸后的感觉不一样)。
教材中从布朗运动的剧烈程度的角度分析,温度越高,分子运动越剧烈,于是可以得到温度越高,分子的平均动能越大的结论[1]。
学生对这个结论的理解是没有任何问题的,但是教材中随后出现的:理想气体的热力学温度与分子的平均动能成正比[1]。
这样的定量的关系,学生就无法理解了。
分子的平均动能为什么与温度有这样的定量关系,而且与物质的状态无关?对于学生而言,这个知识点只能靠记忆了,这样的话物理概念就成了毫无意义的知识记忆,没有任何物理内涵,也失去了物理思想。
如何帮助学生形象理解温度就显得非常有意义了。
下面我们从热平衡的建立过程来帮助我们理解温度的概念:我们知道,在于外界影响隔绝的条件下,使两个物体相互接触,让它们之间发生传热,则热的物体变冷,冷得物体变热,经过一段时间后,最终他们的冷热程度就相同了,即认为温度是相同的。
我们说,它们彼此达到了热平衡状态[2]。
对于这个事实,我们可以用温度计测体温的例子来理解。
热平衡建立的过程从微观上来看就是运动着的分子的碰撞过程,碰撞过程看成是完全弹性碰撞,则碰撞过程要满足动量守恒和系统机械能守恒,计算结果表明,分子间的碰撞过程实际上就是能量传递过程,当分子的平均动能相等时,能量不再传递,即达到了热平衡状态[2]。
对于这样的认识,我们可以从用手触摸物体感觉冷热的例子来理解,如果物体的温度比手的温度高(则物体中分子的运动剧烈),我们会感觉到烫,手发烫的过程实际上就是物体分子对手的碰撞把能量传递给手的过程。
如果物体的温度比手的温度低,我们会感觉到冷,手发冷的过程实际上就是通过分子的碰撞把手上的能量传递给物体的过程。
最终手何物体得温度会相同,则不会感觉到冷热了。
达到热平衡后有两大表现:宏观上物体的温度相同,微观上分子平均动能相同。
也就是说分子的平均动能与温度有关系。
要理解温度与分子平均动能的定量关系,我们可以把问题分解为两个问题:(1)分子平均动能与温度有关系(2)如何得到分子平均动能与温度的关系。
我们从热平衡的建立过程可以已经得到结论,分子平均动能与温度有关系。
怎么得到温度与分子平均动能的定量关系呢?由于热平衡的建立过程与物体的状态无关,即任意状态下的物体都可以达到热平衡状态。
我们可以把气体作为研究对象,分析温度与分子平均动能的关系。
教材中,可以从实验的角度得到理想气体的状态方程:即C T
PV =,对该方程我们可以得到其变式,该气体在标准状态下的方程则可写为C T V P =0
00ν,其中0P 、0V 、0T 为标准状态下气体的压强、摩尔体积、温度。
于是我们得到理想气体的克拉伯龙方程RT PV ν=,该式还可以写成RT N N PV A =,N 为分子总数,A N 为阿伏加德罗常数,更进一步,可以写成T VN NR P A
=(1)。
教材中有关于气体压强的微观解释中压强与分子的平均动能和分子密集程度有关,半
定量地表达为-
∝εn P (2),其中V N n =。
比较(1)(2),可以得到T ∝-ε,于是得到了结论:分子的平均动能与温度成正比。
当然分子的平均动能还与分子的结构有关系(即与分子的自由度有关),但是只要分子的结构相同,其分子平均动能都只有温度有关,与物质的种类和状态无关。
比如,对于双原子分子的氢气和氧气来说,温度相同,则其分子平均动能相同,对于单原子分子的惰性气体而言,温度相同,分子平均动能相同。
温度相同的铁原子和惰性气体,其分子平均动能也相同。
有了热平衡的建立过程的微观认识,对于正文开头提出的问题我们就不难理解了。
如果碰撞传递能量给手,但是铁块的导热性能比木块好,所以感觉铁块比木块烫。
如果木头和铁块的温度低于手的温度,我们会感觉到铁块冷,那是因为手、铁块、木块之间要建立热平衡状态,手的能量要传递给木块和铁块,铁块的导热性能好,从手上吸收热的速度比木块快,所以手感觉到冷。
所以对于温度相同的木块和铁块,有些时候感觉铁块烫,有的时候感觉铁块冷,其实木块和铁块的温度是一样的,只是其导热性能不同罢了。
“温度”是热学中最核心的概念,随着实践的发展,对概念的理解也将逐步深入。
由于本人水平有限,本文仅仅从热平衡的角度来分析了热学中有关温度的两个知识点,期望能帮助学生从某个角度分析理解温度的概念。
对于温度的深入理解,希望学生在以后的学习中能得到不断地深化。
[参考资料]:
1、普通高中课程标准实验教科书《物理》选修3-3
2、新概念物理教程《热学》赵凯华罗蔚茵。
