有机化学人名反应机理全解
有机人名反应——机理及合成应用

有机人名反应——机理及合成应用有机化学里,有一个有趣的领域叫做“人名反应”,听到这个名字是不是觉得有点像是某种神秘的仪式?其实,人名反应是指那些以某个人名命名的经典化学反应。
就像有人给你起个外号,化学家们也给这些反应起了名字,以纪念那些对化学有重大贡献的前辈。
今天我们就来聊聊这些反应的机理以及它们在合成中的应用,让大家对这个领域有个直观的了解。
1. 有机人名反应的机理1.1 什么是机理?简单来说,机理就是解释化学反应为什么会这样发生的故事。
就像你在看一部悬疑剧时,想知道凶手怎么作案一样,化学家们也想弄清楚反应的“幕后黑手”是什么。
机理告诉我们每一步反应过程中的分子怎么舞动,反应怎么一步步进行,就像揭开了化学反应的神秘面纱。
1.2 经典人名反应的机理我们先从最著名的几个反应说起吧,比如费林反应(FriedelCrafts反应)和迈克尔加成反应。
费林反应是由化学家费林(Friedel)和克拉夫茨(Crafts)一起开发的,它主要用来生成芳香族化合物的衍生物。
简单来说,就是把一个芳香环(比如苯)跟一个其他的基团结合起来,形成新化合物。
这就好比把你喜欢的几个菜肴混合在一起,变成一道新的美味。
迈克尔加成反应就像是个“组合拳”,它把两个分子合并,形成一个新的结构。
具体来说,它是一种加成反应,其中一个分子上的亲电中心(可以理解成化学反应中的“吸引力中心”)和另一个分子的亲核中心(“发射点”)发生反应。
这个过程有点像一个化学版的“双簧”——需要两个分子之间的默契配合,才能奏效。
2. 有机人名反应的合成应用2.1 药物合成中的应用说到应用,那可真是五花八门。
药物合成中,有机人名反应简直就是神兵利器。
比如说,某些复杂的药物分子可以通过这些反应合成出来,像阿莫西林这样的抗生素就是通过特定的反应步骤制作的。
想象一下,你要制作一款超级复杂的料理,怎么做呢?得有可靠的食谱和技巧对吧?化学家们也是如此,他们用这些反应作为合成的“食谱”,让复杂的药物分子得以顺利生成。
常见人名反应及其机理

常见人名反应及其机理1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer-Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4. Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault-Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
有机合成人名反应及机理

有机合成人名反应及机理
有机合成中有很多重要的反应,这些反应的机理大多数都是经过
详细论证的。
下面具体介绍几个重要的反应及其机理。
1. 化学家霍夫曼发明了非常有用的反应,叫做“霍夫曼降解反应”。
这个反应可以用来从胺中制备出烷基卤化物。
具体反应步骤是:首先将胺和次氯酸钠混合,然后将水加入混合液中,这样就可以生成
亚氯酰胺。
接下来,将氢氧化钠加入混合液中,反应会生成氯化胺和
氢氧化钠。
最后,烷基化剂加入反应混合物中,生成的产物就是烷基
化合物。
2. 另一个非常重要的有机反应称为“Suzuki–Miyaura偶联反应”,这个反应可以用来将芳香化合物和烯丙基铜或锂互相连接。
这
个反应的机理是:首先,碘化物和芳基卤化物混合,这样就可以形成
碘化芳基化合物。
然后,在其上添加烯丙基铜或锂,这样就可以连接
两种芳香化合物。
最后,加入铜催化剂来促进反应的进行。
3. 最后一个重要的反应是“Diazo反应”,这个反应可以用来制
备罕见的化合物,并且这个反应的机理也比较简单。
首先,从亚硝酸
和苯甲酸中制备出叠氮化物。
接下来,将目标化合物与叠氮化物混合,这样就可以生成新的化合物。
这个反应的一个很好的例子是,将间苯
二酚转化成二苯基二烯。
以上三个反应是有机合成中非常常见的反应,掌握这些反应及其
机理可以为有机合成研究提供非常有用的指导。
各种人名反应及其机理

1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按 S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer----Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault---Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
常见人名反应及机理

1. Aldol Condensation:羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。
反应第一步为羟醛反应,第二部反应为脱水反应。
酸催化碱催化图例使用OCH3 做碱2.Baeyer –Villiger Oxidation酮在过氧化物如过氧化氢、过氧化羧酸等氧化下,在羰基和一个邻近烃基之间引入一个氧原子,得到相应的酯的化学反应。
醛可以进行同样的反应,氧化的产物是相应的羧酸。
2.Baylis –Hillman Reactionαβ-不饱和化合物与亲电试剂(醛、酮)在合适的催化剂作用下,生成烯烃α-位加成产物的反应。
催化剂一般采用DABCO(14-二氮双环222辛烷的缩写形式,俗称:三亚乙基二胺),生成物为烯丙基醇1。
贝里斯-希尔曼反应经历叔胺与活化烯烃的Michael 加成反应启动的加成-消除反应历程4. Beckmann Rearrangement是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
α-二酮、α-酮酸、α-叔烃基酮反式、α-二烷基氨基酮、α-羟基酮和β-酮醚生成的肟在路易,又斯酸或质子酸的作用下断裂为腈及相应的官能团化合物。
这个反应称为―异常贝克曼重排‖称非正常贝克曼重排;二级贝克曼重排;贝克曼断裂反应等。
5. Benzoin Condensation 安息香缩合反应,又称苯偶姻缩合,是一个有机反应,是氰离子催化下两分子芳香醛进行缩合生成一个偶姻分子的反应。
由于生成物是安息香(Ph-CO-CHOH-Ph)的衍生物,故名??. Birch Reduction钠和醇在液氨中将芳香环还原成14-环己二烯的有机还原反应。
Birch 还原的重要性在于:尽管剩下的双键(非芳香性)更为活泼,该反应却能停留在环己双烯上,而不继续还原。
反应中的钠也可以用锂或钾取代,使用的醇通常是甲醇或叔丁醇。
有机化学人名反应
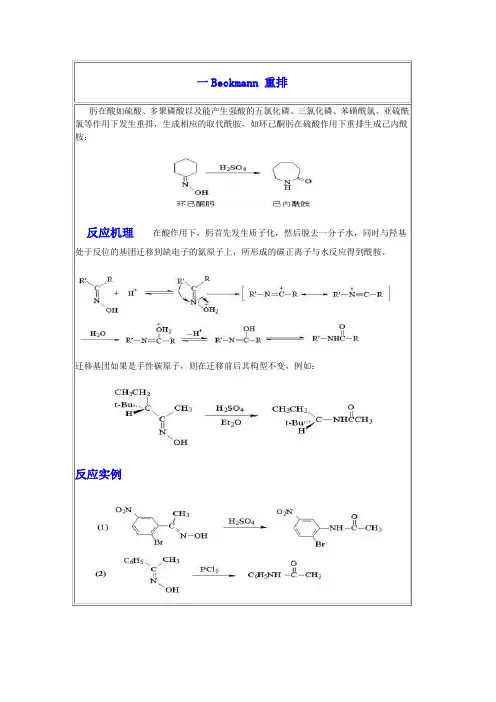
肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例反应机理反应实例反应机理反应实例反应机理反应实例吡啶类化合物不易进行硝化,用硝基还原法制备氨基吡啶甚为困难。
本反应是在杂环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹啉、吖啶和菲啶类化合物均能发生本反应。
二元羧酸酯的分子内酯缩合见Dieckmann 缩合反应。
反应机理反应实例烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 -碳 14C 标记的烯丙基醚进行重排,重排后 -碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是 碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3] 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3] 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3] 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
有机化学人名反应
有机化学人名反应取代反应:1,加特曼反应:加特曼(Gattermann L)发现:用催化量的金属铜代替氯化亚铜或溴化亚铜作催化剂,也可使重氮盐与盐酸或氢溴酸反应制得芳香氯化物或溴化物。
这样进行的反应叫做加特曼反应。
2,加特曼-科赫反应:苯、一氧化碳和氯化氢反应生成苯甲醛,此反应称为加特曼-科赫反应。
3,傅-克反应:芳香化合物芳环上的氢被烷基取代的反应称为傅-克烷基化反应;芳香化合物芳环上的氢被酰基取代的反应称为傅-克酰基化反应;统称傅-克反应。
4,布赫尔反应:萘酚在亚硫酸氢钠存在下与氨作用,转变成相应萘胺的反应称为布赫尔反应。
5,齐齐巴宾反应:吡啶与氨基钠反应,生成?-氨基吡啶,如果?位已被占据,则得?-氨基吡啶,但产率很低。
这个反应称为齐齐巴宾(Chichibabin)反应。
6,刚穆伯―巴赫曼反应:芳香重氮盐中的芳基在碱性条件下与其它芳香族化合物偶联成联苯或联苯衍生物的反应称为刚穆伯(Gomberg)―巴赫曼(Bachmann)反应。
7,柯尔伯―施密特反应:干燥的酚钠或酚钾与二氧化碳在加温加压下生成羟基苯甲酸的反应称为柯尔伯―施密特(Kolbe-Schmitt)反应。
8,威廉森合成法:在无水条件下,醇钠和卤代烷作用生成醚的反应称为威廉森(Williamson A W)合成法。
9,席曼反应:芳香重氮盐和氟硼酸反应,生成溶解度较小的氟硼酸盐,后者加热分解产生氟苯,这称为席曼(Schiemann)反应。
10,桑德迈耳反应:1884年,桑德迈耳(Sandmeyer T)发现:在氯化亚铜或溴化亚铜的催化下,重氮盐在氢卤酸溶液中加热,重氮基可分别被氯或溴原子取代,生成芳香氯化物或溴化物。
这一反应称为桑德迈耳反应。
11,普塑尔反应:一些重氮盐在碱性条件下或稀酸的条件下可以发生分子内的偶联反应。
这个反应是普塑尔(Pschorr R)在寻找合成菲环的新方法中首先发现的,故称为普塑尔反应。
12,瑞穆尔―悌曼反应:酚与氯仿在碱性溶液中加热生成邻位及对位羟基醛的反应称为瑞穆尔―悌曼(Reimer ―Tiemann)反应。
有机化学人名反应
引言概述:有机化学人名反应是有机化学领域中的重要反应,以发现或命名人物命名,旨在纪念对有机化学做出重大贡献的科学家。
本文将介绍五个涉及有机化学人名反应的重要反应,包括Sn2反应、Friedel-Crafts反应、Hofmann降解反应、Diels-Alder反应和Hofmann重排反应。
正文内容:1. Sn2反应1.1 概述:Sn2反应是一种亲核取代反应,其中一个亲核试剂攻击官能团上的消极部分,然后将其替换为新的官能团。
1.2 人名来源:Sn2反应是以科学家在有机化学领域做出开创性贡献的Edwin S. Gould命名。
1.3 反应特点:Sn2反应的反应速率与亲核试剂浓度成正比,但与底物浓度无关。
1.4 影响因素:影响Sn2反应速率的因素包括底物结构、溶剂选择和温度等。
1.5 应用领域:Sn2反应在合成有机化学中广泛应用于底物的碳-氮键或碳-氧键的形成。
2. Friedel-Crafts反应2.1 概述:Friedel-Crafts反应是一种芳香族碳-碳键形成的反应,在芳香族化合物上引入新的取代基团。
2.2 人名来源:Friedel和Crafts是两位法国化学家,他们共同发现并开发了这一重要反应。
2.3 反应类型:Friedel-Crafts反应可以分为两种类型,即芳香烃的烷基化和芳香烃的酰基化。
2.4 反应机理:Friedel-Crafts反应的机理通常涉及亲电取代和负离子取代两种机制。
2.5 应用领域:Friedel-Crafts反应在药物合成和农药合成等领域具有重要的应用价值。
3. Hofmann降解反应3.1 概述:Hofmann降解反应是一种将主要氨基酸转化为次级氨基酸的反应。
3.2 人名来源:Hofmann是德国化学家Hermann Emil Fischer 的学生,他发现并研究了这个反应。
3.3 反应过程:Hofmann降解反应涉及以次氨基酸为中间体进行进一步反应,最终生成次级氨基酸。
有机化学人名反应机理全解
人名反应1.Arbuzov反应(Michaelis-Arbuzov重排)2.Arndt-Eistert反应3.Baeyer-Villiger氧化重排4.Beckmann重排5.Birch还原6.Bischler-Napieralski合成法7.Bouveault-Blanc还原8.Bucherer反应9.Cannizzaro反应10.Chichibabin反应11.Chugaev反应12.Claisen重排13.Claisen缩合反应14.Claisen-Schmidt反应15.Clemmensen还原bes合成法17.Cope重排18.Cope消除19.Corey-House合成法20.Cristol反应21.Curtius重排22.Darzen反应23.Demjanov重排24.Dieckmann反应25.Diels-Alder反应26.Döebner-Miller合成法27.Edman降解法28.Eschweiler-Clarke反应29.Favorski重排30.Fischer吲哚合成法31.Friedel-Crafts烷基化反应32.Friedel-Crafts酰基化反应33.Fries重排34.Gabriel合成法35.Gatterman反应(1)36.Gatterman反应(2)37.Gatterman-Koch反应38.Gomberg-Bachmann反应39.Hantzsch吡啶合成法40.Hantzsch吡咯合成法41.Haworth反应42.Hell-Volhard-Zelinsky反应43.Hell-Volhard-Zelinskyα-溴化法44.Henry反应45.Hinsberg反应46.Hofmann重排(Hofmann降解)47.Hofmann烷基化48.Hofmann消除反应49.Houben-Hoesch反应50.Hunsdiecker反应51.Knoevenagel反应52.Knorr合成法53.Kochi反应54.Kolbe反应55.Kolbe-Schmidt反应56.Kucherov反应57.Leuckart反应58.Lossen重排59.Mannich反应60.McMurry反应61.Meerwein-Ponndorf-Verley还原62.Michael加成反应tkin重排64.Nazarov反应65.Oppenauer氧化66.Paal-Knorr合成法67.Perkin反应68.Pschorr反应69.Reformatsky反应70.Reimer-Tiemann反应71.Ritter反应72.Robinson增环反应73.Rosenmund还原74.Sandmeyer反应75.Schiemann反应76.Schmidt重排77.Shapiro反应78.Simmons-Smith反应79.Skraup合成法80.Smiles重排81.Stephen还原82.Stevens重排83.Strecker氨基酸合成法84.Tiffeneau-Demjanov重排85.Ullmann反应86.Vilsmeier反应87.von Richter重排88.Wacker氧化反应89.Wagner-Meerwein重排90.Williamson合成法91.1,2-Wittig重排92.Wittig反应93.Wittig-Horner反应(Emmons反应、Horner-Emmons反应、Wadsworth-Emmons反应)94.Wolff重排95.Wolff-Kisher-黄鸣龙还原96.Wurtz反应97.Wurtz-Fittig反应Arbuzov反应亚磷酸三烷基酯与卤代烷或其衍生物反应生成烷基膦酸酯和一个新的卤代烷的反应称为Arbuzov反应,也称Michaelis-Arbuzov重排。
常见人名反应及其机理
常见人名反应及其机理1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1,(1在氧化银催化下与水共热,得到酰基卡宾(2,(2发生重排得烯酮(3,(3与水反应生成酸,若与醇或氨(胺反应,则得酯或酰胺。
3.Baeyer-Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4. Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault-Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人名反应1.Arbuzov反应(Michaelis-Arbuzov重排)2.Arndt-Eistert反应3.Baeyer-Villiger氧化重排4.Beckmann重排5.Birch还原6.Bischler-Napieralski合成法7.Bouveault-Blanc还原8.Bucherer反应9.Cannizzaro反应10.Chichibabin反应11.Chugaev反应12.Claisen重排13.Claisen缩合反应14.Claisen-Schmidt反应15.Clemmensen还原bes合成法17.Cope重排18.Cope消除19.Corey-House合成法20.Cristol反应21.Curtius重排22.Darzen反应23.Demjanov重排24.Dieckmann反应25.Diels-Alder反应26.Döebner-Miller合成法27.Edman降解法28.Eschweiler-Clarke反应29.Favorski重排30.Fischer吲哚合成法31.Friedel-Crafts烷基化反应32.Friedel-Crafts酰基化反应33.Fries重排34.Gabriel合成法35.Gatterman反应(1)36.Gatterman反应(2)37.Gatterman-Koch反应38.Gomberg-Bachmann反应39.Hantzsch吡啶合成法40.Hantzsch吡咯合成法41.Haworth反应42.Hell-Volhard-Zelinsky反应43.Hell-Volhard-Zelinskyα-溴化法44.Henry反应45.Hinsberg反应46.Hofmann重排(Hofmann降解)47.Hofmann烷基化48.Hofmann消除反应49.Houben-Hoesch反应50.Hunsdiecker反应51.Knoevenagel反应52.Knorr合成法53.Kochi反应54.Kolbe反应55.Kolbe-Schmidt反应56.Kucherov反应57.Leuckart反应58.Lossen重排59.Mannich反应60.McMurry反应61.Meerwein-Ponndorf-Verley还原62.Michael加成反应tkin重排64.Nazarov反应65.Oppenauer氧化66.Paal-Knorr合成法67.Perkin反应68.Pschorr反应69.Reformatsky反应70.Reimer-Tiemann反应71.Ritter反应72.Robinson增环反应73.Rosenmund还原74.Sandmeyer反应75.Schiemann反应76.Schmidt重排77.Shapiro反应78.Simmons-Smith反应79.Skraup合成法80.Smiles重排81.Stephen还原82.Stevens重排83.Strecker氨基酸合成法84.Tiffeneau-Demjanov重排85.Ullmann反应86.Vilsmeier反应87.von Richter重排88.Wacker氧化反应89.Wagner-Meerwein重排90.Williamson合成法91.1,2-Wittig重排92.Wittig反应93.Wittig-Horner反应(Emmons反应、Horner-Emmons反应、Wadsworth-Emmons反应)94.Wolff重排95.Wolff-Kisher-黄鸣龙还原96.Wurtz反应97.Wurtz-Fittig反应Arbuzov反应亚磷酸三烷基酯与卤代烷或其衍生物反应生成烷基膦酸酯和一个新的卤代烷的反应称为Arbuzov反应,也称Michaelis-Arbuzov重排。
(EtO)3P+RCH2X(EtO)2POCH2R+EtX反应机理P(OEt)3RP(OEt)2O+EtX反应其实是两步连续的S N2反应。
卤代烷反应时,其活性次序为:R'I>R'Br>R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、α-卤代醚、α-或β-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚磷酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
除了亚磷酸三烷基酯外,亚膦酸酯RP(OR')2和次亚膦酸酯R2POR'也能发生该类反应:RP(OR')2+R''X P OR'R''ROR'X+R2POR'+R''X P R''RROR'X+反应实例△(C2H5O)3P+BrCH2CO2C2H5C2H5O2CCH2P(OC2H5)2O+C2H5Br(1)(CH3O)3P+CH3I PCH3OCH3H3COO+CH3I(2)反应中释放出的碘甲烷能继续与亚磷酸三甲酯反应,因此只要加催化量的碘甲烷即可引发反应。
Arndt-Eistert反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热可得高一级的羧酸,该反应称为Arndt-Eistert 反应,这种增长碳链的方法称为Arndt-Eistert 合成法。
RCClO CH 2N 2RCCH O N 2Ag 2O H 2ORCH 2COHO 反应机理重氮甲烷与酰氯反应,生成α-重氮酮,同时放出氯化氢:O CH 2N 2CH 2R N -Cl-CR C HO H -HRC CHON Nα-重氮酮在氧化银存在下加热,重排而生成烯酮,称为Wolff 重排:RC CH O N N RCC ON N -N 2Ag 2O, H 2OC O R RCH C O烯酮在水中反应生成羧酸,在醇溶液中生成酯,在氨(胺)中生成酰胺。
由于氯化氢使重氮酮分解成α-氯代酮:RCCH ONH+RCCH O Cl -RCCH 2Cl O+N 2因此在操作时要把酰氯滴加到过量的重氮甲烷溶液中,使生成的氧化氢立即与重氮甲烷反应,否则得不到α-重氮酮。
反应实例COOH2COClCOCHN 2HC CH 2COOR2225 ℃Ag 2O, H 2OCOROHBaeyer-Villiger 氧化重排酮类化合物被过酸氧化,与羰基直接相连的碳链断裂,插入一个氧形成酯的反应称为Baeyer-Villiger 氧化重排。
常用的过酸有过乙酸、过苯甲酸、间氯过苯甲酸或三氟过乙酸等。
其中三氟过乙酸是最好的氧化剂,这类氧化剂的特点是反应速率快、产率高。
R R 2O+CH 3COOH CH 3COOEt R O R 2+ CH 3COOH O反应机理首先酮羰基生成 盐,然后过酸对羰基进行亲核加成,加成产物发生如下的重排得到产物:R 1R 2O +R 1COOH R O C R 1OR 1OO R 2+R 1COOHO对于不对称酮,羰基两旁的基团不同,两个基团均可迁移,但有一定的选择性,迁移能力的顺序为如迁移基团是手性碳,手性碳的构型保持不变,如CCC 6H 53O CH 3C 6H 5CO 3HC C 6H 5H O C O CH 3反应实例(1)Baeyer-Villiger 反应常用于由环酮来合成内酯,如O +CH 3CO 3HCH 3COOEt 40 ℃OO(2)Beckmann 重排酮肟在酸性催化剂中如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯和亚硫酰氯等作用下重排成酰胺的反应称为Beckmann 重排。
CNR'ROHH R'NHRO 反应机理R 3C— > R 2CH—,> PhCH 2— > Ph— > RCH 2— > CH 3—O333CH 3COONaOOC NR'ROHC NR'2-H 2O N CR R'N C RR'R'NHR OH 2O-HNCRR'OH反应机理表明:酸的催化作用是帮助羟基离去。
Beckmann 重排的特点是:①离去基团与迁移基团处于反式,这是根据产物推断的,②基团的离去与基团的迁移是同步的,如果不是同步,羟基以水的形式先离开,形成氮正离子,这时相邻碳上两个基团均可迁移,得到混合物,但实验结果只有一种产物,因此反应是同步的,③迁移基团在迁移前后构型不变。
反应实例3tOHH 2SO 4乙醚N HtCH 3OBirch 还原碱金属(钠、钾或锂)在液氨与醇的混合液中,与芳香化合物反应,苯环可被还原成1,4-环己二烯类化合物,这种反应叫做Birch(伯奇)还原。
325Na 反应机理Na +NH 3(l)→Na ++e -(NH 3)(溶剂化电子)-3C 2H 5OH-3C 2H 5OH(i)(ii)(iii)首先,钠和液氨作用生成溶剂化电子,此时体系为一蓝色溶液。
然后,苯环得到一个电子生成(i ),(i )仍是环状共轭体系,但有一个单电子处在反键轨道上,(i )从乙醇中夺取一个质子生成(ii )。
(ii )再取得一个溶剂化电子转变成(iii ),(iii )是一个强碱,可以再从乙醇中夺取一个质子生成1,4-环己二烯。
酚不能发生Birch 还原,芳环上带有可被还原的卤素、硝基、醛或酮羰基等官能团的化合物也不能发生Birch 还原;烷基苯、芳香羧酸、芳香醚、酰胺、酯、苯胺及其衍生物都可进行Birch 还原。
给电子基团一般使还原速率减慢;吸电子基团使反应速率加快,而且所得产物取代基团位于被还原的碳原子上,如例5。
反应实例(1)CH3CH3Na/NH3(l)ROHCH3 CH3Na,C2H5OH3CH3CH3(2)若取代基上有与苯环共轭的双键,Birch还原首先在共轭双键处发生。
CH2H3CNa/NH3(l) ROHNa/NH3(l)ROHCH(CH3)2CH(CH3)2不与苯环共轭的双键不能发生Birch还原。
Na/NH3(l)ROHCH2CH CH2CH2CH CH2(3)萘也可以发生Birch还原,萘发生Birch还原时,可以得到1,4-二氢化萘和1,4,5,8-四氢化萘。
Na(K,Li)3Na(K,Li)NH3(l),ROH(4)芳香醚在发生Birch还原时生成的产物是烯醇醚,在酸溶液中很容易水解成3-环己烯酮,并在酸的作用下,最终形成热力学上更稳定的双键与羰基共轭的2-环己烯酮。
OCH3325OCH32HCl/H2O HCl/H2OO OH HO(5)苯甲酸的还原产物为2,5-环己二烯-1-羧酸:COOH325COOHBischler-Napieralski合成法这是一种合成1-取代异喹啉化合物最常用的方法。
首先用苯乙胺与羧酸或酰氯形成酰胺,然后在失水剂如五氧化二磷、三氯氧磷或五氯化磷等作用下,失水关环,再脱氢得1-取代异喹啉化合物:190 ℃NHCCH33Pd-CNCH31-甲基-3,4-二氢异喹啉1-甲基异喹啉反应机理酰氨在三氯氧磷作用下失水关环的机理为:PClO-Cl-HN ORPOCl222NHHPClR+HCl+POOClBouveault-Blanc还原酯与金属钠在醇(常用乙醇、丁醇或戊醇等)溶液中加热回流,可被还原成相应的伯醇,此反应称为Bouveault-Blanc还原反应。
