高考化学考点硫及其重要化合物
高考化学硫知识点总结

高考化学硫知识点总结化学是高考科目之一,对于学生来说,掌握化学知识是非常重要的。
其中,硫元素是化学中的重要一环。
本文将对高考化学中与硫相关的知识点进行总结和归纳。
一、硫的性质和用途硫的原子序数为16,位于氧的下方,属于周期表的第16族。
硫是一种黄色固体,在常温下呈现出异味。
硫的主要存在形式为硫化物,如硫化氢、硫代硫酸盐等。
硫在化学反应中可以表现出特殊的性质,如与氧反应生成二氧化硫,与金属反应生成对应的硫化物。
硫在工业上有着广泛的应用,其中最重要的是在肥料和药物制剂中的应用。
硫肥可以提高农作物的产量和品质,同时还可以作为某些蛋白质和药物的原料。
此外,硫还可以用于橡胶工业、皮革工业、油脂工业等许多领域。
二、硫的氧化态和离子化合物根据硫的氧化态,硫化物可以分为低价态和高价态。
低价态的硫化物中硫的氧化态为-2,如硫化氢(H2S)、硫化镁(MgS)等。
高价态的硫化物中硫的氧化态大于-2,如二氧化硫(SO2)、二氧化硫(SO3)等。
硫的离子化合物也是化学中的重要内容。
硫在离子中的氧化态取决于与硫结合的其他元素的氧化态。
比如,硫与氧结合成硫酸根离子(SO42-),硫的氧化态为+6;而硫与氢结合成硫氢离子(HS-),硫的氧化态为-1。
三、硫的还原性和氧化性硫具有较好的还原性和氧化性,这对于它在化学反应中起着重要的作用。
在还原反应中,硫可以被氢气还原为硫化氢:S + H2 → H2S在氧化反应中,硫可以与金属反应生成硫化物:S + 2M → MS2硫的这种性质使得它在许多工业和生活中都有着广泛的应用,比如制造火柴和火药、脱硫等。
四、硫的环境污染和防治虽然硫是一种重要的元素,但过量的硫却会对环境和人体健康造成危害。
硫在大气中生成二氧化硫,会导致空气污染和酸雨的发生。
同时,硫也会通过水体、土壤等途径进入生态系统,对生态环境造成破坏。
为了减少硫的环境污染,需要采取相应的措施。
其中,使用脱硫装置对工业废气进行处理是一种常见的方法。
高考化学硫及其化合物重要方程式

硫及其化合物重要方程式
(1)知识网络构建
(2)写出下列反应的方程式,是离子反应的写离子方程式。
①.S 溶于热的烧碱溶液生成两种钠盐:【3S +6OH -=====△2S 2-+SO 2-3+3H 2O 】 ②.把H 2S 气体通入CuSO 4溶液中:【H 2S +Cu 2+===CuS↓+2H +】 ③.Na 2S 溶液在空气中放置变浑浊:【2S 2-+O 2+2H 2O===2S↓+4OH -】 ④.铜丝在硫蒸气中燃烧:【2Cu +S =====点燃
Cu 2S 】
⑤.将SO 2气体通入到氢硫酸中:【SO 2+2H 2S===3S↓+2H 2O 】 ⑥.把H 2S 气体通入到FeCl 3溶液中:【H 2S +2Fe 3+===S↓+2Fe 2++2H +】 ⑦.SO 2通入足量的澄清石灰水中:【SO 2+Ca 2++2OH -===CaSO 3↓+H 2O 】 ⑧.SO 2通入溴水中,使溴水褪色:【SO 2+Br 2+2H 2O===SO 2-4+2Br -+4H +】
⑨. SO 2通入酸性KMnO 4溶液中,溶液褪色:【5SO 2+2MnO 4-+2H 2O=5SO 2-4+Mn 2++4H +】 ⑩.Cu 和浓硫酸的反应:【Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O 】 ⑪.C 和浓硫酸的反应:【C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 】 ⑫.把浓H 2SO 4滴到Na 2SO 3固体上:【H 2SO 4(浓)+Na 2SO 3===Na 2SO 4+H 2O +SO 2↑】 ⑬用足量氨水吸收SO 2尾气:【2NH 3·H 2O +SO 2===2NH +4+SO 2-3+H 2O 】。
2019年高考化学考点一遍过考点20 硫及其重要化合物 含解析
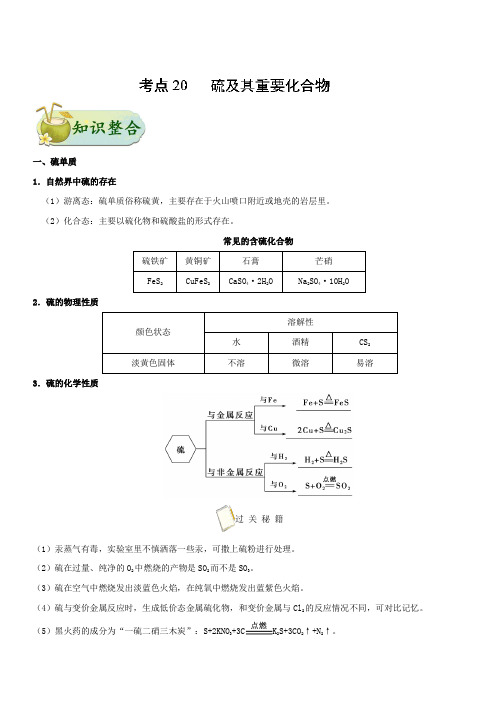
一、硫单质1.自然界中硫的存在(1)游离态:硫单质俗称硫黄,主要存在于火山喷口附近或地壳的岩层里。
(2)化合态:主要以硫化物和硫酸盐的形式存在。
常见的含硫化合物2.硫的物理性质溶解性颜色状态水酒精CS2淡黄色固体不溶微溶易溶3.硫的化学性质过关秘籍(1)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理。
(2)硫在过量、纯净的O2中燃烧的产物是SO2而不是SO3。
(3)硫在空气中燃烧发出淡蓝色火焰,在纯氧中燃烧发出蓝紫色火焰。
(4)硫与变价金属反应时,生成低价态金属硫化物,和变价金属与Cl2的反应情况不同,可对比记忆。
(5)黑火药的成分为“一硫二硝三木炭”:S+2KNO3+3C K2S+3CO2↑+N2↑。
二、硫的氧化物——二氧化硫和三氧化硫1.二氧化硫(1)物理性质(2)化学性质①酸性氧化物的通性a.与水反应:SO 2+H2O H2SO3b.使指示剂变色:SO2能使紫色石蕊溶液变红c.与碱反应:NaOH足量:SO2+2NaOH Na2SO3+H2ONaOH不足量:SO2+NaOH NaHSO3d.与碱性氧化物反应:SO2+CaO CaSO3②氧化性:2H2S+SO23S↓+2H2O(产生淡黄色沉淀)③还原性a.与O2反应:2SO2+O22SO3b.与X2(Cl2、Br2、I2)的水溶液反应:SO2+X2+2H2O2HX+H2SO4c.可被酸性KMnO4溶液、K2Cr2O7溶液、H2O2、Fe3+等氧化。
④漂白性:SO2能漂白某些有色物质(如品红溶液),但不能使紫色石蕊溶液等指示剂褪色。
(3)检验将气体通入品红溶液后,溶液褪色,加热后溶液又恢复到红色则可验证该气体是SO2。
注意“加热”是必不可少的步骤,因为氯气也能使品红溶液褪色,但加热后溶液不会重新变红色。
2.三氧化硫(1)物理性质常温常压下为无色、易挥发的液体,熔点为16.8 ℃,沸点为44.8 ℃。
(2)化学性质:酸性氧化物的通性三、硫酸的性质和23SO -、24SO -的检验 1.硫酸的性质干燥注意:(1)浓硫酸的稀释方法:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌。
高考化学硫单质及其化合物必背知识点

高考化学硫单质及其化合物必背知识点高考化学硫单质及其化合物必背知识点硫单质及其化合物是高考重点考察的知识点,它有哪些关键的地方需要考生们记住呢?下面是店铺为大家精心推荐的高考化学硫单质及其化合物必背知识点,希望能够对您有所帮助。
(一)硫单质的反应(非金属性弱于卤素、氧和氮)1.硫与氧气反应(只生成二氧化硫,不生成三氧化硫)2.硫与氢气加热反应3.硫与铜反应(生成+1价铜化合物,即硫化亚铜)4.硫与铁反应,(生成+2价铁化合物,即硫化亚铁)5.硫与汞常温反应,生成HgS(撒落后无法收集的汞珠应撒上硫粉,防止汞蒸气中毒)7.硫与强碱溶液反应生成硫化物和亚硫酸盐(试管上粘附的硫除了可用CS2洗涤以外,还可以用NaOH溶液来洗)3S+6NaOH=2Na2S+Na2SO3+3H2O(二)二氧化硫或亚硫酸的反应(弱氧化性,强还原性,酸性氧化物)1.氧化硫化氢2.被氧气氧化(工业制硫酸时用催化剂;空气中的二氧化硫在某些悬浮尘埃和阳光作用下被氧气氧化成三氧化硫,并溶解于雨雪中成为酸性降水。
)3被卤素氧化SO2+Cl2+2H2O==H2SO4+2HCl4.与水反应5.与碱性氧化物反应6.与碱反应7.有漂白性(与有机色质化合成无色物质,生成的无色物质不太稳定,受热或时日一久便返色)(三)硫酸性质用途小结1.强酸性(1)、与碱反应(2)、与碱性氧化物反应(除锈;制硫酸铜等盐)(3)、与弱酸盐反应(制某些弱酸或酸式盐)(4)、与活泼金属反应(制氢气)2.浓硫酸的吸水性(作气体干燥剂;)3.浓硫酸的脱水性(使木条、纸片、蔗糖等炭化;乙醇脱水制乙烯)4.浓硫酸的强氧化性(1)、使铁、铝等金属钝化;(2)、与不活泼金属铜反应(加热)(3)、与木炭反应(加热)(4)、制乙烯时使反应混合液变黑5.高沸点(不挥发性)(制挥发性酸)(1)、制氯化氢气体(2)、制硝酸(HNO3易溶,用浓硫酸)实验室制二氧化碳一般不用硫酸,因另一反应物通常用块状石灰石,反应生成的硫酸钙溶解度小易裹在表面阻碍反应的进一步进行。
高中化学硫及其化合物知识大全

高中化学硫及其化合物知识大全1、硫元素的存在:硫元素最外层电子数为6个,化学性质较活泼,容易得到2个电子呈-2价或者与其他非金属元素结合成呈+4价、+6价化合物。
硫元素在自然界中既有游离态, 又有化合态。
(如火山口中的硫就以游离态存在)2、硫单质:①物质性质:俗称硫磺,淡黄色固体,不溶于水,微溶于酒精,易溶于二硫化碳,熔点低。
②化学性质:S+O2 ===(点燃) SO2(空气中点燃淡蓝色火焰,纯氧中为蓝紫色)Fe+SFeS 2Cu+SCu2S 2Na+S=Na2SHg+S==HgS(汞滴处理)3S+6NaOH(浓)2Na2S+Na2SO3+3H2O(洗硫)3、二氧化硫(SO2)(1)物理性质:有刺激性气味有毒气体, 可溶于水(1:40),易液化。
(2)化学性质:①SO2能与水反应:SO2+H2O H2SO3亚硫酸为中强酸,此反应为可逆反应。
可逆反应定义:在相同条件下,正逆方向同时进行的反应。
(关键词:相同条件下)②SO2为酸性氧化物,可与碱反应生成盐和水。
a、与NaOH溶液反应:SO2(少量)+2NaOH=Na2SO3+H2OSO2(过量)+NaOH=NaHSO3对比CO2与碱反应:CO2(少量)+Ca(OH)2=CaCO3↓(白色)+H2O2CO2(过量)+Ca(OH)2=Ca(HCO3)2(可溶)将SO2逐渐通入Ca(OH)2溶液中先有白色沉淀生成,后沉淀消失,与CO2逐渐通入Ca(OH)2溶液实验现象相同,故不能用石灰水来鉴别SO2和CO2。
能使石灰水变浑浊的无色无味的气体一定是二氧化碳,这说法是对的,因为SO2是有刺激性气味的气体。
b、SO2将通入酚酞变红的溶液,溶液颜色褪去,体现了SO2和水反应生成亚硫酸,是酸性氧化物的性质,而不是漂白性,SO2不能漂白指示剂。
③SO2具有强还原性,能与强氧化剂(如酸性KMnO4溶液、Cl2、O2(催化剂:粉尘、V2O5)等)反应。
SO2能使酸性KMnO4溶液、新制氯水褪色,显示了SO2的强还原性(不是SO2的漂白性)。
2022年高考化学一轮复习第四章课时2硫及其重要化合物

H2的混合气体
()
(5)向溶液中滴加Ba(NO3)2溶液出现白色沉淀,说明该溶液
中一定有SO42-
()
答案:(1)× (2)× (3)√ (4)√ (5)×
2.下列关于硫酸的叙述中,正确的是
()
A.浓硫酸具有脱水性,因而能使蔗糖炭化
B.浓硫酸有强氧化性,不可贮存在铝、铁容器中
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
Ca(ClO)2、Na2O2、 H2O2、O3等
不可逆、 持久
与有机色质内
加合 部 “ 生 色
型 团”“化合”
SO2
可逆、 不持久
成无色物质
吸附 将有色物质吸 型 附而褪色
活性炭
物理 变化
备注 无选 择性
有选 择性
吸附 色素
(3)实验室制备与探究流程
[名师点拨] 用70%左右的浓硫酸而不用98.3%的浓硫酸 或稀硫酸的原因:若用98.3%的浓硫酸,因其含水少,硫酸主 要以分子形式存在,H+浓度很小,难以反应。若用稀硫酸, 则含水量多,因SO2易溶于水,不利于SO2的逸出。
即为BaSO4白色沉淀,C项中不能排除AgCl沉淀的可能。
答案:C
知识点三 硫及其化合物的 相互转化及应用
【考必备·清单】 1.理清硫元素的化合价与氧化性、还原性之间的关系
2.掌握硫及其化合物之间的转化规律 (1)相同价态硫的转化是通过与酸、碱反应实现的 如:
②、③、④反应的化学方程式分别为 ②H2SO3+2NaOH===Na2SO3+2H2O; ③Na2SO3+H2SO4===Na2SO4+H2O+SO2↑; ④SO2+Na2SO3+H2O===2NaHSO3。
+3H2O)
知识点二 硫酸 硫酸根离子 的检验
高考化学关于硫知识点

高考化学关于硫知识点硫是我们常见的一种元素,它在自然界中广泛存在,并且在多个领域中都发挥着重要的作用。
在高考化学中,硫也是一个重要的考点。
下面我们将深入探讨一些关于硫的知识点,以帮助同学们更好地准备高考。
1. 硫的性质硫是一种非金属元素,它的原子符号为S,原子序数为16。
硫有非常特殊的性质,其中最为明显的就是它的颜色。
硫可以表现出黄色的颜色,常说的硫黄就是指黄色的硫。
此外,硫还具有非常强烈的气味,有一种特殊的臭味。
这也是我们在生活中经常闻到的硫磺味的来源。
2. 硫的存在形式硫在自然界中以多种形式存在。
其中最常见的就是硫矿石,如黄铁矿和硫化铜等。
此外,硫还存在于许多矿石中,如辉绿石、黄铜矿等。
除此之外,硫还以硫酸、硫酸盐的形式存在于天然水、土壤和生物体内。
3. 与硫有关的化合物硫与其他元素组成了许多重要的化合物。
其中最著名的就是二氧化硫(SO2)和三氧化硫(SO3)。
二氧化硫是一种无色气体,具有刺激性气味。
它是大气中污染物的重要成分,也是酸雨的主要原因之一。
三氧化硫则是硫酸的前体,在工业生产中有着重要的应用。
此外,硫还与氢、氧、碳、氮等元素形成了类似硫醇、硫醚、硫酮和硫脲等多种有机化合物。
这些有机硫化合物在生命体中具有重要的生物学功能,如充当生物催化剂、维持生物膜的完整性等。
4. 硫的化学反应硫在化学反应中也表现出一些特殊的性质。
例如,硫和氧气可以发生化学反应生成二氧化硫。
在这个反应中,硫的化合价由0增加到+4,氧化了。
这个反应是许多火山喷发和燃烧过程中的重要反应。
另外,硫还可以与氢气反应生成硫化氢。
这是一种具有刺激性气味的气体,也是很多硫化物的常见产物。
5. 硫的应用由于硫的特殊性质和广泛存在,它在多个领域中有着重要的应用。
其中最常见的就是化肥生产和硫酸制造。
硫酸是一种重要的工业原料,广泛用于化工、冶金、环保等行业。
此外,硫还可以用于生产橡胶、染料、药品等。
在生物体中,硫也是不可或缺的元素之一。
高中化学硫及其化合物

四是以化工流程图或化学实验为题材考查硫 及其化合物的性质及相互转化。
考点1 硫单质的性质 考点2 硫的氧化物 考点3 硫酸型酸雨及防治
[材料一] 食品的化妆剂——二氧化硫 据媒体报道:受消费者心理因素影响,一些不法生产者采用“硫磺熏蒸”工艺法生
产一些食品,如市面上洁白的馒头,各个超市里外观很美的银耳、果干、果脯等。 这 类经过“化妆”的食品,因残留大量的有毒物质而成为人们健康的隐形杀手。因此,常 吃的馒头、银耳等并不是越白越好。 [材料二] “天堂的眼泪”——酸雨
SO2+NaOH=NaHSO3
CO2 + Ca(OH)2 = CaCO3 + H2O SO2 + Ca(OH)2 = CaSO3 + H2O
2CO2+Ca(OH)2 = Ca(HCO3)2
2SO2+Ca(OH)2 = Ca(HSO3)2
+碱性 氧化物
CO#43;CaO=CaSO3
酸雨一般指pH小于5.6的雨、雪、雾等大气降水,数值5.6的来源是蒸馏水与大气中 CO2(浓度一般在316g/t)达到溶解平衡时的酸度。酸雨被人们美称为“天堂的眼泪”, 又称为“空中的死神”,是因为它对生物、土壤、建筑物等危害很大。我国的西南、华 南地区,已成为与欧洲、北美并列的全球三大酸雨区之一。酸雨形成的主要原因是工业 生产过程中大量矿物燃料的使用,使空气中SO2气体增多,与降水结合产生的。
SO2可以用来漂白食物吗?
考点一:硫
1.硫的存在
(1)游离态:硫单质俗名_硫___磺__,主要存在火山口附近或地壳的岩层里。
(2)化合态:主要以金属硫化物和硫酸盐的形式存在,如硫铁矿(FeS2)、黄铜矿 (CuFeS2)、石膏 (_C__aS__O_4_·2_H__2O__)和芒硝(Na2SO4·10H2O)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
沸点 44.8 ℃
氧化物
酸
(3)硫的氧化物对大气的污染
盐
常温下 液态
标准状况下 固态
+6
+4
+2
0
S
-2 H2S
氢化物
单质
SO3 SO2
氧化物
H2SO4 H2SO3
Na2SO4 Na2SO3 Na2S2O3
FeS/Cu2S/HgS/Na2S
酸
盐(硫化物)
硫
氢化物 氧化物
(1) H2SO3物理性质 无色透明液体,具有二氧化硫的窒息气味,溶于水 (2) H2SO3化学性质 (3)H2SO4物理性质
(2)化学性质
酸
盐
+6
+4
+2
0
S
-2 H2S
氢化物
单质
SO3 SO2
氧化物
H2SO4 H2SO3
Na2SO4 Na2SO3 Na2S2O3
FeS/Cu2S/HgS/Na2S
酸
盐(硫化物)
(1)物理性质
硫
氢化物 氧化物
酸 盐
(2)化学性质
①可燃性
空气充足时
H2S
空气不足时
②还原性
③不稳定性
△ H2S == H2 +S
+6
+4
+2
0
S
-2 H2S
氢化物
单质
SO3 SO2
氧化物
H2SO4 H2SO3
Na2SO4 Na2SO3 Na2S2O3
FeS/Cu2S/HgS/Na2S
酸
盐(硫化物)
硫
氢化物
(1)SO2物理性质 (2)SO2化学性质
氧化物
酸
盐
(3) 实验室制取
硫
氢化物
(1)SO3物理性质
熔点 16.8 ℃
硫及其化合物的价—类二维图
+6
+4
+2
0
S
-2 H2S
氢化物
单质
SO3 SO2
氧化物
H2SO4 H2SO3
Na2SO4 Na2SO3 Na2S2O3
FeS/Cu2S/HgS/Na2S
酸
盐(硫化物)
高三第一轮复习
第四章 非金属及其重要化合物 第三节 硫及其重要化合物 考点一 硫及其重要化合物
+6
+4
+2
0
S
-2 H2S
氢化物
单质
SO3 SO2
H2SO4 H2SO3
氧化物
酸
Na2SO4 Na2SO3 Na2S2O3
FeS/Cu2S/HgS
盐(硫化物)
(1)自然界中硫元素的存在
硫
氢化物 氧化物
②浓硫酸的特性
酸
(4)H2SO4化学性质
① 稀硫酸具有酸的通性:
盐
+6
+4
+2
0
S
-2 H2S
氢化物
单质
SO3 SO2
氧化物
H2SO4 H2SO3
Na2SO4 Na2SO3 Na2S2O3
FeS/Cu2S/HgS/Na2S
酸
盐(硫化物)
硫
氢化物 氧化物
酸 盐
①2Na2SO3+O2==2Na2SO4 ② ③2Na2S+Na2CO3+4SO2====3Na2S2O3+CO2 ④Na2S2O3+H2SO4==Na2SO4 +SO2↑+S↓+H2O ⑤Na2S + H2SO4 = Na2SO4 + H2S
