北京大学药学院高等波谱解析前言和香豆素类化合物
香豆素波谱解析

波谱解析的意义
波谱解析是一种通过分析物质与电磁辐射相互作用的规律,来获取物质结构信息的 方法。
对香豆素进行波谱解析,有助于深入了解其分子结构和性质,为进一步研究其生物 活性、药物作用机制等提供重要依据。
波谱解析还可以用于香豆素的合成、质量控制和鉴别等方面,对于保障药物安全和 促进相关产业的发展具有重要意义。
数据库建设
建立和完善香豆素类化合物波谱数据库,有助于快速检索和比对化 合物结构,促进相关领域的研究和应用。
跨学科合作
加强跨学科合作,将香豆素波谱解析与其他技术手段相结合,拓展 其在不同领域的应用范围。
THANK YOU
01
食品添加剂检测
通过香豆素波谱解析,可以检测食品中 添加的香豆素类化合物,确保食品的安 全性和合规性。
02
03
环境监测
在环境监测中,香豆素波谱解析可用 于检测污染物和有害化学物质,为环 境保护提供技术支持。
香豆素波谱解析的未来发展
新技术应用
随着科技的发展,未来将有更多新的波谱技术应用于香豆素类化合 物的解析,提高解析的准确性和效率。
信号检测
通过检测共振时产生的信号,可以获得与物质内部结构相 关的信息,如化学位移、耦合常数等。
香豆素的核磁共振波谱分析
化学位移
香豆素分子中的氢原子在磁场中的位置不同,会产生不同的化学位 移值,通过分析这些值可以确定香豆素分子中的官能团类型和结构。
自旋耦合
香豆素分子中的氢原子之间会产生自旋耦合现象,通过分析耦合常 数可以进一步解析香豆素分子的结构特征。
紫外光谱法是一种基于物质吸收紫外光的特性进行成分分析的方法。当物质吸收紫外光时,电子从基态跃迁至激发态,从而 产生特定的光谱。
紫外光谱的波长范围通常在190-400nm之间,不同物质在紫外区的吸收波长和强度各不相同,因此可以通过紫外光谱进行物 质的鉴别和含量测定。
《香豆素波谱解析》课件

通过质谱分析确定香豆素的结构和组成。
3
质谱图的解析
解读质谱图以确定物质的分子结构。
核磁共振分析
核磁共振的原理
利用原子核在外加恒定磁场 和射频脉冲的作用下发生共 振现象。Βιβλιοθήκη 核磁共振在香豆素研究 中的应用
通过核磁共振分析探测香豆 素的结构和动力学性质。
核磁共振光谱图的解析
解读核磁共振光谱图以确定 物质的结构。
综合应用多种分析方法可以增加研究结论的
可靠性和准确性。
参考文献
比较研究
不同分析方法的比较
比较红外光谱分析、质谱分析和核磁共振分析的特 点和适用范围。
比较研究的意义和价值
探讨不同分析方法的优势和限制,为香豆素研究提 供参考。
结论
1 香豆素的波谱解析可以提供重要信息 2 不同分析方法的综合应用可以获得
更准确的结论
红外光谱、质谱和核磁共振等波谱分析方法
可以帮助我们了解香豆素的结构和性质。
《香豆素波谱解析》PPT课件
# 香豆素波谱解析 ## 引言 - 什么是香豆素 - 香豆素的性质 - 波谱在香豆素研究中的应用 ## 红外光谱分析 - 红外光谱的原理 - 红外光谱在香豆素研究中的应用 - 红外光谱图的解析
质谱分析
1
质谱的原理
利用质量分析仪器分析物质的质量和相对丰度。
2
质谱在香豆素研究中的应用
(波普解析)有机化合物波谱解析

30
第二节 紫外光谱的基本知识 一、 分子轨道
分子轨道是由组成分子的原子轨道相互作用形成的。 分子成键轨道; 分子反键轨道
33
34
分子轨道的种类
(1) 原子A和B的s轨道相互作用,形成的分子轨道
(2)原子A和B的p轨道相互作用形成的分子轨道
35
(3)原子A的s轨道和原子B的p轨道相互作用形成的分子轨道
• 吸收光谱特征: 吸收峰→λmax 吸收谷→λmin 肩峰→λsh 末端吸收
43
(2)数据表示法
例如λ 溶m剂a2x 37nm(ε104) 或λ 2溶m3剂a7xnm(lgε4.0)
常用术语
生色团(发色团):分子结构中含有π电子的基团 产生π→ π* 跃迁和(或)n→ π*跃迁 跃迁,E较低
例: C=C;C=O;C=N;—N=N— ; —NO2
物质对电磁辐射的吸收性质常用吸收曲线来描述,即考察 物质对不同波长的单色光吸收的情况。
溶液对单色光的吸收程度遵守Lambert-Beer 定律。
A = acl
A 为吸光度(光密度), a为吸光系数, l 为吸收池厚度, c 为溶液的浓度。
29
•若溶液的浓度以mol L-1为单位时, Lambert-Beer 定律的吸 收系数(a) 表示,单位为L mol-1 cm-1,即摩尔吸光系数。 •对于相对分子质量未知的物质,常采用质量百分比浓度 (g/100ml),相应的系数称为百分吸收系数,以E1%1cm表示。 •以摩尔吸收系数 用得最普遍。
三甲基胺n →σ*跃迁的λ分别为173nm、183nm和227nm。
39
第二节 紫外光谱的基本知识
二、 电子跃迁类型
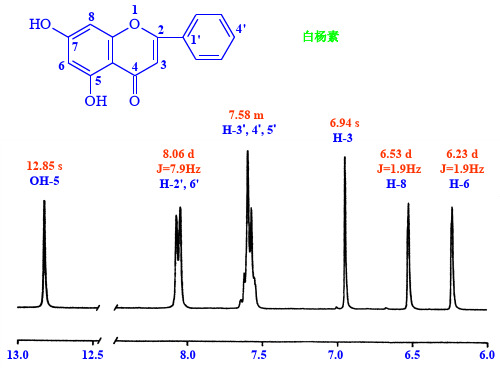
北京大学药学院高等波谱解析黄酮类化合物-
6.93 dd J=2.2, 8.7Hz
H-6
7.00 d J=2.1Hz
H-8
6.79 s H-3
3.84 s -OMe
7.10 d J=8.9Hz H-3', 5'
8.0
7.5
7.0
6.5
4.0
3.5
7.89 d J=8.6Hz H-2, -6
7.04 d J=8.6Hz H-3 or -5
8.26 dd J=1.3, 8.0Hz
+1.7 +1.0
-0.8 +1.1 -0.3 +0.7 -0.4 +1.5
3-O-鼠李糖
+10.3 -1.1 +2.0 +0.6
+1.1
5-O-葡萄糖
-2.8 +2.2 -6.0 -2.7 +4.4 -3.0 +3.2 +1.4 +4.3 -1.3 -1.2 -0.4 -0.8 -1.0 -1.2
4' -氧取代黄酮类化合物的H-2' , H-6'和H-3',-5'的化学位移 ()
化合物 二氢黄酮 二氢黄酮醇 异黄酮 查耳酮 橙酮 黄酮 黄酮醇
H-2', -6' 7.10 ~ 7.30 d 7.20 ~ 7.40 d 7.20 ~ 7.50 d 7.40 ~ 7.60 d 7.60 ~ 7.80 d 7.70 ~ 7.90 d 7.90 ~ 8.10 d
化合物
H-6 H-8
黄酮 黄酮醇 异黄酮
6.00 ~
6.20 d 6.30
~ 6.50
左栏化合物 二氢黄酮 左栏化合物 的7-O-糖苷 二氢黄酮醇 的7-O-糖苷
香豆素波谱解析

2020/4/30
2020/4/30
香豆素波谱解析
(五)质谱 香豆素类化合物有如下特点:
2020/4/30
有强的分子离子峰; 基峰是失去CO的苯骈呋喃离子; 主要裂解途径是:首先失去CO。
香豆素波谱举例
2020/4/30
香豆素波谱举例
2020/4/30
香豆素波谱举例
2020/4/30
2020/4/30
2020/4/30
香豆素的分类
香豆素核上的异戊烯基常 与邻位酚羟基(7-羟基) 环合成呋喃或吡喃环,前
者称为呋喃香豆素。
呋喃香豆素
(
少数为 5,6-吡喃骈
线型和角型)香角型)
香豆素的分 类
简单香豆素
指α-吡喃酮环上有取代
基的香豆素类。还包括二 聚体和三聚体。C3、C4上
香豆素波谱解析
(一)紫外光谱法
UV下显蓝色荧光。 C7位导入-OH——荧光增强 -OH醚化后——荧光减弱
有母核上无含氧取代基
有含氧取代基
▪274 nm——苯环
最大吸收向红位移。
311 nm——吡喃酮环
2020/4/30
2020/4/30
2020/4/30
2020/4/30
2020/4/30
其他香豆素
常有取代基:苯基、羟基、
异戊烯基等。
只有苯环上有取代基 的香豆素 如: 7-羟基香豆素
2020/4/30
2020/4/30
2020/4/30
呋喃香豆素(线型和角型)
2020/4/30
2020/4/30
吡喃香豆素(线型和角型)
2020/4/30
2020/4/30
2020/4/30
《香豆素波谱解析》课件

紫外可见光谱解析
总结词
紫外可见光谱解析是利用紫外光和可见光与分子相互作用,测量分子吸收光谱信息,推 断分子结构和电子跃迁。
详细描述
在紫外可见光谱解析中,香豆素分子的共轭双键和芳香环等结构会产生特征吸收峰。通 过分析这些吸收峰的位置和强度,可以推断出香豆素的取代基、连接方式和电子云分布
等信息。紫外可见光谱解析对于研究香豆素的电子结构和光学性质具有重要意义。
与其他分析技术的联用,如色谱-质谱联用 、红外-拉曼联用等,将进一步提高波谱解 析的实用性和应用范围。
波谱解析在香豆素研究中的未来展望
深入解析香豆素类化合物的结构与性质
随着波谱解析技术的不断进步,有望对香豆素类化合物进行更深入的 结构与性质研究,揭示其独特的生物活性和药理作用机制。
发现新的香豆素类化合物
03
香豆素波谱解析实例
香豆素A的波谱解析红外光谱01香豆素A在红外光谱中显示出明显的特征峰,主要在1650-1600
cm-1和1500-1450 cm-1范围内。
紫外光谱
02
香豆素A在紫外光谱中具有强吸收峰,通常在280-320 nm范围
内。
核磁共振谱
03
香豆素A的氢谱中,可以观察到7个氢的化学位移,表明其具有
04
波谱解析在香豆素研 究中的应用
波谱解析在香豆素结构鉴定中的应用
总结词
波谱解析在香豆素结构鉴定中具有重要作用 ,通过解析香豆素的紫外光谱、红外光谱、 核磁共振谱等波谱信息,可以确定香豆素的 化学结构和分子组成。
详细描述
香豆素是一类具有苯并α吡喃酮结构的化合 物,其结构多样性导致了不同的光谱特征。 通过紫外光谱可以确定香豆素的共轭体系和 取代基类型;红外光谱可以提供分子振动模 式的信息,有助于确定分子中的官能团;核 磁共振谱则可以提供氢原子和碳原子的化学
香豆素类成分分析

荧光光度法
羟基香豆素成分大多能产生强烈荧光 大多能产生强烈荧光, 大多能产生强烈荧光 用荧光光度计进行荧光测定有较高的灵敏 度及选择性。当干扰成分较多时,可先用 可先用 色谱法净化。 色谱法净化。
异香豆素 有取代的香豆素 二聚体和三聚体
结构类型
七叶内酯 (简单香豆素)
结构类型
呋喃香豆素
吡喃香豆素
结构类型
其他香豆素
仙鹤草内酯(异香豆素)
异七叶内酯(二聚体)
双香豆素
理化性质
一、物理性质 二、化学性质 三、荧光特征 四、光谱特征
物理性质
性状: 游离香豆素多有完好的结晶、固定的熔 游离香豆素 点、芳香性气味。小分子游离香豆素尚具 有挥发性和升华性,能随水蒸气蒸馏。 香豆素苷类无香味、挥发性和升华性。 香豆素苷
薄层扫描法
样品经薄层分离后,于荧光灯下定位, 利用香豆素类成分具有紫外吸收或能产生 荧光的特性,不经显色,直接进行荧光扫 荧光的特性 描测定。举例:复方制剂中补骨脂素,异 补骨脂素,白瑞香素,欧前胡素等。
高效液相色谱法
• 由于香豆素类成分含有芳香环及其他共轭 芳香环及其他共轭 结构,用高效液相色谱法测定,紫外检测 结构 器检测,有较高灵敏度。 • 常用固定相:十八烷基硅烷键和硅胶 • 常用流动相:不同比例的甲醇-水 • 举例:补骨脂素,欧前胡素,蛇床子素, 白花前胡甲素。
薄层色谱法(首选)
薄层色谱法也是利用香豆素大多具有荧 利用香豆素大多具有荧 光用薄层色谱法进行鉴别。(PS:不具荧 光或荧光强度较弱的香豆素,可用喷显色 剂或喷碱溶液以增强荧光再进行鉴识)
高速逆流色谱法分离前胡提取物中香豆素类成分

高速逆流色谱法分离前胡提取物中香豆素类成分蔡海林;杜良伟;刘祥英;陈桂华;王彦辉;柏连阳【摘要】The BALB/c mice were immunized with DHV of allantoid liquid in duck embryo which were purified by freezing and melting repeatedly, dealt with by chloroform, concentrated by PEG and overspeed membrane filtrating.Eight hybridoma cell lines were obtained after detecting and 3 sub-cloning by I-ELISA. They were named DHV-1,DHV-6, DHV-7, DHV-8, DHV-9, DHV-IO, DHV-11 and DHV-I2 respectively. The ascites titres of these MAbs were between 1 : 2 000 and 1 : 512 000. The ascites had no cross reaction with other antigen and the normal allantoid liquid in duck embryo. MAbs belonged to IgG with K -chain, neutralization test and young duck pretection test indicated that neutralization characters of DHV-6, DHV-7, DHV-9, DHV-1O are stronger.%采用超临界CO2流体萃取中药前胡中总香豆素,以石油醚:乙酸乙酯为洗脱系统,对提取物进行硅胶柱初步分离,利用高效液相色谱确定石油醚:乙酸乙酯:甲醇:水=5:5:5:4作为高速逆流色谱(HSCCC)分离的溶剂体系,在主机转速为850 r/min、流动相流速为2.0 mL/min、254 nm 波长检测条件下,根据色谱图手动收集各色谱峰组分,分离所得化合物通过核磁共振(NMR)检测并确定其结构,得到4个单体化合物,分别是前胡香豆素Ⅱ、北美芹素、白花前胡甲素、补骨脂素.【期刊名称】《湖南农业大学学报(自然科学版)》【年(卷),期】2011(037)001【总页数】4页(P86-89)【关键词】白花前胡;高速逆流色谱;前胡香豆素Ⅱ;北美芹素;白花前胡甲素;补骨脂素【作者】蔡海林;杜良伟;刘祥英;陈桂华;王彦辉;柏连阳【作者单位】湖南农业大学,生物安全科学技术学院,湖南,长沙,410128;广西大学,化学化工学院,广西,南宁,530004;湖南农业大学,生物安全科学技术学院,湖南,长沙,410128;湖南农业大学,生物安全科学技术学院,湖南,长沙,410128;湖南农业大学,生物安全科学技术学院,湖南,长沙,410128;湖南农业大学,生物安全科学技术学院,湖南,长沙,410128;湖南人文科学技术学院,湖南,娄底,417000【正文语种】中文【中图分类】O657.7对白花前胡(Peucedanum praeruptorum Dunn.)功能成分的提取主要采用水煎煮、乙醇加热回流法等,利用效率不高[1],而对前胡提取物的分离则主要采用硅胶柱层析、制备液相色谱分离等技术[2],成本较高,制备量小,过程复杂,不适合大规模的分离制备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8
OO
1
The 1H NMR Spectrum of Umbelliferone
5 4
7 2 8a
63 4a 8
129.6 144.4
113.0 161.2
111.3 111.3 155.4 160.3
HO
OO
102.1 1
The 13C NMR Spectrum of Umbelliferone
确定分子结构 ( 1H 原子的归属)
天然化合物结构解析的一般程序
13C 原子的归属
H = H0 + 2H'
H = H0 + H' - H' = H0 H0
H = H0 - H' + H' = H0
可
H = H0 - 2H'
1:2:1
能
ห้องสมุดไป่ตู้
(Triple t)
存
H
H
在
HC
CH
自
Cl
H
旋
方
H = H0 + 3H'
1H NMR 谱(一维)
CH, CH2, CH3中质子信号的归属
1H 化学位移相关二维 NMR 谱 (自旋体系的解析)
13C NMR 谱(一维) INEPT 谱(识别碳原子基团) 1H-13C 化学位移相关二维 NMR 谱
确定碳原子骨架
NOE 相关二维 NMR 谱 NOE 差谱
(确定 1H 的空间排布)
5' 4'
O
2'
O7
OH 1''
6'
5
4
4a
8a
8
O
1
3 2
O
7.49
7.94
1H
1H
s
d
H-5
J=9.5Hz
H-4
6.81
6.23
1H
1H
s
d
H-8
J=9.5Hz
H-3
4.89
1H
4.91 d
1H J=7.3Hz 4.40
t H-1'' 1H
J=8.8Hz
d
H-2'
J=8.0Hz
H-6b''
3.28 2H d J=8.8Hz H-3'
2'
O7 8
6'
OH
8a
O
1
3 2
O
3.80 OMe
3.61 1H ddd J=2.3, 8.0, 9.0Hz
G-5
G-3 G-4
G-2 2'
7.60 1H d J=9.3Hz
H-4
7.46 1H d J=16.1Hz
H-8"
7.17
6.68
6.52
1H
6.89
1H
1H
s
1H
d
s
H-5
d
J=2.0Hz
3.68 1H dd J=8.0, 12.5Hz H-6a''
4" 5"
3" 2"
The 1H NMR Spectrum of Nodakenin
1.19 1.32 3H 3H s
s H-6' H-5'
61.2 OH
29. 1
70. 3
HO HO
76. 6
76.9 O
73. 5
23. 2
O
89. 7
4.97 2H t J=8.8Hz
H-3'
5 ''
4 ''
HO
6 ''
7 ''
1 ''
8 ''
2 '' 3 ''
OM e
O
9 ''
O
HO HO
4.62
1H
OH
d
J=7.8Hz
G-1
4.49 1H dd J=11.6Hz
G-6b
4.35 1H dd J=11.6Hz
G-6a
5
4
3'
6
4a
5' 4'
OO
7.45 (1H, d, J=8.3Hz, H-5)
7.85 (1H, d, J=9.5Hz, H-4)
6.71 (1H, d, J=2.2Hz, H-8)
6.79 (1H, dd, J=2.2, 8.3Hz, H-6)
6.18 (1H, d, J=9.5Hz, H-3)
5
4
6
4a
3
7
8a 2
HO
9
6
10
O7
5
4
4a
8a
8
O
3 2
O
The 1H NMR Spectrum of Tetraacetyl[6'-O-(trans-Feruloyl)Nodakenin]
The 1H NMR Spectrum of Tetraacetyl[6'-O-(trans-Feruloyl)nodakenin]
6.79
J=8.1Hz
H-8
1H
H-5"
H-2"
dd
J=2.0, 8.1Hz
H-6"
6.17
6.09
1H
1H
d
d
J=16.1Hz J=9.3Hz
H-7" H-3
5''
4''
AcO
O
6''
7''
9''
1''
8''
O
4'
6'
CH2
2'' 3''
OM e
AcO AcO
3'
5'
12 11
O
2'
O
13
OAc 1'
The 1H NMR Spectrum of Nodakenetin
28.7
90.9
24.8
HO
69.9 O
25.8
123.8 144.5
125.4 163.2
96.7
112.0 155.0
O
111.1 160.4
O
4
8 2'
4'
5 3
7 2 8a
6 4a
5' 6'
3'
The 13C NMR Spectrum of Nodakenetin
7.94
7.49
1H
1H
d
s
J=9.5Hz H-5
H-4
6.23
6.23
1H
1H
s
d
H-8
J=9.5Hz
H-3
4.91 1H t J=8.8Hz
H-2'
4.89 1H d J=7.3Hz
H-1''
4.40 1H d J=7.3Hz
H-1''
4'' 6'' OH
3'
6
HO HO
3''
5'' O
2''
2.33 3H s Ar-OAc (-Me)
5.24 1H t J=9.4Hz H-3'
1.99
1.86
2.05 3H
3H
3H
s
s
s Glc-OAc
Glc-OAc
Glc-OAc (-Me) (-Me)
(-Me) O
6''
7''
9''
5''
4''
AcO
1'' 2'' 3''
OM e
8''
5
4
3'
6
4a
3
2'
8a 2
5' 4'
O7
OO
HO
8
1
6'
7.47
1H
7.92
s
1H H-5
d
J=9.5Hz
H-4
6.78 1H s H-8
6.21 1H d J=9.5Hz H-3
4.71 1H t J=8.8Hz H-2'
3.19 2H d J=8.8Hz H-3'
1.16 1.14 3H 3H ss H-5' H-6'
向
H0
H = H0 + H' H = H0 - H'
预
峰
期
强
图
度
谱
比
H = H0 - 3H'
1:3:3:1 (Quarterlet)
H HC
H
H CH Cl
7.85
7.45
(1H, d, J=9.5Hz, H-4) (1H, d, J=8.3Hz, H-5)
6.18 (1H, d, J=9.5Hz, H-3)
77.0 O
OH 97.2
20. 6
125.4 144.6
123. 8 163. 0
