反应热量衡算-4.18
热量恒算--年产60000吨悬浮法生产聚氯乙烯生产车间设计

附二:热量衡算(1)聚合釜(进料温度按20℃计算).A所处理的物料带入聚合釜的热量Q120℃时,VCM:Cp=0.350kcal/kg℃水: H=20.04 kcal/kg℃1=(40400) ⨯0.350⨯20=282800kcal (助剂全部以VCM计算) VCM: Q12=(48358)⨯20.04= 969094kcal水: Q1=282800kcal+969094kcal=1251894kcal所以:Q1B反应热效应Q2反应热:13274161cal/kg=258126kcalQ3(离开物料,温度以50℃计算) C所处理物料带出聚合釜的热量 Q550℃时 PVC: Cp=0.44 kcal/kg℃水: H=50.99 kcal/kg℃VCM: Cp=0.368 kcal/kg℃1=40298⨯0.44⨯50⨯0.90=797900kcalPVC: Q43=48358⨯50.99=2465774kcal水 : Q43=(4030+106.8)⨯0.368⨯50=76117 kcalVCM: Q4所以Q=76117+2465774+797900=33399791 kcal5E设备上消耗的热量 Q(初始温度计为20℃)4=0.11 kcal/kg℃设备估计自重为38050 kg材料选用钢,其热熔CP所以Q=80000⨯0.11⨯30=264000kcal5F搅拌带进的热量 Q6根据有关文献估计值为258126 kcalG夹套循环水带走的热量Q6=Q3+Q4+Q5Q1+Q2+Q6所以Q3=11417990 kcal表2-1聚合釜热量平衡表(2)沉析槽:A物料带入热量-----Q1 (进料温度以50℃计)50℃时: PVC: Cp=0.44 kcal/kg℃水: H=49.99 kcal/kg℃VCM: Cp=0.368kcal/kg℃VCM: Q11=(2503.2+67)⨯0.368⨯50=47291.7kcalPVC:Q12=22303.5⨯0.44⨯50=490677kcal水 : Q13=(38639+52.2) ⨯49.99= 1934173.1kcal所以Q1= Q11+ Q12 + Q13=3343584kcalB蒸汽加热带入热量-----Q2Q2=2081555 kcal(祥见物料平衡表)C物料带出热量----- Q3(设计出料温度为75℃)75℃时: PVC: Cp=0.44 kcal/kg℃水: H=75 kcal/kg℃VCM(汽): Cp=0.232kcal/kg℃所以 PVC:Q31=(35726+149.43+42.6)⨯75⨯0.44=1183889kcal(包括纯碱和助剂)水 : Q32=(48828+3903+58.9)⨯75=3959242.2kcalVCM: Q33=17.96⨯0.232⨯75=310kcalQ3= Q31+ Q32+ Q33=5143441 kcalD加热沉析槽的热量-----Q4(初温以20℃计算)33000⨯0.11⨯(75-20)=199650 kcal表2-2 沉析槽热量平衡表(3)汽提:A.物料带入热量-----Q1(温度以95℃计算)95℃时:水: H=95.07 kcal/kg;PVC:CP=0.44 kcal/kg℃则:PVC: Q11=hrkcal/2622759544.0)22.264.1064.1044.96.7914(=⨯⨯++++水: Q22=11695⨯95.07=877125 hrkcal/所以: Q1= Q 11+ Q 22=1139469hr kcal /B.塔底蒸汽带进的热量:(塔底温度以105℃计算)----- Q2 105℃时:H (水蒸汽)=640.9 kcal/kg; 则:hr kcal Q /15217539.6404.23742=⨯=C.VCM 带走的热量(温度以95℃计算)------Q3 95℃时:VCM(气态) C P =0.236kcal/kg.K Q3hr kcal /278)27395(236.02.3=+⨯⨯=D.物料带走的热量:(出料温度以95℃计算)-----Q4 Q 41hr kcal /1279119504.14069957.95=⨯⨯= Q 42hr kcal /3921759544.07875=⨯⨯=所以:Q4hr kcal /13530459217531279119 =+= E.塔顶冷凝器带走的热量:-----Q5 由热量平衡计算:54321Q Q Q Q Q ++=+hr kcal Q /13779025=表2-3汽提塔热量平衡表(4)干燥过程: (闪蒸干燥)A 、物料带入热量Q1(设60℃为进料温度) 40℃时,水:H=59.55Kcal/Kg PVC Cp=0.44 Kcal/Kg ℃所以,水 Q1=59.55小时cal/1175505.1959K =⨯PVC Q2=7835.6小时ka/l 20686060440K 。
热量衡算

化工计算中的能量衡算是根据热力学第一定律,即能量守恒与转化定律,对化工过程进行能量计算。
化工生产中消耗的能量形式有机械能,电能和热能等等,其中以热能为主要形式,因此化工过程中的能量衡算重点是热量衡算。
本章具体对苯酐氧化反应器进行能量衡算如下:热量衡算方程式: Q 1+Q 2+Q 3=Q 4+Q 5其中式中: Q 1——初始物料带入设备中的热量,kJQ 2——加热剂或冷却剂与设备和物料传递的热量,kJ Q 3——物理变化及化学变化的热效应,kJ Q 4——离开设备物料带走的热量,kJ Q 5——反应器系统热量损失,kJ 4.1 反应过程的能量方框图图4-1 反应工段能量衡算图4.2 反应器能量横算过程根据图4-1及能量守恒可知:Q 2=Q 4+Q 5-Q 1-Q 3 4.2.1 Q 1和Q 4的计算Q=∑M i ×C i (t 1-t 2) (Q 1和Q 4的计算都适用) 式中:M i ——反应物体系中组分的质量,kg ;C i ——组分i 在0-T℃时的平均比热容,KJ/kg.K ; t 1,t 2——反应物系在反应前后的温度,℃。
物料进入设备时的温度为145℃,热量衡算的基准为145℃,△T=0,则: Q 1=0查得各物项平均比热容数据: (kJ/kg.℃)所以: ()21i i 4t C M Q t -=∑=9.4000×6.96×(370-145)+8124.3234×1.15×225+70547.000×1.06×225+9990.0000×5.23×225+796.1912×4.52×225+162.0164×4.52×225+273.9496×4.91×225+574.4248×5.18×225+4972.6368×4.18×225+411.8582×1.11×225+2830.2066×1.45×225=38347694.4kJ 4.2.2 过程Q 3的计算过程热效率可以分为两类:一类是化学过程的热效率即化学反应速率;另一类是物理过程热效率。
热量衡算——精选推荐

第二章 能量衡算2.1 能量衡算概述物料衡算完成后,对于没有传热要求的设备,可以由物料处理量,物料的性质及工艺要求进行设备的工艺设计,以确定设备的型式,台数,容积以及重要尺寸。
对于有传热要求的设备则必须通过能量衡算,才能确定设备的主要工艺尺寸。
无论进行物理过程的设备或是化学过程的设备,多数伴有能量传递过程,所以必须进行能量衡算。
2.2 能量衡算目的对于新设计的生产车间,能量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小,所处理物料的性质及工艺要求在选择传热面的型式,计算传热面积,确定设备的主要尺寸。
传热所需要的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
对于有些伴有热效应的过程,其物料衡算也要通过与能量衡算的联合求解才能得出最后的结果。
2.3 能量衡算依据能量衡算的主要依据是能量守恒定律。
能量守恒定律是以车间物料衡算的结果为基础而进行的。
2.4 能量衡算过程 2.4.1 反应釜的热量衡算反应工段的热量衡算主要体现在反应釜和夹套。
对于有传热要求的的设备,其热量衡算为:654321Q Q Q Q Q Q ++=++;式中 1Q —物料带入到设备的热量kJ ; 2Q —加热剂传给设备的热量kJ ; 3Q —物理变化及化学反应的热效应kJ ; 4Q —物料离开设备所带走的热量kJ ; 5Q —消耗于提高设备本身温度的热量kJ ; 6Q —设备向环境散失的热量kJ 。
物料热量衡算以天为单位。
1Q 与4Q 的计算1Q 与4Q 均可按照下式计算:()tkJ mc Q Q p ∑=41 式中m —输入或输出设备的物料量,kgp c —物料的平均比热容,()C kg kJ ︒⋅/t —物料的温度,℃。
该式的计算标准是标准状态,即Pa C 3101013.10⨯︒及为计算标准。
固体和液体的比热容可以采用下式计算:Mn c c p ∑⋅=α184.4; []1式中:αc —元素的原子比热容,()C kg kJ ︒⋅/ ;n —分子中同一原子的原子数;M —化合物的分子量,kmol kg /。
热量衡算

热量衡算1计算方法与原则1.1热量衡算的目的及意义热量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小、所处理物料的性质及工艺要求再选择传热面的形式、计算传热面积、确定设备的主要工艺尺寸。
传热所需的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
1.2热量衡算的依据及必要条件热量衡算的主要依据是能量守恒定律,其数学表达式为Q1+ Q2+Q3=Q4+Q5+Q6 式1其中:Q1——物料带入到设备的热量,kJQ2——加热剂或冷却剂传给设备和所处理物料的热量,kJQ3——过程热效应,kJQ4——物料离开设备所消耗的热量,kJQ5——加热或冷却设备所消耗的热量,kJQ6——设备向环境散失的热量,kJQ1(Q4)=Σ mC P(t2- t0) kJ式2m——输入或输出设备的物料质量,kgC P——物料的平均比热容,kJ/(kg•℃)t2——物料的温度,℃t0——基准温度,℃Q5=Σ C P M (t2-t1) kJ式3M——设备各部件的质量,kgC P——设备各部件的比热容,kJ/(kg•℃)t1——设备各部件的初始温度,℃t——设备各部件的最终温度,℃2Q5+Q6=10%Q总式4热量衡算是在车间物料衡算的结果基础上而进行的,因此,车间物料衡算表是进行车间热量衡算的首要条件。
其次还必须收集有关物质的热力学数据,例如比热容,相变热,反应热等。
本设计还将涉及到的所有物料的热力学数据汇总成表4,以便于后期的计算。
1.3热量衡算基准因为物料衡算计算的是各个岗位的天处理量,所以热量衡算计算的也是某个设备天换热介质消耗量,同时温度基准采用的是0℃做基准。
当然,进行传热面积校核时,是根据批处理量计算。
2全车间物料热力学数据的估算2.1所用纯化合物比热的推算0i i pMc n C ∑=式 5式中M ——化合物分子量;n i ——分子中同种元素原子数; c i ——元素的原子比热容,kJ/(kg•℃)查《制药工程工艺设计》P111,得到原子的摩尔热容相关数据,见表1表1 元素原子的摩尔热容单位:kcal/( kmol•℃)(当物质为固体时,各原子的C a 取值近似值)原子 C a 原子 C a 原子 C a 碳C 2.8 氧O 6.0 氮N 2.6 氢H4.3硫S7.4其他8.0(当物质为液体时,各原子的C a 取值近似值)而在实际生产的过程中遇到的物质大多是混合物,极少数的混合物有实验测定的热容数据,一般都是根据混合物内各种物质的热容和组成进行推算的,其中杂质的含量极少,热效应可以忽略不计。
热量衡算

硫酸铝制备技术一、硫酸铝制备方法:目前,国内制备硫酸铝两种方法:铝土矿法+硫酸、氢氧化铝+硫酸第一种:有铁硫酸铝制备方法:用硫酸直接处理铝土矿(或粘土)的方法而制得硫酸铝,其化学反应式为: H2Al(SiO4)2·H2O+3H2SO4=Al2(SO4)3+2H4SiO4+H2O特点:原材料铝土矿便宜,但铁含量高,且不易脱除,目前,山东等铝土矿资源丰富的地方大量生产。
第二种:无铁硫酸铝制备方法:氢氧化铝+硫酸制备2Al(OH)3+3H2SO4 = Al2(SO4)3 + 6H2O + Q氢氧化铝粉出厂已脱铁,铁含量低,故硫酸铝铁含量低。
生产的硫酸铝有固体硫酸铝和液体硫酸铝。
固体硫酸铝的Al2O3含量15.8~17%,而氢氧化铝粉中Al2O3含量64~65%,运1吨氢氧化铝粉相当运4吨固体硫酸铝。
而本地浓硫酸价格相对便宜,所以,用氢氧化铝粉和浓硫酸反应生产成本低。
二、硫酸铝的反应形式- 1 -硫酸铝反应形式有两种:一种常压反应(老基地),一种带压反应(新基地)常压反应所用设备一般用玻璃钢反应釜,通蒸汽一般有两种:一种通过故泡器通蒸汽(催化剂长岭分公司),故泡器起到搅拌的作用;另一种直接通蒸汽,用工业风搅拌(齐鲁)。
带压反应所有设备一般有三种:搪瓷反应釜、搪铅通过胶泥贴耐酸瓷砖、锆反应釜(国内第一家,存在风险)。
带压反应的理论基础热量衡算:(1)、2Al(OH)3+3H2SO4 = Al2(SO4)3 + 6H2O + Q2 3 1 6 Q-1284kj/mol -194.5Kcal/mol -3435Kj/mol -285.83Kj/molQ=△RH=-285.83*6-3435+1284*2+3*194.5*4.18=-142.95kj/mol故此反应为放热反应整年反应的热量为Q反:Q反=-142.95*25000*50*3.353*1000/342=-1751869000Kj/年(2)对产物Al2(SO4)3 (1年的产量)从0℃升至140℃所需要的热量Q Al2(SO4)3Q Al2(SO4)3=CM△T 其中C=0.35Kcal/Kg.℃Q Al2(SO4)3=CM△T =0.35*4.2*25000*50*3.353*(140-0)=862559250kj/年对水的吸热(从0℃升至140℃)所需要的热量Qk100℃蒸汽r1=539Kcal/kg,H1=639.1Kcal/kg- 2 -140℃蒸汽r2=512.3Kcal/kg,H1=653Kcal/kgMH20=1324+10117=11441T故Q水=CM△T+R1*M+(H2-H1)*M=M*(4.2*100+539*4.2+13.9*4.2)=11441*4.2*(100+539+13.9)*1000=3.137*1010KJ(4)、浓硫酸稀释所放出的热量Q稀Q稀=(3677×103/98)*21021*4.2=3.313*1010KJ(5)对整个反应(时间为一年)需向反应釜提供的热量Q提Q提=Q放-Q吸=(3.313+0.175-0.086-3.137)×1010=0.265×1010KJ/年故反应无需向反应气补充蒸汽三、化工原材料性质及产品质量指标本项目原料主要有氢氧化铝粉浓硫酸,其规格及来源见下表。
第二节 热量平衡计算

3.热损失 米醪升温和第一次煮沸过程的热损失约为 前二次耗热量的15%,即: Q Q Q 2 =15%( 2 + 2 ) 4.由上述结果得: Q2=1.15( Q 2 +Q 2) =2088898(kJ)
(三)第二次煮沸前混合醪升温至70℃的耗 热量Q3 按糖化工艺,来自糊化锅的煮沸的米醪 与糖化锅中的麦醪混合后温度应为 63℃, 故混合前米醪先从100℃冷却到中间温度t。
=3.63„kJ/(kg· K)‟
混合醪比热容:
c混合 G 麦醪 c麦醪 G 米醪 c米醪 G 混合
=3.67„kJ/(kg· K)‟
(4)故Q4=26.7%G混合C混合(100-70) =559860(kJ)
2.二次煮沸过程蒸汽带走的热量Q4 煮沸时间为10min,蒸发强度5%,则蒸发水分 量为: V2=26.7%G混合5%1060 =42.4(kg) 故Q4=IV2=2257.242.4 =95705.3(kJ) 式中,I为煮沸温度下饱和蒸汽的焓(kJ/kg)。
( 5)设备向环境散热Q8为了简化计算,假定设备壁 面的温度是相同的,则: Q8=FT(tw-ta) 式中 F——设备总表面积(m2) T——壁面对空气的联合给热系数„W/(m2· ℃)‟ tw——壁面温度(℃) ta——环境空气温度(℃) ——操作过程时间(s) T的计算: ① 空气作自然对流,T=8+0.05tw ② 强制对流时,T=5.3+3.6W(空气流速W=5m/s) 或T=6.7W0.78(W>5m/s)
二、计算实例 (3000t/a啤酒厂糖化车间热量衡算)
二次煮出糖化法是啤酒生产常用的糖 化工艺,下面就以此工艺为基准进行糖 化车间的热量衡算。工艺流程示意图如 图5-6所示,其中的投料量为糖化一次的 用量(计算参考本章第一节表5-7)。
(整理)第四章能量衡算及热数据的估算习题解答
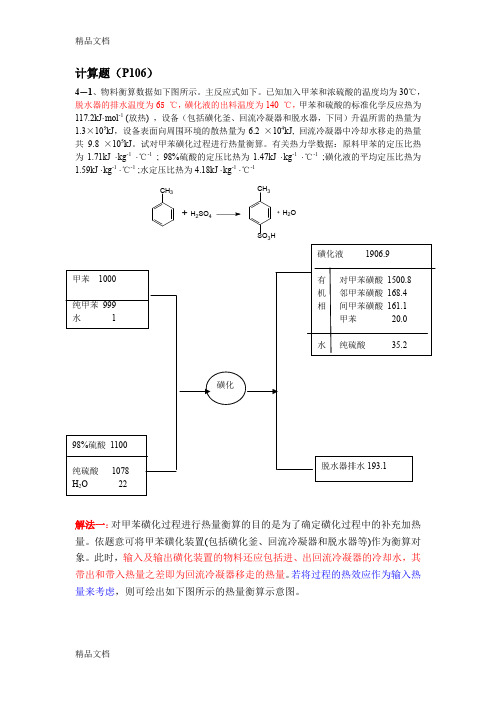
计算题(P106)4-1、物料衡算数据如下图所示。
主反应式如下。
已知加入甲苯和浓硫酸的温度均为30℃,脱水器的排水温度为65 ℃,磺化液的出料温度为140 ℃,甲苯和硫酸的标准化学反应热为117.2kJ·mol -1 (放热) ,设备(包括磺化釜、回流冷凝器和脱水器,下同)升温所需的热量为1.3×105kJ ,设备表面向周围环境的散热量为6.2 ×104kJ, 回流冷凝器中冷却水移走的热量共9.8 ×105kJ 。
试对甲苯磺化过程进行热量衡算。
有关热力学数据:原料甲苯的定压比热为1.71kJ ·kg -1 ·℃-1 ; 98%硫酸的定压比热为1.47kJ ·kg -1 ·℃-1 ;磺化液的平均定压比热为1.59kJ ·kg -1 ·℃-1 ;水定压比热为4.18kJ ·kg -1 ·℃-1解法一:对甲苯磺化过程进行热量衡算的目的是为了确定磺化过程中的补充加热量。
依题意可将甲苯磺化装置(包括磺化釜、回流冷凝器和脱水器等)作为衡算对象。
此时,输入及输出磺化装置的物料还应包括进、出回流冷凝器的冷却水,其带出和带入热量之差即为回流冷凝器移走的热量。
若将过程的热效应作为输入热量来考虑,则可绘出如下图所示的热量衡算示意图。
CH 3+H 2SO 4CH 33H+H 2O则热量平衡方程式可表示为 取热量衡算的基准温度为25o C (若取0 ℃作为基准,结果又如何?),则(1)(2)磺化过程热效应反应中共加入98%浓硫酸的质量为1100kg ,其中含水22kg 。
若以SO 3计,98%硫酸的质量分率为80%。
由式(4-44)得反应结束后,磺化液含硫酸35.2kg,水21.4kg 。
以SO 3计,硫酸的质量分率为50.8%。
则1234567Q Q Q Q Q Q Q ++=+++141000 1.71(3025)1100 1.47(3025) 1.6610Q kJ=⨯⨯-+⨯⨯-=⨯3p cQ Q Q =+1-122111 2.989(2515)110.20130.062 4773.4 kJ (kg H )s H m mm mO -∆=+--++=⋅2-122111 2.989(2515)10.50810.5080.20130.0620.5080.5081833.6 kJ (kg H )s H O ⨯-∆=+--++=⋅所以有反应消耗的甲苯量为979 kg ,则(3)反应产物(磺化液、脱水器排出的水)带走的热量Q 4 Q 4=1906.9 x 1.59 x (140-25)+193.1 x 4.18 x (65-25)=3.77 x 105 KJ (4)由题意知 Q 5=1.3 x 105 KJ Q 6=6.2 x 104 KJ Q 7=9.8 x 105 KJ 所以Q 2=Q 4+Q 5+Q 6+Q 7-Q 1-Q 3=2.12 x 105 KJ4224773.421.41833.6 6.610p Q kJ=⨯-⨯=⨯kJ1025.1 2.1179210979Q 63c ⨯=⨯⨯=kJ1032.1 1025.1106.6 Q Q Q 664cp 3⨯=⨯+⨯=+=解法二:对甲苯磺化过程进行热量衡算的目的是为了确定磺化过程中的补充加热量。
热量衡算

热量衡算1计算方法与原则1.1热量衡算的目的及意义热量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小、所处理物料的性质及工艺要求再选择传热面的形式、计算传热面积、确定设备的主要工艺尺寸。
传热所需的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
1.2热量衡算的依据及必要条件热量衡算的主要依据是能量守恒定律,其数学表达式为Q1+ Q2+Q3=Q4+Q5+Q6 式1其中:Q1——物料带入到设备的热量,kJQ2——加热剂或冷却剂传给设备和所处理物料的热量,kJQ3——过程热效应,kJQ4——物料离开设备所消耗的热量,kJQ5——加热或冷却设备所消耗的热量,kJQ6——设备向环境散失的热量,kJQ1(Q4)=Σ mC P(t2- t0) kJ式2m——输入或输出设备的物料质量,kgC P——物料的平均比热容,kJ/(kg•℃)t2——物料的温度,℃t0——基准温度,℃Q5=Σ C P M (t2-t1) kJ式3M——设备各部件的质量,kgC P——设备各部件的比热容,kJ/(kg•℃)t1——设备各部件的初始温度,℃t——设备各部件的最终温度,℃2Q5+Q6=10%Q总式4热量衡算是在车间物料衡算的结果基础上而进行的,因此,车间物料衡算表是进行车间热量衡算的首要条件。
其次还必须收集有关物质的热力学数据,例如比热容,相变热,反应热等。
本设计还将涉及到的所有物料的热力学数据汇总成表4,以便于后期的计算。
1.3热量衡算基准因为物料衡算计算的是各个岗位的天处理量,所以热量衡算计算的也是某个设备天换热介质消耗量,同时温度基准采用的是0℃做基准。
当然,进行传热面积校核时,是根据批处理量计算。
2全车间物料热力学数据的估算2.1所用纯化合物比热的推算0i i pMc n C ∑=式 5式中M ——化合物分子量;n i ——分子中同种元素原子数; c i ——元素的原子比热容,kJ/(kg•℃)查《制药工程工艺设计》P111,得到原子的摩尔热容相关数据,见表1表1 元素原子的摩尔热容单位:kcal/( kmol•℃)(当物质为固体时,各原子的C a 取值近似值)原子 C a 原子 C a 原子 C a 碳C 2.8 氧O 6.0 氮N 2.6 氢H4.3硫S7.4其他8.0(当物质为液体时,各原子的C a 取值近似值)而在实际生产的过程中遇到的物质大多是混合物,极少数的混合物有实验测定的热容数据,一般都是根据混合物内各种物质的热容和组成进行推算的,其中杂质的含量极少,热效应可以忽略不计。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.热量衡算主要对氯化反应器进行热量衡算,通过衡算,可以确定塔顶排出的汽化苯的量。
本衡算中,为计算方便,取进料中H 2和Cl 2温度同为25℃,取出料中氯化液的温度和塔顶排出气体的温度同为81℃。
2.1 反应器热量衡算中所使用到的数据参考葛化厂资料,画出反应器热量衡算图:81℃) (30℃) (81℃) 图2-1 反应器热量衡算图考虑到本衡算中是多处进料和多处出料,并且温度也有差异,故对液体物料取25℃液相为计算基准,氯气、氯化氢等气体物料取25℃汽相为计算基准。
应用下面形式的热衡算方程[8]:Q 1+Q 2+Q 3=Q 4+Q 5+Q 6+Q 7 (2-1)式中 Q 1 ——物料带入热;Q 2 ——过程放出的热; Q 3 ——从加热介质获得的热; Q 4 ——物料带出热; Q 5 ——冷却介质带出的热; Q 6 ——过程吸收的热; Q 7 ——热损失,一般取5%Q 2。
本衡算中,经过分析可知Q 3(从加热介质获得的热),Q 5(冷却介质带出的热)以及Q 6(过程吸收的热)都可以取0,于是该热衡算方程可简化为:Q 1+Q 2=Q 4+Q 7。
查得:物质的液体热容温度关联式系数[9]:C pl =A+BT+CT 2+DT 3表2-1 物质的液体热容温度关联式系数表物质的理想气体热容温度关联式系数[10]:C p =a 0+a 1T+a 2T 2+a 3T 3+a 4T 4 苯在25℃下的气化热:△v H 298,苯= 33.6KJ/mol,T c 苯=562.05K;表2-2 物质的理想气体热容温度关联式系数表物质的标准生成热:△f H 298,苯(l )=48.99KJ/mol ,△f H 298,氯苯(l )=11.0 KJ/mol ,△f H 298,氯化氢(g )=-92.3 KJ/mol ,△f H 298,氯气(g )=0, △f H 298,二氯苯(l )= -17.5KJ/mol.根据物料衡算,结果列于表2-3中:2.2 物料带入热Q 1的热量衡算分别取25℃液相和25℃汽相为计算基准,有:①进料苯:Q进料苯=0②循环苯:Q循环苯=n循环苯∫303298C p苯dT=n循环苯[119.1207×(303-298)-9.995542×10-2×(3032-2982)/2+5.251917×10﹣4×(3033-2983)/3]= n循环苯×682.55=682.55×n循环苯③进料Cl2:Q进料Cl2=0④进料H2:Q 进料H2=0则:Q1 =Q进料苯+ Q循环苯+ Q进料Cl2+ Q 进料H2=0+682.55×n循环苯+0=682.55×n循环苯2.3 物料带出热Q4的热量衡算分别取25℃液相和25℃汽相为计算基准,有:2.3.1 出料氯化液的热衡算①氯化液中的苯:Q氯化液中的苯=n氯化液中的苯∫354C p苯dT=32.88×[119.1207×(354-298)-9.995542×10-2×(3542-2982)/2+5.251917×10﹣4×(3543-2983)/3]= (32.88×7979.3)KJ/h=2.624×105KJ/h②氯化液中的氯苯:Q氯化液中的氯苯=n氯化液中的氯苯∫354C p氯苯dT=9.958×[64.358×(354-298)+61.902×10-2×(3542-2982)/2-16.346×10﹣4×(3543-2983)/3+1.8478×10﹣6×(3544-2984)/4]=(9.958×8764.2)KJ/h=8.727×104 KJ/h③氯化液中的二氯苯(取邻位):Q氯化液中的二氯苯=n氯化液中的二氯苯∫354C p二氯苯dT =0.254×[68.542×(354-298)+7.7568×10-1×(3542-2982)/2-1.838×10﹣3×(3543-2983)/3+1.8585×10﹣6×(3544-2984)/4]=(0.254×10665.9)KJ/h= 2.709.×103KJ/h④氯化液中的HCl:Q氯化液中的HCl= n氯化液中的HCl∫354C p HCl dT=0.205×[3.827×(354-298)-2.936×10-3×(3542-2982)/2+0.879×10﹣5×(3543-2983)/3-1.031×10﹣8×(3544-2984)/4+0.439×10﹣11×(3545-2985)/5﹚]=(0.205×8764.2)KJ/h =40.28KJ/h⑤氯化液中的Cl2:Q氯化液中的Cl2= n氯化液中的Cl2∫354C p Cl2dT=0.005×[3.0560×(354-298)+5.3708×10-3×(3542-2982)/2-0.8098×10﹣5×(3543-2983)/3+0.5693×10﹣8×(3544-2984)/4-0.15256×10﹣11×(3545-2985)/5﹚]=(0.005×231.02)KJ/h=1.155KJ/h2.3.2 塔顶排出气体的热衡算①塔顶气化苯:由△v H298,苯=33.6KJ/mo,T c苯=562.05K及公式T r=T/T c:△v H354,苯气化/△v H298,苯气化=(1-T r苯81℃/1-T r苯25℃)0.38得:△v H354,苯气化=[(1-354/562.05)/(1-298/562.05)]0.38×33.6=30.69KJ/mol∫354C p苯dT=[119.1207×(354-298)-9.995542×10-2×(3542-2982)/2+5.251917×10﹣4×(3543-2983)/3]=7979.3J/mol则:Q塔顶气化苯=n塔顶气化苯×△v H354,苯气化+ n塔顶气化苯×∫354C p苯dT= (n循环苯/0.97)×30.69×103+(n循环苯/0.97)×7979.3= n循环苯×3.987×104=(3.987×104)n循环苯②塔顶HCl:Q塔顶HCl=n塔顶HCl∫354C p HCl dT=10.26×[3.827×(354-298)-2.936×10-3×(3542-2982)/2+0.879×105(3543-2983)/3-1.031×10﹣8×(3544-2984)/4+0.439×10﹣11×(3545-2985)/5﹚] =( 10.26×196.48 )KJ/h =2.009×103KJ/h③塔顶Cl2:Q氯化液中的Cl2= n氯化液中的Cl2∫354C p Cl2dT=0.039×[3.0560×(354-298)+5.3708×10-3×(3542-2982)/2-0.8098×10﹣5×(3543-2983)/3+0.5693×10﹣8×(3544-2984)/4-0.15256×10﹣11×(3545-2985)/5﹚]=9.010KJ/h④塔顶H2: Q塔顶H2=n塔顶H2∫354C p H2dT=11.58×[2.8833×(354-298)+3.6807×10-3×(3542-2982)/2-0.7720×10﹣5×(3543-2983)/3+0.6915×10﹣8(3544-2984)/4-0.2125×10﹣11(3545-2985)/5]=2.255×103KJ/h则:Q4= Q氯化液中的苯+ Q氯化液中的氯苯+Q氯化液中的二氯苯+ Q氯化液中的Cl2+ Q氯化液中的HCl+ Q塔顶气化苯+ Q + Q氯化液中的Cl2+ Q塔顶H2塔顶HCl=2.624×105+8.727×105+2.709.×103+40.28+1.155+(3.987×104)n循环苯+2.016×103+9.010+2.255×103=3.567×105+(3.987×104)n循环苯2.4 过程放出热Q2的热量衡算过程放出的热量可通过下式进行计算:Q2=(-△H主反应)+ (-△H副反应)分别计算出主反应的反应热△H主反应和副反应的反应热△H副反应2.4..1 主反应的反应热△H主反应对主反应可以假设如下热力学途径:反应物料在354K下降到298K,在298K下进行化学反应,反应后的物料再从298K升温到354K:△H主反应(354K) C6H6(l)+Cl2(g)C6H5Cl(l)+HCl(g)(354K)△H主1 △H主2△H主r,25℃(298K) C6H6(l)+Cl2(g)C6H5Cl(l)+HCl(g)(298K)①以354K下的物料为初状态,298K下物料为末状态,进行计算△H主1:△H主1=n反应苯∫298C p苯dT+n反应Cl2∫298C p Cl2dT则:n反应苯∫298C p苯dT=9.958×(-7979.3)=-7.946×104 KJ/hn反应Cl2∫354C p Cl2dT=9.958×(-231.02)=-2.300×103 KJ/h△H主1=n反应苯∫298C p苯dT+n反应Cl2∫298C p Cl2dT=-7.946×104 -2.300×103 = -8.176×104 KJ/h②298K下化学反应的反应热为:△H主r,25℃= n氯苯△f H298,氯苯(l)+ n HCl△f H298,HCl(g)- n苯△f H298,苯(l)- n Cl2△f H298,Cl2 =9.958×103×(11-92.3-48.99-0)= -1.297×106 KJ/h(g)③以298K下反应产物为初状态,354K下反应产物为末状态,进行计算△H主2:△H主2=n生成氯苯∫354C p氯苯dT+n生成HCl∫354C p HCl dT则:n生成氯苯∫354C p氯苯dT =9.958×8764.2=8.727×104 KJ/hn生成HCl∫354C p HCl dT= 9.958×196.48=1.957×103 KJ/h△H主2= n生成氯苯∫354C p氯苯dT+ n生成HCl∫354C p HCl dT=8.727×104+1.957×103=8.923×104 KJ/h则: △H主反应=△H主1+△H主r,25℃+△H主2= -8.176×104-1.297×106+8.923×104 =-1.290×106 KJ/h2.4.2 副反应的反应热△H副反应对副反应可以假设如下热力学途径:反应物料在354K下降温到298K,在298K下进行化学反应,反应后的物料再从298K升温到354K:△H主反应354K C6H6(l)+2Cl2(g)C6H4Cl2(l)+2HCl(g)354K△H副1 △H副2△H副r,25℃298K C6H6(l)+2Cl2(g)C6H4Cl2(l)+2HCl(g)298K①以354K下的物料为初状态,298K下物料为末状态进行计算△H主1:△H副1=n反应苯∫298C p苯dT+2n反应Cl2∫298C p Cl2dTn反应苯∫298C p苯dT=0.254×(-7979.3)=-2.027×103 KJ/hn反应Cl2∫354C p Cl2dT=0.254×2×(-231.03)=-1.174×102 KJ/h△H副1=n反应苯∫298C p苯dT+n反应Cl2∫298C p Cl2dT=-2.027×103-1.174×102 =-2.144×103 KJ/h②298K温度下化学反应的反应热为:△H副r,25℃=n二氯苯(l)△f H298,二氯苯(l)+n HCl(g)△f H298,HCl(g)-n苯(l)△f H298,苯(l)-n Cl2(g)△f H298,Cl2(g)=[0.254×(-17.5) +2×0.254×(-92.3)-0.254×48.990-0]×103= -6.378×104 KJ/h氯苯③以298K下反应产物为初状态,354K下反应产物为末状态,进行计算△H副2:△H副2=n生成二氯苯∫354C p二氯苯dT+2生成HCl∫354C p HCl dTn生成邻二氯苯∫354C p邻二氯苯dT =0.254×10665.9=2.709×103 KJ/h2n生成HCl∫354C p HCl dT=2×0.254×196.48=99.81 KJ/h△H副2= n l生成氯苯∫354C p氯苯dT+ n生成HCl∫354C p HCl dT= 2.709×103+99.81= 2.809×103 KJ/h则: △H副反应=△H副1+△H副r,25℃+△H副2=-2.144×103 -6.378×104+ 2.809×103= -6.312×104 KJ/hQ2 =(-△H主反应)+ (-△H副反应)=1.290×106+6.312×104=1.353×106KJ/h2.5 热损失Q7的热量衡算根据经验,取反应热的5%为热损失,则:Q7=5%Q2=0.05×1.353×106 = 6.765×104KJ/h2.6 总热量衡算由热量衡算方程:Q1+Q2= Q4+Q7,带入数据得:682.55×n循环苯+1.353×106=3.567×105+(3.987×104)n循环苯+6.765×104n循环苯=23.70最后相对误差为(23.70 – 18.60)/18.60×100%= 27.42%表2-4 热量衡算总表参考文献[8] 黄璐、王保国、化工设计、北京:化学工业出版社,2001:174-401[9] 马沛生、有机化合物实验性数据手册、北京:化学工业出版社,2006:427-556[10] 马沛生、化工热力学、北京:化学工业出版社,2005:347-380[11] 张濂、许志美、化学反应器分析、上海:华东理工大学出版社,2005:11-304。
