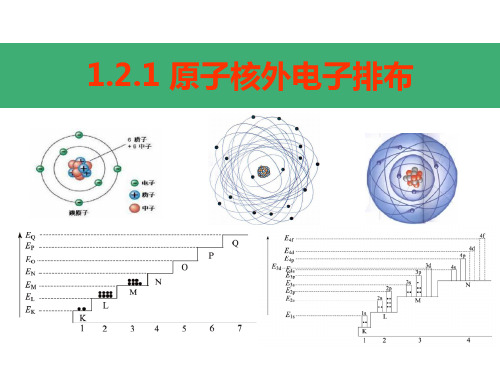
核外电子排布
核外电子排布轨道

• ∴ 2021/10/10
E4S < E3d
3
钻穿效应:
多电子原子中,n大 l 小的轨道上的电子潜入 核附近的空间区域,较好地躲避其他电子的屏蔽 作用,增加核引力,使轨道能量降低的渗透作用, 称为电子的钻穿效应。
2021/10/10
4
二、核外电子排布
1、电子排布三原理 ⑴、保里不相容原理
每个原子轨道至多容纳两个自旋方向相反 的电子。或者说,在同一原子中,不能有四 个量子数完全相同的两个电子。
2021/10/10
返回9
13
12
说明:
为了简化原子的电子结构,通常将内层已达 稀有气体的电子层结构,用稀有气体加方括 号表示,并称为“原子实”。
例:Cr、Cu、Br和Hg的电子排布式为: Cr:[Ar] 3d5 4s1 Cu:[Ar] 3d10 4s1 Br:[Ar] 3d10 4s2 4p5 Hg:[Xe] 4f14 5d10 6s2
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
所以其电子排布式为:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
Hg:(80) 电子排布式为:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2
2021/10/10
③、同一原子内,n、l 都不同的分层间有能 级交错现象。
E4S < E3d < E4P
E5S < E4d < E5P
E6S < E4f < E5d < E6P • 轨道能级E用n+0.7 × l 规则求算:
•
n+0.7 ×l 越小,能级越低
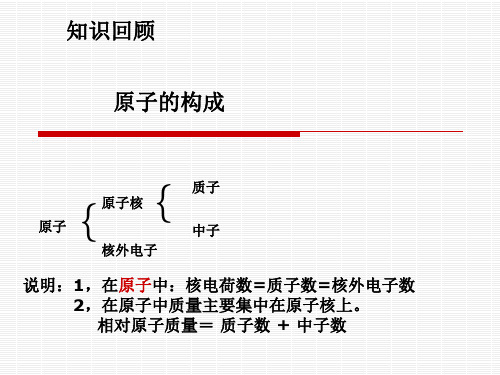
原子核外电子排布规律

【21】以第1、2、3周期的元素为例,了解原子核外电子排布规律。
1.核外电子排布的一般规律。
(1)各电子层最多容纳的电子数目为2n2。
(2)最外层不超过8个电子(K层例外)。
(3)次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
核外电子排布规律的依据:(1)核外电子运动的特点①电子的质量很小,运动空间很小,但电子的运动速度很快,接近于光速。
②在高速的运动时,不能找到运动轨迹,不能准确地测量和计算出电子的确切位置。
(2)核外电子总是尽先排布在能量最低电子层里,然后由里到外,依次排布在能量逐步升高的电子层里。
总之,是核外电子运动的客观事实。
2.元素的性质与元素的原子核外电子排布的关系。
(1)稀有气体的不活泼性。
稀有气体元素的原子最外层有8个电子(氦是2个)处于稳定结构,因此化学性质稳定,一般不跟其它物质发生化学反应。
(2)非金属性与金属性(一般规律)最外层电子数得失电子趋势元素的性质金属元素4易得非金属性3.第1、2、3周期的元素(短周期元素)微粒结构特点(1)稀有气体原子的电子层结构与同周期的非金属元素形成的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同(所谓电子层结构相同是指:电子层数相同;电子总数相同;各层电子数相同)。
①与He核外电子排布相同的离子有:H-、Li、Be2②与Ne电子层结构相同的离子有:F-、O2-、N3-、Na、Mg2、A3③与Ar原子电子层结构相同的离子有:C-、S2-、和Y n-的核外电子排布相同,则下列关系式中正确的是()A a=b+m+nB a=b-m+nC a=b+m-nD a=b-m-n【解析】由元素X、Y的核电荷数分别是a和b,离子X m和Y n-的核外电子排布相同,可得:a-m=b+n,即a=b+m+n。
【答案】A【点评】离子X m和Y n-可表示为:a X m和b Y n-。
a X m意为a X原子失去m个电子形成的阳离子,所以a X m的电子数为a-m;b Y n-意为b Y原子得到n个电子形成的阴离子,所以b Y n-的电子数为b+n。
核外电子排布

小试牛刀:
• 某元素的原子结构示意图为 +12 2 8 2,该元
素原子核内有 12 个质子,最外层电子层上 2 有 个电子。
19/24
判断下列原子结构示意图的正误
O
Al
F
Na
P
【思考】下列1-18元素原子结构示意图中
17/24பைடு நூலகம்
1.(2009•南充)从原子的结构可知( ) A.原子核是由质子和电子组成B.原子核内的中子个数和核外 电子个数总是相等C.原子仅由质子和中子组成D.原子是由原 子核和核外电子组成 2.(2011•新疆)某原子的结构示意图为 核电荷数为( ) A.6 B. 8 C.10 ,则它的 D.16
第二课时
原子核外电子的排布
15/24
【思考】电子在核外的空间里做高速的运 动。它们会相互碰撞打架吗?电子在核外 运动有没有可遵循的规律呢?
一、原子核外电子的排布
(电子在核外是按照能量由低 →高,由里→外分层排布的。 离核最近的电子层为第一层, 次之为第二层,依次类推为三、 四、五、六、七层,离核最远 的也叫最外层)
举例
He、Ne Ar、Kr等
不稳定
Li、Na、 K、Mg等
非金属元素
一般≥4个
易得到电子
不稳定
N、O、 P、C等
结论:元素的化学性质主要决定于 最外层电子数 。
排布特点1:电子在 核外是分层排布的
18/24
排布特点2:
1、从里到外电子的能量从低到高。 2 2、每层最多排2N 个电子 (N表示电子层数) 3、最外层电子数最多不超过8个(只有1 层的不超过2个电子)。
16/24
【】我们可以用一个更简明的图形来表 示原子的结构及原子核外电子的分层排 布。
电子的核外排布

≥4个
稳定(不得失)
在化学反应中 易失去电子
在化学反应中 易得到电子
总结:元素的性质,特别是化学性质,跟它的原
子的 最外层电子数
关系密切。
练习:
下面的结构示意图正确的是:( )
+3 2 1 A
+3 3 B
+11 2 8 1 +11 2 9
C
D
练习:
画出下列原子的结构示意图:
7N
12Mg
17Cl
部分金属元素的原子结构示意图
3、下列具有相似化学性质的元素组别
是: C、D
。
A.
B.
C.
D.
同学们有没有想过电子是 怎样围绕原子核做高速运
动的呢?
三、原子核外电子的不同运动区域
多电子原子核外电子的分层运动状况
核外电子分层排布
电子按能量高低在核外分层排布。 1234567 K LMNOPQ
由内到外,能量逐渐升高
核外电子的分层排布(又叫分层运动)
电子层符号 K L M N O P Q
电子层序数(n) 1 2 3 4 5 6 7
电子离核的距离 近
远
电子具有的能量 低
高
2、原子结构示意图
如: Na
核内质子数
电子层
原子核
每个电子层上的电子数
称有气体元素原子电子层排布
各电子层的电子数
核电 元素名 元素
荷数 称 符号 K
L
M
N
O
P
最外层电子 数
2
氦
He
2
2
10
氖
Ne
2
8
8
18
氩
Ar
1.2.1 原子核外电子排布
元素的金属性、非金属性。
二、元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性 的变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外 电子排布周期性变化的必然结果。
随堂练习:
1、R元素形成的化合物RH3,其中R的化合价是其 最低负化合价,则R元素最高价氧化物的化学式是:
111
88
77
N(氮) O(氧) F(氟)
70
66
64
Ne(氖) —
11~17 号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷)
原子半
径/pm
186
160
143
117
110
S(硫) 104
Cl(氯) Ar(氩)
99
—
提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。 (2)表中数据的单位是pm(皮米),1pm=10-12m。
1.2.1 原子核外电子排布
一、原子核外电子排布 原子结构示意图
一、原子核外电子排布
各电子层排布的电子数
电子层(从里到外为K、L、M······层) 核电荷数
原子核
一、原子核外电子排布
1、原子核外电子排布
(1)核外电子按能量高低分层排布(运动)
电子层: 根据电子的能量差异和通常运动区域离核
(能层)
〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子 半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表 示原子半径,根据数据表作图,表示出3~9、11~17的元素的 原子最外层电子数与原子半径的函数图像。
3~9号 元素
原子半 径/pm
原子的核外电子排布

04 核外电子排布的实例
氢原子的核外电子排布
1
氢原子只有一个电子,排布在1s轨道上。
2
氢原子是所有原子中最简单的,其核外电子排布 遵循泡利不相容原理和能量最低原理。
3
氢原子核外电子排布的能量状态由主量子数n决 定,本例中n=1。
轨道表示式
轨道表示式是另一种表示原子核外电 子排布的方法,它通过图形的方式表 示电子云的分布和电子的运动状态。
轨道表示式的优点是可以直观地展示 电子云的分布情况和电子的运动状态, 有助于理解电子的行为和性质。
能级交错现象
能级交错现象是指在实际的原子核外电子排布中,有些电子 会出现在比其理论能级高的能级上,这种现象称为能级交错 。
。
05 核外电子排布的意义
对元素性质的影响
决定元素的化学性质
核外电子排布决定了元素的化学性质,因为元素的化学反应主要涉及电子的得失或偏移。
元素周期表中的位置与性质
同一周期内,随着原子序数的增加,核外电子数增多,电子填充到更高能级,元素的非金属性增强,金属性减弱。
对周期律的解释
周期表的形成
核外电子排布规律是形成元素周期表的基础,周期表中元素的排列顺序是根据核外电子排布来确定的 。
最低。
当电子从高能级跃迁到低能级时, 会释放出能量,这个能量可以通
过发射光子的方式释放出去。
洪特规则
洪特规则指出,在任何一个原子中,对于同一 能级上的电子,总是优先以等价的方式占据不 同的轨道。
这个规则的原因是,当电子以等价的方式占据 不同的轨道时,它们之间的相互作用是最小的, 从而使得整个原子的能量最低。
原子核外电子排布

原子核外电子排布
⑴电子层——能量高低不同的区域,并非真实存在
⑵核外电子的分层排布:
通常用电子层形象地表示电子离核远近的不同,离核越近,电子能量越低;离核越远,电子能量越高。
⑶核外电子排布的规律:
第一层最多容纳2个电子;第二层最多容纳8个电子;最外层电子数不超过8个。
注意点:核外电子排布是由内到外排,尽量排在能量较低的电子层里,即排满第一层才轮到第二层,以此类推。
⑷原子结构与性质的关系:(依照元素周期表)
①每一横行,核电荷数即质子数依次增加,电子层数相同,每一横行的开头是金属原子(H 除外),靠近结尾是非金属原子,结尾是稀有气体原子;
②每一纵列,电子层数依次增加,最外层电子数相同;
③最外层电子数与原子性质的关系:
A 金属原子——最外层电子一般< 4个(H、He除外);~易失电子
B 非金属原子——最外层电子一般≥4个;~易得电子
C 稀有气体原子——一般为8个(He是2个)~不易得失电子
原子的化学性质主要取决于原子最外层电子数。
原子最外层电子数是相对稳定结构的,该原子的性质就稳定。
1。
核外电子排布
C它有3个电子层
D.它的最外层有2个电子 2、右图为硫原子的结构示意图。 (1)硫原子核内质子数为 16 (2)硫离子的符号为 S ; ;
(3)硫元素属于 金属元素 素”)
(填“金属元素”或“非金属元
3、 1998年中国十大科技成果之一是合成氮化镓纳米 材料,已知镓(Ga)的原子结构示意图如下图(甲) 31 所示,则x的值为________ ,镓元素的化学性质与下列 B 哪种元素的化学性质最相似________ (在A、B、C图 中选择,填字母);下列所示的四种元素最本质的区 质子数不同 别是_________________________ 。
铵根离子碳酸根离子来自12Mg2 82
+16
2 8 6
S
原子中,质子数=电子数
1、在原子中,质子数和电子数有何关系 ?
Mg2+
+12 2 8
S2- +16 2 8
8
2、在离子中,质子数和电子数又有何关系?
阳离子中,质子数>电子数 阴离子中,质子数<电子数
1、如右图是某原子结构示意图,有关它的说法错误的是 ( ) A.它的核内有12个质子 B.它属于非金属元素
He
二
Li Be B C N O F Ne
三
Na Mg Al Si P S Cl Ar
四
K Ca
周 期 一 二
1——20号元素的原子核外电子的排布
H He
Li
Be
B
C
N
O
F
Ne
三
Na Mg Al Si P S Cl Ar
非金属元素:原 子最外层 电子个 稀有气体元素: 四 数一般大于或等 原子最外层一般 于 4 (易得到电 K Ca 子) 为8个电子 金属元素:原子最外层电子个 (氦是2个电子) 数一般少于4 ( 易失去电子)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
▪
用心呵护,塑造金牌品质。2020年10月 18日星 期日上 午9时42分35秒09:42:3520.10.18
▪
安全不仅关系自己,安全连同国家集 体。2020年10月上午9时42分 20.10.1809:42October 18, 2020
▪
人人齐努力,创造好品质。2020年10月18日 星期日9时42分 35秒09:42:3518 October 2020
(2)核电荷数小于18的两种元素B、C,B 原子最外层电子数为a,次外层电子数为b; C原子M层电子数为a-b,L层电子数为a+b。
A: M g
B:O
C: Si
练习
现有A和B两种原子,A原子的M层比B原子
的M层少3个电子, B原子的L层电子数恰为A原子的L
层电子数的两倍。则A和B是何种原子?
K层
L层
▪
以安全第一为荣,以忽视安全为耻。 上午9时 42分35秒上午 9时42分09:42:3520.10.18
▪
遵章是幸福的保障,违纪是灾祸的开 端。20.10.1820.10.1809:4209:42:3509:42:35Oct-20
▪
不接受不合格品,不制造不合格品, 不交付 不合格 品。2020年10月18日 星期日9时42分 35秒Sunday, October 18, 2020
2、核外电子排布规律
“一低四不超原则”
▪
效果很全面,持之以恒是关键。20.10.1820.10.18Sunday, October 18, 2020
▪
自觉遵守饭堂纪律,养成饮食卫生习 惯。09:42:3509:42:3509:4210/18/2020 9:42:35 AM
▪
防止违章动火六大禁令。20.10.1809:42:3509:42Oct- 2018-Oct-20
M层
A 原子
2
x
y
B 原子
2
2x
y+3
对B原子,M层至少有3个电子,L层排M层。
A原子核外电子排布为 2 , 4 , A是碳原子
B原子核外电子排布为 2, 8 , 3 B是铝原子
小结:
原子核外电子的排布
1、电子层的划分
按能量由低到高,离核由近到远:1、2、3、4、5、6、7 符号:K、L、M、N、O、P、Q
▪
生产再忙安全不忘,人命关天安全优 先。20.10.182020年10月18日 星期日 9时42分35秒20.10.18
谢谢大家!
(3)次外(倒数第三)层电子数不超过18(32)个电子;
(4)核外电子总是尽先排布在能量较低的 电子层,然后由里向外,依次排布在能量逐
步升高的电子层(能量最低原理)。
练习:
1、总结1至18号原子结构的特 殊性。
(1)原子中无中子的原子:11H
(2)最外层有1个电子的元素:
H、Li、Na
(3)最外层有2个电子的元素:
第一章 物质结构 元素 周期律
第二节 元素周期律
一、原子核外电子的排布
1、电子层的划分
电子层(用n表示) 1、2、3、4…….
电子层符号 离核距离
K、L、M、N、O、P、 Q
近
远
能量高低
低
高
看1~18号元素原子结构示 意图,思考:有什么特点
2、核外电子排布规律
(1)各电子层最多容纳2n2个电子; (2)最外电子数不超过8个电子(K层为最外层时 不超过2个);
He、Be、Mg (4)最外层电子数等于次外层电子 数的元素:Be、Ar
(5 )最外层电子数是次外层 电子数2倍的元素:C
(6)最外层电子数是次外层 电子数3倍的元素: O
(7)最外层电子数是次外层 电子数4倍的元素:Ne
2、根据下列叙述,写出元素名称并画出原 子结构示意图
(1)A元素原子核外M层电子数是L层的 四 分之一
▪
没有措施的管理是空谈,没有计划的 工作是 空洞。09:42:3509:42:3509:42Sunday, October 18, 2020
▪
防事故年年平安福满门讲安全人人健 康乐万 家。20.10.1820.10.1809:42:3509:42:35October 18, 2020
▪
推动全员品质活动,提高全员工作十 七。2020年10月18日 上午9时 42分20.10.1820.10.18
