知识总结物质间的相互转化
八年级物理物态变化的知识点

八年级物理物态变化的知识点知识点1:物质的三态及相互转化物质一般存在于三种状态,即固态、液态和气态。
这些状态之间可以通过物态变化相互转化。
1.1 固态在固态下,物质的分子相对稳定地固定在一起。
固态物质的分子间有较强的相互作用力。
固态物质具有固定的形状和体积,原子或分子只能做微小的振动运动。
1.2 液态在液态中,物质的分子之间的相互作用力比在固态中要弱,分子之间能够互相滑动。
液态物质具有较强的流动性和一定的体积。
1.3 气态在气态下,物质的分子之间的相互作用力很弱,分子之间几乎没有相互吸引力。
气态物质具有很高的流动性和变化的体积。
1.4 相互转化物质之间可以通过加热或降温、加压或减压等方法实现相互转化。
以下是常见的物态变化:•固态向液态的变化称为熔化。
在熔化过程中,物质吸收热量,温度保持不变。
•液态向固态的变化称为凝固。
在凝固过程中,物质释放热量,温度保持不变。
•液态向气态的变化称为蒸发。
在蒸发过程中,物质吸收热量,温度保持不变。
•气态向液态的变化称为冷凝。
在冷凝过程中,物质释放热量,温度保持不变。
•固态向气态的变化称为升华。
在升华过程中,物质吸收热量,温度保持不变。
•气态向固态的变化称为凝华。
在凝华过程中,物质释放热量,温度保持不变。
知识点2:测量物质状态变化的指标2.1 温度温度是测量物质热运动程度的物理量。
常用的温度单位有摄氏度(℃)和开氏度(K)。
在物态变化过程中,温度的变化能够反映物质状态的改变。
2.2 热量热量是物质内部或与外界交换的能量。
在物态变化时,热量的吸收或释放可以引起物质的相互转化。
2.3 无定形态部分物质在某些条件下可呈现无定形态。
无定形物质没有固定的形状和体积。
知识点3:物态变化与压强的关系物态变化一般与压强有关。
以下是一些常见的物态变化与压强的关系:3.1 气体的压强气体的压强与气体的体积和温度有关,可通过下列关系来描述:•压强与体积成反比:当气体的温度不变时,气体的压强和体积成反比关系,即压强越大,体积越小。
初中化学物质的相互转化

初中化学物质的相互转化知巨细:物质的相互转化知识点一:非金属单质与其化合物的转化1.非金属单质可以转化为相应的化合物,例如点燃硫可以得到二氧化硫,燃烧碳可以得到二氧化碳,碳和硫可以反应得到二硫化碳。
2.某些非金属氧化物可以和水反应生成对应的酸,例如二氧化碳和水可以生成碳酸,二氧化硫和水可以生成亚硫酸,三氧化硫和水可以生成硫酸。
3.不稳定的酸可以受热分解成相应的氧化物,例如碳酸氢钠受热分解可以得到碳酸钠和二氧化碳。
例1:下列现象中,能够证明木炭在氧气中燃烧是化学反应的是什么?答案:生成使澄清石灰水变浑浊的无色气体二氧化碳能够证明木炭在氧气中燃烧是化学反应。
例2:下列关于实验现象的描述,正确的是什么?答案:铁丝在氧气中燃烧时火星四射,生成黑色固体。
例3:单质碳和部分碳的化合物间转化关系如图所示。
1) 物质X可能为什么?答案:物质X可能是碳酸。
2) 若X为CaCO3,写出图中物质转化的化学方程式。
答案:CO → CO2:C + O2 → CO2;CaCO3 → CO2:CaCO3 → CaO + CO2 或CaCO3 → CaO + CO2.3) 低碳经济是一种以低能耗和高效能等为主要特征、以较少的温室效应气体排放获得较大产出的新经济发展模式。
除了二氧化碳以外,温室效应的主要气体还有什么?答案:甲烷等气体。
近年来大气中二氧化碳含量不断增加,低碳经济已成为全球关注的热点。
二氧化碳是造成气候变化的主要原因,其化学方程式为CO2.自然界中消耗CO2的主要途径是植物的光合作用,化学方程式为6CO2+6H2O+光能→C6H12O6+6O2.不符合“低碳经济”理念的做法是D,因为大力发展火力发电会增加二氧化碳的排放量。
陈述的知识推出的结论是B,因为汽车尾气中主要含有氮氧化物。
检验净化后的烟气中是否含SO2的简单实验方案是用酸碱指示剂测定烟气中SO2的含量。
氧化后的海水需要用大量的天然海水与之混合后才能排放的主要目的是将酸性的氧化海水稀释,减少对海洋生态的影响。
知识总结物质间的相互转化
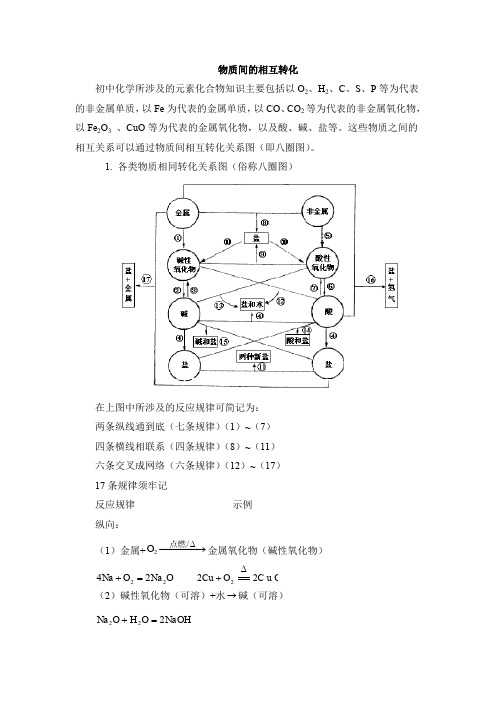
物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为:两条纵线通到底(七条规律)(1)~(7)四条横线相联系(四条规律)(8)~(11)六条交叉成网络(六条规律)(12)~(17)17条规律须牢记反应规律示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ C u O O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水 O H PO Na PO H NaOH 2434333+=+O H C u S O SO H OH Cu 244222)(+=+ (5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+ (6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232S i O O H S i O H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐 32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H(15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用:(1)可知某物质的性质。
物态变化知识点简短总结

物态变化知识点简短总结首先,让我们来看一下物质的三种基本物态及其相互转化的过程:1.固态:固态是物质最常见的状态之一,其特点是具有一定的形状和体积,分子间相互之间距离较小,并且分子保持相对静止状态。
在固态下,分子之间的作用力主要是静电作用力,所以固态的物质通常比液态和气态的物质更加稳定。
2.液态:液态是介于固态和气态之间的状态,其特点是具有一定的体积但没有确定的形状,分子之间的相互距离比较大,并且分子之间以及分子与容器壁之间的作用力都比较弱。
所以在液态下,物质可以比较容易地流动和变形。
3.气态:气态是物质最具流动性的状态,其特点是既没有确定的形状也没有确定的体积,分子之间的相互距离比较大,并且分子之间以及分子与容器壁之间的作用力都比较弱。
在气态下,物质可以自由地扩散和充满整个容器。
在不同的条件下,物质之间可以发生相互转化的过程,我们称之为物态变化。
常见的物态变化包括:1.凝固:凝固是指物质由液态转变为固态的过程。
当温度降低到物质的凝固点以下时,液态物质的分子会逐渐减速并互相靠近,最终形成有序排列的结晶固态物质。
2.融化:融化是指物质由固态转变为液态的过程。
当温度升高到物质的熔点以上时,固态物质的分子会逐渐加速并渐渐脱离原本的位置,最终形成无序排列的液态物质。
3.汽化:汽化是指物质由液态转变为气态的过程。
当温度升高到物质的沸点以上时,液态物质的分子会不断增加速度并逐渐脱离表面,最终形成气态物质。
4.凝华:凝华是指物质由气态转变为固态的过程。
当温度降低到物质的凝华点以下时,气态物质的分子会逐渐减速并互相靠近,最终形成有序排列的固态物质。
物态变化的过程受着影响温度、压强和物质本身的性质。
在物态变化的过程中,温度和压强是至关重要的因素。
通过改变温度和压强,我们能够实现不同物态之间的相互转化。
总结:物态变化是物质在不同条件下的物理性质发生变化的现象,包括固态、液态和气态之间的相互转化以及凝固、融化、汽化和凝华等过程。
物质的转化知识点总结

物质的转化知识点总结1. 化学反应化学反应是指物质之间发生化学变化,形成新物质的过程。
化学反应包括合成反应、分解反应、置换反应、氧化还原反应等。
合成反应是指两种或两种以上的物质反应生成一种新的物质,例如氢气和氧气反应生成水;分解反应是指一种物质分解成两种或两种以上的新物质,例如电解水生成氢氧气;置换反应是指两种物质中某一种元素与另一种物质中的某一元素互换位置,生成两种新物质,例如金属和酸反应生成盐和氢气;氧化还原反应是指在反应过程中原子的电子转移,使得元素的化合态发生改变,例如铁与氧气反应生成氧化铁。
2. 物理变化物理变化是指物质在形态上发生改变,但其化学成分和结构并未发生变化的过程。
物理变化包括溶解、沉淀、升华、凝固、融化等。
溶解是指一种物质在另一种溶剂中分散成分子和离子的过程,例如盐溶解在水中形成盐水;沉淀是指两种溶液混合后发生的化学反应生成的固体颗粒,通常是不溶的,例如硫酸铜和氯化钠反应生成氯化铜沉淀;升华是指某些物质在一定条件下从固体直接变成气态,然后再从气态直接变成固态的过程,例如固态二氧化碳直接变成气态二氧化碳;凝固是指液体变成固体的过程,例如水在冰点以下变成冰;融化是指固体变成液体的过程,例如冰在融化点以上变成水。
3. 物质的转化过程物质的转化过程是指物质在化学反应中或物理变化中所经历的变化过程。
在化学反应中,物质首先经历反应物质之间的碰撞和反应,其中化学键可能断裂或形成新的化学键,随后形成中间体,最终生成产物。
在物理变化中,物质经历相变的过程,包括固体、液体、气体之间相互转换的过程。
4. 能量在物质转化中的作用能量在物质转化中扮演着至关重要的角色。
在化学反应中,化学键的形成和断裂都需要吸收或释放能量,因此反应的进行需要能量的参与。
在物理变化中,物质的相变过程也需要吸收或释放能量,例如融化和凝固过程中需要吸收或释放热量。
能量在物质转化过程中的转移和转换是化学和物理反应进行的基础。
5. 物质的转化速率物质的转化速率是指单位时间内反应物质转化成产物的数量。
化学转化知识点总结大全

化学转化知识点总结大全化学转化是化学方程式中反应物变为生成物的过程,涉及物质的性质变化和形态变化。
化学转化是化学变化的基本形式,是化学研究和应用的基础。
本文将对化学转化的知识点进行详细总结,包括化学反应的基本概念、化学反应的类型、化学平衡、化学反应速率等内容。
一、化学反应的基本概念1. 化学反应的定义化学反应是指由于化学物质之间相互作用而引起的物质变化。
在化学反应中,一种或者多种物质(即反应物)通过化学反应转变为另一种或者多种物质(即生成物),并且伴随着能量的变化。
化学反应是化学变化的过程,是物质从一种形式转变为另一种形式的过程。
2. 化学反应的示意图化学反应通过化学方程式进行描述,化学方程式表明了反应物转变为生成物的化学变化过程,包括反应物的化学式和生成物的化学式,以及反应物与生成物之间的摩尔比。
3. 化学反应的热效应在化学反应过程中,通常会伴随着能量的变化,包括吸热反应和放热反应。
吸热反应是指在反应过程中吸收热量,使周围环境的温度下降;放热反应是指在反应过程中释放热量,使周围环境的温度升高。
4. 化学反应的速率化学反应的速率是指单位时间内反应物消耗的数量或者生成物产生的数量。
化学反应速率受到多种因素的影响,包括温度、浓度、催化剂等因素。
5. 化学反应的动力学化学反应动力学研究化学反应速率与反应条件之间的关系,包括速率常数、反应级别、反应机理等内容。
6. 化学反应的平衡化学反应达到化学平衡时,反应物和生成物的浓度不再发生明显变化,但是反应仍然在进行。
在平衡状态下,反应物和生成物之间的浓度比称为平衡常数。
二、化学反应的类型1. 合成反应合成反应是指两种或者多种物质结合成一种化合物的反应,通常伴随着放热反应。
合成反应是制备化合物的重要手段,常见的合成反应包括氧化反应、还原反应等。
2. 分解反应分解反应是指一种化合物在一定条件下分解为两种或者多种物质的反应,通常伴随着吸热反应。
分解反应在化学研究和应用中具有重要作用,常见的分解反应包括热分解反应、电解反应等。
高一物质的相互转化知识点

高一物质的相互转化知识点在高一物质的相互转化知识点中,我们学习了许多有关物质变化与能量转化的重要概念。
本文将从化学反应、能量转化以及实际应用等方面进行探讨和总结。
一、化学反应及其特征化学反应是指物质发生转变,形成新的物质的过程。
物质的相互转化是在化学反应中进行的。
化学反应有以下几个基本特征:1. 反应物与生成物:化学反应中,原有物质称为反应物,产生的新物质称为生成物。
2. 反应条件:化学反应需要一定的条件,如温度、压力、催化剂等。
3. 反应热效应:化学反应伴随着能量的转化,有些反应会放出热能(放热反应),而有些反应则吸收热能(吸热反应)。
4. 反应速率:化学反应的进行速度称为反应速率,会受到温度、浓度、催化剂等因素的影响。
二、能量转化与物质的相互转化能量转化是物质相互转化的一个重要方面。
根据热力学第一定律,能量既不能创造,也不能消失,只能从一种形式转化为另一种形式。
1. 热能转化:化学反应中的能量转化主要表现为热能的转化。
放热反应中,原有物质分子的势能被转化为热能释放出来;而吸热反应则是吸收周围热能供化学反应进行。
2. 光能转化:光能是一种能量形式,可以通过化学反应进行光能的转化。
例如光合作用中,植物利用光能将二氧化碳和水转化为有机物质,同时释放出氧气。
3. 电能转化:化学反应还可以产生电能或被电能驱动。
例如,在电池中,化学反应通过氧化还原(电子转移)过程来产生电能。
三、物质转化的实际应用物质相互转化的知识在许多实际应用中发挥着重要作用。
以下是几个例子:1. 合成反应:化学反应可以被用于合成新的物质。
例如,通过合成反应可以制备药物、化学品等。
2. 燃烧反应:燃烧是一种常见的化学反应,将燃料与氧气进行反应产生热能。
这种热能可以用于加热、照明和发电等。
3. 腐蚀反应:许多金属会与环境中的氧气、水分等发生化学反应,并导致腐蚀。
对于腐蚀的研究和防护措施是工程建设和金属材料保护中的重要问题。
四、总结高一物质的相互转化知识点涵盖了化学反应、能量转化以及实际应用等内容。
高一物质相互转化知识点

高一物质相互转化知识点在高中化学学习中,物质相互转化是一个非常重要的知识点。
物质相互转化是指物质在化学反应过程中发生的转变,其中包括化学反应的类型、化学方程式的表达、化学反应速率等。
下面我们就来一起深入了解一下高一物质相互转化的知识点。
一、化学反应的类型在化学反应中,我们通常可以分为几种类型,如合成反应、分解反应、置换反应、氧化还原反应等。
合成反应是指两种或两种以上的物质反应生成一种新的物质。
例如,2H2(氢气)+ O2(氧气)→ 2H2O(水)。
分解反应则相反,是指一种物质分解为两种或两种以上的物质。
例如,2KClO3(高氯酸钾)→ 2KCl(氯化钾)+ 3O2(氧气)。
置换反应是指一种物质中的元素被另一种元素取代,生成一种新的物质。
例如,Zn(锌)+ 2HCl(盐酸)→ ZnCl2(氯化锌)+H2(氢气)。
氧化还原反应是指物质中的原子失去或获得电子,形成新的物质,其中至少有一种物质发生氧化反应,一种物质发生还原反应。
例如,2Na(钠)+ Cl2(氯气)→ 2NaCl(氯化钠)。
二、化学方程式的表达化学方程式是化学反应过程的符号表示法,可以描述反应物与生成物及其摩尔比例。
化学方程式由反应物和生成物的化学式以及符号“→”组成。
在化学方程式中,反应物通常位于方程式的左边,生成物位于方程式的右边。
反应物与生成物之间用“+”连接,表示它们参与同一个化学反应。
化学方程式中的化学式采用化学元素的符号表示。
例如,H2(氢气)、O2(氧气)代表氢气和氧气。
化学方程式中还可以出现物质的状态(固体、液体、气体、溶液等)。
例如,Ca(固体)+ 2H2O(液体)→ Ca(OH)2(固体)+ H2(气体)。
化学方程式还需要满足质量守恒定律,即反应物的质量等于生成物的质量。
通过配平方程式可以确保反应物与生成物的原子数目相等。
三、化学反应速率化学反应速率是指在单位时间内参与反应的物质的摩尔数或质量数的变化量。
可以用反应物质量变化与时间的比值表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质间的相互转化
初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)
在上图中所涉及的反应规律可简记为:
两条纵线通到底(七条规律)(1)~(7)
四条横线相联系(四条规律)(8)~(11)
六条交叉成网络(六条规律)(12)~(17)
17条规律须牢记
反应规律
示例
纵向:
(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ CuO O Cu 222∆+
(2)碱性氧化物(可溶)+水→碱(可溶)
NaOH O H O Na 222=+
(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水
∆
==2)(OH Cu O H CuO 2+
(4)酸+碱→盐+水 O H PO Na PO H NaOH 2434333+=+
O H CuSO SO H OH Cu 244222)(+=+
(5)非金属+−−
→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+ (6)酸性氧化物(易溶)+水→酸(易溶)
3222CO H O H CO =+ 4325223PO H O H O P =+
(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)
↑+=2232CO O H CO H 2232SiO O H SiO H +∆
从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:
(8)金属+非金属→(无氧酸)盐
NaCl Cl Na 222点燃+
(9)碱氧+酸氧→(含氧酸)盐
32CaSiO SiO CaO 高温+
(10)含氧酸盐→碱氧+酸氧
↑+23CO CaO CaCO 高温
(11)盐+盐→两种新盐
↓+=+AgCl NaNO AgNO NaCl 33
交叉:
(12)酸+碱氧→盐+水
O H CuSO CuO SO H 2442+=+
(13)碱+酸氧→盐+水
O H CO Na CO NaOH 23222+=+
(14)酸+盐→新酸+新盐
32423242CO H SO Na CO Na SO H +=+
↑+=2232CO O H CO H
(15)碱+盐→新碱+新盐
↓+=+2424)(2OH Cu SO Na CuSO NaOH
(16)金属+酸→盐+↑2H
↑+=+2442)(H ZnSO SO H Zn 稀
(17)金属+盐→新盐+新金属
44ZnSO Cu CuSO Zn +=+
以上十七条规律的应用:
(1)可知某物质的性质。
(2)可知某物质的制法。
如:(4)、(8)、(9)、(11)~(17)为盐的十种制法。
(3)已知各类物质间的相互关系。
说明:
<1> 以上各规律为各物质间相互转化的一般规律,具体到某些物质有些规律要具体分析,未必均适用。
例如:制取2ZnCl 的方法与制取4CuSO 的方法各有几种?(思考)
答:制取2ZnCl :
① ↑+=+222H ZnCl HCl Zn
② O H ZnCl HCl ZnO 222+=+
③ O H ZnCl HCl OH Zn 22222)(+=+
④ ↑++=+22232CO O H ZnCl HCl ZnCO
⑤ 22ZnCl Cl Zn 点燃+
⑥ ↓+=+4224BaSO ZnCl BaCl ZnSO
⑦ Cu ZnCl CuCl Zn +=+22
因2ZnCl 为无氧酸盐,故规律(9)、(13)不适用。
因2)(OH Zn 为难溶碱,故规律(15)不适用。
∴ 只有如上7种制法。
制取4CuSO :
① O H CuSO SO H CuO 2442+=+
② O H CuSO SO H OH Cu 244222)(+=+
③ ↑++=+224423CO O H CuSO SO H CuCO
因Cu 为H 后金属,2)(OH Cu 为难溶碱、CuO 不能直接与SO 3反应生成CuSO 4,Ag 2SO 4为微溶物,不符合与CuCl 2发生复分解反应的条件,也不能与Cu 发生置换反应等原因,∴ CuSO 4只有上述三种制取方法(初中范围内,方法③也不常见)
<2> 此外,在物质的制取中还有一些常见的规律,如:
对于盐+酸→新盐+新酸,有如下规律:
① 强酸→弱酸
如:↑++=+22232CO O H CaCl HCl CaCO
② 稳定的(不易分解的)酸→不稳定的(另分解的)酸。
如:↑++=+22232CO O H CaCl HCl CaCO
③ 高沸点(不易挥发的)酸→低沸点(易挥发的)酸。
如:↑+∆+HCl SO Na NaCl SO H 2)
(2)(4242固浓
④ 可溶性酸→难溶性酸。
如:↓+=+323222SiO H NaCl HCl SiO Na
<3> 从反应规律与反应类型的关系来看。
属于化合反应的有:规律(1)、(2)、(5)、(6)、(8)、(9)。
属于分解反应的有:规律(3)、(7)、(10)。
属于置换反应的有:规律(16)、(17)。
属于复分解反应的有:规律(4)、(11)、(12)、(14)、(15)。
规律(13)不属于任何一种基本反应类型。
初中阶段不属于任何一种基本反应类型的反应包括:
O H CO O CH 222422++点燃
O H CO O OH H C 222
52323++点燃
2CO Cu CuO CO +∆+ 酸氧+碱→盐+水
2. 金属活动顺序表及其使用范围:
(1)金属活动顺序:很活泼Na Ca K 较活泼Fe Zn Al Mg )(H Pb Sn 钝化不活泼Au
Pt Ag Hg Cu
(2)在金属活动性顺序里,位于氢以前的较活泼金属,能与盐酸或稀硫酸发生置换反应,置换出酸中的氢,氢后的金属则不能。
较活泼的金属能将不活泼金属从它的盐溶液里置换出来。
(3)很活泼的金属与某些盐溶液反应时,先与水反应生成碱,然后碱再与盐溶液发生复分解反应,无金属生成。
2、 酸、碱、盐的溶解性规律
(1)酸:无机化合物中,除硅酸(32SiO H )不溶于水,大多数常见的酸易溶于水。
(2)碱:一水合氨(O H NH 23⋅)、2)(OH Ba KOH NaOH 、、易溶;2)(OH Ca 微溶;其余碱不溶于水。
(3)盐:铵盐、钾盐、钠盐、硝酸盐易溶;盐酸盐中22Cl Hg AgCl 、(氯化亚汞)不溶,其余溶;硫酸盐中44PbSO BaSO 、不溶,4CaSO 、42SO Ag 微溶,其
余都溶;碳酸盐中,+++
Na K NH 、、4溶,+2Mg 微溶,其余不溶;磷酸盐、硫化
物中除+++Na K NH 、、4溶外,其余不溶。
(4)酸中342HNO SO H HCl 、、为强酸,43PO H 为中强酸,、、3232CO H SiO H COOH CH S H 32、为弱酸。
(5)可溶性碱除O H NH 23⋅(弱碱)外均为强碱,不溶性碱为弱碱。
了解酸、碱、盐的溶解性的应用之一是判断某些复分解反应能否发生。
4. 复分解反应的发生条件
(1)复分解反应需在溶液里才能发生,在固态时无自由移动的离子时不发生反应。
还要看生成物是否满足下列条件之一:
① 产生沉淀 ② 放出气体 ③ 生成难电离的水
(2)复分解反应常发生在下列几条反应规律中:
① 酸+碱→盐+水(有强酸或强碱,至少一种物质可溶,若碱不溶于水但能溶于酸)
② 酸+碱性氧化物→盐+水(碱氧可不溶于水,但要溶于酸,酸为强酸) ③ 酸+盐→新酸+新盐(盐可不溶于水,但要溶于酸,酸为强酸) ④ 碱+盐→新碱+新盐(反应物的碱和盐均要溶于水)
⑤ 盐+盐→两种新盐(反应物均要溶于水)。
