化学平衡及等效平衡
化学平衡经典总结-等效平衡、计算、图像

化学等效平衡解题技巧一、概念在一定条件(恒温恒容或恒温恒压)下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,在达到化学平衡状态时,任何相同组分的含量(体积分数、物质的量分数等)均相同,这样的化学平衡互称等效平衡(包括“相同的平衡状态”)。
概念的理解:(1)外界条件相同:通常可以是①恒温、恒容,②恒温、恒压。
(2)“等效平衡”与“完全相同的平衡状态”不同:“完全相同的平衡状态”是指在达到平衡状态时,任何组分的物质的量分数(或体积分数)对应相等,并且反应的速率等也相同,但各组分的物质的量、浓度可能不同。
而“等效平衡”只要求平衡混合物中各组分的物质的量分数(或体积分数)对应相同,反应的速率、压强等可以不同。
(3)平衡状态只与始态有关,而与途径无关,(如:①无论反应从正反应方向开始,还是从逆反应方向开始②投料是一次还是分成几次③反应容器经过扩大—缩小或缩小—扩大的过程,)只要起始浓度相当,就达到相同的平衡状态。
二、等效平衡的分类在等效平衡中比较常见并且重要的类型主要有以下三种:I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△V≠0的体系):等价转化后,对应各物质起始投料的物质的量与原平衡起始态相同。
II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△V=0的体系):等价转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。
III类:恒温恒压下对于气体体系等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。
解题的关键,读题时注意勾画出这些条件,分清类别,用相应的方法求解。
我们常采用“等价转换”的方法,分析和解决等效平衡问题三、例题解析I类:在恒温恒容下,对于化学反应前后气体体积发生变化的可逆反应,只改变起始加入物质的物质的量,如果通过可逆反应的化学计量数之比换算成化学方程式的同一边物质的物质的量与原平衡相同,则两平衡等效。
化学课件《化学平衡——等效平衡》优秀ppt2 通用

可左右
K
移动
(1)A中X的转化率Aα(A) = _____。 B (2)A、B中X的转化率的关系:α(A)_α(B)。 (3)打开K,一段时间后又达到平衡时,A的体 积为_____ L(连通管中气体体积不计)
7、相同容积的四个密闭容器中,进行同样的可逆反应
2A (g) +B(g)
3C(g)+2D(g) ,起始时四个
二、等效平衡的含义
• 完全等同——相同组分的分数和 物质的量都相同(等量等比)
• 比例相同——相同组分的分数相 同、物质的量不等(等比不等量)
三、等效平衡建立的规律
1、恒温恒容条件下
I类:对于反应前后气体分子数不 等的可逆反应,只改变起始加入 情况,只要通过可逆反应的化学 计量数比换算成平衡式左右两边 同一边物质的物质的量与原平衡 相同,则二平衡等效。
它条件不变时,若按下列四种配比作为起始物
质,平衡后A的体积分数大于a%的是( )
A.2molC B.2molA、1molB和1molHe(不参加反应) C.1molB和1molC D.2molA、3molB和3molC
4、将amolPCl5充入一个容积恒为VL的 密闭容器中,发生如下反应:
PCl5(g) == PCl3(g) + Cl2(g) ,在t℃ 的温度下反应达到化学平衡,此时容器 内气体压强为P1,保持温度不变,再向该 容器中充入amolPCl5再达到化学平衡时, 容器内气体压强为P2,则P1和P2的大小 关系是
化学平衡---等效平衡

化学平衡----等效平衡有关化学平衡的等效平衡类知识,是高考考查的重点知识之一。
(I)等效平衡有以下三种情况1、恒温恒容,可逆反应前后气体前化学计量数之和不等。
条件:加入的物质的物质的量与原平衡相同结论:①平衡时各物质的物质的量与原平衡相同②平衡时各物质的含量与原平衡相同2、恒温恒容,可逆反应前后气体前化学计量数之和相等。
条件:加入的物质的物质的量之比例与原平衡相同①平衡时各物质的含量与原平衡相同②平衡时,各物质是原平衡时的倍数与起始加入的为原平衡的倍数相同3、恒温、恒压条件、结论与乙相同(Ⅱ)方法:通过可逆反应的化学计量数比换算成同一边物质的物质的量看成是否相同或比例是否相同。
例6(2003江苏)恒温、恒压下,在一个可变容积的容器中发生如下反应:A(气)+B(气)C(气)(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为_______________mol.(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为______mol。
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=________mol,y=________mol。
平衡时,B的物质的量____________(选填一个编号)(甲)大于2mol (乙)等于2mol(丙)小于2mol (丁)可能大于、等于或小于2mol作出此判断的理由是__________________________。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是_________________。
II 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成bmolC.将b与(1)小题中的a进行比较__________(选填一个编号)(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a 和b 的大小 作出此判断的理由是_______________________________。
化学课件《化学平衡——等效平衡》优秀ppt 人教课标版

0.6 mol,B为0.3 mol,C为1.4 mol充入容
器,达到平衡后,C的体积分数仍为W%,则
x的值为 ( ) C
A.只能为2 B.只能为3
C.可能是2,也可能是3
D.无法确定
等效平衡建成条件的探究三
压 恒温恒容 2SO2(g)+O2(g)
2SO3(g)
途径1起始 2mol 1mol
0
途径2起始 4 mol 2 mol
与途径1等效? a+c=2 2b+c=2
恒温恒容:等效平衡建成条件
结论:
恒温恒容条件下对于反应前后气体分
子数发生变化的可逆反应,若改变起始加入
情况,通过可逆反应的化学计量数换算成同 一边物质的物质的量与原平衡起始加入量相 同,则二平衡等效。
等效平衡建成条件的探究二
恒温恒容下,H2 (g)+I2 (g) 途径1起始 2 mol 1mol
0
0.5
2(g-2m) (g-m)a
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
2HI(g) 0 0
结论:
恒温恒压条件下若改变起始加入情况, 只要通过可逆反应的化学计量数换算成同一 边物质的物质的量之比与起始加入量相同, 则两平衡等效。
等效平衡小结
投料换算成相 两平衡各组分百分含 同物质表示时 量均相同(n、c相同)
物质的量相同
投料换算成相同 两平衡各组分百分
第三节化学平衡(五)等效平衡

P(g)+Q(g)
的是( B )
R(g)+S(g) , 在恒温下已达平衡状态
•
反应容器内压强不随时间变化
B. P和S的生成速率相等 C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间而变化
3. 在一定温度下的恒容容器中,当下列物理量不再 发生变化时,表明A(s)+3B(g) 2C(g)+D(g)已达平 衡状态的是 ( BC ) A.混合气体的压强 B.混合气体的密度 C.B的物质的量浓度 D.气体的总物质的量
结论:在恒温恒容条
件下,在可逆反应中 若气态反应物的浓度 均按比例改变,视为 加压或减压。
[例题]在一个盛有催化剂的密闭容器中,保持一定温度和压强 进行下列反应:2SO2(g) + O2(g) 2SO3(g)。已知加入 1 mol O2、3 mol SO2,达到平衡时生成a mol SO3,在相同温度 和压强下,保持平衡时各组分的含量不变,填写下表: 编号 O2 已知 (1) 1 0 起 始 状 态 (mol) SO2 3 0.5 SO3 0 1 2(n-3m) y 平衡时SO3 物质的量(mol) a 0.5a a(n-2m) a(x + 0.5y)
(2)相似型等效平衡
a、恒温恒容时,反应前后气体分子数相等的可逆反应, 把所加物质按化学计量数之比转化为同一边的物 质,若其物质的量之比与原平衡相同,则两平衡等效。 特点:平衡时同一物质的百分含量相同, n、c、m、v(气)、N也成比例。 b、恒温恒压下,任何可逆反应,把所加物质按化学计量 数之比转化为同一边的物质,若其物质的量之比与原 平衡相同,则两平衡等效。 特点:平衡时同一物质的百分含量相同,c(气)相同, n、m、N成比例。
化学平衡常数与等效平衡

2、利用K进行简单计算
例如:在温度、体积1L的密闭容器中
CO + H2O CO2+ H2 已知:K=5 始1:1mol 1mol 0 0
始2: 0
0 1mol 1mol
计算两种情况之下达到平衡时各物质的物质的量?
在相同的条件下,可逆反应无论从 正反应开始还是从逆反应开始,还 是从既有反应物又有生成物开始, 达到的化学平衡状态是相同的,平 衡混合物中各组成物质的百分含量
B. 1molB+2molC+1molD
C. 1molA+1molB
D. 1molA+4molB+4molC+2molD
保持不变,也就是等效平衡。
例如:在一定条件下:(定T、V)
对于: 2SO2 + O2
2SO3
起始:A 2mol 2 mol 0
起始:B 0
1mol 2mol
起始:C 1mol 1.5 mol 1mol
(换算成同一半边的物质后,相当于)
起始:A: 2 2 0
起始:
A.2mol C
B.3mol C C.4mol A、2mol B D.1mol A、2mol C
例3、在一定温度下保持压强相等的密闭容器中,
充入1molA、2molB发生A+B 2C+D,达到平
衡时A的含量为w,下列物质组合充入该容器中,
A的含量仍为w的是(
) BD
A. 2molC+1molD
(2012·江苏高考)温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。 反应过程中测定的部分数据见下表:
《化学平衡》平衡中的等效平衡

《化学平衡》平衡中的等效平衡在化学世界中,“化学平衡”是一个至关重要的概念,而其中的“等效平衡”更是理解和解决许多化学问题的关键。
今天,咱们就来好好聊聊这神奇的等效平衡。
想象一下,在一个封闭的容器里,发生着一场化学变化。
反应物们努力地转化为生成物,生成物们也不甘示弱,又试图变回反应物。
当双方的转化速率达到相等的时候,化学平衡就形成了。
而等效平衡呢,就是在不同的起始条件下,最终达到的平衡状态相同。
等效平衡有三种类型,咱们一个一个来。
第一种是恒温恒容条件下的等效平衡。
比如说,对于一个反应 aA(g) + bB(g) ⇌ cC(g) + dD(g),如果 a + b = c + d,那么只要起始加入的物质的量按照化学计量数换算成同一边的物质,其物质的量对应相等,就能达到等效平衡。
举个例子,有个容器中发生反应 2A(g) + B(g) ⇌ 3C(g) + D(g),如果一开始加入 2 mol A 和 1 mol B,和一开始加入 4 mol A 和 2 mol B,最终达到的平衡状态就是等效的。
因为在恒温恒容的条件下,这两种起始加入的情况,经过反应的进行,最终各物质的浓度、分压等都会相同。
再来说说恒温恒容下,当 a +b ≠ c + d 时的情况。
这时候,要想达到等效平衡,起始加入的物质就必须完全相同。
比如反应 A(g) +2B(g) ⇌ 3C(g),如果一开始是 1 mol A 和 2 mol B,那要想达到等效平衡,起始加入的就必须也是 1 mol A 和 2 mol B,不能有任何偏差。
接下来是恒温恒压条件下的等效平衡。
在这种情况下,不管反应的方程式中各物质的化学计量数关系如何,只要起始加入的物质的量按照化学计量数换算成同一边的物质,其物质的量之比相等,就能达到等效平衡。
比如说,对于反应 2A(g) + 3B(g) ⇌ 4C(g) + 5D(g),一开始加入 2 mol A 和 3 mol B,和一开始加入 4 mol A 和 6 mol B,在恒温恒压的条件下,最终达到的平衡状态就是等效的。
化学平衡——等效平衡
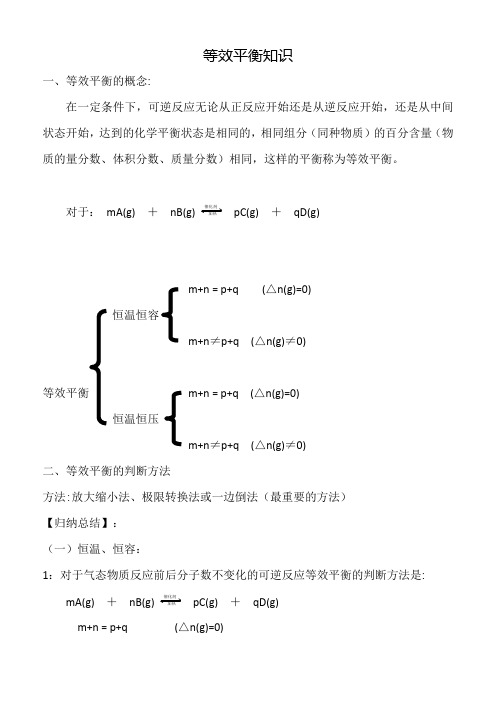
等效平衡知识一、等效平衡的概念:在一定条件下,可逆反应无论从正反应开始还是从逆反应开始,还是从中间状态开始,达到的化学平衡状态是相同的,相同组分(同种物质)的百分含量(物质的量分数、体积分数、质量分数)相同,这样的平衡称为等效平衡。
对于:mA(g) +nB(g) 催化剂加热pC(g) +qD(g)m+n = p+q (△n(g)=0)恒温恒容m+n≠p+q (△n(g)≠0)等效平衡m+n = p+q (△n(g)=0)恒温恒压m+n≠p+q (△n(g)≠0)二、等效平衡的判断方法方法:放大缩小法、极限转换法或一边倒法(最重要的方法)【归纳总结】:(一)恒温、恒容:1:对于气态物质反应前后分子数不变化的可逆反应等效平衡的判断方法是: mA(g) +nB(g) 催化剂加热pC(g) +qD(g)m+n = p+q (△n(g)=0)使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的物质的量比是否相等。
若相等各组分百分量相同,n 、c 同比例变化,则为等效平衡2:对于气态物质反应前后分子数有变化的可逆反应等效平衡的判断方法是:mA(g) + nB(g) 催化剂加热 pC(g) + qD(g)m+n ≠p+q (△n(g)≠0)使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的物质的量是否对应完全相等。
若相等各组分百分量、n 、c 均相同,则为等效平衡(等同平衡)例1、恒温恒容时对于反应:H2(g) + I2(g) 催化剂加热 2HI(g)下列条件能与下图达到等效平衡的是( )A. 2 mol HIB. 2 mol H 2+2 mol I 2C. 1 mol H2+1 mol I 2+2 mol HID. 0.5 mol H 2+0.5 mol I 2+1 mol HI例2:在一个1L 的密闭容器中,加入2molA 和1molB ,发生下述反应: 2A(g)+B(g) 催化剂加热 3C(g)+D(s) 达到平衡时, C 的浓度为1.2mol/L 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学平衡1可逆反应(1)定义在条件下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。
(2)特点:三同一小。
①三同:a.相同条件下;b.正逆反应同时进行;c.反应物与生成物同时存在。
②一小:任一组分的转化率都100%。
(3)表示方法:在化学方程式中用“”表示。
2化学平衡状态(1)定义一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率,反应物的浓度和生成物的浓度,我们称之为“化学平衡状态”,简称化学平衡。
(2)特征①“逆”指化学平衡研究的对象是。
②“动”指化学平衡是一种,反应达到平衡状态时,反应并没有停止。
③“等”指和相等,都大于零。
④“定”指平衡体系混合物中,一定,不再随时间改变而改变。
⑤“变”指当改变时,原平衡被破坏,会使,在新条件下建立新的平衡。
3化学平衡的移动(1)定义可逆反应达到平衡状态以后,若反应条件(或、、等)发生了变化,平衡混合物中各组分的浓度也会随之,从而在一段时间后达到。
这种由向的变化过程,叫做化学平衡的移动。
(2)化学平衡移动原理(勒夏特列原理)①概念如果改变影响化学平衡的条件(浓度、压强、温度等)之一,平衡将向着的方向移动。
②具体内容若其他条件不变,改变下列条件对平衡的影响如下:学霸巧学卡(1)改变固体或纯液体的量,对平衡无影响。
(2)当反应混合物中不存在气态物质时,压强的改变对平衡无影响。
(3)对于反应前后气体体积无变化的反应,如H 2(g)+I 2(g)⇌2HI(g),压强的改变对平衡无影响。
但增大(或减小)压强会使各物质的浓度增大(或减小),混合气体的颜色变深(或浅)。
(4)“惰性气体”对化学平衡的影响 ①恒温、恒容条件原平衡体系――→充入惰性气体体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温、恒压条件(5)恒容时,同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响,增大(减小)浓度相当于增大(减小)压强。
(6)在恒容容器中,当改变其中一种气态物质的浓度时,必然会引起压强的改变,在判断平衡移动的方向和物质的转化率、体积分数变化时,应灵活分析浓度和压强对化学平衡的影响。
1.思维辨析(1)增大任何一种反应物的量,化学平衡一定正向移动。
( ) (2)改变化学反应速率,化学平衡一定会发生移动。
( )(3)对一个可逆反应而言,改变温度,化学平衡一定会发生移动。
( )(4)其他条件不变,增大体系的压强,对一个有气体参与的可逆反应而言,平衡一定会发生移动。
( )(5)不论恒温恒容,还是恒温恒压容器,加入稀有气体,平衡皆发生移动。
( ) (6)起始加入原料的物质的量相等,则各种原料的转化率一定相等。
( ) (7)通过改变一个条件使某反应向正反应方向移动,转化率一定增大。
( )2.将NO2装入带有活塞的密闭容器中,当反应2NO2(g)⇌N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是()A.升高温度,气体颜色加深,则正反应为吸热反应B.慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来压强的两倍D.恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅[考法综述]化学平衡是中学化学重要理论之一,考查内容主要集中在平衡状态的判断;应用平衡移动原理判断平衡移动的方向以及由此引起的反应物的转化率、各组成成分的百分含量、气体的体积、压强、密度、混合气体的平均相对分子质量等变化。
考查方式多配图表,非选择题部分常结合化工生产形式出现,综合性较强,属偏难题。
命题法1化学平衡状态的判断典例1将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。
判断该分解反应已经达到化学平衡的是()A.2v(NH3)=v(CO2)B.密闭容器中c(NH3)∶c(CO2)=2∶1C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变【解题法】化学平衡状态常用的判断方法练习1.在两个密闭容器中进行下列两个可逆反应:(甲)2NO(g)+O2(g) ⇌ 2NO2(g);(乙)H2(g)+I2(g) ⇌ 2HI(g)。
现有下列状态:①反应物的消耗速率与生成速率相等;②反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比;③各物质浓度之比等于化学计量数之比;④恒温恒容条件下,混合气体的压强不再改变;⑤恒温恒压条件下,混合气体的体积不再改变;⑥恒温恒容条件下,气体的密度不再改变;⑦混合气体的平均相对分子质量不再改变;⑧反应物的转化率不再改变;⑨生成物的百分含量不再改变;⑩恒温恒压或恒温恒容条件下,混合气体的颜色不再改变;⑪恒容绝热条件下,体系温度不再改变其中,能表明(甲)达到化学平衡状态的是___________________。
能表明(乙)达到化学平衡状态的是_____________________。
命题法2化学平衡常数及转化率的相关应用典例2在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)⇌M(g)+N(g),所得实验数据如下表:A .实验①中,若5 min 时测得n (M)=0.050 mol ,则0至5 min 时间内,用N 表示的平均反应速率v (N)=1.0×10-2mol/(L·min)B .实验②中,该反应的平衡常数K =2.0C .实验③中,达到平衡时,X 的转化率为60%D .实验④中,达到平衡时,b >0.060【解题法】 化学平衡常数和转化率的应用总结 (1)化学平衡常数的应用 ①判断平衡移动的方向对于可逆反应:m A(g)+n B(g)⇌p C(g)+q D(g),在任意状态下,生成物的浓度和反应物的浓度之间的关系用浓度商Q c =c p (C)·c q (D )c m (A )·c n (B )表示,则:Q c⎩⎨⎧<K 反应向正反应方向进行,v 正>v逆=K 反应处于化学平衡状态,v 正=v 逆>K 反应向逆反应方向进行,v 正<v逆②判断反应进行的程度升高温度,若K 值增大,则正反应为吸热反应;若K 值减小,则正反应为放热反应。
④计算平衡体系中的相关“量”根据相同温度下,同一反应的平衡常数不变,计算反应物或生成物的浓度、转化率等。
⑤书写化学平衡表达式不能把反应体系中固体、纯液体及稀溶液中水的浓度写入平衡常数表达式中。
但非水溶液中发生的反应,若有水参加或生成,则此时水的浓度不可视为常数,应写入平衡常数表达式中。
如C 2H 5OH(l)+CH 3COOH(l)⇌CH 3COOC 2H 5(l)+H 2O(l) K =c (CH 3COOC 2H 5)·c (H 2O )c (C 2H 5OH )·c (CH 3COOH )⑥推导平衡常数间的关系对于同一可逆反应,正反应的平衡常数等于逆反应的平衡常数的倒数,即:K 正=1K 逆;若化学方程式中的化学计量数等倍扩大n 倍,则K 2=K n 1;若化学计量数等倍缩小n 倍,则K 2=nK 1;运用盖斯定律,若方程式相加,则K 相乘,若方程式相减,则K 相除。
(2)转化率的分析与判断①反应a A(g)+b B(g)⇌c C(g)+d D(g)的转化率分析a .若反应物起始物质的量之比等于化学计量数之比,达到平衡后,它们的转化率相等。
b .若只增加A 的量,平衡正向移动,B 的转化率提高,A 的转化率降低。
c .若按原比例同倍数地增加(或降低)A 、B 的浓度,等效于压缩(或扩大)容器体积,气体反应物的转化率与其化学计量数有关。
同倍增大c (A )和c (B )⎩⎨⎧a +b =c +d A 、B 的转化率不变a +b >c +d A 、B 的转化率增大a +b <c +d A 、B 的转化率减小②反应m A(g) n B(g)+q C(g)的转化率分析在T 、V 不变时,增加A 的量,等效于压缩容器体积,A 的转化率与化学计量数有关。
增大c (A)⎩⎨⎧m =n +q A 的转化率不变m >n +q A 的转化率增大m <n +q A 的转化率减小练习:1.[2016·长郡中学测试]已知在25 ℃时,下列反应的平衡常数如下: ①N 2(g)+O 2(g) ⇌ 2NO(g) K 1=1×10-30 ②2H 2(g)+O 2(g) ⇌ 2H 2O(g) K 2=2×1081 ③2CO 2(g) ⇌ 2CO(g)+O 2(g) K 3=4×10-92 下列说法正确的是( )A .NO 分解反应:NO(g) ⇌ 12N 2(g)+12O 2(g)的平衡常数为1×10-30B .根据K 2的值可以判断常温下H 2和O 2很容易反应生成H 2OC .常温下,NO 、H 2O 、CO 2三种物质分解放出O 2的倾向顺序为NO>H 2O>CO 2D .温度升高,上述三个反应的平衡常数均增大2.一定量的CO 2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO 2(g)⇌2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示。
已知:气体分压(p 分)=气体总压(p 总)×体积分数。
下列说法正确的是( )A.550 ℃时,若充入惰性气体,v正、v逆均减小,平衡不移动B.650 ℃时,反应达平衡后CO2的转化率为25.0%C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p=24.0p总3.某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+m Y(g)⇌3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。
在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。
下列叙述不正确的是() A.m=2B.两次平衡的平衡常数相同C.X与Y的平衡转化率之比为1∶1D.第二次平衡时,Z的浓度为0.4 mol·L-14.已知,相关数据见下表:根据以上信息判断,下列结论错误的是()A.a>bB.增大压强,平衡状态Ⅱ不移动C.升高温度平衡状态Ⅲ向正反应方向移动D.反应Ⅱ、Ⅲ均为放热反应命题法3 等效平衡的应用典例3 (双选)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N 2(g)+3H 2(g)⇌2NH 3(g) ΔH =-92.4 kJ·mol -1]:A .2c 1>c 3B .a +b =92.4C .2p 2<p 3D .α1+α3<1【解题法】 “等效平衡”解题策略 (1)等效平衡的类型及特点①构建等温等容平衡思维模式新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
