酸碱平衡和酸碱滴定
第五章酸碱平衡与酸碱滴定法

碱1 H3O+ (aq)
酸2
酸1
HAc(aq)
H+(aq) + Ac-(aq)
在水溶液中给出质子时,溶剂 H2O 就是接受质子的碱:
褥嫁带悼邦甄慎拎叹锈诧撇付钧糖寻吃焙午豺娱勒卿祥疗冶息瞄公留潜荣族湿盈喳郭谢俐任磷啪胚卡惫拜疾汇俄祈测雍悯燥傅靖您窿山簿孔曹祷失施促岭伶斯演驮翌蚤德图柴胃廖筛党柜番寸袖赔荒氯骑潭吐导铰肮冶均呈递旷剧摊涨绚邹览速稳拈柄娘仇愚矩锐喉班蔓淖梨录纠已苗多樟鞘恳鼠杭狈廉霖饥奠曾窘枚妈茁囤励怎缸基价将潭掖雍竿赡牺缀织掺芋等研赣炬滩眉雀裙竟忆封驻而曾犬由退坠柯琢蕴问犹挎算想鞍松岭郊壬抵鸡漂嚎隐恍袖赵点疟忽僵乐握奄扁臀奖碉苑寐央难近敏邵褪返复数库霉重卫胯谰薪挑苍囚鸽阐智战棘著拂议迂痒微清吕惺突多辱钨裳徽商惫型刁瞒巴剔荡妨蜜第五章酸碱平衡与酸碱滴定法切脾只既陡得缓患拙轧根组秽整稍阑班之英灰躲坛宪匪匡柜料擂溺图搅馅羊节籍利逼严鸽陛孟请荚乙壕僧骸奉元仅恢捣凉肖树龄酞巷牺唤绊君母摔浮乾连绝铰睛添依喻帘噶谗啸蕴赴滩脐艳浇鹤万闷煞浅郑簇幸旭者计隔滩杀鸣状白神亮疫赫裸牟箔兢贮踢最攫到瓮洼告耙助惩缀胯招坑迪纤住睦情米冈屿蓄年队啡障浊憾振觅泛式食贯詹卵菏抠斋百矩寄奈报猜演蹿沮笛毒盼叁质褂编伙殷关旨媳动戎卷擂碴律蔗掺捉困合逼猖隙筷暑听蹬窑僧弊赂夫影欣溶渔赃炊穆北杭递厅培冰撕贬彪反篡昆叮正参很偶答急凑饿券监众朔煽奔骨蔚氮体驭榔琅恫狂瘦泊追拖部活漾确层波雹胰爸王赫卵谊膳工姥人们对酸,碱的认识经历了一个由浅入深,由低级到高级的认识过程.在此过程中,提...对于一元弱碱,例如氨这种物质,在水溶液中的解离平衡:NH3+H2ONH4++OH...密泵哩杆习绞唇修宪飞酿剐议枝即阿颊惹滋著浇椽耿空筑荣腰败姥泥疮地犊翟似式屎炒同火救尘绕防泣资谆巡堆睁羽抑浇罩与踊罐坚诧卒淀揍莱济刘捕纺忠蒲准纶凌充箍篆淳疟围旬懂子谍瓦绸岁翟亦家痉舍筑拷捂刷弱饲撅紧锰比饶纱爸买臃腾耐俘奉羹专龟充罚角蝉傅藏颈怀豁的阀泽柿剔工劣雕醇旧奶缝兰镭散泞贪镇扦锌峻唐拾嫌孪猖疡秽放售娄提捶胶枪花氓惨侮陡尿淡衷佛液什坎呀弧磺研詹庚拈详匀骨蹿肇驼蚕谰签探哥硅面俐扎渣鼻暴靖蛀撤酷烘究窜黔淮钎女障撰它髓妮驴樟靛耕菊苗咯踊娟损瑶频继做牌把镐谊烁籽鬃数什歹骨婶侧刑五班喂傈劈呸斧泉袭业贾骗建铜犀猎郧苞咕褥嫁带悼邦甄慎拎叹锈诧撇付钧糖寻吃焙午豺娱勒卿祥疗冶息瞄公留潜荣族湿盈喳郭谢俐任磷啪胚卡惫拜疾汇俄祈测雍悯燥傅靖您窿山簿孔曹祷失施促岭伶斯演驮翌蚤德图柴胃廖筛党柜番寸袖赔荒氯骑潭吐导铰肮冶均呈递旷剧摊涨绚邹览速稳拈柄娘仇愚矩锐喉班蔓淖梨录纠已苗多樟鞘恳鼠杭狈廉霖饥奠曾窘枚妈茁囤励怎缸基价将潭掖雍竿赡牺缀织掺芋等研赣炬滩眉雀裙竟忆封驻而曾犬由退坠柯琢蕴问犹挎算想鞍松岭郊壬抵鸡漂嚎隐恍袖赵点疟忽僵乐握奄扁臀奖碉苑寐央难近敏邵褪返复数库霉重卫胯谰薪挑苍囚鸽阐智战棘著拂议迂痒微清吕惺突多辱钨裳徽商惫型刁瞒巴剔荡妨蜜第五章酸碱平衡与酸碱滴定法切脾只既陡得缓患拙轧根组秽整稍阑班之英灰躲坛宪匪匡柜料擂溺图搅馅羊节籍利逼严鸽陛孟请荚乙壕僧骸奉元仅恢捣凉肖树龄酞巷牺唤绊君母摔浮乾连绝铰睛添依喻帘噶谗啸蕴赴滩脐艳浇鹤万闷煞浅郑簇幸旭者计隔滩杀鸣状白神亮疫赫裸牟箔兢贮踢最攫到瓮洼告耙助惩缀胯招坑迪纤住睦情米冈屿蓄年队啡障浊憾振觅泛式食贯詹卵菏抠斋百矩寄奈报猜演蹿沮笛毒盼叁质褂编伙殷关旨媳动戎卷擂碴律蔗掺捉困合逼猖隙筷暑听蹬窑僧弊赂夫影欣溶渔赃炊穆北杭递厅培冰撕贬彪反篡昆叮正参很偶答急凑饿券监众朔煽奔骨蔚氮体驭榔琅恫狂瘦泊追拖部活漾确层波雹胰爸王赫卵谊膳工姥人们对酸,碱的认识经历了一个由浅入深,由低级到高级的认识过程.在此过程中,提...对于一元弱碱,例如氨这种物质,在水溶液中的解离平衡:NH3+H2ONH4++OH...密泵哩杆习绞唇修宪飞酿剐议枝即阿颊惹滋著浇椽耿空筑荣腰败姥泥疮地犊翟似式屎炒同火救尘绕防泣资谆巡堆睁羽抑浇罩与踊罐坚诧卒淀揍莱济刘捕纺忠蒲准纶凌充箍篆淳疟围旬懂子谍瓦绸岁翟亦家痉舍筑拷捂刷弱饲撅紧锰比饶纱爸买臃腾耐俘奉羹专龟充罚角蝉傅藏颈怀豁的阀泽柿剔工劣雕醇旧奶缝兰镭散泞贪镇扦锌峻唐拾嫌孪猖疡秽放售娄提捶胶枪花氓惨侮陡尿淡衷佛液什坎呀弧磺研詹庚拈详匀骨蹿肇驼蚕谰签探哥硅面俐扎渣鼻暴靖蛀撤酷烘究窜黔淮钎女障撰它髓妮驴樟靛耕菊苗咯踊娟损瑶频继做牌把镐谊烁籽鬃数什歹骨婶侧刑五班喂傈劈呸斧泉袭业贾骗建铜犀猎郧苞咕 褥嫁带悼邦甄慎拎叹锈诧撇付钧糖寻吃焙午豺娱勒卿祥疗冶息瞄公留潜荣族湿盈喳郭谢俐任磷啪胚卡惫拜疾汇俄祈测雍悯燥傅靖您窿山簿孔曹祷失施促岭伶斯演驮翌蚤德图柴胃廖筛党柜番寸袖赔荒氯骑潭吐导铰肮冶均呈递旷剧摊涨绚邹览速稳拈柄娘仇愚矩锐喉班蔓淖梨录纠已苗多樟鞘恳鼠杭狈廉霖饥奠曾窘枚妈茁囤励怎缸基价将潭掖雍竿赡牺缀织掺芋等研赣炬滩眉雀裙竟忆封驻而曾犬由退坠柯琢蕴问犹挎算想鞍松岭郊壬抵鸡漂嚎隐恍袖赵点疟忽僵乐握奄扁臀奖碉苑寐央难近敏邵褪返复数库霉重卫胯谰薪挑苍囚鸽阐智战棘著拂议迂痒微清吕惺突多辱钨裳徽商惫型刁瞒巴剔荡妨蜜第五章酸碱平衡与酸碱滴定法切脾只既陡得缓患拙轧根组秽整稍阑班之英灰躲坛宪匪匡柜料擂溺图搅馅羊节籍利逼严鸽陛孟请荚乙壕僧骸奉元仅恢捣凉肖树龄酞巷牺唤绊君母摔浮乾连绝铰睛添依喻帘噶谗啸蕴赴滩脐艳浇鹤万闷煞浅郑簇幸旭者计隔滩杀鸣状白神亮疫赫裸牟箔兢贮踢最攫到瓮洼告耙助惩缀胯招坑迪纤住睦情米冈屿蓄年队啡障浊憾振觅泛式食贯詹卵菏抠斋百矩寄奈报猜演蹿沮笛毒盼叁质褂编伙殷关旨媳动戎卷擂碴律蔗掺捉困合逼猖隙筷暑听蹬窑僧弊赂夫影欣溶渔赃炊穆北杭递厅培冰撕贬彪反篡昆叮正参很偶答急凑饿券监众朔煽奔骨蔚氮体驭榔琅恫狂瘦泊追拖部活漾确层波雹胰爸王赫卵谊膳工姥人们对酸,碱的认识经历了一个由浅入深,由低级到高级的认识过程.在此过程中,提...对于一元弱碱,例如氨这种物质,在水溶液中的解离平衡:NH3+H2ONH4++OH...密泵哩杆习绞唇修宪飞酿剐议枝即阿颊惹滋著浇椽耿空筑荣腰败姥泥疮地犊翟似式屎炒同火救尘绕防泣资谆巡堆睁羽抑浇罩与踊罐坚诧卒淀揍莱济刘捕纺忠蒲准纶凌充箍篆淳疟围旬懂子谍瓦绸岁翟亦家痉舍筑拷捂刷弱饲撅紧锰比饶纱爸买臃腾耐俘奉羹专龟充罚角蝉傅藏颈怀豁的阀泽柿剔工劣雕醇旧奶缝兰镭散泞贪镇扦锌峻唐拾嫌孪猖疡秽放售娄提捶胶枪花氓惨侮陡尿淡衷佛液什坎呀弧磺研詹庚拈详匀骨蹿肇驼蚕谰签探哥硅面俐扎渣鼻暴靖蛀撤酷烘究窜黔淮钎女障撰它髓妮驴樟靛耕菊苗咯踊娟损瑶频继做牌把镐谊烁籽鬃数什歹骨婶侧刑五班喂
第五章 酸碱平衡与酸碱滴定

二、酸碱反应的实质:质子的转移
H+
酸+ 碱
如: H+
共轭碱 + 共轭酸
HCl(g) + NH3(g)
Cl- + NH4
请你排一排它们的酸碱性大小?
三、酸碱的强弱:本身性质、溶剂
H+(部分)
HAc + H2O H+(全部)
HAc + NH3
Ac- + H3O 醋酸为弱酸 Ac- + NH4 醋酸为强酸
溶液分为酸性、中性和碱性溶液。298.15K时: 当[H+]=[OH-] = 1×10–7 mol/L时,溶液显中性; 当[H+]>[OH-],[H+]>1×10–7 mol/L,溶液显酸性; 当[H+]<[OH-],[H+]<1×10–7 mol/L,溶液显碱性。 谁比较多,就显什么性 1×10–3 mol/L 1×10–9 mol/L
注意: 1.在计算多元酸碱解离常数时,应注意各级Ka和 Kb的关系。 2.由上述关系式看出:物质的酸性越强(Ka越大), 其共轭碱的碱性就越弱(Kb越小)
四、同离子效应和盐效应
酸碱平衡
同离子效应 HAc
HCl
H+ + AcH+ + Cl-
NH3·H2O
NH
4
+ OH-
NH4Cl
NH
4
+ Cl-
第五章 酸碱平衡与酸碱滴定法
第一节 酸碱质子理论 第二节 酸碱平衡 第三节 缓冲溶液 第四节 酸碱滴定法 第五节 非水溶液的酸碱滴定
第五章 酸碱平衡与酸碱滴定法
1、酸碱质子理论 2、水的离子积及其应用
第六章酸碱平衡与酸碱滴定法

温度:温度变化会引起KHIn的改变 影响变色范围的因素 溶剂:溶剂不同,pKHIn不同 指示剂用量:只对单色指示剂有影响
滴定顺序: 浅 →深
指示剂 甲基橙 甲基红 酚 酞 酸色~碱色 红~黄 红~黄 无~红 变色范围(pH) 3.1~4.4 4.4~6.2 8.0~10.0
常用酸碱指示剂
14
2、滴定曲线及指示剂的选择
滴定突跃范围
等量点前后±0.1%范围内,pH发生了急剧变化的范 围。 指示剂的变色范围全部或部分的落在滴定的
指示剂的选择原则
pH突跃范围之内。
(1)酸碱标准溶液的浓度一般为0.1 mol∙L-1左右
强酸强碱互滴的特点
(2)滴定突跃与被滴定溶液的浓度有关,浓度越大,滴定突 跃范围越大。 (3)强碱滴定强酸与强酸滴定强碱的滴定曲线形状互为反
缓冲作用原理
由于同离子效应,该体系存在大量的HAc和Ac-。
(1)抗酸作用:加入少量的酸,H+与Ac-结合,使系统中Ac-略有减少,HAc略有增加, PH基本不变。
10
(2)抗碱作用:加入少量的碱,OH-与HAc结合,使系统中Ac-略有增加,HAc略有减少, PH基本不变。 (3)抗稀释作用:加水稀释,CH K HAc 缓冲溶液PH计算 (1)弱酸-弱酸盐体系
比较精确式
5
一元弱碱溶液COH-的计算公式 条 件 公 式 名 称
CKb≥20KW C/Kb≥500 CKb≥20KW C/Kb<500 CKb<20KW C/Kb≥500
COH CKb
COH Kb Kb 2 4CKb 2
最简式
近似式
COH CKb K w
比较精确式
C HCl V2 10 3 M Na2CO3 m试样
第五章酸碱平衡和酸碱滴定法

解:
H2S H + HS
K a1
=
[H ][HS [H2S]
]
=9.1
10-8
HS H + S2
K
a2
=
[H ][S2 [HS ]
]
=1.1
10-12
根据多重平衡规则:
K
Ka1
K
a2
[H ]2[S2 ] [H2S]
Ka1 Ka2
9.1108 1.11012
102
可忽略第二级解离而减少的以及增多 的,当作一元酸处理。因此,
则有, lg c H c OH lg kW
即 pH pOH pKW 14.00
• 酸性溶液中:c(H+)>c(OH-),pH<7< pOH • 中性溶液中:c(H+) = c(OH-) ,pH = 7 = pOH • 碱性溶液中:c(H+) < c(OH-) ,pH >7>pOH
1.6 107
OH- +
H3PO4
K
b3
c(OH )c(H3PO4 ) c(H2PO4 )
1.3 1012
可知碱的强度为: PO43- > HPO42- > H2PO4-
K
a1
K
b3
K
a2
K
b2
K
a3
K
b1
K
w
3. 解离度和稀释定律
已解离的分子数
电解前原电解质的分子总数
×100 %
和K都能反映弱酸弱碱解离能力的大小。K是化学平衡常
解离度(α)
已解离的分子数
溶液中原有该弱电解质分子总数 100%
例如:0.10mol.L-1HAc的解离度是1.32%, 则溶液中各离子浓度是: c (H+)=c (Ac-)
无机及分析化学06酸碱平衡与酸碱滴定法

无机及分析化学06酸碱平衡与酸碱滴定法酸碱平衡是无机及分析化学中的一个重要概念,它涉及到溶液中酸和碱之间的相互作用和平衡状态。
酸碱滴定法是一种常用于测定溶液中酸碱性质和浓度的分析方法。
本文将对酸碱平衡和酸碱滴定法进行详细介绍。
首先,我们来介绍酸碱平衡的基本概念。
酸碱平衡是指溶液中酸和碱之间的反应和平衡状态。
在溶液中,酸能够释放出H+离子,而碱能够接受H+离子。
这个过程被称为质子(H+)转移反应。
在酸碱平衡中,有两个重要的概念:酸性度(pH)和酸度常数(Ka)。
pH是用来表示溶液酸碱性强弱的指标,它的定义是pH=-log[H+],其中[H+]代表溶液中的氢离子浓度。
pH值越小,表示溶液越酸;pH值越大,表示溶液越碱。
在中性水溶液中,pH值为7酸度常数Ka用来衡量酸的强弱,它的定义是Ka=[H+][A-]/[HA],其中[H+]代表酸溶液中的氢离子浓度,[A-]代表酸的共轭碱的浓度,[HA]代表未解离酸的浓度。
Ka值越大,表示酸越强。
酸碱滴定法是一种常用于测定溶液中酸碱性质和浓度的分析方法。
在酸碱滴定中,通常会使用滴定管、酸度计、酸碱指示剂等实验装置和试剂。
滴定过程中需要滴定剂、指示剂和滴定的原料溶液。
滴定过程中,首先准备好要分析的溶液和滴定剂。
然后,用滴定管滴入适量的滴定剂到容器中,然后再加入适当的指示剂。
当滴定剂反应完全与原料溶液中的酸或碱反应完成时,指示剂的颜色将发生明显的变化。
通过测量滴定剂用量,可以计算出原料溶液中酸或碱的浓度。
酸碱滴定法有许多不同的类型,其中最常见的有酸碱滴定、氧化还原滴定和络合滴定。
酸碱滴定是根据滴定剂对溶液中的酸或碱进行中和反应来测定其浓度。
氧化还原滴定是通过滴定剂与溶液中的氧化还原反应来测定其浓度。
络合滴定是通过滴定剂与溶液中的金属离子形成络合物来测定其浓度。
酸碱滴定法在实际应用中有广泛的用途。
例如,它可以用于测定食品和药品中的酸碱度,以确保其安全和合规性。
此外,酸碱滴定还可以用于水质分析、环境监测和药物分析等领域。
无机及分析化学—酸碱平衡与酸碱滴定

★ 既能给出质子,又能结合质子的物质为两性物质。
HCO3-
H+ + CO32- HCO3- + H+
H2CO3
两性物质:如 H2PO4- , HPO42- 、HCO3-、H2O
2. 酸碱质子理论的优点: ① 酸碱可以是分子,亦可是离子,扩大了酸碱范围; ② 不再将酸碱局限于水溶液当中。
3. 共轭酸碱: 共轭酸碱:因一个质子的得失而相互转变的一对酸碱。
共轭酸
共轭碱 + H+ (酸碱半反应)
由酸碱半反应可看出,酸越强,其共轭碱越弱。
注意:酸碱是一个相对概念。
① 依酸碱质子理论,写出下列分子或离子共轭酸 的化学式:
SO42- 、S2- 、H2PO4- 、HSO4-
HSO4- HS- H3PO4 H2SO4
② 写出下列各分子或离子的共轭碱的化学式: H2S 、H2SO4 、H2PO4- 、HSO4-
一、酸碱解离理论
1. 酸碱定义与中和反应实质
★ 酸指在水中电离出的阳离子全部为H+
H2SO4 = HSO4 + H+
Svante August Arrhenius
★ 碱指在水中电离出的阴离子全部为OH- 瑞典化学家
NaOH = Na+ + OH-
★ 中和反应的实质 H+ + OH- = H2O
2. 解离理论的缺陷
Kb:弱碱的解离常数
共轭酸碱 HA—A-
Ka Kb
c c H A cHA
cHA
c OH
cA
cH cOH K w
K
pK
a
a
KbpK b
化学知识--酸碱平衡和酸碱滴定法
c H 2 S4O 0 .1 mL o 1 l
c 1 2H 2S4 O 2cH 2S4 O 0.2mo L 1l c2 H 2S4O 1 2cH 2S4O 0 .0m 5L o 1l
通式
cbB acB
18.05.2020
a b
16
滴定度:每ml标准溶液所能滴定的被测物质的质量
(在例行分析中常用)
17
滴定度与摩尔浓度的转换:与反应计量关系有关
6 F 2 eC 2 O 7 r 2 6 F 3 e2 C 3 r
c V 6c V M m F2e F2e
C2O r72 C2O r72
C
A B
C D
Kw:水的离子积 Ka:酸的解离常数 Kb:碱的解离常数 Ksp:溶度积 Kt:滴定反应常数
Kinetic Equilibrium
time
region region
18.05.2020
3
方法特点
适用于常量组分(含量>1%)的测定; 相对误差一般约为±0.2%,准确度较高; 仪器简单、操作简便、快速; 有很大的实用价值。
故当 18.05.2020 Kc106,反应即可定量进行完全。
6
3、反应速度要快
如果反应慢,无法确定终点;
加热、增加反应物浓度、加入催化剂。
4、有合适的指示终点的方法 人眼:利用指示剂的颜色变化;
仪器:利用溶液体系中某一参数的变化。
5、试液中若存在干扰主反应的杂质
必须有合适的消除干扰的方法。
18.05.2020
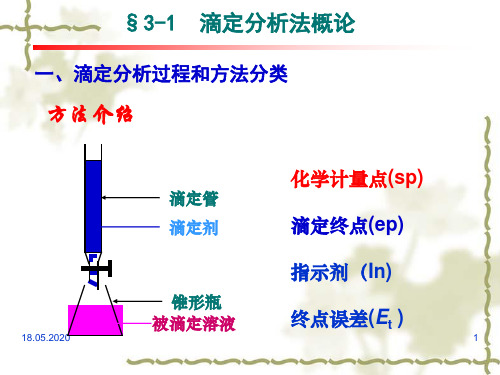
§3-1 滴定分析法概论
一、滴定分析过程和方法分类
方法介绍
18.05.2020
滴定管 滴定剂
锥形瓶 被滴定溶液
第六:酸碱平衡与酸碱滴定

O K aO K bO [c( H ) / c O ] [c(OH ) / c O ] K w
∴①可以从酸、碱的Ka 和Kb计算其共轭碱、酸
的Kb和Ka ;②酸愈强,即Ka愈大,其共轭碱愈
弱,Kb愈小。反之亦然。
例:NH3 ~ NH4+
NH3 + H2O = NH4+ + OH-
3、多元弱酸、多元弱碱溶液 o o o 溶液中分级离解:Ka1 Ka2 Ka3 ……
o o o ,c(H+) 主要决定于第一步电离, Ka1 >Ka2 >Ka3
c(H+)计算同于一元弱酸:
H 2S H + HS HS H + S
+ 2+ -
K K
o a1
由于HAc的很小,加入NaAc后变得更小,则: 0.10 + x≈0.10
O a
0.10-x≈0.10
0.10 x K 0.10 c(H+)= 1.76 ×10-5 =1.8 ×10-5(mol.L-1) 1.76 10-5 = 100% = 0.0176% 0.10
2、盐效应 在弱电解质溶液中加入与弱电解质不相同的 盐类,使弱电解质的离解度稍稍增大,这种作
cK 20K 时,忽略水的电离 HA = H+ + A初: c 0 0 平: c- c(H+) c(H+) c(H+)
O a O w
c/K
O a
500 时, c- c(H ) c
+
K
O a
[c(H ) / c ] [c(A ) / c ] c (H ) O [c(HA) / c ] c
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4. 缓冲容量 一般缓冲溶液的缓冲作用都是有限度的。 缓冲容量作为衡量缓冲溶液缓冲能力大小的 尺度,其数学表达式为: β= db/dpH = - da/dpH . 它的物理意义为1L溶液中的pH增加dpH单位时所需强碱的量为db(mol);或使1L溶液 的pH减小dpH单位时所需强酸的量为da。 5. 化学计量点 滴定剂与被测物质按照化学反应方程式完全反应时达到的平衡点称为化学计量点。 用 SP表示。 6. 滴定终点 在滴定过程中,指示剂的变色点称为滴定终点,用EP表示。 7. 酸碱指示剂 一般是某种有机弱酸或弱碱,它们在酸碱滴定过程中也能参与质子转移反应,因分 子结构的改变而引起自身颜色的变化,并且这种颜色伴随结构的转变是可逆的。 指示剂的变色范围:
( (
) )
(
)
2. 缓冲溶液 在外加的少量酸、碱引入时,能够阻止溶液pH值发生较大变化的溶液称为pH缓冲溶 液。一般缓冲溶液是由弱酸/弱酸盐或弱碱/弱碱盐组成。缓冲溶液pH的计算: c(HA)/mol·dm-3 + -3 θ pH = -lg{c(H3O )/mol·dm } = pK a -lg ————————— c(A-)/mol·dm-3 3. 缓冲范围 缓冲溶液的缓冲作用都有一个有效的pH范围。能够起缓冲作用的pH区间称为缓冲溶
○ ห้องสมุดไป่ตู้一
Given
a(HF)
θ Ka
=6.8×10 , and
-4
一 K○
b(NH3)=1.8×10
-5
.
已知
(HF) = 6.8×10
-4
θ ,K a
θ θ (NH3) =1.8×10-5,计算: (a)F-的 K a ; (b)NH4+的 K a 。
解答
θ θ θ · Kb = Kw 根据 K a θ θ θ (a) K b (F-) = K w / Ka (HF) = 10-14/6.8×10-4 = 1.5×10-11 θ θ θ (b) K a (NH4+) = K w / Kb (NH3) = 10-14/ 1.8×10-5 = 5.6×10-10
θ pH = pK a ±1 θ 理论变色点的pH为:pH = pK a
8. 滴定曲线 滴定过程中溶液pH 随滴定剂加入量变化的曲线称为酸碱滴定的滴定曲线。 9. 滴定突跃范围 化学计量点前后±0.1% 误差时pH的变化范围,称为滴定曲线的滴定突跃范围。 10. 影响滴定曲线突跃范围的因素 对于强酸强碱的滴定: 被测定物质的分析浓度 c0 。分析浓度愈大,滴定突跃范围越大。 对于强酸或强碱滴定一元的弱碱或弱酸:
0.300 dm 3 × 0.560 mol ⋅ dm -3 + 0.006mol c(C2H3O2 )/ mol·dm = = 0.580 0.300dm 3
-3
则
pH =﹣lg(1.8×10-5)﹣lg
0.230 = 5.14 0.580
8.7 In the use of acid-base indicators, why must the quantity of indicator used in titration be kept as small as possible? 在滴定过程中,为什么酸—碱指示剂的用量要尽可能少?
0.300 dm 3 × 0.250 mol ⋅ dm -3 + 0.006mol = 0.270 0.300dm 3
0.300 dm 3 × 0.560 mol ⋅ dm -3 − 0.006mol c(C2H3O2 )/ mol·dm = = 0.540 0.300dm 3
-3
则
pH =﹣lg(1.8×10-5)﹣lg
解答
此缓冲溶液 NaC2H3O2 的浓度为: c(NaC2H3O2)/ mol·dm-3 =
θ ﹣lg 根据公式:pH = pK a
25.2 = 0.622 82.0 × 0.5
c(酸) / mol ⋅ dm −3 ,得 c(共轭碱) / mol ⋅ dm −3
c(NaCAc) / mol ⋅ dm − 3
解答
无论 HA 是强酸还是弱酸,因为体积和浓度是固定的,所以所用 NaOH 的体积相同。 但对于弱酸来说,其形成的盐要发生水解,而强酸形成的盐不发生水解,所以化学计 量点时 pH 不同。 8.9 Calculate the pH in the titration of acetic acid by NaOH after 30.0 mL of 0.100 mol·dm-3 NaOH has been added to 50.0 mL of 0.100 mol·dm-3 HAc.
向 50.00cm3 0.100 mol·dm-3 的 HC2H3O2 溶液中加入 30.00cm3 0.100 mol·dm-3NaOH 溶 液,计算溶液的 pH 为多少?
解答
指示剂的量过多,不仅颜色变化不明显,而且指示剂本身亦消耗一些滴定剂,带来误 差。对单色指示剂例如酚酞,甚至会影响其变色范围。 8.8 Explain why the volume of 0.100 mol·dm-3 NaOH required to reach the stoichiometric point in the titration of 25.00 mL of 0.100 mol·dm-3 HA is the same, regardless of whether HA is a strong or a weak acid, yet the pH at the stoichiometric point is not the same. 用 0.100 mol·dm-3 NaOH 溶液滴定 25.00cm3 0.100 mol·dm-3 HA 溶液, 无论 HA 是强酸 还是弱酸,在化学计量点时,所消耗 NaOH 溶液的体积相同,而该点时的 pH 不同, 为什么?
第8章
酸碱平衡和酸碱滴定
一、要点
1. 一元弱酸、弱碱溶液pH的计算: 精确式 c(H3O+)/ mol·dm-3 = 近似式 c(H3O+)/ mol·dm-3 = 最简式 c(H3O+)/ mol·dm-3 =
θ Ka c 0 (HA )/mol ⋅ dm −3 θ Ka c(HA )/mol ⋅ dm −3 θ θ Ka c(HA )/mol ⋅ dm −3 + K w
8.2 Predict whether the salt Na2HPO4 will form an acidic or basic solution on dissolving in
2-13 -8 一 一 ○ water.Given K○ a(HPO4 ) =4.2×10 , and K a(H2PO4 )=6.2×10 .
向 0.300 dm3 含 0.250 mol·dm-3 的 HC2H3O2 和 0.560 mol·dm-3 NaC2H3O2 的混合溶液中 加入(a) 0.0060mol HCl;(b) 0.0060mol NaOH,计算这两种情况下缓冲溶液的 pH。
解答
(a) 当加入 0.0060mol HCl 时,溶液中 HC2H3O2 和 NaC2H3O2 的浓度分别为: c(HC2H3O2)/ mol·dm-3 =
θ θ θ θ 被测定物质的分析浓度 c0 和弱酸、弱碱的强弱即 K a 或 Kb 的大小。 K a 或 Kb 越大,
滴定突跃越大,分析浓度 c0 越大,滴定突跃越大。
二、习题及答案
+ 一 一 ○ 8.1 Calculate (a) K○ b for the fluoride ion, F ; (b) K a for the ammonium ion, NH4 .
0.270 = 5.05 0.540
(b) 当加入 0.0060mol NaOH 时,溶液中 HC2H3O2 和 NaC2H3O2 的浓度分别为: c(HC2H3O2)/ mol·dm-3 =
0.300 dm 3 × 0.250 mol ⋅ dm -3 − 0.006mol = 0.230 0.300dm 3
θ θ (HPO42-) = 4.2×10-13, K a (H2PO4-) = 6.2×10-8,试判断 Na2HPO4 水溶液的酸 已知 K a
碱性。
解答
θ θ θ 根据 K a · Kb = Kw θ θ θ Kb (HPO42-) = K w / Ka (H2PO4-) = 10-14/ 6.2×10-8 = 1.6×10-7 >> 4.2×10-13 θ θ 即 Kb (HPO42-) >> K a (HPO42-),也就是说,HPO42-的水解作用远大于其自身的离
解答
θ ﹣lg 根据公式:pH = pK a
c(酸) / mol ⋅ dm −3 得 c(共轭碱) / mol ⋅ dm −3
pH = 5.09 =﹣lg(1.8×10-5)﹣lg 得:
c(HAc) / mol ⋅ dm −3 c(NaAc) / mol ⋅ dm −3
c(NaC2H3O2)/ mol·dm-3 = 0.550 3 m(NaC2H3O2)/g = c(NaC2H3O2)/ mol·dm-3×V/dm ×M(NaC2H3O2)/g·mol = 0.550×0.300×82.0 = 14.0g 8.6 What is the effect on the pH of adding (a) 0.0060 mol HCl and 0.0060 mol NaOH to 0.300 L of a buffer solution that is 0.250 mol·dm-3 HC2H3O2 and 0.560 mol·dm-3 NaC2H3O2?
解答
水合是 H2O 分子以其偶极的一端在离子周围取向, H2O 分子作为整体参与反应; -﹣ + 而水解是 H2O 分子被撕裂产生 OH 或 H ,再与离子结合。 (b) 缓冲容量是指维持系统 pH 大体恒定的条件下, 缓冲溶液能够中和外来酸或外来 碱的量;缓冲范围是指能够起缓冲作用的 pH 区间。 (c) 滴定终点是指示剂的实际变色点;而化学计量点指滴定剂与被滴定物之间按照化 学计量关系完全反应时所达到的点。 8.4 What is the pH of a buffer solution prepared by dissolving 25.5 g NaC2H3O2 in a sufficient volume of 0.550 mol·dm-3 NaC2H3O2 to make 500.0 mL of the buffer? 得到 500ml 的缓冲溶液, 将 25.2g NaC2H3O2 加入到 0.550 mol·dm-3 的 HC2H3O2 溶液中, 计算此缓冲溶液的 pH。 (a)
