常考点高考题——无机反应图象题
常见无机框图型题
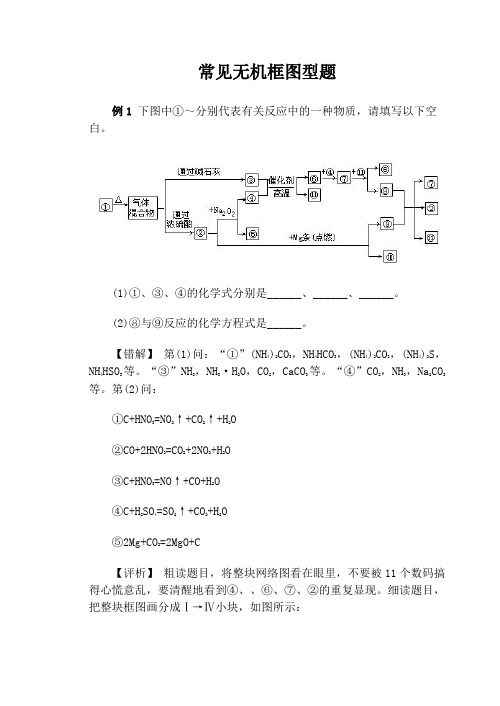
常见无机框图型题例1下图中①~分别代表有关反应中的一种物质,请填写以下空白。
(1)①、③、④的化学式分别是______、______、______。
(2)⑧与⑨反应的化学方程式是______。
【错解】第(1)问:“①”(NH4)2CO3,NH4HCO3,(NH4)2CO3,(NH4)2S,NH4HSO3等。
“③”NH3,NH3·H2O,CO2,CaCO3等。
“④”CO2,NH3,Na2CO3等。
第(2)问:①C+HNO3=NO2↑+CO2↑+H2O②CO+2HNO3=CO2+2NO2+H2O③C+HNO3=NO↑+CO+H2O④C+H2SO4=SO2↑+CO2+H2O⑤2Mg+CO2=2MgO+C【评析】粗读题目,将整块网络图看在眼里,不要被11个数码搞得心慌意乱,要清醒地看到④、、⑥、⑦、②的重复显现。
细读题目,把整块框图画分成Ⅰ→Ⅳ小块,如图所示:第Ⅰ块中,Na2O2是个突破口,能与Na2O2反应的气体应该是CO2,由此估量②可能是CO2,④可能是O2。
由①加热得气体混合物,该气体混合物通过浓硫酸后,得到气体②,可认为①为碳酸铵或碳酸氢铵(中学学过的物质受热得到气体混合物的,当属这两种盐)。
第Ⅱ块中,气体混合物通过碱石灰后,CO2和H2O均被除去,③应为NH3,③与④在催化剂、高温条件下,生成⑥和的反应为=2NO2,由此可知⑥为NO,⑦为NO2,为H2O。
⑦与反应生成⑥和⑧,应该是3NO2+H2O=2HNO3+NO,由此可知⑧为HNO3。
第Ⅲ块中,⑧与⑨反应,生成⑦、②和,只有⑨是未知的,HNO3与什么物质反应能生成NO2,CO2和H2O呢?明显⑨应该是碳。
第Ⅳ块中,②与Mg条在点燃条件下反应生成⑨和⑩,可确定⑨为碳(发生的反应因此,也能够按Ⅰ、Ⅳ、Ⅱ、Ⅲ块的顺序摸索。
本题使用了11种物质,用了15个序号,其中④、、⑥、⑦、②重复显现,涉及9步反应(或操作),组成了元素化合物的框图题,考查四种主族元素的典型反应之间的相互关系及相关的化学用语。
“无机框图题题眼归类专题

“无机框图题题眼归类专题一、特征反应1.与碱反应产生气体Al、SiOHH2(1)单质2Al2NaOH2H2O2NaAlO23H2Si2NaOHH2ONa2SiO32H2(2)铵盐:NH4NH3H2O碱2.与酸反应产生气体HClH2浓H2SO4SO2金属HNO3NO2、NO浓HSO4(1)单质SO2、CO22C 浓HNO3NO2、CO2非金属浓H2SO4SO2S浓HNO3SO2、NO2HCO32HCO3CO22H (2)化合物SHSH2S2HSOHSOSO2333.Na2S2O3与酸反应既产生沉淀又产生气体:S2O3+2H=S↓+SO2↑+H2O4.与水反应产生气体2-+2Na2H2O2NaOHH2(1)单质2F22H2O4HFO22Na2O22H2O4NaOHO2Mg3N23H2O3MgOH22NH3(2)化合物Al2S36H2O2AlOH33H2SCaC2HOCaOHCH2222212OCO32HCO3HCO2AlOH3H2O5.强烈双水解Al3与S2HSH2SAlOH3H2OAlOAlOH326.既能酸反应,又能与碱反应(1)单质:Al(2)化合物:Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
CO2O2Na2CO37.与Na2O2反应HO2O2NaOH8.2FeCl3+H2S=2FeCl2+S↓+2HClH2O电解H2O2电解AlO29.电解Al2O3熔融电解NaCl溶液NaOHCl2H210.铝热反应:Al+金属氧化物金属+Al2O3 3+-11.AlAl(OH)3AlO212.归中反应:2H2S+SO2=3S+2H2O高温4N2+6H2O4NH3+6NO13.置换反应:(1)金属→金属催化剂1.金属盐金属盐2.铝热反应或H2OHH2活泼金属(Na、Mg、Fe)(2)金属→非金属点燃2MgOC2MgCO22F22H2O4HFO2高温Si2CO2CSiO2(3)非金属→非金属高温COH2CH2OCl(Br、I)HSS2HCl(HBr、HI)2222高温金属H2OH2金属氧化物(4)非金属→金属高温金属CO2C金属氧化物214.三角转化:35.受热分解产生2种或3种气体的反应:NH4HCO3[(NH4)2CO3]NH3CO2H2O(1)铵盐NH4HSO3[(NH4)2SO3]NH3SO2H2ONHHS[(NH)S]NH3H2S4422CuO4NO2O22Cu(NO3)2(2)硝酸盐2Ag2NO2O22AgNO322216.特征网络:(1)ABCD(酸或碱)OOHO222①NH(气体)NONO2HNO33OOHO222②H2S(气体)SO2SO3H2SO4OOHO222③C(固体)COCO2H2CO3OOHO222④Na(固体)Na2ONa2O2NaOHOOHO强酸气体B(2)A—强碱气体CA为弱酸的铵盐:(NH4)2CO3或NH4HCO3;(NH4)2S或NH4HS;(NH4)2SO3或NH4HSO3(3)无机框图中常用到催化剂的反应:2,2KClO3MnO2KCl3O222H2O2MnO2H2OO22SO2O2催化剂,2SO34NH35O2催化剂,4NO6H2ON23H2催化剂,2NH3二、特征现象1.焰色反应:Na+(黄色)、K+(紫色)2.浅黄色固体:S或Na2O2或AgBr3.使品红溶液褪色的气体:SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)4.有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3]蓝色[Cu(OH)2]黑色(CuO、FeO、FeS、CuS、Ag2S、PbS)黄色(AgI、Ag3PO4)白色[Fe(0H)2、CaCO3、BaSO4、AgCl、BaSO3]有色气体:Cl2(黄绿色)、NO2(红棕色)5.特征反应现象:白色沉淀[Fe(OH)2]空气红褐色[Fe(OH)3]4。
无机框图题推断PPT教学课件

2.电容的标识与测量
• 电容器的容量和允许误差有两种表示方法: ① 数值表示法 即用文字、数字或符号直接打印 在电容器上的表示方法。 例如:CJ3-400-0.01—Ⅱ,表示密封金属化纸介 电容器,额定直流工作电压400V,电容量0.0lμF, 允许误差±10%。 ② 色环表示法 用三到四个色环在产品表面上标 出电容器的容量和允许误差。各颜色所代表的意 义如表7-9所示。
一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成
的化合物(图中部分反应物或生成物没有列出C)H4、CCl4或P4
HCl A
D
G
Cl2 ②
H
H2O ③
AKl4C3
Fe或Al B
E
①
I
高温
C
F
请按要求回答:
J Al2O3是较好
的耐火材料
(1)写出B的化学式_______,G的电子式__________。 (2)反应①的离子方程式为_____________。 (3)反应②进行的条件是_______、______。 (4)反应③的化学方程式为_____________。
Cu、Cu2O KMnO4、I2
Fe2O3
蓝色溶液
Cu2+
棕黄色溶液
Fe3+
血红色溶液 [Fe(SCN)]2+
黑色固体
MnO2Fe3O4、C、 橙色溶液 CuO
Br2(水)
红褐色沉淀 白色沉淀
Fe(OH)3 BaSO4、CaCO3、 AgCl、Fe(OH)2
蓝色晶体 红棕色气体
CuSO4·5H2O Br2、NO2
2021/1/12
元件的识别 • 二、电容
1 、电容元件的分类 2 、电容的标识与测试方法
高考化学图像题知识点归纳及专项练习题(含答案解析)

高考化学图像题知识点归纳及专项练习题(含答案解析)一、知识点归纳1.图像题的主要特点(1)图像在一个坐标系上有多个变量,图像较为复杂。
(2)图像中隐含信息量大,读图获取信息能力要求高。
(3)会多角度、多层面去思考和探究问题。
2.无机图像题的解题要领先审题干再看图,物变量变两手抓;反应线段要对准,端点拐点定数量;问题陷阱要审清,找准切口再解决。
3.图像试题解题关键(1)看清横纵坐标代表的含义,理解图示化学曲线的意义。
(2)理清图像变化的趋势,重点把握起点、拐点、终点、交叉点。
突破口在于抓住图像中关键点的含义,结合化学反应原理作出正确判断。
4.无机图像题的解题技能二、专项练习题1.(2016·江苏化学,10)下列图示与对应的叙述不相符合的是( )A.图甲表示燃料燃烧反应的能量变化B.图乙表示酶催化反应的反应速率随反应温度的变化C.图丙表示弱电解质在水中建立电离平衡的过程D.图丁表示强碱滴定强酸的滴定曲线解析燃料燃烧为放热反应,而图示表示吸热反应,A错误;酶的主要成分是蛋白质,在活性温度范围内,酶的催化效率高,速率加快,随温度升高,蛋白质变性,催化效率下降,速率减慢,B正确;开始时分子离解成离子速率快,而离子浓度小,结合成分子速率慢,随着反应进行,分子浓度减小,分子电离为离子的速率减慢,离子浓度增大,离子结合为分子的速率加快,当两者速率相等时,达到平衡,C正确;强碱滴定强酸,当恰好完全反应时,溶液呈中性,D正确。
答案 A2.(2016·吉林长春模拟)向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )A.a点对应的溶液中:Na+、OH-、SO2-4、NO-3B.b点对应的溶液中:Al3+、Fe3+、MnO-4、Cl-C.c点对应的溶液中:Na+、Ca2+、NO-3、Cl-D.d点对应的溶液中:F-、NO-3、Fe2+、Ag+解析向Na2CO3、NaHCO 3混合溶液逐滴加入稀盐酸,a点溶液中含有CO2-3和HCO-3,b点全部为HCO-3,c点恰好完全反应生成NaCl,溶液呈中性,d点盐酸过量,呈酸性。
2023年高考化学:常考图表图像题解-无机综合推断框图

(1)考查原子结构的特点和成键规律。
(2)考查元素化合物的物理性质和化学性质,以及相互之间的转化。
(3)考查元素周期表位置的掌握和元素周期律的应用。
(4)考查元素“位—构—性”之间的联系和推断。
一、推断题解题思路明显条件隐含条件结构特征反应特征现象特征其他特征二、推断题常见突破口1、重要物质的物理性质①有色气体:NO2(红棕色)、Cl2(黄绿色)。
无色、有刺激性气味的气体:SO2、NH3、HCl。
②溶液中的有色物质:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)、Mn O4-(紫红色)。
③有色固体:淡黄色固体如Na2O2、S;黑色固体如MnO2、C、CuO、FeO、Fe3O4;紫黑色固体如KMnO4、I2;紫红色固体如Cu。
④有色沉淀:白色沉淀如H2SiO3、AgCl、BaSO4、BaSO3、Mg(OH)2、Al(OH)3、BaCO3、CaCO3等;红褐色沉淀如Fe(OH)3;蓝色沉淀如Cu(OH)2;黑色沉淀如CuS、FeS。
⑤常温下呈液态的物质:H2O、H2O2、Br2、Hg等。
2、既能与强酸溶液反应又能与强碱溶液反应的物质①金属单质:Al。
②两性物质:两性氧化物如Al2O3,两性氢氧化物如Al(OH)3。
③弱酸弱碱盐:(NH4)2CO3、CH3COONH4等。
④弱酸的酸式盐:NaHCO3、Ca(HCO3)2、NaHSO3等。
3、特征反应如NH3+HCl NH4Cl(出现白烟);2NO+O22NO2(无色变为红棕色);I2遇淀粉溶液变蓝;4Fe(OH)2+O2+2H2O4Fe(OH)3(白色→灰绿色→红褐色)等。
4、元素推断题中常用到的推断依据(1)气态氢化物的水溶液呈碱性或气态氢化物能与其最高价氧化物对应的水化物发生化合反应的元素:N 。
(2)最活泼的非金属元素或无正化合价的主族元素或无氧酸可腐蚀玻璃的元素或简单气态氢化物最稳定的元素或简单阴离子的还原性最弱的元素:F 。
(3)焰色反应呈黄色的元素:Na ;焰色反应呈紫色(透过蓝色钴玻璃观察)的元素:K 。
高考化学二轮复习:微题型【18】无机反应“图像”题(含答案)

[题型专练]1.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )解析本题涉及多个反应,当刚开始通入CO2时,溶液中存在着OH-与AlO-2之间的竞争,因为碱性:OH->AlO-2,故CO2应先与OH-反应生成CO2-3,而Ba2+会与CO2-3结合生成BaCO3沉淀,因此可以看作是Ba(OH)2先与CO2反应,然后再与KOH反应。
当KOH全部生成K2CO3后,再通入CO2,则存在着BaCO3、CO2-3与AlO-2间的竞争,如果BaCO3先发生反应生成Ba(HCO3)2,由于溶液中存在CO2-3,则Ba2+又会与CO2-3结合成BaCO3,所以BaCO3不会先溶解。
如果CO2先与CO2-3反应生成HCO-3,则又由于HCO-3+AlO-2+H2O===Al(OH)3↓+CO2-3,可知又生成了CO2-3,从而确定CO2应先与AlO-2反应,再与CO2-3反应生成HCO-3,最后CO2才与BaCO3反应。
答案 C2.某澄清透明溶液中只可能含有①Al3+;②Mg2+;③Fe3+;④Fe2+;⑤H+;⑥CO2-3;⑦NO-3中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。
则该溶液中一定含有的离子是( )A.②⑤⑥⑦B.②③⑤⑦C.①②③⑥⑦ D.①②③④⑤⑦解析根据图像变化,不含Al3+、CO2-3、Fe2+,一定含H+、NO-3。
若只含Mg2+,n(Mg2+)=1.5 mol,Mg(OH)2质量为1.5 mol×58 g·mol-1=87 g;若只含Fe3+,n(Fe3+)=1 mol,Fe(OH)3质量为1 mol×107 g·mol-1=107 g,而实际得到沉淀100 g,所以Mg2+、Fe3+都含有,B项正确。
答案 B3.现有含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。
无机反应机理图像(能垒图、循环图、直线图)专练
3
整理与编辑 沈立鹏
【答案】Cu、Cl、H
增加氧气的通入量或增加起始时 c(Fe3+)
7.用 H2 制备 H2O2 的一种工艺简单、能耗低的方法, 反应原理如下图所示。总反应的化学方程式为___________。
【答案】H2+O2
H2O2
8.光催化降解过程中形成的羟基自由基(·OH)和超氧离子(·O2-)具有光催化能力,催化原理如图 2 所示。请
2.科学工作者研发了一种 SUNCAT 的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确 的是( ) A.过程 I 得到的 Li3N 中 N 元素为—3 价 B.过程Ⅱ生成 W 的反应为 Li3N+3H2O===3LiOH+NH3↑ C.过程Ⅲ中能量的转化形式为化学能转化为电能 D.过程Ⅲ涉及的反应为 4OH--4e-=O2↑+2H2O 【答案】C 【解析】A.Li3N 中锂元素的化合价为+1 价,根据化合物中各元素的代数和为 0 可知,N 元素的化合价为-3 价, A 项正确; B.由原理图可知,Li3N 与水反应生成氨气和 W,元素的化合价都无变化,W 为 LiOH,反应方程式:Li2N+3H2O =3LiOH+NH3↑,B 项正确; C.由原理图可知,过程Ⅲ为电解氢氧化锂生成锂单质、氧气和水,电能转化为化学能,C 项错误; D.过程Ⅲ电解 LiOH 产生 O2,阳极反应为 4OH--4e-=O2↑+2H2O,D 项正确。
3.热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致 NH3 产率降低。我国科研
1
人员研制了 Ti-H-Fe 双温区催化剂(Ti-H 区域和 Fe 区域的温度差可超过 100℃)。Ti-H-Fe 双温区催化合成氨的反 应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
2021届年高考第二轮热点专题训练24—无机框图题(word含答案版)
2021年高考第二轮热点专题训练24—无机框图题1.(2020海南卷)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。
化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式___________________________________________(2)写出E与A的氢化物反应生成A的化学方程式___________________________(3)写出一个由D生成B的化学方程式____________________________________;(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
2.(2020全国Ⅰ卷)V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。
它们之间的反应关系如下图:(1)5种化合物分别是V 、W 、X 、Y 、Z 。
(填化学式)(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是。
(3)V的电子式是。
3.(2020四川卷)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。
其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
请填写下列空白:(1)在周期表中,组成单质G的元素位于第______周期第______族。
高考化学人教一轮复习热点题型专练:无机框图推断(含解析)
高考化学人教一轮复习热点题型专练无机框图推断一选择题1、已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。
M与X的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )A.X使蔗糖变黑的现象主要体现了X的强氧化性B.若M为铁,则足量M与X在室温下即可完全反应C.若M为碳单质,P溶于水得到的酸的酸性比Q溶于水得到的酸的酸性强D.工业上,N转化为Q的反应条件为高温、常压、使用催化剂解析:X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,Q和水反应生成硫酸,则Q是三氧化硫,N和氧气反应生成三氧化硫,则N是二氧化硫。
X使蔗糖变黑的现象主要体现了X的脱水性,故A错误;若M是铁,常温下,铁与浓硫酸发生钝化现象,所以铁不能完全溶解,故B错误;若M是碳,浓硫酸和碳反应生成二氧化碳,对应的酸为碳酸,碳酸是弱酸,而三氧化硫与水反应生成硫酸,硫酸是强酸,所以若M为碳单质,P溶于水得到的酸的酸性比Q溶于水得到的酸的酸性弱,故C错误;工业上,二氧化硫转化为三氧化硫的反应条件为高温、常压、使用催化剂,故D正确。
答案:D2、由一气体甲开始,可发生如下四个变化:甲气体――→通过灼热的炭层乙气体――→通过灼热的炭层丙气体――→通过灼热的CuO乙气体――→通过石灰水丁固体,则甲、乙、丙、丁分别为( )A .CO 2、CO 、O 2、CaOB .O 2、CO 、CO 2、CaCO 3C .O 2、CO 2、CO 、CaCO 3D .CO 、CO 2、O 2、Ca(OH)2解析:分析流程图最终生成丁固体,丁为CaCO 3,丙气体具有还原性,则丙为CO ,故C 项正确。
答案:C3、A 、B 、C 、X 均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。
下列说法正确的是( )A.若X 为Fe ,则C 可能为Fe(NO 3)2溶液B.若X 为KOH 溶液,则A 可能为AlC.若A 、B 、C 均为焰色反应呈黄色的化合物,则X 一定为CO 2D.若X 为O 2,则A 可为有机物乙醇,也可为非金属单质硫解析 若A 为Al 、X 为KOH ,Al 与KOH 反应只能生成KAlO 2,B 项错误;若A 、B 、C 均为焰色反应呈黄色的化合物,则三者中都含有钠元素,则X 可能为CO 2、SO 2、H 2S 等,C 项错误;如果A 为S ,则S 与O 2反应只能生成SO 2,D 项错误。
高三化学无机框图题归纳总结
4. 在空气中变为红棕色: NO
(三)、特殊反应
·既能与酸反应,又能与碱反应的物质
(1)单质:Al (2)化合物: ①两性氧化物(Al2O3等) ②两性氢氧化物〔Al(OH)3〕 ③弱酸弱碱盐〔如:(NH4)2S〕 ④弱酸的酸式盐〔如NaHCO3、NaH2PO4〕 ⑤氨基酸
·与水反应产生气体的反应
碘水: 黄色
I2-CCl4:紫
(二):特殊反应现象
1.Fe(OH)2的氧化: 4Fe(OH)2+O2+2H2O=4Fe(OH)3
2.特殊颜色: 白色 → 灰绿 → 红褐
①Fe3+与苯酚 显紫色
,
②Fe3+与SCN- 显红色质(含苯环)与浓硝酸 显黄色 .
3.焰色反应: Na+(黄色)、K+(紫色)
它包含了5种化合物中的所有元素,生成该化合物的化学方程式
是 Ca(OH)2+2CO2===Ca(HCO3)2
。
2+
2-
(3)V的电子式是 Ca C C 。
一、无机框图题的主要特点
1. 低起点,高落点。即叙述简洁,完成起来难度大。 2. 知识覆盖面广。有可能一步推错,整题失分。 3.考题内容多为常见元素及其化合物知识,且常 有气体物质出现。“常见”是指短周期的元素。
(2)含氧酸盐热分解: 2NaHCO3=Na2CO3+CO2↑+H2O 2KMnO4=K2MnO4+MnO2+O2↑
(3)含氧酸分解:4HNO3=4NO2↑+O2↑+2H2O
·高温下的反应:
·置换反应 化合物A+单质B→化合物C+单质D
Fe+Cu2+=Fe2++Cu Cu+2Ag+=Cu2++2Ag
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常考点高考题——无机反应图象题
无机反应的图象是指两种无机物的反应中,随着某种量的增加而引起生成的沉淀量、气体量或溶液pH变化,以及相关计算量的图象,这是物质反应知识与坐标图的有机结合,缺一方面的知识都不能很好解题。
22.下列实验过程中产生的现象与对应的图形相符合的是( D )
A. NaHSO3粉末加入HNO3溶液中
B. H2S气体通入氯水中(03上海化学)
C. NaOH溶液滴入Ba(HCO3)2溶液中
D. CO2气体通入澄清石灰水中
15.将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是(02上海化学)( D )
A B C D
29.图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线。
试回答:(01上海综化)
OA段曲线和AB段曲线所表示的反应方程式是
OA:
AB :
A 点时已参加反应的CO 2和Ca (OH )2的物质的量之比为1比 。
B 处溶液中存在的浓度较大的两种离子是 和 。
(填离子符号)
将B 处生成的溶液煮沸,可见到的现象是 。
29. Ca (OH )2+CO 2 → CaCO 3↓+H 2O (1分)
CaCO 3+H 2O +CO 2 → Ca(HCO 3)2(1分) 1∶1 ;Ca 2+ ; -3HCO ;生成白色沉淀
31.已知Fe 2O 3在高炉中有下列反应:(01上海化学) Fe 2O 3+CO →2FeO +CO 2
反应形成的固体混合物(Fe 2O 3、FeO )中,元素铁和氧的质量比用 m Fe ︰m O 表示。
(1)上述固体混合物中,m Fe ︰m O 不可能是 (选填 a 、b 、c 多选扣分) (a )21︰9 (b )21︰7.5 (c ) 21︰6
(2)若m Fe ︰m O =21︰8,计算Fe 2O 3被CO 还原的百分率
(3)设Fe 2O 3被CO 还原的百分率为A %,则A %和混合物中m Fe ︰m O 的关系式为(用含m Fe 、m O 的代数式表示)。
A %=
请在下图中画出A %和O
Fe m m 关系的图形。
(4)如果 Fe 2O 3和CO 的反应分两步进行:
3Fe 2O 3+CO →2Fe 3O 4+CO 2
Fe 3O 4+CO →3FeO +CO 2
试分析反应形成的固体混合物可能的组成及相应的m Fe ︰m O (令m Fe ︰m O =21︰a ,写出a 的取值范围)。
将结果填入下表。
31.(1)a c
(2)解法一:取Fe 2O 3 m Fe ︰m O =21︰9 FeO m Fe ︰m O =21︰
6
解法二:设Fe 2O 3原有n 0 mol ,还原百分率为A %,则有 O Fe m m =162%163%)1(562000⨯⨯⨯+⨯⨯-⨯⨯⨯A n A n n =821 A %=3
1≈33.3% (3)3-O
Fe 7
m m
(4)Fe 2O 3 Fe 3O 4 8<a < 9 Fe 3O 4 FeO 6<a < 8 Fe 2O 3 Fe 3O 4 FeO 6<a <9。
