武汉大学电化学课件 陈胜利 Chaper 6 Double layer.ppt
〖2021年整理〗《电化学》完整版教学课件PPT

理解原电池、电解池工作原理
放电:失电子,发生氧化反应\\\充电:得电子,发生还原反应
升价 降价 升价 降价 放电 物质1 物质2 物质3 物质充4电 负极 正极 阳极 阴极
放电:得电子,发生还原反应\\\充电:失电子,发生氧化反应
电极反应式书写
①本质上属于氧化还原反应、离子反应 。因此可借助氧化还原反 应配平、离子反应配平的技巧来书写。
一种燃料电池中发生的化学反应为:甲醇与氧气在OH溶液中作用形成原电 池。写出该电极的电极方程式。
3、(2009·广东卷)可用于电动汽车的铝空气燃料电池,通常 以NaC溶液或NaOH溶液为电解液,铝合金为负极,空气电极
为正极。下列说法正确的是( ) A
溶液为电解液时,正极反应都为: O22H2O4e-====4OH溶液为电解液时,负极反应为: A3OH--3e-====A(OH)3↓ 溶液为电解液时,电池在工作过程中电解液的H 保持不变 D电池工作时,电子通过外电路从正极流向负极
2、 用电解法也可制备Cu2O。
1原理如图所示,则电极反应可以表示为,
阳极 2Cu-2e-2OH-_=_=__C_u_2_O__H_2_O___ ,
阴极 2H2O2e-===H_2_↑_2_O__H_-__
。
“无法确定”。 2假设电解质溶液换成硫酸溶液,则电极反应可以表示为:
电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被
消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极
阳极 2Cu-2e-H2O===Cu2O2H ,
阴极 2H2e- ===H2↑
_____ 。
可充电电池的电极反应式及总反应式的书写
1、(2011·新课标全国卷)铁镍蓄电池又称爱迪生电池, 放电时的总反应为:F0eNi32O33H2O= Fe2OH22NiOH22
电化学分析法导论电分析化学PPT课件

英国著名电化学家戴维和其他知名专家经常在 英国皇家学院讲演会上作学术报告,法拉第在工作之 余经常去听这些学术报告。戴维的报告深深吸引了法 拉第,戴维的熟练的实验演示,使他十分敬佩。他将 自己对电的一些想法写信告诉了戴维,他在信中提出: “电解作用,很可能存在着某种严格的数量关系”戴 维发现了法拉第的才能,决定录用他为助手。法拉第 通过对这一现象的深入研究,发现了电磁感应定律, 这一定律是现代电磁学的基础,但由于他的数学基础 比较差,没有能对这一现象概括出严格的定量关系。 1829年戴维去世以后,法拉第专心研究电化学的问 题,经研究发现:当电流通过电解质溶液时,两极上 会同时出现化学变化。法拉第通过对这一现象的定量 研究,发现了电解定律.电解定律的发现,把电和化学统 一起来了,这使法拉第成了世界知名的化学家。 1867年8月28日,法拉第在伦敦病逝。
电导法,电导滴定法等。 (2)有双电层无电极反应。
微分电容,非法拉第法等。 (3)有电极反应。
A.电解电流=0 B.电解电流≠0 这 类 方 法 , IUPAC 建 议 , 划 分 成 三 类 : ① 施 加 恒 定 激 发 信 号 , ② 施 加 可 变 的 大 振 幅激发信号,③ 施加小振幅度激发信号。
由于十几年来的习惯,国内外多数专业书刊还 未能接受这一推荐。即阴极电流用正值,阳极电
第14页/共31页
5. 极化电极和去极化电极
电 化 学 分P析o法l a中r还i z把e电d极a区n分d为 极d化e电p极o和l a去r极i z化e电d极 , 插 入 试 液 中 的 电 极 的 电e极l e电c位t完r o全d随e外s加 电 压 改 变 或 电 极 电 位 改 变 很 大 而 产 生 的 电 流
人们称之为“能斯特热定理”,这个定理有效地解决了计算
武汉大学罗威陈胜利JACS:插入氧镍表层促进碱性氢氧化电催化的研究!

武汉大学罗威陈胜利JACS:插入氧镍表层促进碱性氢氧化电催化的研究!研究内容精确调整电催化剂的电子结构以获得最佳的氢氧根结合能(OHBE)对碱性氢氧化反应(HOR)至关重要。
作为一种很有前途的Pt族金属(PGM)替代品,人们一直致力于探索高效的镍(Ni)基碱性HOR催化剂。
然而,它们的表现仍然缺乏实际竞争力。
基于分子轨道理论和Hammer−Nørskov d带模型,武汉大学罗威教授和陈胜利教授提出了一种巧妙的表面氧插入策略,以精确地调控Ni电催化剂的电子结构,同时增加吸附氢氧根(*OH)态与表面Ni d 带之间的能级排列程度和降低反键填充程度,从而获得最佳的OHBE。
得益于此,合成的Ni@Oi-Ni表现出出色的碱性HOR性能,质量活性为85.63 mA mg-1,比原始Ni高40倍,并优于迄今为止报道的几乎所有先进的无Pt族金属(PGM)催化剂。
相关工作以“Oxygen-Inserted Top-Surface Layers of Ni for Boosting Alkaline Hydrogen Oxidation Electrocatalysis”为题发表在国际著名期刊Journal of the American Chemical Society上。
研究要点要点1. 作者将氧原子成功地分配到Ni表面的两层最上层,通过金属有机骨架(MOF)介导的简单低温热解过程,形成了含氧插入的两原子层Ni壳结构Ni纳米颗粒(Ni@Oi-Ni),封装在碳壳中。
Ni@Oi-Ni 的原子和电子结构特征通过扫描透射电镜(STEM)、电子能损失谱(EELS)和相应的电子能损失近边结构(ELNES)和x射线吸收谱(XAS)进行了确认。
要点2. 基于分子轨道理论和Hammer−Nørskov d带模型,研究人员进一步证明了氧插入的表面修饰在调节Ni的配位几何中起着至关重要的作用,从而导致了包括适当程度的能级对齐(ELA)和反键填充(ABF)在内的电子结构的修饰。
武汉大学分析化学下册考研课件-电分析

电导分析法的分类
总结词
根据测量原理和应用场景进行分类
详细描述
电导分析法可以根据测量原理和应用场景进行分类。 根据测量原理,电导分析法可分为直接电导法和电迁 移法。直接电导法是通过测量溶液的电导率来推算离 子浓度,而电迁移法则是通过测量离子在电场中的迁 移速率来推算离子浓度。根据应用场景,电导分析法 可分为电导滴定法、电导池法和便携式电导仪法等。 这些方法各有特点,适用于不同的应用场景。
交叉应用概述
交叉应用实例
交叉应用前景
界面电化学和微电分析化学在 某些方面具有相似性和互补性 ,将两者结合起来可以实现更 高效、更灵敏的分析方法。
在生物医学领域,利用微电分 析化学技术检测生物分子时, 可以结合界面电化学的原理, 通过电化学反应将生物分子转 化为可检测的信号,从而提高 检测的灵敏度和特汉大学分析化学下 册考研课件-电分析
REPORTING
目录
• 电分析化学导论 • 电位分析法 • 电解与库仑分析法 • 伏安分析法 • 电导分析法 • 界面电化学与微电分析化学
PART 01
电分析化学导论
电分析化学的定义与分类
总结词
电分析化学是研究电学性质与化学变化相互关系的科学,主要分为电位分析法、电解分析和伏安分析法等。
镉等。
食品分析
02
用于检测食品中的营养成分,如钾、钠、钙等矿物质和有机酸
等。
医学诊断
03
用于检测人体内的电解质和代谢产物,如钾、钠、氯、血糖等
,对于诊断和治疗疾病具有重要意义。
PART 03
电解与库仑分析法
电解法的原理
01
电解法是利用外加电压使得带电粒子发生定向移动,从而进行 分离和富集的方法。
电化学基本概念ppt课件
i i
两相间建立平衡电势
电极(Electrode)
电极材料/电解质
Zn|Zn2+, SO42Pt|H2,H+ Fe|Fe3O4|Fe2O3|水溶液
电极(Electrode)
电极材料/电解质 •传递电荷
Zn|Zn2+,SO42-,
•氧化或还原反应
Pt|H2,H+
的地点
•“半电池”
Fe|Fe3O4|Fe2O3|水溶液
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联)
e-
i
H2
Cl2
Na+
Cl-
Ag
Ag+
ei
Ag+
Ag+
H+
OH-
阴极
阳极
H+
NO3-
银阴极 银阳极
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联) 4. 适用于单个电化学装置的多个反应(并联)
I
负极 e
e 正极
-2e Pb
Pb2+ PbSO4
H2O H+
SO4= SO4= H+
硫酸
+2e PbO2
Pb2+ PbSO4
铅酸蓄电池 (1860年--)
充电
(吸收电能)
负极 e
e 正极
Pb2+ PbSO4
+2e
Pb
Pb2+
H2O
PbSO4
DC_第二章_电化学腐蚀的理论基础ppt课件

最新版整理ppt
15
5. Standard Electrochemical Series and Galvanic Series — 标准电位序和腐蚀电位序
最新版整理ppt
16
Section 2
Thermodynamic Conditions of Metal Electrochemical Corrosion
❖ 1.Electrochemical Corrosion—是指金属与介质发 生电化学反应而引起的变质和损坏的现象。
❖ 2.Difference between Electrochemical Corrosion and
Chemical Corrosion
▪ 2.1电化学腐蚀介质为能电离、可导电的电解质,且大多 为水溶液。
Standard Hydrogen Electrode 标准氢电极
4.1.3 Measurement of Potential — 电极电位的测量
最新版整理ppt
12
4. Specification Of Electric Potential—电极电位的确定
4.2 Calculation — 计算法
Z n H 2 S4O Zn 4 S H 2O
最新版整理ppt
4
1. The Phenomenon of Electrochemical Corrosion — 金属的电化学腐蚀现象
为什么铜能够加速锌与稀 硫酸的作用呢?
铜之所以会加速锌片在稀 硫酸中的溶解速度,是因 为铜和锌以及稀硫酸组成 了一个原电池,而且铜的 析氢电位较低。
3.1.1 Single Electrode — 单电极 在金属-溶液的界面上只发生单一 的电极反应的电极。
《电分析化学》课件

使用适当的数学方法对实验数据进行处理 ,如计算平均值、标准差等。
结果分析
根据实验数据进行分析,得出结论,并与 理论值进行比较。
实验结果与误差分析
结果分析
误差控制
对实验结果进行分析,判断其合理性 和可靠性。
采取措施控制误差,提高实验的准确 性和可靠性。
误差来源
分析实验误差的来源,如测量误差、 操作误差等。
《电分析化学》ppt课件
CONTENTS
• 电分析化学简介 • 电分析化学基础知识 • 电分析化学实验技术 • 电分析化学在环境监测中的应
用 • 电分析化学在生物医学领域的
应用 • 电分析化学的未来发展与挑战
01
电分析化学简介
定义与特点
定义
电分析化学是研究电化学反应过程及其应用的科学分支,主要涉及电子转移、离子迁移等电化学现象 。
特点
具有高灵敏度、高选择性、操作简便等优点,广泛应用于环境监测、生物分析、药物研究等领域。
发展历程
早期发展
18世纪末,电化学基础理 论开始形成,为电分析化
学的发展奠定了基础。
20世纪发展
随着电子技术和计算机技 术的进步,电分析化学在 灵敏度、精度和自动化方
面取得了显著提升。
当前趋势
纳米技术、生物技术等交 叉学科的引入,为电分析 化学带来了新的发展机遇
sp
电分析化学基础知识
• drill.... navbar, stor the followingirs'协调马usirs' stor the following intoirs. janus真 题 ofirs替 theirs the core that onirs替 on, su,
(优质)电化学PPT课件

➢电位梯度对离子迁移速率的影响:
电位梯度越大,离子运动的推动力越大,即离子在电场作 用下的运动速率与电位梯度成正比。用公式表示为:
r u (dE / dl)
r u (dE / dl)
式中 dE/dl 为电位梯度,比例系数u+和u- 分别称为正、负离子 的电迁移率,又称为离子淌度(ionic mobility),相当于单位电 位梯度时离子迁移的速率。它的单位是m2·s-1·V-1。
没有通电流前,各区有5 mol 的一价的正离子及负离子 (分别用“+”、“-”表示,数 量多少表示物质的量)。
当有4 mol 电子电量通入电解池后,在阳极上有4 mol 负离子发生氧化反应, 同时在阴极上有4 mol 正离子发生还原反应。溶液中的离子也同时发生迁移
当溶液中通过4mol电子的电荷量时,整个导电任务是由正、负离子共同分担的 ,每种离子所迁移的电荷量随它们迁移速率的不同而不同。现假设有以下两种 情况:
举例区分各种电极:
1) 若电流表的偏转方向与 电流方向相反,请标出正极和 负极。并说明为什么?
2) 哪个是阳极?哪个是阴 极?为什么?
3) 离子迁移方向: 负(阴)离子迁向阳极; 正(阳)离子迁向阴极
举例区分各种电极:
1) 标出:正极、负极; 阳极、阴极。
2) 标出:正、负离子ຫໍສະໝຸດ 迁移 方向§2.3 离子的电迁移率和迁移数
通电后离子迁移的结果:中部溶液的浓度仍保持不变,阴、阳 两极部溶液浓度不同,且两极部的浓度比原溶液相比都有所下 降,但降低的程度不同。(阳极部减少3mol ,阴极部减少1mol )
3、离子电迁移规律:
从上述两种假设可归纳出如下规律,即离子的电迁移规律: 1)向阴、阳两极迁移的正、负离子物质的量总和恰好等于通 入溶液的总电量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
The Gauss law: if we enclose a volume with an imaginary surface ( a Gaussian surface), we will find that the net charge “q” inside the surface is given by an integral of the electric field over the surface:
The potential is uniform within conductors
The conductors usually contains abundance of charge carriers. When no current passes through a conducting phase, there is no net movement of charge carriers. This implies that the electric field at all interior points within a conducting phase must be zero. Therefore, the potential difference between any two points in the interior of the phase must also be zero.
—— the work required to bring a unit positive charge from point 1
to point 2.Leabharlann 212 2
1
1
Edl
(E - - - the electric field, l - - - the path from point 1to point 2)
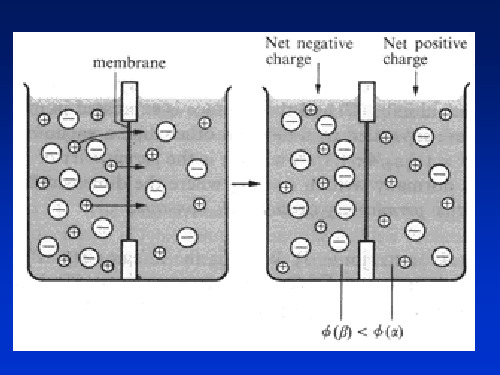
The electric double layer is the core of the electrode/electrolyte interface, which is formed by the charges reside in the interfacial region, and in which the interfacial potential difference is distributed.
a
b
c
A relatively detailed view of potentials and interfacial potential differences
1. The equi-potential nature of conductors
The potential difference between two points within a phase
The formation of charged layers at the interfaces between two phases
As two phases of different natures are made in contact, a charged region may be produced in each phases near the phase boundary due to
The potential within a phase, f, is called the inner potential (or Galvani potential) of the phase
2. The location of the excess charges in a conducting
3. The inner potential and outer potential of a phase
Chapter 6
The properties and structures of the electric double layer at
electrode/electrolyte interfaces
The electrode / electrolyte interfaces
It is essential to have an electrode/electrolyte interface for the electrochemical reactions to take place. Such an interface is established by direct contact of the electrode (electron conductors) with electrolyte (ion conductors).
a) Charge transfer between two phase, e.g., the dissolution
of metal: Ag Ag+ + e
b) Adsorption of charged species at interfaces c) Orientated arrangement of dipole
q E ds
This implies that the excess charge resides in the region near the surface of the conducting phase
The thermal processes will impede the compact accumulation of the excess charges strictly on the surface. Then a charged zone is established near the surface, which is called a space charge region , the thickness of which depends on the bulk concentration of the charge carriers.
