九年级酸和碱化学方程式小结
酸碱盐等化学方程式汇总

酸碱盐等化学方程式汇总酸碱盐是化学中常见的三类物质,每一类物质都具有特定的性质和反应方式。
在这篇文章中,我将为您提供酸碱盐等化学方程式的汇总,希望对您的学习有所帮助。
一、酸的化学方程式:1.酸与水的反应:酸+水→酸溶液例如:HCl+H2O→H3O++Cl-2.酸与金属的反应:酸+金属→相应盐+氢气例如:2HCl+Zn→ZnCl2+H23.酸与碱的反应:酸+碱→相应盐+水例如:HCl+NaOH→NaCl+H2O4.酸与碱式盐的反应:酸+碱式盐→相应盐+水例如:HCl+NaHCO3→NaCl+H2O+CO25.酸与碱式氢氧化物的反应:酸+碱式氢氧化物→相应盐+水例如:HCl+Cu(OH)2→CuCl2+H2O二、碱的化学方程式:1.碱与水的反应:碱+水→非金属氢氧化物例如:NaOH+H2O→Na++OH-+H2O2.碱与酸的反应:碱+酸→相应盐+水例如:NaOH+HCl→NaCl+H2O3.碱与金属的反应:碱+金属→相应盐+氢气例如:2NaOH+Zn→Na2ZnO2+H24.碱与酸式盐的反应:碱+酸式盐→相应盐+酸例如:NaOH+NaHCO3→Na2CO3+H2O+CO25.碱与酸式氢氧化物的反应:碱+酸式氢氧化物→相应盐+酸+水例如:2NaOH+Cu(OH)2→Na2[Cu(OH)4]+H2O三、盐的化学方程式:1.酸与碱的反应:酸+碱→相应盐+水例如:HCl+NaOH→NaCl+H2O2.酸与碱式盐的反应:酸+碱式盐→相应盐+水例如:HCl+NaHCO3→NaCl+H2O+CO23.酸与碱式氢氧化物的反应:酸+碱式氢氧化物→相应盐+水例如:HCl+Cu(OH)2→CuCl2+H2O四、酸碱盐反应中的氧化还原反应方程式:1.酸与金属的反应:酸+金属→相应盐+氢气例如:2HCl+Zn→ZnCl2+H22.酸与非金属氢氧化物的反应:酸+非金属氢氧化物→相应盐+水例如:HCl+Cu(OH)2→CuCl2+H2O3.酸与非金属氧化物的反应:酸+非金属氧化物→相应盐+水例如:H2SO4+CaO→CaSO4+H2O总结:本文汇总了酸、碱和盐的化学方程式,涵盖了酸与水、酸与金属、酸与碱、酸与碱式盐、酸与碱式氢氧化物的反应,以及碱与水、碱与酸、碱与金属、碱与酸式盐、碱与酸式氢氧化物的反应,还包括酸碱盐反应中的氧化还原反应方程式。
人教版九年级化学下册第十单元课题一常见的酸和碱知识点总结笔记

第十单元酸和碱课题一、常见的酸和碱一、酸、碱、盐的组成及其电离方程式:1、【酸==H++酸根离子】如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)、CH3COOH(醋酸,又名乙酸)、碳酸(H2C O3) HCl = H+ + Cl-,H2SO4 = 2H+ + SO42-HNO3 = H+ + NO3-H 2C O3= 2H+ + C O32-CH3COOH = CH3COO-+ H+2、【碱==金属阳离子/ NH4++ OH-】如:KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)KOH = K++ OH-NaOH = Na++ OH-Ca(OH)2= Ca2++ 2OH-Ba(OH)2 = Ba2++ 2 OH-NH3·H2O=NH4++ OH-3、【盐==金属阳离子/ NH4++酸根离子】如:氯化钠NaCl、碳酸钠Na2CO3、硫酸铜CuSO4硝酸钡Ba(NO3)2 硫酸铵(NH4)2SO4 硫酸铁Fe2(SO4)3NaCl = Na++Cl-Na2CO3 =2Na++CO32-CuSO4 =Cu2++ SO42-Ba(NO3)2 = Ba2++2NO3-(NH4)2SO4 = 2NH4+ + SO42- Fe2(SO4)3= 2Fe3++ 3SO42-【小结:因为酸、碱、盐的水溶液都能离解成自由移动的阴、阳离子,所以它们的水溶液都能导电】二、酸碱指示剂●定义:像石蕊、酚酞溶液一样能跟酸或碱的溶液起作用而显示不同颜色的物质叫做酸碱指示剂。
●在氨分子运动、CO2与水的反应等实验探究中我们分别用过紫色石蕊溶液和无色酚酞溶液。
●某些植物的花瓣或果实(如牵牛花、月季花、紫卷心菜等)也可用作酸碱指示剂。
●紫色石蕊溶液遇酸溶液(含H+)变红,遇碱溶液(含OH-)变蓝,在中性溶液中呈紫色。
无色酚酞溶液遇酸溶液不变色,在中性溶液中不变色,遇碱溶液变红。
九年级科学酸、碱、盐化学方程式总结

2019年九年级科学酸、碱、盐化学方程式总结一、金属单质 + 酸 -------- 盐 + 氢气(置换反应)1. 锌和稀硫酸Zn+H2SO4==ZnSO4+H2↑2. 铁和稀硫酸Fe+H2SO4==FeSO4+H2↑3. 镁和稀硫酸Mg+H2SO4==MgSO4+H2↑4. 铝和稀硫酸2Al+3H2SO4==Al2(SO4)3+3H2↑5. 锌和稀盐酸Zn+2HCl==ZnCl2+H2↑6. 铁和稀盐酸Fe+2HCl==FeCl2+H2↑7. 镁和稀盐酸Mg+2HCl==MgCl2+H2↑8. 铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑二、金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐1. 铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu2. 锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu3. 铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg三、碱性氧化物 +酸 -------- 盐 + 水1. 氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O2. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O3. 氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O4. 氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O5. 氧化镁和稀硫酸反应:MgO+H2SO4==MgSO4+H2O6. 氧化钙和稀盐酸反应:CaO+2HCl==CaCl2+H2O四、酸性氧化物 +碱 -------- 盐 + 水1.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O2.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O3.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O4.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O5. 消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O五、酸 + 碱 -------- 盐 + 水1.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O2. 盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O3.盐酸和氢氧化铜反应:2HCl+Cu(OH)2==CuCl2+2H2O4. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O5. 盐酸和氢氧化铁反应:3HCl+Fe(OH)3==FeCl3+3H2O6.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O7.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O8.硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O9.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2==CuSO4+2H2O10.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O11.硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O六、酸 + 盐 -------- 另一种酸 + 另一种盐1.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑2.碳酸钠与稀盐酸反应: Na2CO3+2HCl==2NaCl+H2O+CO2↑3.碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑4.盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO35. 硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑6.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl七、碱 + 盐 -------- 另一种碱 + 另一种盐1.氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓+Na2SO42.氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3↓+3NaCl3.氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓+2NaCl4. 氢氧化钠与氯化铜:2NaOH+CuCl2==Cu(OH)2↓+2NaCl5. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH八、盐 + 盐 ----- 两种新盐1.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO32.硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl九、熟记下列反应方程式:(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
九年级化学全册 第7单元 常见的酸和碱基础知识总结与应用 鲁教版
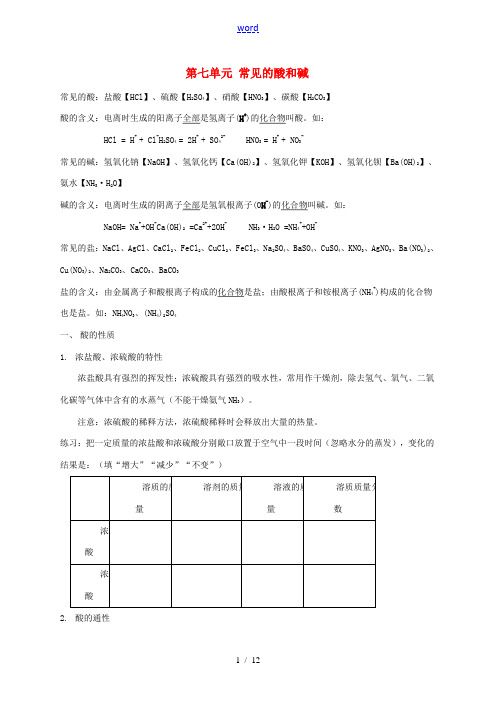
第七单元常见的酸和碱常见的酸:盐酸【HCl】、硫酸【H2SO4】、硝酸【HNO3】、碳酸【H2CO3】酸的含义:电离时生成的阳离子全部是氢离子(H+)的化合物叫酸。
如:HCl = H+ + Cl-H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3-常见的碱:氢氧化钠【NaOH】、氢氧化钙【Ca(OH)2】、氢氧化钾【KOH】、氢氧化钡【Ba(OH)2】、氨水【NH3·H2O】碱的含义:电离时生成的阴离子全部是氢氧根离子(O H-)的化合物叫碱。
如:NaOH= Na++OH-Ca(OH)2 =Ca2++2OH- NH3·H2O =NH4++OH-常见的盐:NaCl、AgCl、CaCl2、FeCl2、CuCl2、FeCl3、Na2SO4、BaSO4、CuSO4、KNO3、AgNO3、Ba(NO3)2、Cu(NO3)2、Na2CO3、CaCO3、BaCO3盐的含义:由金属离子和酸根离子构成的化合物是盐;由酸根离子和铵根离子(NH4+)构成的化合物也是盐。
如:NH4NO3、(NH4)2SO4一、酸的性质1.浓盐酸、浓硫酸的特性浓盐酸具有强烈的挥发性;浓硫酸具有强烈的吸水性,常用作干燥剂,除去氢气、氧气、二氧化碳等气体中含有的水蒸气(不能干燥氨气NH3)。
注意:浓硫酸的稀释方法,浓硫酸稀释时会释放出大量的热量。
练习:把一定质量的浓盐酸和浓硫酸分别敞口放置于空气中一段时间(忽略水分的蒸发),变化的结果是:(填“增大”“减少”“不变”)2.酸的通性⑴酸溶液能使紫色的石蕊溶液变红,不能使无色的酚酞溶液变色。
⑵酸+金属→盐+氢气Fe+2HCl=FeCl2+H2↑ Mg+2HCl=MgCl2+H2↑Zn+H2SO4=ZnSO4+H2↑ 2Al+3H2SO4=Al2(SO4)3+3H2↑要求:能够熟练写出镁、锌、铁、铝分别与稀盐酸、稀硫酸反应的化学方程式,并叙述实验现象。
注意:氯化亚铁的溶液是浅绿色。
酸和碱的化学性质及化学方程式

酸和碱的化学性质及化学方程式金属+酸→盐+氢气Zn+2HCl=ZnCl2+H2↑Zn+H2SO4=ZnSO4+H2↑碱性氧化物+酸→盐+水Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O 碱+酸→盐+水NaOH+HCl=NaCl+H2OCu(OH)2+H2SO4=CuSO4+2H2O 盐+酸→另一种盐+另一种酸AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓+2HCl酸性氧化物+碱→盐+水2NaOH+CO2=Na2CO3+H2OCa(OH)2+CO2=CaCO3↓+H2O酸+碱→盐+水NaOH+HCl=NaCl+H2OCa(OH)2+H2SO4=CaSO4+2H2O 盐+碱→另一种盐+另一种碱2NaOH+CuSO4=Na2SO4+Cu(OH)2↓Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 盐溶液+金属→盐ˊ+金属ˊCuSO4+Zn=ZnSO4+Cu盐+酸→盐ˊ+酸ˊBaCl2+H2SO4=BaSO4↓+2HCl盐溶液+碱溶液→盐ˊ+碱ˊ3NaOH+FeCl3=3NaCl+Fe(OH)3↓盐溶液+盐溶液→盐ˊ+盐ˊAgNO3+NaCl=AgCl↓+NaNO3AgNO3+KCl=AgCl↓+KNO3Ba(NO3)2+H2SO4=BaSO4↓+2HNO3K2CO3+2HCl=2KCl+CO2↑+H2OCO2+Ca(OH)2=CaCO3↓+H2O糟糕它不认识表格你用下面的那个吧没表格的(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸+碱=盐+水。
(3)酸+某些金属氧化物=盐+水。
(4)酸+活泼金属=盐+氢气。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反应:Zn+2HCl=ZnCl2+H2↑有气泡产生,锌粒逐渐减少。
2、锌跟稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑3、铁跟稀盐酸反应:Fe+2HCl=FeCl2+H2↑有气泡产生,铁逐渐减少,4、铁跟稀硫酸反应:Fe+H2SO4=FeSO4+H2↑溶液变成浅绿色。
九年级化学各单元化学方程式汇总

化学方程式是描述化学反应的符号式表示方法,可以表示反应物和生成物之间的关系。
九年级化学主要包括酸碱中和、金属与非金属的反应、氧化与还原反应、浓度溶液的配制和稀释等单元。
以下是九年级化学各单元的化学方程式汇总。
一、酸碱中和反应1.酸和碱的中和反应HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)2.酸性氧化物和碱性氧化物的反应SO2(g) + 2NaOH(aq) → Na2SO3(aq) + H2O(l)CO2(g) + 2NaOH(aq) → Na2CO3(aq) + H2O(l)二、金属与非金属的反应1.金属与酸的反应2HCl(aq) + Zn(s) → ZnCl2(aq) + H2(g)2HNO3(aq) + 3Cu(s) → 3Cu(NO3)2(aq) + 2NO(g) + H2O(l)2.金属与非金属氧化物的反应Cu(s) + 2AgNO3(aq) → Cu(NO3)2(aq) + 2Ag(s)Ca(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g)三、氧化与还原反应1.金属的氧化反应2Mg(s)+O2(g)→2MgO(s)4Al(s)+3O2(g)→2Al2O3(s)2.金属的还原反应2Ag2O(s)→4Ag(s)+O2(g)CuO(s)+H2(g)→Cu(s)+H2O(l)四、浓度溶液的配制和稀释1.溶质的质量计算C1V1=C2V22.液体体积和浓度的计算C=n/V3.溶质溶解效应的计算m1V1+m2V2=(m1+m2)V'以上几个单元的化学方程式只是其中的一部分,涵盖了九年级化学的主要内容。
通过学习这些方程式,我们可以理解化学反应的基本原理和变化过程,掌握化学方程式的书写和计算方法。
同时,需要注意的是,化学方程式在实际应用中还有很多其他的变化和反应方式,不同的实验条件和反应物也会影响方程式的形式和系数。
酸和碱的化学方程式

酸和碱的化学方程式复分解反应:(1)碱性氧化物+酸→盐+H2OFe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2OCuO+H2SO4==CuSO4+H2O ZnO+2HNO3==Zn(NO3)3+H2O(2)碱+酸→盐+H2OCu(OH)2+2HCl==CuCl2+2H2O Cu(OH)2+H2SO4==CuSO4+2H2ONaOH+HCl==NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2ONaOH+HNO3==NaNO3+H2O Mg(OH)2+2HNO3==Mg(NO3)2+2H2OBa(OH)2+H2SO4==BaSO4↓+2H2O(3)酸+盐→新盐+新酸CaCO3+2HCl==CaCl2+H2O+CO2↑ Na2CO3+2HCl==2NaCl+H2O+CO2↑HCl+AgNO3==AgCl↓+HNO3 H2SO4+BaCl2==BaSO4↓+2HClBa(NO3)2+H2SO4==BaSO4↓+2HNO3NaHCO3+HCl==NaCl+H2O+CO2↑(4)盐1+盐2→新盐1+新盐2KCl+AgNO3==AgCl↓+KNO3 NaCl+AgNO3==AgCl↓+NaNO3Na2SO4+BaCl2==BaSO4↓+2NaCl BaCl2+2AgNO3==2AgCl↓+Ba(NO3)2 (5)盐+碱→新盐+新碱CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 FeCl3+3NaOH==Fe(OH)3↓+3NaCl Ca(OH)2+Na2CO3==CaCO3↓+2NaOH NaOH+NH4Cl==NaCl+NH3↑+H2O 其它反应:1、二氧化碳通入澄清石灰水:CO2 +Ca(OH)2 ==CaCO3↓+ H20现象:澄清石灰水变浑浊.(用澄清石灰水可以检验CO2,也可以用CO2检验石灰水)2、氢氧化钙和二氧化硫反应:SO2 +Ca(OH)2 ==CaSO3+ H203、氢氧化钙和三氧化硫反应:SO3 +Ca(OH)2 ==CaSO4+ H204、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O5、氢氧化钠和二氧化硫反应(除去二氧化硫):2NaOH + SO2 ==== Na2SO3 + H2O6、氢氧化钠和三氧化硫反应(除去三氧化硫):2NaOH + SO3 ==== Na2SO4 + H2O注意:1-6都是:酸性氧化物 +碱 -------- 盐 + 水。
九上全部化学方程式总结

九上全部化学方程式总结化学方程式是描述化学反应过程的符号表示方法。
在九年级的化学学习中,学生主要学习了酸碱中和反应、氧化还原反应、还原反应以及金属活动性等方面的知识。
下面将对九年级全部化学方程式进行总结。
一、酸碱中和反应:1.酸和碱反应生成盐和水的反应:HCl + NaOH → NaCl + H₂OH₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O2HNO₃ + Ca(OH)₂ → Ca(NO₃)₂ + 2H₂O2.酸和金属碱反应生成盐和水的反应:HCl + NaOH → NaCl + H₂OHNO₃ + KOH → KNO₃ + H₂OH₂SO₄ + 2KOH → K₂SO₄ + 2H₂O二、氧化还原反应:1.金属和非金属元素的氧化反应:2Mg + O₂ → 2MgO2Na + Cl₂ → 2NaClCa + S → CaS2.金属和酸的反应:Zn + 2HCl → ZnCl₂ + H₂Mg + 2HNO₃ → Mg(NO₃)₂ + H₂O + NO₂3.金属和盐酸的反应:Mg + 2HCl → MgCl₂ + H₂Zn + HCl → ZnCl₂ + H₂4.单质和氧气的反应:C + O₂ → CO₂S + O₂ → SO₂2Fe + 3O₂ → 2Fe₂O₃5.金属和非金属氧化物的反应:Na₂O + H₂O → 2NaOHMgO + H₂O → Mg(OH)₂CaO + H₂O → Ca(OH)₂三、还原反应:1.金属氧化物还原反应:2Na + 2H₂O → 2NaOH + H₂2Al + 3H₂O → Al₂O₃ + 3H₂2Zn + O₂ → 2ZnO2.金属酸还原反应:Zn + H₂SO₄ → ZnSO₄ + H₂3Fe + 4H₂SO₄ → 3Fe₂(SO₄)₃ + 4H₂O + SO₂3.单质还原反应:C + 2H₂O → CO₂ + 2H₂S + 2H₂O → H₂S + H₂SO₄四、金属活动性:1.金属置换反应:Zn + CuSO₄ → ZnSO₄ + CuMg + FeSO₄ → MgSO₄ + FeFe + Zn(NO₃)₂ → Fe(NO₃)₂ + Zn2.金属和酸的反应:Zn + 2HCl → ZnCl₂ + H₂Mg + 2HNO₃ → Mg(NO₃)₂ + H₂O + NO₂以上是九年级化学学习中的一些常见化学方程式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学-化学方程式整理小结
三、碱+(某些)非金属氧化物== 盐+水
13、二氧化碳通入澄清石灰水:CO2 + Ca(OH)2 == CaCO3↓+ H2O;
14、二氧化碳与氢氧化钠:CO2 +2NaOH == Na2CO3 + H2O
15、二氧化硫与氢氧化钠溶液:SO2 +2NaOH == Na2SO3 + H2O
16、三氧化硫与氢氧化钠溶液:SO3 +2NaOH == Na2SO4 + H2O
四、酸+金属==盐+氢气
17、铝与盐酸反应制氢气:2Al + 6HCl == 2AlCl3 + 3H2↑;
18、铝与盐酸、硫酸反应制氢气:2Al + 3H2SO4 == Al2(SO4)3 + 3H2↑
19、镁与盐酸、硫酸反应制氢气:Mg + 2HCl == MgCl2 + H2↑;Mg + H2SO4 == MgSO4 + H2↑
20、铁与盐酸、硫酸反应制氢气:Fe + 2HCl == FeCl2 + H2↑;Fe + H2SO4 == FeSO4 + H2↑
浅绿色浅绿色
21、锌与盐酸、硫酸反应制氢气:Zn + 2HCl == ZnCl2 + H2↑;Zn + H2SO4 == ZnSO4 + H2↑
五、其他
22.生石灰与水反应:CaO + H2O == Ca(OH)2
23、实验室制二氧化碳:CaCO3 + 2HCl == CaCl2 + CO2↑+ H2O;
24、泡沫灭火器原理:Na2CO3 + 2HCl == 2NaCl+ CO2↑+ H2O
六、俗名与化学式
1、生石灰:CaO 5、盐酸:HCl
2、熟石灰、消石灰:Ca(OH)2 6、纯碱:Na2CO3
3、火碱、烧碱、苛性钠:NaOH 7、醋酸:CH3COOH
4、石灰石、大理石、鸡蛋壳:CaCO3
一、酸+ 碱== 盐+水
1、氢氧化钠与稀盐酸:NaOH + HCl == NaCl + H2O;
2、氢氧化钠与稀硫酸:2 NaOH + H2SO4 == Na2SO4+ 2H2O
3、氢氧化钙溶液与稀硫酸:Ca(OH)2 + H2SO4 == CaSO4 + 2H2O
4、石灰水与稀盐酸:Ca(OH)2 + 2HCl == CaCl2 +2H2O
5、氢氧化镁中和胃酸过多:Mg(OH)2 + 2HCl == MgCl2 +2H2O
6、用氢氧化铝中和胃酸过多:Al(OH)3 + 3HCl == AlCl3 +3H2O
7、氢氧化铜与稀硫酸:Cu(OH)2 + H2SO4 == CuSO4↓ + 2H2O
二、酸+(某些)金属氧化物== 盐+水
8、.盐酸除铁锈:Fe2O3 + 6HCl == 2FeCl3 + 3H2O;
红色黄色
9、硫酸除铁锈:Fe2O3 + 3H2SO4 == Fe 2(SO4)3 + 3H2O
10、氧化铜与稀硫酸:CuO + H2SO4 == CuSO4 + H2O
黑色蓝色
11、氧化铜与稀盐酸:CuO + 2HCl == CuCl2 + H2O;
12、氧化钙与稀盐酸:CaO + 2HCl == CaCl2 + H2O;
一、酸+ 碱== +
1、氢氧化钠与稀盐酸:
2、氢氧化钠与稀硫酸:
3、氢氧化钙溶液与稀硫酸:
4、石灰水与稀盐酸:
5、氢氧化镁中和胃酸过多:
6、用氢氧化铝中和胃酸过多:
7、氢氧化铜与稀硫酸:
二、酸+(某些)金属氧化物== +
8、.盐酸除铁锈:
9、硫酸除铁锈:
10、氧化铜与稀硫酸:
11、氧化铜与稀盐酸:
12、氧化钙与稀盐酸:
三、碱+(某些)非金属氧化物== +
13、二氧化碳通入澄清石灰水:
14、二氧化碳与氢氧化钠:
15、二氧化硫与氢氧化钠溶液:
16、三氧化硫与氢氧化钠溶液:
四、酸+金属== +
17、铝与盐酸反应制氢气:
18、铝与硫酸反应制氢气:
19、镁与盐酸反应制氢气:
20、铁与硫酸反应制氢气:
21、锌与硫酸反应制氢气:
五、其他
22.生石灰与水反应:
23、实验室制二氧化碳:
24、泡沫灭火器原理:
六、俗名与化学式
1、生石灰:5、盐酸:
2、熟石灰、消石灰:6、纯碱:
3、火碱、烧碱、苛性钠:7、醋酸:
4、石灰石、大理石、鸡蛋壳:。
