常见的燃烧现象
关于氧气燃烧的实验现象

关于氧气燃烧的实验现象在化学实验中,氧气燃烧是一个重要的实验之一。
下面将详细介绍氧气燃烧的实验现象,主要包括焰色反应、热量变化、产物性质、反应速率、燃烧过程、氧气浓度影响和燃烧后现象等方面。
1.焰色反应氧气燃烧时,不同的物质具有不同的焰色反应。
例如,钠元素在氧气中燃烧时,会产生明亮的黄色火焰。
铜元素在氧气中燃烧时,会产生鲜艳的蓝色火焰。
这些不同的焰色反应可以帮助我们识别不同的元素和化合物。
2.热量变化氧气燃烧会释放大量的热量。
在燃烧过程中,热量会传递给周围的物质,导致温度升高。
因此,在实验过程中需要注意控制火源,避免引起火灾等安全事故。
3.产物性质氧气燃烧的产物通常是一种或多种氧化物。
例如,氢气在氧气中燃烧会产生水,水蒸气在空气中凝结成小水滴;碳在氧气中燃烧会产生二氧化碳,二氧化碳是一种无色、无味的气体。
这些氧化物通常具有不同的性质和用途。
4.反应速率氧气燃烧的反应速率与反应物的性质和浓度有关。
一些物质在氧气中燃烧非常迅速,而另一些物质则需要更长的时间才能完全燃烧。
此外,氧气浓度也会影响燃烧速率。
高浓度的氧气可以加快燃烧速率,而低浓度的氧气则会使燃烧速率减慢。
5.燃烧过程氧气燃烧的过程通常包括以下步骤:点火、预热、燃烧、熄灭。
在点火时,需要将可燃物与氧气混合并点燃。
预热阶段中,可燃物被加热到着火点温度以上。
在燃烧阶段中,可燃物与氧气发生化学反应并释放大量热量。
最后在熄灭阶段,火源被移除,热量逐渐散失,反应停止。
6.氧气浓度影响氧气浓度对燃烧的影响非常大。
在空气中,氧气的体积分数约为21%,这个浓度足以支持大部分物质的燃烧。
但是,如果氧气的浓度过低,燃烧会变得缓慢甚至停止。
相反,如果氧气的浓度过高,燃烧会过于剧烈甚至引起爆炸。
因此,在实验过程中需要控制氧气的浓度以保证安全和有效的燃烧。
7.燃烧后现象氧气燃烧后,通常会出现一些明显的现象。
例如,燃烧后产生的烟尘可能会污染空气;燃烧后产生的高温可能会烧焦或熔化周围的物质;燃烧后产生的气体可能会改变周围环境的压力等等。
燃烧反应的类型与特征

燃烧反应的类型与特征燃烧(combustion)是指燃料与氧气或其他氧化剂在适当条件下进行的放热反应,产生大量能量和二氧化碳、水等物质。
燃烧是生活中常见的化学反应之一,不同类型的燃烧反应具有不同的特征和表现形式。
本文将介绍燃烧反应的几种常见类型以及它们的特征。
一、明火燃烧明火燃烧是人们日常生活中最常见的燃烧形式,也是最直观的燃烧形象。
明火燃烧的特征是有明显的火焰和火光,并伴有明确的热能释放。
明火燃烧需要燃料、氧气和一定的活动性,如花柴等可燃物置于明火中所产生的燃烧现象。
明火燃烧是一个复杂的过程,其中涉及许多细节的化学反应。
燃料物质在明火中发生氧化反应,产生热能和火焰,热能以光和热的形式释放出来。
明火燃烧的能量既可以用于供人们的日常生活,也可以用于工业生产。
二、隐火燃烧隐火燃烧,顾名思义,指的是在没有明显火焰和火光的情况下进行的燃烧反应。
隐火燃烧的典型例子是木炭的燃烧。
在没有外部燃烧源的情况下,木炭与空气中的氧气进行反应,产生热能,但没有显著的火焰。
隐火燃烧具有一些独特的特点。
首先,由于没有明显的火焰,隐火燃烧的热能主要通过传导和对流进行传输。
其次,隐火燃烧的温度相对较低,热能释放较为缓慢。
此外,隐火燃烧产生的烟雾相对较少,具有较好的环境友好性。
三、爆炸爆炸是一种剧烈而迅速的燃烧反应,其特征是产生巨大的声响、冲击波以及大量的热能和气体产物。
爆炸常常发生在可燃气体、液体或固体与氧气或其他氧化剂形成可燃混合物的情况下。
爆炸反应需要燃料、氧气和源源不断的火花或脉冲能量作为引爆源。
当火花或脉冲能量达到一定的能量阈值时,反应迅速进行,生成大量的热能和气体产物,并伴随着巨大的声响和冲击波。
四、自燃自燃是指一些物质在特定条件下,无需外部点火源而自动燃烧的现象。
自燃现象经常发生在易燃液体或固体,如某些油类、木材、碳等。
自燃反应的特征是无需外界燃烧源的直接点燃,而是由于物质自身的特性引起的。
一些物质具有较低的自燃温度,当遇到氧气或其他氧化剂时,可以自动发生反应,释放出热能。
第二节燃烧的类型与特点

第二节燃烧的类型与特点第二节燃烧的类型与特点一燃烧的类型燃烧的类型有许多种,主要有闪燃、着火、自燃和爆炸。
1、闪燃一定温度下,液体能蒸发成蒸汽或少量固体如樟脑、萘、木材、塑料(聚乙烯、聚苯乙烯等表面上能产生足够的可燃蒸气,遇火源能产生一闪即灭的现象。
发生闪燃的最低温度称为闪点;液体的闪点越低,火险性越大。
闪点是评定液体火灾危险性的主要依据。
表 1-2 给出了某些可燃液体的闪点温度表 1-2某些可燃液体的闪点温度可燃物二硫乙醚汽油丙酮润滑油甲苯乙醇松节油石油名称化碳闪点/ ℃-45-4510-1028526.3103230注:①闪点低于或等于45℃的液体为易燃液体,闪点大于45℃的称为可燃液体;②易燃和可燃液体的闪点高于贮存温度时,火焰的传播速度低。
2、着火可燃物质发生持续燃烧的现象叫着火;如油类、酮类。
可燃物开始持续燃烧的所需要的最低温度,叫燃点(又称为着火点),燃点越低,越容易起火。
根据可燃物质的燃点高低,可以鉴别其火灾危险程度,表1-3 给出了几种可燃物质着火的燃点。
表 1-3几种可燃物质的燃点名称汽油煤油乙醇樟脑萘赛璐橡胶纸张石蜡麦草珞燃点168660~7086100120130190200/ ℃76名称布匹棉花烟草松木有机胶布聚乙聚氯涤纶尼龙玻璃烯乙烯6燃点200210222250260325340391390395 / ℃3、自燃可燃物在空气中没有外来火源,靠自热和外热而发生的燃烧现象称为自燃。
根据热的来源不同,可分为本身自燃和受热自燃。
使可燃物发生自燃的最低温度叫自燃点。
物质的自燃点越低发生火灾的危险性越大。
自燃有固体自燃、气体自燃及液体自燃。
表1-4 给出了几种物质的自燃点表 1-4几种可燃物的自燃点物黄松汽煤柴木无稻涤纶纤质磷香油油油材烟草维名煤称自302425524035040028033442燃0~~~~~0点530290380500500/℃物氢CO CO2H2S乙乙丙醋苯质醇醛酮酸名称自576012029239227566165580燃290点/℃物铝铁镁锌有硫聚树合成橡胶质机苯脂名玻乙称璃烯自643152068044019049046320燃550点/℃自燃物品的防火与灭火:储运自燃物品时必须通风散热,远离火源、热源、电源,不要受日光曝晒,装卸时防止撞击、翻滚、倾倒和破损容器。
燃烧的类型

燃烧类型燃烧现象按其发生瞬间的特点,可分为闪燃、着火、自燃、爆燃等类型,每一种类型的燃烧有各自的特点。
1.闪燃闪燃是液体可燃物的特征之一。
各种液体的表面都有一定量的蒸气存在,蒸气的浓度取决于该液体的温度。
可燃液体表面或容器内的蒸气与空气混合而形成混合可燃气体,遇火源即发生燃烧。
当火焰或炽热物体接近易燃和可燃液体时,其液面上的蒸气与空气的混合物会发生一闪即灭的燃烧,这种燃烧现象叫做闪燃。
闪燃是短暂的闪火,不是持续的燃烧,这是因为液体在该温度下蒸发速度不快,液体表面上聚积的蒸气一瞬间燃尽,而新的蒸气还未来得及补充,故闪燃一下就熄灭了。
尽管如此,闪燃仍是引起火灾事故的危险因素之一。
在一定的条件下,易燃和可燃液体蒸发出足够的蒸气,在液面上能发生闪燃的最低温度,叫做该物质的闪点。
闪点与物质的饱和蒸气压有关,饱和蒸气压越大,闪点越低。
同一液体饱和蒸气压随其温度的增高而变大,所以温度较高时容易发生闪燃。
如果可燃液体的温度高于它的闪点,一旦接触点火源就会被点燃,所以把闪点低于45℃的液体叫易燃液体,易燃液体比可燃液体危险性高。
易燃液体与可燃液体又分别根据其闪点的高低分成不同的级别,如表1所示。
闪点这个概念主要适用于可燃性液体,某些固体如樟脑和萘等,也能在室温下挥发或缓慢蒸发,因此也有闪点,几种液体的闪点如表2所示。
表1 易燃和可燃液体闪点分类分级2.着火可燃物质受到外界火源的直接作用而开始的持续燃烧现象叫着火,这是日常生活中最常见的燃烧现象。
例如,用火柴点燃柴草,就会引起柴草着火。
可燃物质开始持续燃烧所需的最低温度叫做该物质的燃点或着火点。
物质的燃点越低,越容易着火。
几种可燃物质的燃点如表3所示。
表2 几种液体的闪点表3 几种可燃物质体的燃点3.自燃可燃物质虽没有受到外界点火源的直接作用,但当受热达到一定温度,或由于物质内部的物理(辐射、吸附等),化学(分解、化合等)或生物(细菌、腐败作用等)反应过程所提供的热量聚积起来使其达到一定的温度,从而发生自行燃烧的现象叫自燃。
燃烧的主要类型

燃烧的主要类型
燃烧是一种化学反应,它需要氧气参与并产生能量、二氧化碳和水。
根据燃烧的不同类型,我们可以将其分为以下几种:
1. 燃料燃烧:这是最常见的燃烧类型,其中燃料被点燃,并在氧气的存在下燃烧产生能量。
例如,木材、煤、石油和天然气等化石燃料都是常见的燃料。
2. 蒸汽燃烧:这种燃烧类型通常是从水中提取能量。
在这种过程中,水被加热并转化为蒸汽,然后将蒸汽引入一个涡轮机中,以产生电力。
这种类型的燃烧通常使用煤或天然气来加热水。
3. 爆炸燃烧:这种类型的燃烧通常是非常快速和暴力的,产生的能量会引起爆炸。
例如,汽油和炸药等易燃物质通常被用于这种类型的燃烧。
4. 星际燃烧:这是一种在恒星中发生的燃烧类型,其中核反应将氢转化为氦,释放出大量的能量。
这是宇宙中最常见的燃烧类型之一。
总的来说,燃烧是一种非常重要的化学反应,它不仅在我们的日常生活中起着重要作用,而且也是宇宙中一些最神秘和壮观的现象之一。
- 1 -。
木炭在氧气中燃烧的现象

木炭在氧气中燃烧的现象
燃烧的现象:木炭在氧气中剧烈燃烧、发出白光、放出热量,并产生能使澄清石灰水变浑浊的气体。
燃烧的化学方程式:C+O2=点燃=CO2。
扩展资料
木炭在空气中燃烧的实质是木炭与氧气发生反应,因此燃烧现象不如在氧气中那么明显。
燃烧的'现象:木炭的表面发红,放出热量,并产生能使澄清石灰水变浑浊的气体。
燃烧的化学方程式:C+O2=点燃=CO2。
木炭在氧气、空气中燃烧的异同
1、剧烈程度不同。
木炭在氧气中是属于剧烈燃烧,而在空气中由于其他气体的存在,燃烧的程度没有在氧气中剧烈。
2、颜色不同。
木炭在氧气中燃烧发出的是白光,而在空气中是红色火焰。
3、反应方程式相同。
在两种气体中发生的化学反应是相同的;两种燃烧的过程中都属于放热现象,且都产生产生能使澄清石灰水变浑浊的气体。
向你推荐的相关文章
相关文章列表
微信扫码分享。
物质的燃烧现象

物质的燃烧现象
1、非金属的燃烧
S:在空气中燃烧产生淡蓝色火焰,在氧气中燃烧产生蓝紫色火焰,会生成有刺激性气味的气体(S+O2 ==SO2)
C: 木炭在空气中发红光,缓慢燃烧,放出热量:在氧气中发出较强白光,生成气体使澄清石灰水变混浊,放出热量。
(C+O2==点燃==CO2)
P:在空气中或氧气中燃烧现象::剧烈燃烧、放出大量的热、产生白烟、生成白色固体。
(5O2+4P==点燃==2P2O5)
2、金属的燃烧
Mg:在空气中燃烧现象:剧烈燃烧、放出大量的热、发出耀眼的白光、生成白色固体。
,在氧气中更强烈。
(2Mg+O2==点燃==2MgO)
Zn:在空气中很难燃烧,在氧气中发出强烈白光。
(2Zn+O2==点燃==2ZnO)
Fe:在空气中很难燃烧,在氧气中燃烧现象:剧烈燃烧、放出大量热、火星四射、生成黑色的固体(3Fe+2O2==点燃==Fe3O4 )
Al: 在空气中很难燃烧,在氧气中燃烧,发出耀眼的白光。
(4Al+302==点燃==2Al203)
二、常见非金属的燃烧
H2:在空气中或氧气中燃烧产生淡蓝色火焰,用烧杯罩住会有小水珠生成。
(2H2+O2==点燃==2H2O)
CO:在空气中或氧气中燃烧都产生淡蓝色火焰,生成气体通入澄清石灰水会使其变浑浊。
(2CO+O2==点燃==2CO2)。
木炭,磷,硫,铁丝燃烧的现象
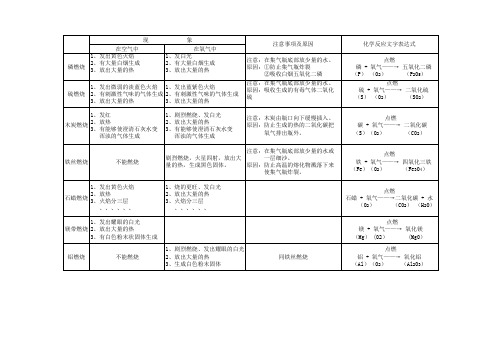
铁丝燃烧
不能燃烧
注意:在集气瓶底部放少量的水或 剧烈燃烧,火星四射,放出大 一层细沙。 量的热,生成黑色固体。 原因:防止高温的熔化物溅落下来 使集气瓶炸裂。 1、烧的更旺、发白光 2、放出大量的热 3、火焰分三层 、、、、、、
点燃 铁 + 氧气——→ 四氧化三铁 (Fe)(O2) (Fe3O4)
1、发出黄色火焰 2、放热 石蜡燃烧 3、火焰分三层 、、、、、、 1、发出耀眼的白光 镁带燃烧 2、放出大量的热 3、有白色粉末状固体生成 铝燃烧 不能燃烧
点燃 石蜡 + 氧气——→二氧化碳 + 水 (O2) (CO2) (H2O) 点燃 镁 + 氧气——→ 氧化镁 (Mg) (O2) (MgO)
1、剧烈燃烧、发出耀眼的白光 2、放出大量的热 3、生成白色粉末固体
同铁丝燃烧
点燃 铝 + 氧气——→ 氧化铝 (Al)(O2) (Al2O3)
化学反应文字表达式 点燃 磷 + 氧气——→ 五氧化二磷 (P) (O2) (P2O5) 点燃 硫 + 氧气——→ 二氧化硫 (S) (O2) (SO2) 点燃 碳 + 氧气——→ 二氧化碳 (S)(O2) (CO2)
1、发出微弱的淡蓝色火焰 1、发出蓝紫色火焰 硫燃烧 2、有刺激性气味的气体生成 2、有刺激性气味的气体生成 3、放出大量的热 3、放出大量的热 1、发红 2、放热 木炭燃烧 3、有能够使澄清石灰水变 浑浊的气体生成 1、剧烈燃烧、发白光 2、放出大量的热 3、有能够使澄清石灰水变 浑浊的气体生成
现 在空气中 1、发出黄色火焰 磷燃烧 2、有大量白烟生成 3、放出大量的 3、放出大量的热
注意事项及原因 注意:在集气瓶底部放少量的水。 原因:①防止集气瓶炸裂 ②吸收白烟五氧化二磷 注意:在集气瓶底部放少量的水。 原因:吸收生成的有毒气体二氧化 硫 注意:木炭由瓶口向下缓慢插入。 原因:防止生成的热的二氧化碳把 氧气排出瓶外。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a)碳和氧气反应
方程式:C + O2CO2
现象:剧烈燃烧,发白光,放热,生成使澄清石灰水变浑浊的气体
b)硫和氧气反应
方程式:S + O2SO2
现象:发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体注意:实验前应在瓶底放少量水,用来吸收生成的有毒气体。
c)红磷和氧气反应:
方程式:4P + 5O22P2O5
现象:发出耀眼的白光,放热,生成大量白烟
生成的P2O5是固体小颗粒,现象为白烟,不是白雾。
d)铁和氧气的反应:
方程式:3Fe + 2O2Fe3O4
现象:剧烈燃烧,火星四射,放出热量,生成黑色物质
注意:集气瓶底放一层细沙或少量水。
e)镁和氧气反应:
方程式:2Mg + O22MgO
现象:剧烈燃烧,发出耀眼的白光,放出热量,生成白色粉末状固体,有白烟。
注意:不能手持镁条,应用坩埚钳夹持。
f)石蜡和氧气反应
文字表达式:石蜡+氧气水+二氧化碳
现象:剧烈燃烧,放出热量,发出白光,如果在火焰上方罩一个干冷烧杯,
烧杯内壁有水珠,生成使澄清石灰水变浑浊的气体。
b)烟和雾的区别:
a)烟:大量固体小颗粒分散在空气长产生烟。
红磷燃烧产生大量白烟,是燃烧生成的固体P2O5分散在空气中形成的
b)雾:大量小液滴分散在气体中产生雾。
打开盛浓盐酸的瓶塞,瓶口有白雾,是挥发的HCl 气体遇到空气中的水蒸气形成了盐酸小液滴。
a)光:固体物质燃烧使发光。
镁条燃烧发出耀眼的强光,木炭在氧气中燃烧产生白光
b)气体物质和容易气化的物质燃烧时产生火焰。
蜡烛在氧气中燃烧产生白色的火焰,是石蜡熔化后生成的气体燃烧而产生的。
描述物质在氧气中燃烧的现象的技巧:
可按三个顺序从三个方面进行:
(1)剧烈燃烧,有什么颜色的光,火焰;
(2)放热;
(3)生成物的特性。
