极化曲线测量金属的腐蚀速度
极化曲线 标准

极化曲线标准极化曲线是电化学分析中常用的一种曲线,它反映了电极电位与电流之间的关系。
在不同的电化学测试中,极化曲线的获取和分析方法可能会有所不同,但它们的基本原理和标准是相似的。
以下是关于极化曲线的获取、分析和应用的一些基本标准和原则。
一、极化曲线的获取1. 测量方法:极化曲线通常通过控制电流法或控制电位法来获取。
在控制电流法中,电流保持恒定,而电位随时间变化;在控制电位法中,电位保持恒定,而电流随时间变化。
2. 实验设备:进行极化曲线测量时,需要使用电化学测试系统,包括电极(工作电极、参比电极和辅助电极)、电解池、电流源和电位测量装置。
3. 测试条件:测试条件应保持一致,包括电解质的种类和浓度、温度、搅拌速度等。
这些因素都会影响极化曲线的形状和特征。
二、极化曲线的分析1. 曲线形状:极化曲线通常分为三个区域:活性溶解区、钝化区和过钝化区。
活性溶解区表现为电流随电位增加而线性增加;钝化区电流随电位增加而减少,表明电极表面形成了一层稳定的氧化物膜;过钝化区电流再次增加,表明氧化物膜被破坏。
2. 腐蚀速率:通过极化曲线可以估算金属的腐蚀速率。
在活性溶解区,腐蚀速率可以通过斜率(电流密度/电位)来计算。
3. 钝化行为:钝化区的出现和形态可以用来评估金属的钝化能力,即金属抵抗腐蚀的能力。
三、极化曲线的应用1. 腐蚀研究:极化曲线是研究金属腐蚀行为的重要工具,通过分析极化曲线可以了解金属在不同环境条件下的腐蚀特性。
2. 防腐设计:极化曲线的分析结果可以用于指导金属结构的防腐设计,选择合适的材料和涂层。
3. 电化学测试:极化曲线是电化学测试中的一种基本曲线,它可以用于评估电镀、电池、燃料电池等电化学系统的性能。
四、结论极化曲线是电化学分析中的一种重要工具,它通过反映电极电位与电流之间的关系,提供了关于金属腐蚀行为和电化学系统性能的详细信息。
通过标准的测量方法和分析技术,可以获得准确的极化曲线,为腐蚀研究和电化学应用提供重要的数据支持。
实验四、金属电化学腐蚀及腐蚀极化曲线测定

三、仪器及试剂
仪器:CHI660B电化学工作站,电解池、
辅助电极(铂电极).参比电极(带盐桥的 饱和甘汞电极),铁工作电极 。
试剂:硫酸(1mol/L的H2SO4溶液) ,中
性水溶液
四、操作步骤
1.电极处理 工作电极先后800#,1000#砂纸打磨,然后用三次水 清洗,再放入乙醇清洗。 2. 线性扫描伏安法测量铁的极化曲线在工作站中选择 线性扫描伏安法(Linear Sweep Voltammetry),设 置电位范围为-0.6V ~ +1.9V ,扫描速率为2550mV/s,扫描间隙(Interval)设为0.002V及相应的性 能参数,可由仪器自动获得整个的极化曲线。所采用 的扫描速率(即电势变化的速率)需要根据研究体系 的性质选定。 3.测完之后,应使仪器复原,清洗电极。把参比电极 放回原处。
பைடு நூலகம்
同一种金属内的腐蚀电池也是普遍存在的,
它同样导致了金属的电化学腐蚀。同种金属 内部不同部位的电位差是因为金属内部不可 避免地存在着晶间、应力、疲劳、电偶、缝 隙等诸多因素而产生的,这些诸多的因素又 是金属结构在冶炼、加工、安装、焊接等过 程中造成的。这就导致在同一金属结构内部 存在着众多小范围的阳极区和大片的阴极区。 金属一旦处于电解质的环境中,腐蚀电池即 开始工作。
实验装置示意图
五、 数据处理
作阳极极化曲线和阴极极化曲线,由二条切
线的交点z求Ecor、Icor,求出本实验中的腐蚀 速率。
六、 思考讨论
三个电极各有何作用?
以下是腐蚀电池形成的缺一不可的条件: 1.必须有阴极和阳极。 2.阴极和阳极之间必须有电位差(这种电位差 因金属内晶间、应力、疲劳程度、电偶等的差 异的存在以及金属表面缝隙、氧浓差等现象的 存在,极容易在同一金属结构体内形成);亦 可在两个不同电位金属间形成。 3.阴极和阳极之间必须有金属的电流通道。 4.阴极和阳极必须浸在同一电解质中,该电解 质中有流动的自由离子。
碳钢极化曲线测定

碳钢极化曲线测定实验项目性质:设计性所属课程名称:化工装备腐蚀与防护计划学时:4学时一、实验目的及任务通过本实验的学习,使学生能从金属腐蚀的基本理论出发,学生亲自进行常见的金属腐蚀实验的操作,进一步理解金属腐蚀的基本理论,掌握金属腐蚀的研究方法和手段。
本实验是以测定碳钢腐蚀极化曲线来研究和分析金属电化学腐蚀的腐蚀机理、腐蚀速度。
通过本实验的学习,应达到以下目的:1. 使学生掌握电化学腐蚀测试方法的基本操作技术,使学生了解电化学腐蚀的成因和机理;2. 培养学生具有科学的思维方法、科学的工作态度和协作精神;3. 对于设计性实验,初步学会设计电化学腐蚀实验方案;通过学生的独立设计,使学生对实验的研究方法和设计方案有较深入的理解;从而培养综合设计能力和大胆创新的思想。
二、实验内容及要求本实验项目为设计性实验,由学生自行设计或选择恰当的电化学腐蚀实验方法和装置,自己确定实验步骤,拟定实验方案,通过对碳钢极化曲线进行电化学解析,最后得出实验的结论。
具体要求如下:1. 掌握腐蚀实验室研究的基本实验技能;2. 对于设计性实验,初步学会设计电化学腐蚀实验方案;3. 熟悉常用电化学腐蚀实验设备的使用方法;4. 掌握实验数据的处理及实验报告撰写;5. 实验中存在的问题及解决方法,实验收获体会。
三、实验条件1. 仪器设备条件PAR2273腐蚀电化学测试系统,corrTest电化学系统,电解池为三电极电化学测试体系,辅助电极为25mm×25mm的铂片,参比电极为饱和甘汞电极(SCE)。
2. 物质条件实验中所用铁电极为碳钢。
(处理方法:加工为直径6mm,高为5mm的小圆柱体,真空炉中900℃退火8小时,随炉降至室温,消除铁电极的晶体缺陷。
)电极用环氧+固化剂(顺丁烯二酸酐,比例为100:25~30,温度为130~140℃,恒温8小时)或用松香+石蜡(比例1:1)。
电极表面依次用400#,800#水砂纸在预磨机上打磨。
线性极化法测定金属的腐蚀速度实验

线性极化法测定金属的腐蚀速度实验一、 实验目的1.了解线性极化法测量金属腐蚀速度的基本原理。
2.掌握PS-1型恒电位仪的使用方法。
二、 实验原理线性极化法也称极化电阻法,是基于金属腐蚀过程的电化学本质而建立起来的一种快速测定腐蚀速度的电化学方法。
由金属腐蚀动力学基本方程式(1-1) :⎥⎦⎤⎢⎣⎡--⎩⎨⎧⎥⎦⎤⎢⎣⎡=A c c c C 3.2exp 3.2exp corr b b i i ηη外(1-1)通过微分和适当的数学处理可导出:c Ac A c c c C corr corr )3.23.2()3.23.2(ηηηi b b b b i i +=+=外 可知 c外C A c Ac )b (3.2b bcorr ηi b i•+=可见i c 外与ηC 成正比,即在η<10mV 内极化曲线为直线。
直线的斜率称为极化电阻R P ,即0d d C C →⎪⎪⎭⎫⎝⎛=ηηη外p R 可得 ()c a c a b b b b +⋅⋅=3.2R 1i P corr 式中p R ——极化电阻,Ωcm 2; corr i ——金属自腐蚀电流,A /cm 2;a b 、c b ——常用对数,阳极、阴极塔菲尔(Tafel)常数,V ;若令 ()c a ca b b b b B +⋅=3.2则有 corri B R p =pR B i =corr 式(1-1)即为活化极化控制下的腐蚀体系其极化电阻与腐蚀电流之间存在的线性极化关系的基本公式(Stern 公式)。
很显然极化电阻p R 与腐蚀电流corr i 成反比。
当实验测得p R 和a b 、c b 后就可以求得腐蚀电流corr i 。
对于大多数体系可以认为腐蚀过程中a b 和c b 是一个常数。
确定a b 和c b 的方法有以下几种:1.极化曲线法:在极化曲线的塔菲尔直线段求直线斜率a b 、c b 。
2.根据电极过程动力学基本原理,由F n a RT b a a )1(3.2-=和Fan RTb c c 3.2=等公式求a b 、c b ,该法的关键是要正确选择传递系数a 值(a 值为0~l 之间的数值),这要求对体系的电化学特征了解得比较清楚,例如,析2H 反应,在20℃各种金属上反应a ≈0.5,所以c b 值都在0.1~0.12V 之间。
极化曲线测量金属的腐蚀速度

极化曲线测量金属的腐蚀速度一、 目的和要求1. 掌握恒电位法测定电极极化曲线的原理和实验技术。
通过测定Fe 在NaCl 溶液中的极化曲线,求算Fe 的自腐蚀电位,自腐蚀电流。
2. 讨论极化曲线在金属腐蚀与防护中的应用。
二、 基本原理当金属浸于腐蚀介质时,如果金属的平衡电极电位低于介质中去极化剂(如H +或氧分子)的平衡电极电位,则金属和介质构成一个腐蚀体系,称为共轭体系。
此时,金属发生阳极溶解,去极化剂发生还原。
以金属锌在盐酸体系中为例:阳极反应: Zn-2e=Zn 2+阴极反应: H ++2e=H 2阳极反应的电流密度以 i a 表示, 阴极反应的速度以 i k 表示, 当体系达到稳定时,即金属处于自腐蚀状态时,i a =i k =i corr (i corr 为腐蚀电流),体系不会有净的电流积累,体系处于一稳定电位c ϕ。
根据法拉第定律,体系通过的电流和电极上发生反应的物质的量存在严格的一一对应关系,故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。
金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。
因此求得金属腐蚀电流即代表了金属的腐蚀速度。
金属处于自腐蚀状态时,外测电流为零。
极化电位与极化电流或极化电流密度之间的关系曲线称为极化曲线。
极化曲线在金属腐蚀研究中有重要的意义。
测量腐蚀体系的阴阳极极化曲线可以揭示腐蚀的控制因素及缓蚀剂的作用机理。
在腐蚀点位附近积弱极化区的举行集会测量可以可以快速求得腐蚀速度。
还可以通过极化曲线的测量获得阴极保护和阳极保护的主要参数。
在活化极化控制下,金属腐蚀速度的一般方程式为:其中 I 为外测电流密度,i a 为金属阳极溶解的速度,i k 为去极化剂还原的速度,βa 、βk 分别为金属阳极溶解的自然对数塔菲尔斜率和去极化剂还原的自然对数塔菲尔斜率。
若以十为底的对数,则表示为b a 、b k 。
这就是腐蚀金属电极的极化曲线方程式,令 ∆E 称为腐蚀金属电极的极化值,∆E =0时,I =0;∆E>0时,是阳极极化,I>0,体系通过阳极电流。
铁的极化曲线的测定

实验步骤
2.测量极化曲线: (2)将三电极分别插入电极夹的三个小孔中,
使电极进入电解质溶液中。将CHI工 作站的 绿色夹头夹Fe电极,红色夹头夹Pt片电极, 白色夹头夹参比电极。
实验步骤
2.测量极化曲线: (3)测定开路电位。点击“T”(Technique) 选中对话框中“Open Circuit PotentialTime”实验技术,点击“OK”。点击“░” (parameters)选择参数,可用仪器默认 值,点击“OK”。点击“►”开始实验,测得 的开路电位即为电极的自腐蚀电势Ecorr。
仪器与药品
CHI660A电化学工作站1台;电解池1个; 硫酸亚汞电极(参比电极)、Fe电极(研究 电极)、Pt片电极(辅助电极)各1支。 0.1mol•L-1、1mol•L-1H2SO4溶液; 1mol•L-1HCl溶液; 乌洛托品(缓蚀剂)
实验步骤
1. 电极处理:用金相砂纸将铁电极表面打磨 平整光亮,用蒸馏水清洗后滤纸吸干。每次测 量前都需要重复此步骤,电极处理得好坏对测 量结果影响很大。
实验步骤
2.测量极化曲线: (4)开路电位稳定后,测电极极化曲线。点
击“T”选中对话框中“Linear Sweep Voltammetry”实验技术,点击“OK”为 使Fe电极的阴极极化、阳极极化、钝化、过 钝化全部表示出来。
实验步骤
初始电位(Init E)设为“-1.0V”,终态电 位(Final E)设为“2.0V”,扫描速率 (Scan Rate)设为“0.01V/s”灵敏度 (sensivitivty)设为“自动”,其它可用 仪器默认值,极化曲线自动画出。
测量方法
动态法:控制电极电势以较慢的速度连续地 改变(扫描),并测量对应电势下的瞬时电 流密度,并以瞬时电流密度值与对应的电势 作图就得到整个极化曲线。所采用的扫描速 度(即电势变化的速度)需要根据研究体系 的性质选定。
电化学腐蚀
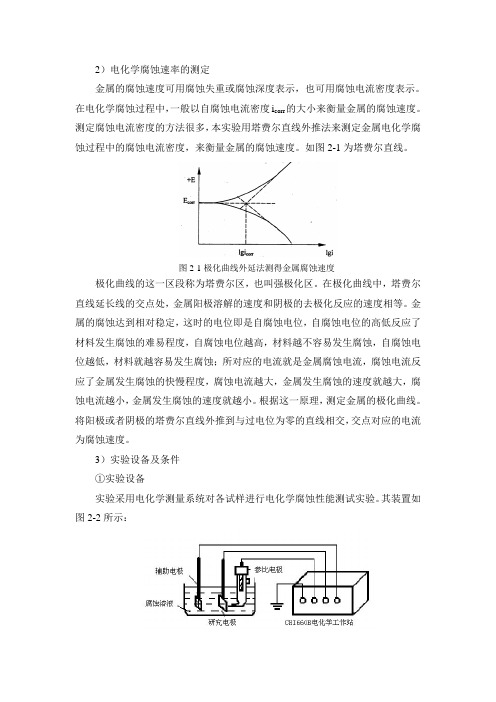
2)电化学腐蚀速率的测定金属的腐蚀速度可用腐蚀失重或腐蚀深度表示,也可用腐蚀电流密度表示。
在电化学腐蚀过程中,一般以自腐蚀电流密度i corr的大小来衡量金属的腐蚀速度。
测定腐蚀电流密度的方法很多,本实验用塔费尔直线外推法来测定金属电化学腐蚀过程中的腐蚀电流密度,来衡量金属的腐蚀速度。
如图2-1为塔费尔直线。
图2-1极化曲线外延法测得金属腐蚀速度极化曲线的这一区段称为塔费尔区,也叫强极化区。
在极化曲线中,塔费尔直线延长线的交点处,金属阳极溶解的速度和阴极的去极化反应的速度相等。
金属的腐蚀达到相对稳定,这时的电位即是自腐蚀电位,自腐蚀电位的高低反应了材料发生腐蚀的难易程度,自腐蚀电位越高,材料越不容易发生腐蚀,自腐蚀电位越低,材料就越容易发生腐蚀;所对应的电流就是金属腐蚀电流,腐蚀电流反应了金属发生腐蚀的快慢程度,腐蚀电流越大,金属发生腐蚀的速度就越大,腐蚀电流越小,金属发生腐蚀的速度就越小。
根据这一原理,测定金属的极化曲线。
将阳极或者阴极的塔费尔直线外推到与过电位为零的直线相交,交点对应的电流为腐蚀速度。
3)实验设备及条件①实验设备实验采用电化学测量系统对各试样进行电化学腐蚀性能测试实验。
其装置如图2-2所示:图2-2 电化学极化曲线测量装置示意图实验装置中三电极体系中以饱和甘汞(SCE)电极作为参比电极(reference electrode);Pt 电极作为辅助电极(auxiliary electrode);代测试样为研究电极(research electrode)。
参比电极和研究电极间用盐桥连接,鲁金毛细管(capiliary)距研究电极1~2毫米。
电化学工作站部分参数如下:初始电位(V):-2;终止电位(V):2.2;扫描段数:1;终止电位处保持时间:0;静置时间:2s;电流灵敏度(A/V):1.e-0.04。
②实验条件a.腐蚀试样:对1#到12#试样进行蜡封,即:在试样上用油性笔取1cm×1cm 的面积,并在其上放置橡皮,而后将烧化的蜡汁快速滴于试样表面,即蜡封处理。
实验一-----失重法测金属腐蚀速度

材料腐蚀与防护实验指导书山东科技大学材料学院金属材料系 2007 ———————★★———————目录1.腐蚀体系的极化性能2.失重法测金属腐蚀速度实验一 腐蚀体系的极化性能1. 实验目的(1)分析活化极化控制腐蚀体系极化曲线的特征。
(2)掌握恒电位法测定极化曲线的基本原理和方法。
(3)学习塔菲尔区外延法求腐蚀电流的原理和方法。
(4)熟悉恒电位仪或电化学综合测试仪的操作规程。
2. 基本原理见《金属腐蚀理论及腐蚀控制》第四章,见《金属腐蚀理论及应用》第二章的第二、四、八、十节内容。
当电极上有净电流通过时,电极电位显著偏离了未通电时的开路电位(平衡电位或非平衡的稳态电位),这种现象叫做电极的极化。
当通过外加电流时电极电位偏离稳定电位的的现象,成为腐蚀体系的极化。
研究对一腐蚀金属电极外加极化时,其极化电位与外加电流之间的关系即是腐蚀金属电极的极化曲线。
金属的电化学腐蚀中,常用电流密度来表示腐蚀速度(单位时间内金属腐蚀的程度)。
腐蚀金属电极的一般速度方程式如下:⎥⎦⎤⎢⎣⎡∆--∆=c a corr b E b E I I 303.2exp 303.2exp它是大部分测定腐蚀速度的电化学方法的理论基础。
方程式中通过试验测定的数据是自腐蚀电位corr E和一系列极化电位E ∆以及相对应的极化电流I ,然后从实验测定的极化数据计算出金属的腐蚀速度corr i以及其它有关电化学参数。
3.实验内容及要求(1)用恒电位法测量低碳钢(Q235)试样在0.05mol/L 硫酸氢钠中的极化曲线,了解这种活化极化腐蚀体系极化曲线的特征。
(2)用塔菲尔区外延法确定腐蚀电流密度及极化曲线的Tafle 斜率值。
4.实验装置及仪器用品(1) 实验仪器和试剂实验仪器: 烧杯500mL 2个玻璃棒 1个 鲁金毛细管 1个1480A 8通道恒电位仪和POTENTIOSTAT/GALVANOSTAT 273试 剂: NaHSO 4 (2)实验参数实验温度:常压、室温 26-28o C实验溶液: NaHSO溶液0.05mol/L4实验气氛:空气装置状态:静止静置时间: 2000s电极体系:三电极体系待测电极: Q235(面积约为1cm2)参比电极:饱和甘汞电极辅助阴极: pt电极(面积约为2cm2)阳极极化曲线电压: -0.05V~0.8V(相对于开路电压)扫描速度: 0.5mV/s扫描方式:动电位线性扫描图1 极化曲线测量电路示意图(3)试样的准备试样用砂纸打光、酒精脱脂去污洗净,然后取10×10mm试样面积作为工作表面,背部焊接导线,其余部分用环氧树脂(或绝缘清漆、AB胶、石蜡等)覆盖。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
极化电位与极化电流或极化电流密度之间的关系曲线称为极化曲线。极化曲线在金属腐蚀研究中有重要的意义。测量腐蚀体系的阴阳极极化曲线可以揭示腐蚀的控制因素及缓蚀剂的作用机理。在腐蚀点位附近积弱极化区的举行集会测量可以可以快速求得腐蚀速度。还可以通过极化曲线的测量获得阴极保护和阳极保护的主要参数。
极化曲线测量金属的腐蚀速度
一、目ห้องสมุดไป่ตู้和要求
1.掌握恒电位法测定电极极化曲线的原理和实验技术。通过测定Fe在NaCl溶液中的极化曲线,求算Fe的自腐蚀电位,自腐蚀电流。
2.讨论极化曲线在金属腐蚀与防护中的应用。
二、基本原理
当金属浸于腐蚀介质时,如果金属的平衡电极电位低于介质中去极化剂(如H+或氧分子)的平衡电极电位,则金属和介质构成一个腐蚀体系,称为共轭体系。此时,金属发生阳极溶解,去极化剂发生还原。以金属锌在盐酸体系中为例:
测定腐蚀速度的塔菲尔直线外推法
当对电极进行阳极极化,在强极化区,
阴极分支电流ik=0,
改写为对数形式:
当对电极进行阴极极化,∆E <0,在强极化区,阳极分支电流ia=0
改写成对数形式:
强极化区,极化值与外测电流满足塔菲尔关系式,如果将极化曲线上的塔菲尔区外推到腐蚀电位处,得到的交点坐标就是腐蚀电流。
(3)测定开路电位。点击“T”(Technique)选中对话框中“Open Circuit Potential-Time”实验技术,点击“OK”。点击“░”(parameters)选择参数,可用仪器默认值,点击“OK”。点击“►”开始实验,测得的开路电位即为电极的自腐蚀电势Ecorr。
(4)开路电位稳定后,测电极极化曲线。点击“T”选中对话框中“Tafel”实验技术,点击“OK”初始电位(Init E)设为比Ecorr低“-0.5V”,终态电位(Final E)设为比Ecorr高“1.25V”,扫描速率(Scan Rate)设为“0.001V/s”灵敏度(sensivitivty)设为“自动”,其它可用仪器默认值,极化曲线自动画出。
阳极反应:Zn-2e=Zn2+
阴极反应:H++2e=H2
阳极反应的电流密度以ia表示,阴极反应的速度以ik表示,当体系达到稳定时,即金属处于自腐蚀状态时,ia=ik=icorr(icorr为腐蚀电流),体系不会有净的电流积累,体系处于一稳定电位 。根据法拉第定律,体系通过的电流和电极上发生反应的物质的量存在严格的一一对应关系,故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。因此求得金属腐蚀电流即代表了金属的腐蚀速度。
图1塔菲尔外推法求金属腐蚀电流的基本原理
三、仪器药品和实验装置
CHI660A电化学工作站1台;
烧杯一个;
饱和甘汞电极(参比电极)1支
Pt片电极(辅助电极)1支。
45号钢(圆柱体)
松香
石腊
分析纯氯化钠
蒸馏水
铜导线
图2极化曲线测量示意图
四、操作步骤
1.电极处理:用金相砂纸将45号钢电极表面打磨平整光亮,测量试样的直径,将45号钢试样和铜导线连接。
在活化极化控制下,金属腐蚀速度的一般方程式为:
其中I为外测电流密度,ia为金属阳极溶解的速度,ik为去极化剂还原的速度,βa、βk分别为金属阳极溶解的自然对数塔菲尔斜率和去极化剂还原的自然对数塔菲尔斜率。若以十为底的对数,则表示为ba、bk。
这就是腐蚀金属电极的极化曲线方程式,令
∆E称为腐蚀金属电极的极化值,∆E=0时,I=0;∆E>0时,是阳极极化,I>0,体系通过阳极电流。∆E<0时,I<0,体系通过的是阴极电流,此时是对腐蚀金属电极进行阴极极化。因此外测电流密度也称为极化电流密度
(5)自腐蚀电流的拟合,打开CHI660A的控制软件,利用自带的软件求得自腐蚀电流密度
4.实验完毕,清洗电极、电解池,将仪器恢复原位,桌面擦拭干净。
五、思考与讨论
(1)平衡电极电位、自腐蚀电位有何不同。
(2)为什么可以用自腐蚀电流石腊融化,用来封装表面清洗干净的试样(用蒸馏水清洗、酒精去油),电极处理得好坏对测量结果影响很大。
3.测量极化曲线:
(1)打开CHI660A工作站的窗口。
(2)将三电极分别插入电极夹的三个小孔中,使电极进入电解质溶液中。将CHI工作站的绿色夹头夹Fe电极,红色夹头夹Pt片电极,白色夹头夹参比电极。
